仙茅苔黑酚龙胆二糖苷调控NF-κB/Nrf2 通路抑制破骨细胞氧化应激及其骨吸收的研究
2024-02-28李鹤鸣刘梦琴虞艳玮杜金蔓胡思婧徐金龙张泉龙秦路平张巧艳
李鹤鸣,刘梦琴, ,虞艳玮,沈 燚,杜金蔓,胡思婧,徐金龙,张泉龙,秦路平*,张巧艳*
1. 浙江中医药大学药学院,浙江 杭州 310053
2. 福建中医药大学药学院,福建 福州 350108
3. 中国人民解放军联勤保障部队第九六九医院,内蒙古自治区 呼和浩特 010051
骨质疏松症(osteoporosis,OP)是一种常见的老年性疾病,是参与骨代谢的成骨细胞的骨形成作用和破骨细胞(osteoclasts,OCs)的骨吸收作用失衡,导致骨量减少、骨组织微结构退化、骨脆性增加,以致易于发生骨折的骨骼疾病[1]。OCs 是唯一具有骨吸收功能的细胞,由骨髓单核细胞在巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)和核因子-κB 受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)的刺激下形成的多核细胞,其活性受丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)通路的调控[2]。随着机体的衰老,体内雌激素水平降低,活性氧(reactive oxygen species,ROS)水平升高,导致氧化应激,造成OCs 活性增强,致使骨量减少和OP 的发生[3-4]。核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)通路是调节机体氧化应激的关键机制[5],激活OCs 的Nrf2 通路,增强其抗氧化能力,抑制其形成分化和骨吸收活性,可以减缓OP 的发生发展。目前,一些抗氧化剂如维生素E、维生素C,尤其是N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)被发现能够作为ROS 清除剂抑制OCs 在骨形成作用中的负面影响[6]。而天然药物含有丰富的抗氧化成分,从中寻找能够抑制OCs 骨吸收的活性成分,研究其抑制OCs 形成分化的机制,可为中药新产品的开发及临床应用提供科学依据。
仙茅为石蒜科植物仙茅CurculigoorchioidesGaertn. 的干燥根茎[7],含有酚苷、木脂素和环阿尔廷醇型三萜皂苷等多种结构类型的化学成分,具有补肾阳及与之相关的调节免疫、抗氧化、抗抑郁、保肝、保护心血管、抗骨质疏松及植物雌激素样作用[8-9],应用于二仙汤、黄芪三仙汤、调经促孕丸、更年安片、骨仙片、益气固本片等多个中药方剂和中成药中,显示出了良好的应用前景。仙茅酚苷类成分为其主要活性成分,具有良好的抗氧化以及抗骨质疏松作用[10],其结构类型包括苯甲酸酯类酚苷如仙茅苷、仙茅苷乙;苔黑酚类酚苷如苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷;含氯苯酚衍生物类酚苷如仙茅素A[11-12]。课题组前期研究发现,仙茅苷能够通过对抗氧化应激增加铁超载和表达嵌合小鼠/人淀粉样蛋白前体蛋白(Mo/HuAPP695swe)和突变人早老蛋白1(PS1-dE9)双转基因小鼠的骨形成[13-14],并发现其通过对抗氧化应激抑制OCs 骨吸收的机制[15]。仙茅苷在《中国药典》2020 年版规定的质量分数≥0.10%,而研究发现苔黑酚类酚苷在仙茅中质量分数高达1.0%[16],也具有抗氧化和抗骨质疏松的作用[17],但其深入的机制尚不清楚。苔黑酚龙胆二糖苷(orcinol gentiobioside,OGB)为仙茅中主要的苔黑酚类酚苷,其是否通过抗氧化发挥抗OP 作用值得进一步探讨。因此,本研究以sRANKL 联合H2O2诱导RAW264.7细胞分化的OCs 为模型,观察OGB 对OCs 形成分化和骨吸收作用的影响,研究其通过NF-κB 和Nrf2通路减缓OCs 氧化应激和骨吸收的机制,以期为仙茅的临床应用及资源开发利用提供科学依据。
1 材料
1.1 细胞
RAW264.7 细胞购自中国科学院典型培养物保藏委员会细胞库。
1.2 药品与试剂
OGB(批号P23M10S84022,质量分数≥98%)、NAC(批号L17O9X7236,质量分数≥98%)、Nrf2抑制剂ML385(批号L17JD9L77422,质量分数≥98%)、NF-κB 抑制剂 BAY 11-7082(批号K10J10D92650,质量分数≥98%)购自上海源叶生物科技有限公司;重组小鼠可溶性核因子-κB 受体活化因子配基(soluble receptor activator of nuclear factor-κB ligand,sRANKL,批号0715612J1217)购自美国PeproTech 公司;胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;CCK-8 增殖检测试剂盒(批号MA0218)购自大连美伦生物医药有限公司;抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒购自上海碧云天生物技术有限公司;4%多聚甲醛(批号XS185001)购自武汉赛维尔生物科技有限公司;ROS 测定试剂盒(批号20200520)、钙测定试剂盒(批号 20201121)、γ-谷氨酰半胱氨酸合成酶(gamma-glutamyl cysteine synthetase,γ-GCS)测定试剂盒(批号20200529)、小鼠I 型胶原C 末端肽(cross-linked carboxy-terminal telopeptide of type I collagen,CTX-I)ELISA 试剂盒(批号20201130)、小鼠I 型前胶原氨基端前肽(procollagen type I intactNterminal propeptide,PINP)ELISA 试剂盒(批号20201130)、小鼠醌氧化还原酶 1(quinone oxidoreductase 1,NQO1)ELISA 试剂盒(批号20200601)、小鼠血红素加氧酶-1(heme oxygenase-1,HO-1)ELISA 试剂盒(批号20200601)、小鼠还原型辅酶 II(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶1(NADPH oxidase 1,NOX1)ELISA 试剂盒(批号20200601)、小鼠NADPH 氧化酶4(NADPH oxidase 4,NOX4)ELISA试剂盒(批号20200601)购自南京建成生物工程研究所;组织蛋白酶K(cathepsin K,CTSK)抗体(批号ab19027)、肿瘤坏死因子受体相关蛋白6(tumor necrosis factor receptor-associated factor 6,TRAF6)抗体(批号ab33915)购自英国Abcam 公司;活化T-细胞核因子1(nuclear factor of activated T-cells,NFATc1)抗体、Nrf2 抗体、Kelch 样ECH 关联蛋白1(kelch-like ECH-associated protein 1,Keap1)抗体、磷酸化p65(p-p65)抗体、p65 抗体、山羊抗兔IgG二抗购自美国CST 公司(批号分别为8032、12721、8047、3033、8242、7074);核因子-κB 抑制因子α(inhibitor of NF-κB-α,IκBα)抗体、基质金属蛋白酶9(matrix metalloprotein 9,MMP9)抗体、c-Fos抗体(批号分别为BM3932、BA2202、BA0207-2)购自武汉博士德生物工程有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号AT0010)购自上海维景生物科技有限公司。
1.3 仪器
DMi1 型显微镜(德国Leica 公司);Axio Imager 2 型正置显微镜、LSM880 型激光共聚焦显微镜(卡尔蔡司股份公司);1510 型酶标仪(美国Thermo Fisher Scientific 公司)。
2 方法
2.1 H2O2 诱导OCs 模型的建立
将RAW264.7 细胞在含25 ng/mL sRANKL 的α-MEM 完全培养基中诱导36 h 后,再用含20 μmol/L H2O2的α-MEM 完全培养基继续诱导36 h,即可得到H2O2诱导的OCs。
2.2 CCK-8 法检测细胞活力
将RAW264.7 细胞接种于96 孔板中,贴壁过夜,用20 μmol/L NAC 以及不同剂量(0、1、5、10 μmol/L)的OGB 处理36 h,在给药基础上再加入20 μmol/L H2O2,并单独设置H2O2组,继续处理36 h,CCK-8 法检测细胞活力。
2.3 TRAP 染色及活性测定
设置sRANKL 和H2O2诱导的OCs 模型组、NAC 处理的阳性药组以及OGB(1、5、10 μmol/L)给药组,给药处理36 h 后,在给药基础上再加入20 μmol/L H2O2处理36 h,收集上清,按照课题组前期建立的方法[18]测定TRAP 活性,并按照试剂盒说明书进行TRAP 染色,显微镜下观察并拍照。
2.4 F-actin 环的免疫荧光染色
将RAW264.7 细胞接种于玻底细胞培养皿中,分组给药处理24 h,再加入H2O2并给药处理12 h,用PBS 清洗2 次,4%多聚甲醛室温固定30 min 后,采用鬼笔环肽和DAPI 对OCs 细胞核及F-actin 环进行免疫荧光染色,最后于激光共聚焦显微镜下观察并拍照。
2.5 ELISA 检测OCs 骨吸收作用
将无菌的牛皮质骨切片置于96 孔板,然后将RAW264.7 细胞接种于板中,培养8 h 后分组给药处理36 h,再加入H2O2并给药处理36 h,按照ELISA试剂盒说明书检测上清液中Ca2+、PINP、CTX-I 的含量。
2.6 ROS 水平检测
以sRANKL 诱导RAW264.7 细胞得到的OCs为对照组,细胞分组处理后用PBS 清洗,每孔加入含10 μmol/L DCFH-DA 的无血清培养基,37 ℃孵育30 min,PBS 清洗后,于485 nm 激发波长和528 nm 发射波长下检测其荧光值。
2.7 NADPH 氧化酶及抗氧化酶活性测定
将sRANKL 诱导的RAW264.7 细胞分化的OCs分组给药处理36 h,再加入H2O2并给药处理24 h,PBS 清洗后低温裂解30 min,于4 ℃、12 000 r/min离心15 min,取上清并按照试剂盒说明书检测NOX2、NOX4、HO-1、NQO1 和γ-GCS 活性。
2.8 Western blotting 检测蛋白表达
设置对照组、模型组、给药组以及ML385(5 μmol/L)或BAY 11-7082(1.5 μmol/L)处理的抑制剂组,分组处理后,收集并裂解细胞获得蛋白,通过BCA 法测定总蛋白浓度,并定量为等浓度等体积的蛋白样品,加入上样缓冲液,100 ℃加热10 min 使蛋白变性,蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,置于5%牛血清白蛋白溶液室温封闭2 h,分别加入c-Fos、CTSK、MMP9、NFATc1、TRAF6、IκBα、p-p65、p65、Nrf2、Keap1及GAPDH 抗体,于4 ℃孵育过夜后TBST 洗膜;加入二抗室温孵育1 h,TBST 洗膜,用ECL 化学发光法进行显影,采用Image J 软件分析条带灰度值。
2.9 p65 及Nrf2 免疫荧光染色
将RAW264.7 细胞接种于玻底细胞培养皿中,分组给药处理48 h,再加入H2O2并给药处理4 h,PBS 清洗2 次,4%多聚甲醛室温固定30 min,继续用PBS 清洗2 次,加入5%牛血清白蛋白于37 ℃封闭1 h,分别加入p65 和Nrf2 抗体稀释液,4 ℃孵育过夜,PBS 清洗2 次,加入荧光二抗室温避光孵育30 min,PBS 清洗2 次后加入DAPI 室温避光染色10 min,用PBS 清洗2 次后再加入200 μL PBS,于激光共聚焦显微镜下观察并拍照。
2.10 统计学分析
3 结果
3.1 OGB 对RAW264.7 细胞活力及H2O2 诱导的OCs 形成和分化的影响
如图1-A 所示,与对照组比较,20 μmol/L NAC以及1、5、10 μmol/L OGB 处理36 h 后,在药物处理的同时加入 20 μmol/L H2O2再处理 36 h,RAW264.7 细胞的活力均无明显变化。TRAP 特异性地分布于OCs 中,如图1-B、C、D 所示,NAC显著减少TRAP 阳性细胞数量(P<0.01),OGB 可剂量相关性地显著降低OCs 的TRAP 活性(P<0.05、0.01),减少TRAP 阳性细胞数目(P<0.01),表明OGB 可显著抑制OCs 的形成和分化。
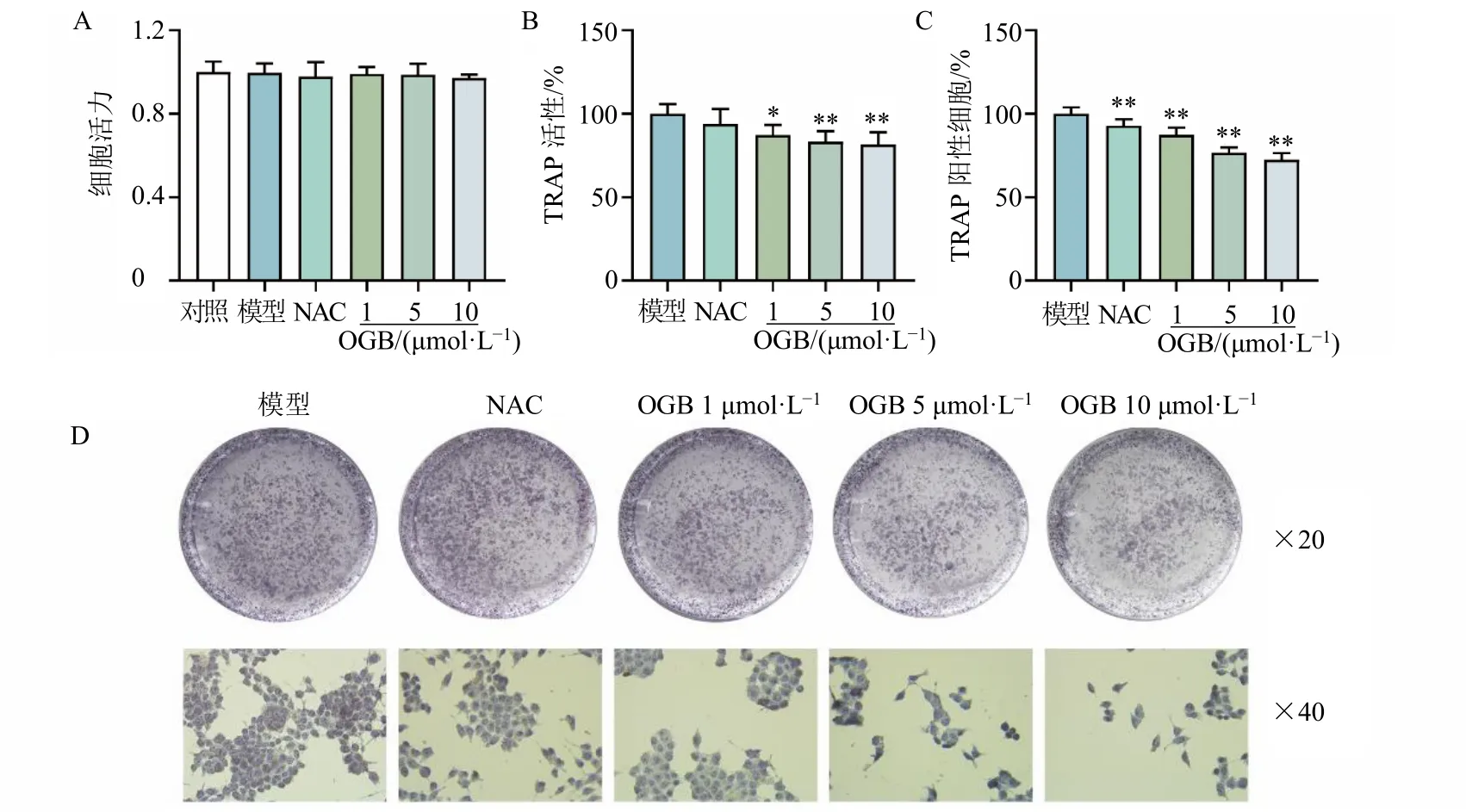
图1 OGB 对sRANKL 和H2O2 诱导的RAW264.7 细胞活力 (A)、TRAP 活性 (B)、TRAP 阳性细胞数 (C、D) 的影响(±s, n = 6)Fig.1 Effect of OGB on RAW264.7 cells activity (A), TRAP activity (B), number of TRAP positive cells (C, D) induced by sRANKL and H2O2 (±s, n = 6)
3.2 OGB 对H2O2诱导的OCs 的F-actin 环形成和骨吸收的影响
F-actin 环是OCs 发挥骨吸收功能的重要结构,如图2-A 所示,H2O2诱导的OCs 的F-actin 环厚且完整,不同浓度的OGB 处理后,OCs 的F-actin 环变薄、缺失,甚至消失,表明OGB 可抑制OCs 的F-actin 构建。
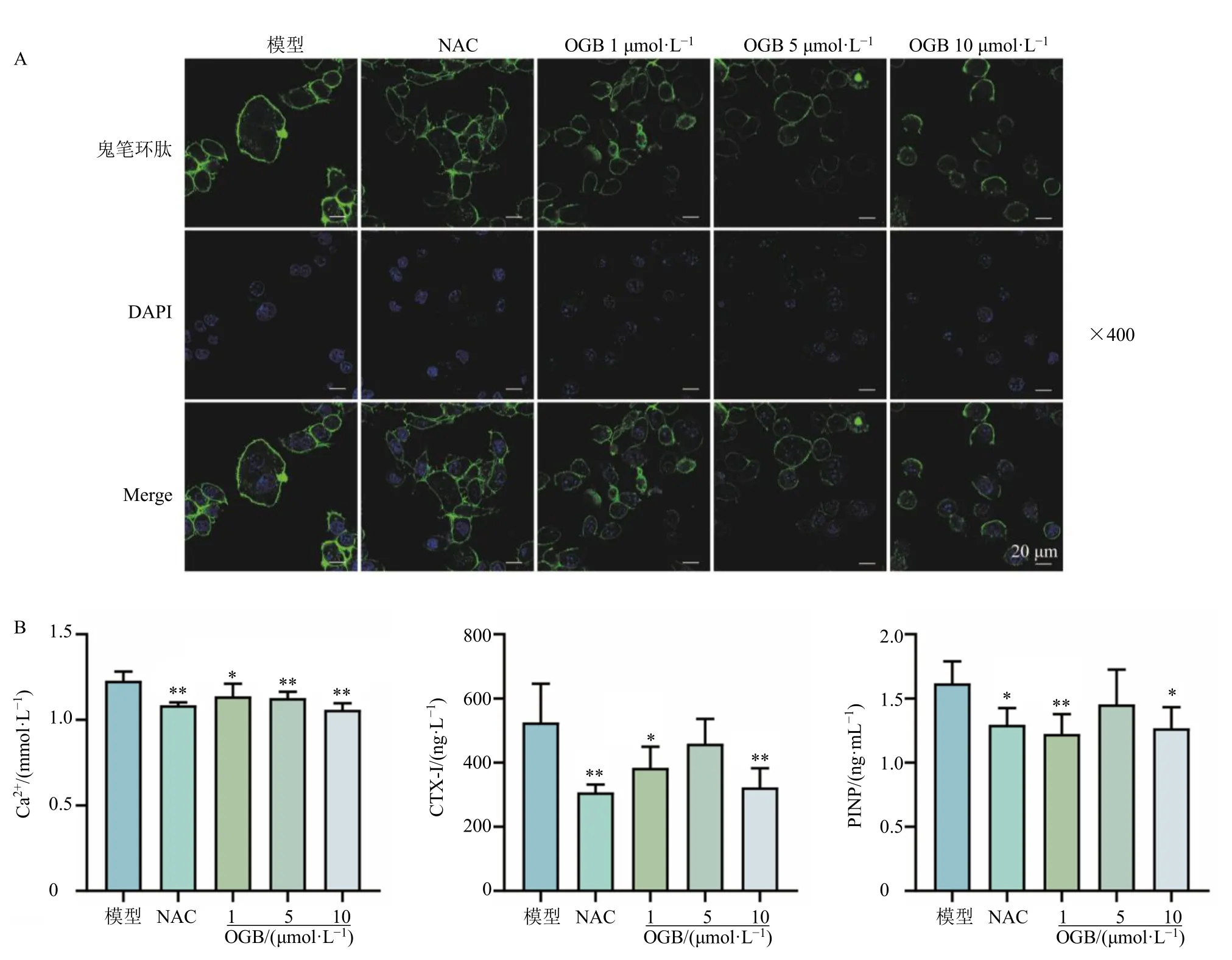
图2 OGB 对H2O2 诱导的OCs 的F-actin 环形成 (A) 及骨吸收活性 (B) 的影响 (±s, n = 4)Fig.2 Effect of OGB on construction of F-actin ring (A) and bone resorption activity (B) of OCs induced by H2O2(±s, n = 4)
OCs 能够分泌骨基质降解酶,降解骨基质,释放Ca2+以及胶原降解产物如CTX-I 和PINP,因此,培养OCs 的培养基中Ca2+及CTX-I 和PINP 的水平可用于表征其骨吸收活性。如图2-B 所示,NAC 显著降低培养基中Ca2+、CTX-I 和P1NP 的水平(P<0.05、0.01);OGB 能够剂量相关性地显著降低培养基中Ca2+的含量(P<0.05、0.01),降低培养基中CTX-I 和P1NP 的水平(P<0.05、0.01),显示出显著抑制OCs 骨吸收活性的作用。
3.3 OGB 对H2O2 诱导的OCs 骨吸收相关蛋白表达的影响
转录因子NFATc1 和c-Fos 介导OCs 的形成分化,促进骨吸收相关蛋白MMP9 和CTSK 的表达,使OCs 发挥骨吸收作用。如图3 所示,与模型组比较,OGB 能够显著下调H2O2诱导的OCs 的c-Fos、CTSK 和MMP9 的表达(P<0.05、0.01),但对NFATc1 的表达无显著影响。
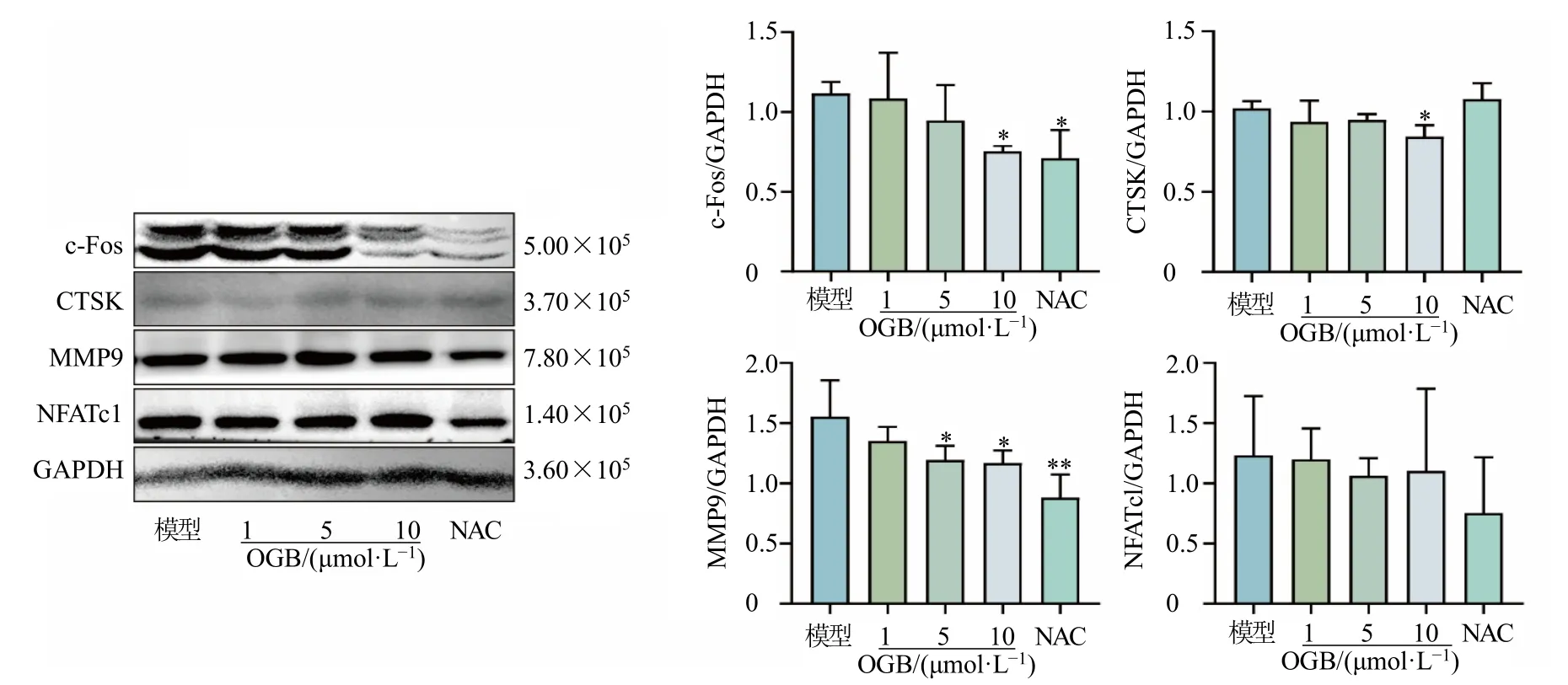
图3 OGB 对H2O2 诱导的OCs 骨吸收相关蛋白表达的影响 (±s, n = 3)Fig.3 Effect of OGB on expressions of bone resorption related proteins in OCs induced by H2O2 (±s, n = 3)
3.4 OGB 对H2O2 诱导的OCs 的ROS 水平及NADPH 氧化酶和抗氧化酶活性的影响
H2O2诱导增加OCs 的ROS 水平,促进OCs 的形成、分化和骨吸收活性。ROS 的产生由NADPH氧化酶调控,HO-1、NQO1、γ-GCS 等抗氧化酶可对抗ROS 对细胞产生的氧化应激。如图4-A 所示,H2O2处理显著增加OCs 内ROS 的水平(P<0.05),NAC 和OGB 可显著降低H2O2诱导的OCs 内ROS的水平(P<0.05、0.01)。如图4-B、C 所示,H2O2的诱导使OCs 的NOX4 活性显著增加(P<0.01),NAC 和高剂量的OGB 可以显著抑制OCs 的NOX4活性(P<0.05、0.01),但H2O2及NAC 和OGB 对OCs 的NOX2 活性均无明显的影响。如图4-D、E、F 所示,H2O2显著降低OCs 内HO-1 和NQO1 的活性(P<0.05、0.01),NAC 和OGB 处理后,HO-1、NQO1 的活性显著增加(P<0.05、0.01);H2O2处理显著增加OCs 的γ-GCS 活性(P<0.01),相较模型组,NAC 和OGB 处理对OCs 的γ-GCS 活性没有显著的影响,表明OGB 可减缓H2O2引起的OCs氧化应激。
3.5 OGB 对H2O2诱导的OCs 中Nrf2 通路的调控作用
Nrf2 是调控氧化应激的关键转录因子。如图5所示,OGB 能够增加H2O2诱导的OCs 的Nrf2 表达(P<0.05)及其核转位,但对其Keap1 的表达没有显著的影响,Nrf2 通路抑制剂ML385 在一定程度上逆转OGB 对OCs 的Nrf2 核转位的促进作用,表明OGB 能够通过激活Nrf2 通路减缓H2O2诱导的OCs 的氧化应激。
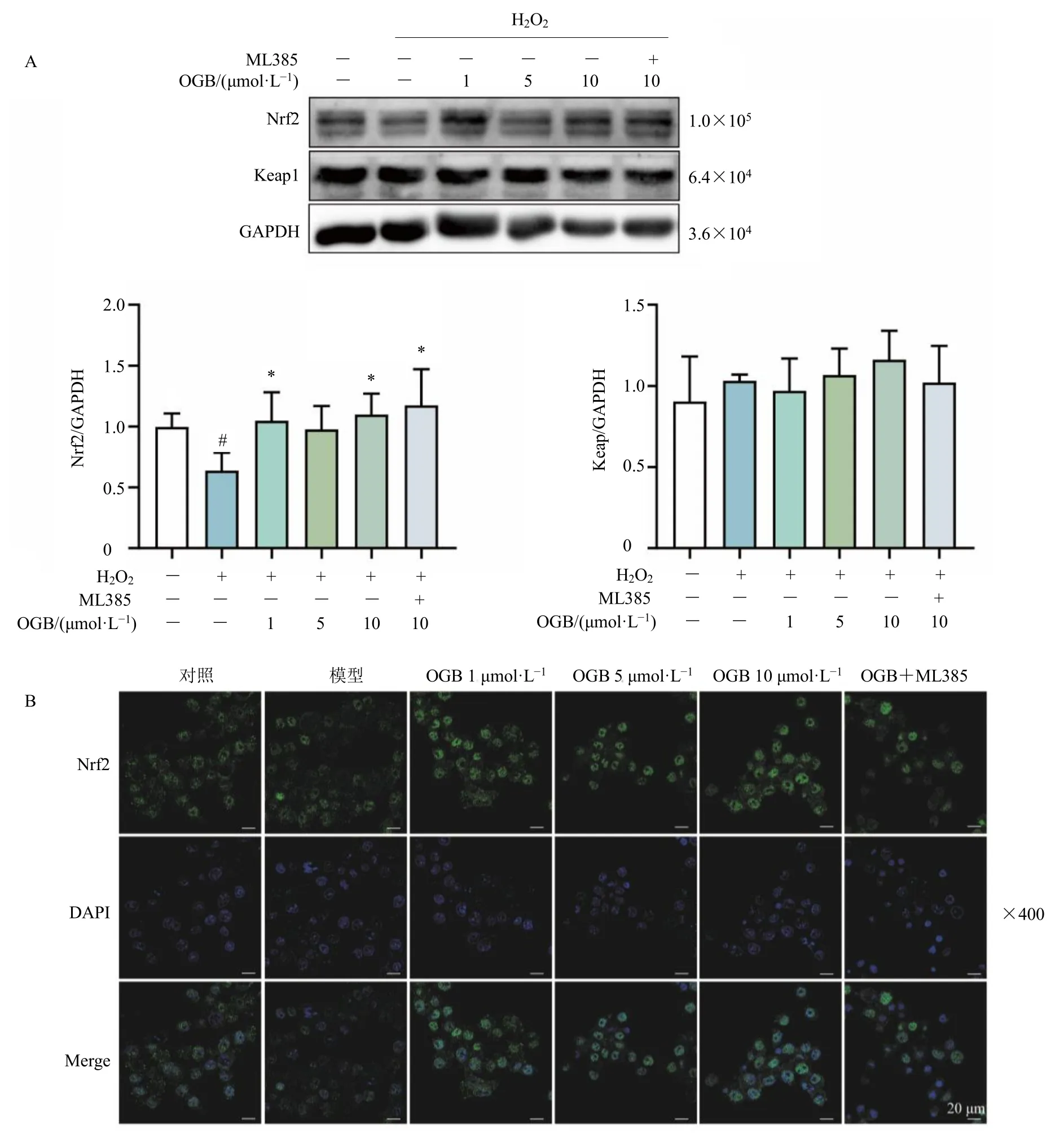
图5 OGB 对H2O2 诱导的OCs 中Nrf2 通路 (A) 和Nrf2 核转位 (B) 的调控作用 (±s, n = 3)Fig.5 Regulatory effect of OGB on Nrf2 pathway (A) and nucleus translocation of Nrf2 (B) in OCs induced by H2O2(±s, n = 3)
3.6 OGB 对H2O2诱导的OCs 中NF-κB 通路的调控作用
进一步研究了OGB 对H2O2诱导的OCs 中NFκB 通路的调控作用。如图6 所示,OGB 能够显著抑制TRAF6 的募集(P<0.05),降低IκBα 的降解(P<0.05),抑制p65 的磷酸化(P<0.05),阻止p65的入核,进而抑制NF-κB 通路的激活。当OGB 与NF-κB 通路抑制剂BAY 11-7082 联用后,OGB 对IκBα 降解的抑制作用增强(P<0.05),表明OGB 能够通过抑制NF-κB 通路的激活,抑制OCs 的形成和分化。
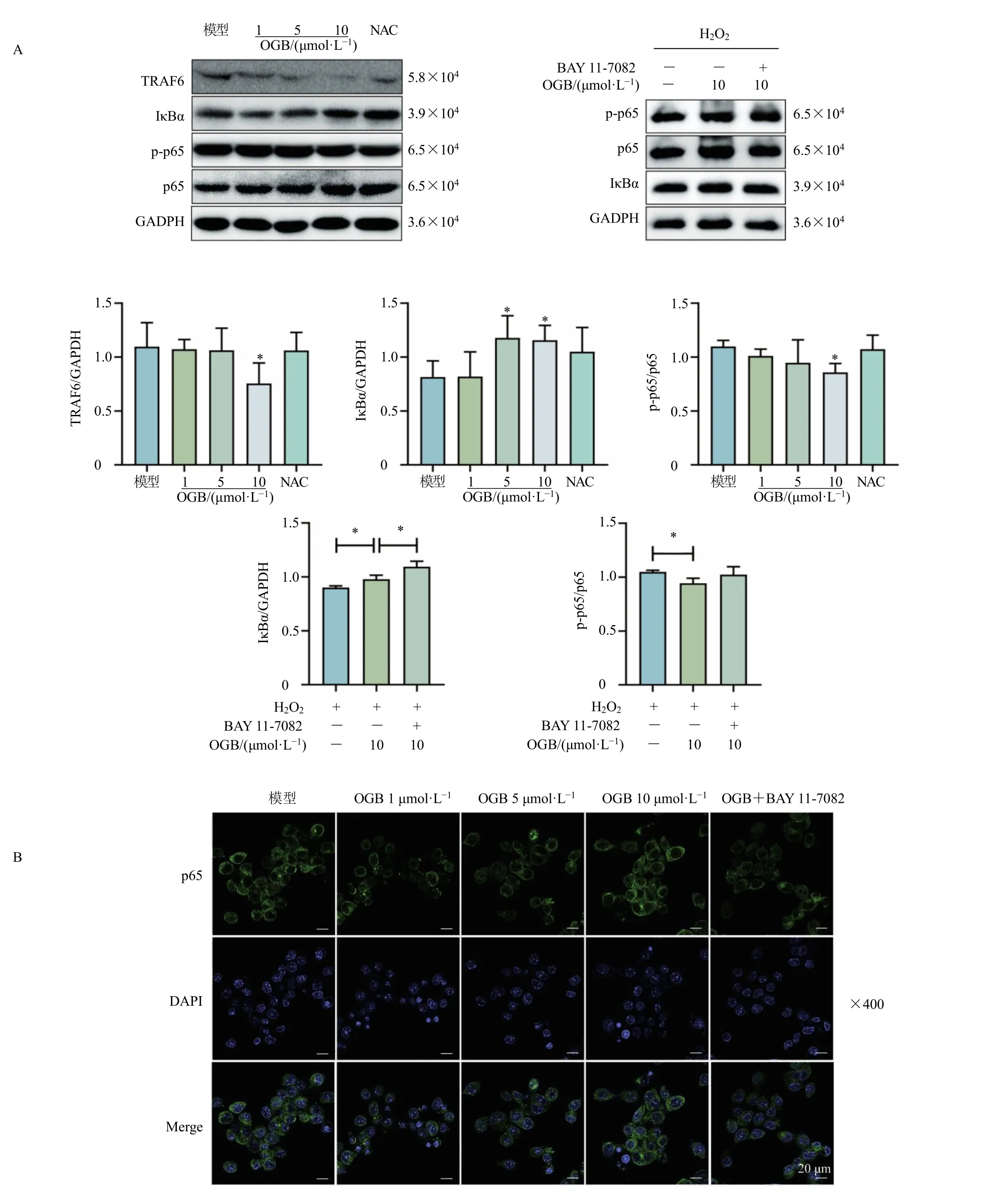
图6 OGB 对H2O2 诱导的OCs 中NF-κB 通路 (A) 和p65 核转位 (B) 的调控作用 (±s, n = 3)Fig.6 Regulatory effect of OGB on NF-κB pathway (A) and nucleus translocation of p65 (B) in OCs induced by H2O2(±s, n = 3)
4 讨论
雌激素缺失和衰老导致的机体氧化应激已被证实是OP 发生的关键因素[19],减缓机体的氧化应激状态成为调控骨代谢、减少骨丢失的新策略。抗氧化剂NAC 能够阻止RANKL 介导的NF-κB、蛋白激酶B(protein kinase B,Akt)以及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路的激活,抑制OCs 的形成分化[20]。许多中药及天然化合物如白藜芦醇、红景天苷等也被证实能够调控机体氧化应激,具有减少骨丢失的作用[6]。课题组前期发现仙茅酚苷类成分对去卵巢大鼠和快速老化小鼠的骨丢失具有确切的防治作用[17,21],并可通过对抗氧化应激降低ROS 对成骨细胞功能的损伤作用和对OCs 功能的激活作用[22],仙茅苔黑酚葡萄糖苷也被证实可通过与p38 结合,促进成骨细胞活性,减缓糖皮质激素所致OP 小鼠的骨丢失[23]。本研究进一步发现OGB 抑制氧化应激OCs 的形成分化和骨吸收的作用,并揭示了OGB 发挥这一作用的机制。
OCs 作为唯一进行骨吸收的功能细胞,其形成分化受转录因子NFATc1 和c-Fos 的调节[24]。OCs通过F-actin 环附着在骨基质上,分泌TRAP、MMP9和CTSK,降解骨矿物质和骨胶原,进行骨吸收[25]。研究发现,抗氧化剂NCA 以及OGB 可显著减少H2O2诱导的OCs 的TRAP 活性及TRAP 阳性细胞的数目,抑制其转录因子c-Fos 的表达、F-actin 环的形成及骨基质降解酶MMP9 和CTSK 的活性,降低骨基质降解产物Ca2+、CTX-I 和PINP 的释放,显示出良好的抑制H2O2诱导的OCs 形成分化和骨吸收活性作用,与阳性药NAC 相比,OGB 具有相同甚至更好的抗OP 作用。
氧化应激诱导OCs 的形成和分化。NADPH 氧化酶,如NOX1、NOX2 和NOX4 参与调控OCs 中ROS 产生,骨骼中过多的ROS 将直接增加OCs 活性[26]。氧化应激状态下,ROS 激活的OCs 骨吸收作用是由转录因子Nrf2 调控的[27],稳态条件下,Nrf2被细胞质中的Keap1 结合,进行泛素介导的降解,而氧化应激则导致Keap1 释放,阻止了Nrf2 的降解,此时Nrf2 被激活并转位到细胞核中,促进HO-1、NQO1、γ-GCS 和G6PD 等抗氧化基因的转录和表达,调节OCs 内ROS 水平,调控RANKL 依赖的OCs 形成和分化,减缓骨质的破坏[28]。研究发现,OGB 能够降低H2O2诱导的OCs 中NOX4 水平,促进Nrf2 的表达和核转位,进而提高抗氧化酶HO-1、NQO1 和γ-GCS 的水平,清除ROS,表明OGB可激活Nrf2 通路减缓OCs 的氧化应激。
氧化应激状态下,ROS 还将作为第二信使激活OCs 的NF-κB 信号通路[29]。在OCs 分化和成熟的过程中,RANKL 和ROS 促进TRAF6 的募集,激活下游NF-κB 通路,IκB 被IκB 激酶复合物磷酸化并从三聚体解离,p65 表现出核转位的活性,入核后诱导OCs 转录因子c-Fos 的表达,调节MMP9、CTSK 以及TRAP 的表达和活性,促使OCs 的骨吸收作用[30]。本研究证实OGB 能够抑制氧化应激OCs的TRAF6 募集,抑制IκBα 的降解、p65 的磷酸化及其核转位,表明OGB 可通过抑制H2O2诱导OCs的NF-κB 通路激活,抑制OCs 的形成分化和骨吸收作用。
综上,本研究阐明了OGB 通过调节NF-κB 和Nrf2 通路减缓H2O2诱导的OCs 氧化应激和骨吸收的机制,结合前期文献报道可为仙茅酚苷类成分的开发利用,以及仙茅防治OP 的临床应用提供科学依据。
利益冲突所有作者均声明不存在利益冲突
