基于转录组测序的兔儿伞羽扇豆醇合成途径及关键酶基因研究
2024-02-27张京晶许景垚单婷玉赵历强钟欣欣张帅帅吴家文
张京晶, 许景垚, 单婷玉, 赵历强, 钟欣欣, 张帅帅, 吴家文
(1. 安徽中医药大学研究生院, 合肥 230012; 2. 安徽中医药大学科研技术中心新安医学教育部重点实验室, 合肥 230038; 3. 安徽省中医药科学院, 合肥 230012; 4. 安徽道地中药材品质提升协同创新中心, 合肥 230012)
兔儿伞(Syneilesisaconitifolia(Bunge)Maxim),又名贴骨伞、龙头七,为菊科(Compositae)兔儿伞属草本植物。兔儿伞以根或全草入药,多用于治疗痈疽肿毒、痨疬和抗肿瘤等,极具经济及药用价值[1-2]。
兔儿伞含有三萜、生物碱及黄酮[3]等活性成分,其中,三萜类物质是一类结构复杂多样、生物学功能丰富的次生代谢产物,可依照结构中所具有的碳环数划分为单环、双环、三环、四环和五环三萜,其中,五环三萜类物质如羽扇豆醇有广泛的药理作用及生物活性,具有免疫调节、抗病毒及抗肿瘤等功效[4-7]。
五环三萜类化合物经MVA(甲羟戊酸)及MEP(甲基-D-赤藓糖醇-4-磷酸)途径完成其生物合成[8],虽然两条途径的起始端及路径各不相同,但二者都可以产生所有合成萜类的基本单位:IPP(异戊烯基焦磷酸)与DMAPP(二甲丙烯焦磷酸)。IPP和DMAPP结合为GPP(牻牛儿基焦磷酸),GPP再和IPP在FPPS(法尼基焦磷酸合酶)的作用下以头尾连接的方式生成FPP(法尼基焦磷酸);而后2分子FPP在SS(角鲨烯合成酶)催化下形成1分子SQ(角鲨烯),再经SE(角鲨烯环氧酶)氧化形成2,3-氧化角鲨烯,此阶段是三萜类化合物的公共起始阶段;2,3-氧化角鲨烯通过构象变化生成dammarenyl阳离子中间体,再转化生成五环的lupanyl阳离子,进而形成五环三萜类物质羽扇豆醇[9-10]。
RNA-Seq(转录组测序技术)目前已广泛用于中草药功能基因、关键酶基因挖掘及活性成分生物合成途径研究等方面[11-13]。近年来,研究人员已从人参[14-15]、刺五加[16-18]等植物中获得了FPPS、SS和SE酶基因,但目前尚未有对兔儿伞转录组测序及关键酶基因的研究报道。本研究通过RNA-Seq对兔儿伞4个组织(叶、茎、根及根茎)进行转录组测序,进而对羽扇豆醇生物合成途径及关键酶基因进行分析,并比较其在各组织中的差异表达,为兔儿伞羽扇豆醇生物合成途径的解析提供依据。
1 材料与方法
1.1 材料
1.1.1 样品及总RNA提取
兔儿伞植株于2021年4月采摘自安徽中医药大学(少荃湖校区)药园,经安徽中医药大学杨青山教授鉴定为菊科兔儿伞属植物兔儿伞。将现采的兔儿伞植株经灭菌水冲洗干净,取其叶、茎、根及根茎4个组织(各3个生物学重复),擦干水分后立即置于液氮之中,冻存大约1 h,再放入-80 ℃冰箱备取。使用RNA试剂盒(美国,OMEGA)和安捷伦2100生物分析仪(美国,AGILENT)进行4个组织总RNA的提取,以及对所提取RNA的完整性及浓度进行检测。
1.2 方法
1.2.1 cDNA文库构建
利用获取的总RNA完成mRNA纯化,将其富集和片段化处理,再加入随机引物进行反转录,构成双链cDNA,从而进行cDNA的5′端磷酸化及3′端加A尾,使其与测序接头相连。最终,筛选合适的片段,完成PCR扩增,构建cDNA文库。
1.2.2 转录组测序与组装
利用DNBSEQ测序平台[19]完成对兔儿伞4个组织的cDNA文库测序。将原始数据内质量低、接头受污染、未知碱基N含量高于5%的读段进行筛选清除,获取高质量读段。通过Trinity[20]软件完成高质量读段从头组装,得到转录本序列,再运用TGICL[21]软件完成对转录本的聚类及去冗余,获取Unigenes。
1.2.3 Unigenes的富集及注释
运用Map Man软件进一步对兔儿伞FPKM(Fragments per kilobase million)值大于1的Unigenes于总代谢途径中进行富集与分析。利用NCBI BlastX[22]软件将Unigenes分别注释于KOG(蛋白直系同源数据库)、KEGG(京都基因与基因组百科全书)和GO(基因本体论数据库)。
1.2.4 序列比对、空间结构分析
通过ExPASy Translation Tool(https://web.expasy.org/translate/)检测兔儿伞FPPS、SS和SE的开放阅读框(ORF)序列,运用DNAMAN(6.0.3.99)和CLUSTALX(1.83)软件将编码FPPS、SS和SE的Unigenes序列分别比对分析,通过Swiss Model在线平台(https:∥swissmodel.expasy.org/)及PyMOL软件对关键酶FPPS、SS和SE的空间结构模型进行描绘。
2 结果与分析
2.1 转录组测序与数据组装
运用DNBSEQ测序平台对兔儿伞进行转录组测序,共获取125.2 Gb数据,其叶、茎、根及根茎的转录组高质量读段Q30(质量值≥30的碱基所占百分比)均大于90%。数据组装高质量读段后,最终生成191 541条Unigenes。
2.2 兔儿伞Unigenes总代谢途径富集
运用MapMan软件将兔儿伞FPKM值大于1的Unigenes于总代谢途径中进行富集与分析。结果显示,在总代谢途径中,Unigenes主要富集于脂类和次生代谢通路中,并对其进行进一步研究分析,发现在次生代谢通路中Unigenes则主要富集于萜类、黄酮类、苯丙素类代谢途径(图1)。
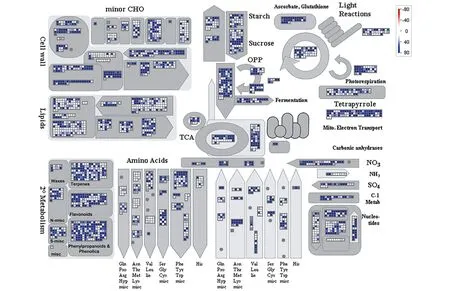
图1 兔儿伞中FPKM>1的Unigenes在总代谢中的富集及表达水平Figure 1 Enrichment and expression level of Unigenes(FPKM>1)from S. aconitifolia in total metabolism
2.3 蛋白直系同源数据库(KOG)分类
利用KOG数据库对组装获得的Unigenes进行注释,共有126 126条Unigenes被注释到25个类别中。其中,注释到“一般功能”“信号转导机制”和“蛋白质修饰后翻译、蛋白质转化或蛋白伴侣”这3类功能的Unigenes最为丰富,分别为24 456、15 705和10 408条(图2)。
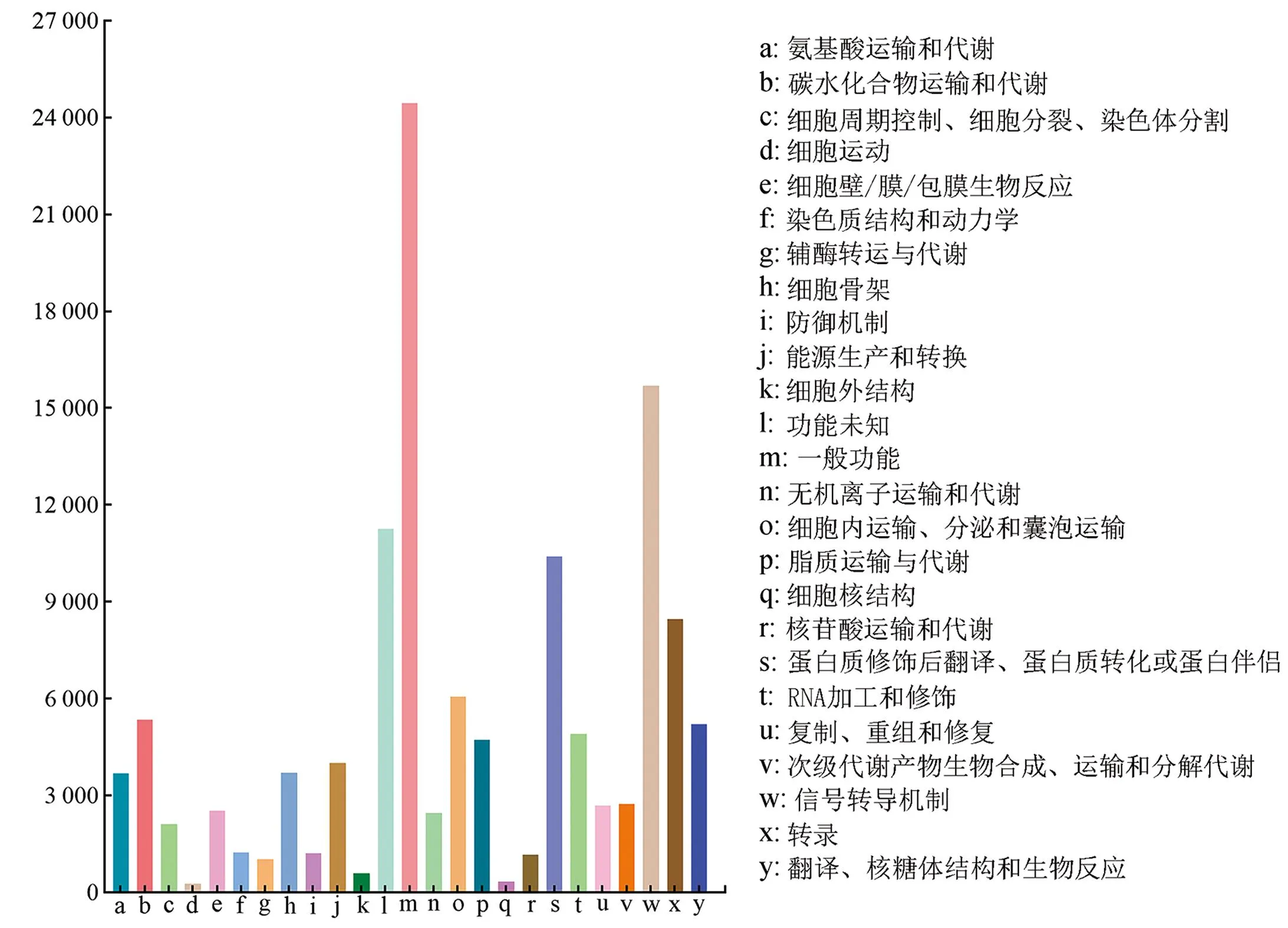
图2 兔儿伞Unigenes的KOG功能分类Figure 2 Functional classification of S. aconitifolia Unigenes in KOG database
2.4 兔儿伞羽扇豆醇生物合成相关Unigenes的GO分析
结果表明,共有6 742条与兔儿伞羽扇豆醇生物合成相关的Unigenes被注释GO数据库,并将其归为分子功能、细胞组成、生物过程3种类别。其中,分子功能内具有“催化活性”的Unigenes为1 628条,具有“结合”功能的Unigenes为1 050条;细胞组成内含954条Unigenes聚类在“细胞结构体”,487条Unigenes聚类在“细胞内”;生物过程中聚类在“代谢过程”的Unigenes为1 059条,聚类在“细胞过程”的Unigenes为946条”(图3)。
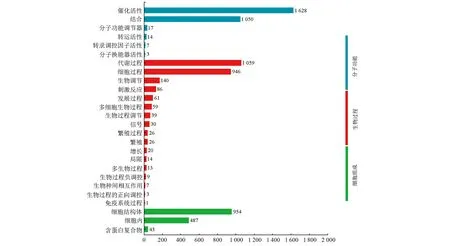
图3 兔儿伞羽扇豆醇生物合成相关Unigenes的GO分析Figure 3 GO analysis of Unigenes associated with biosynthesis of lupeol in S. aconitifolia
2.5 兔儿伞羽扇豆醇生物合成差异表达基因(DEGs)分析
兔儿伞以根或全草入药,本研究将其根与其他各组织的差异基因表达水平进行比较分析[图4(a)];在3个比较组中含24条共有的DEGs参与羽扇豆醇生物合成,其中,有3条(CL12331-1、CL12331-2、CL4703-5)编码HMGR,3条(CL12247-8、CL4159-1、CL4159-4)编码DXS,1条(Un46968)编码MVK,1条(Un63137)编码FPPS,1条(CL3814-6)编码SS,1条(Un69301)编码SE[图4(b)]。

(a)兔儿伞羽扇豆醇生物合成途径中DEGs数目,与叶、茎及根茎相比,根中具有高或低表达水平的DEGs分别定义为“上调”和“下调”;(b)参与羽扇豆醇生物合成中差异表达基因比较维恩图。图4 兔儿伞羽扇豆醇生物合成途径差异基因数目Figure 4 Number of differentially expressed genes involved in lupeol biosynthesis by S. aconitifolia
2.6 通过KEGG鉴定羽扇豆醇生物合成相关Unigenes
通过KEGG数据库对兔儿伞Unigenes进行注释,发现14条与其他次生代谢生物合成相关的通路,其中,注释到“苯丙素生物合成途径”的Unigenes数目最多[图5(a)],而在与羽扇豆醇生物合成代谢相关的途径中,Unigenes最为丰富的是“萜类骨架生物合成途径”[图5(b)]。萜类骨架生物合成途径、倍半萜和三萜生物合成途径是羽扇豆醇合成的主要代谢途径,包括AACT、DXS、IPPI等17个关键酶(表1)。
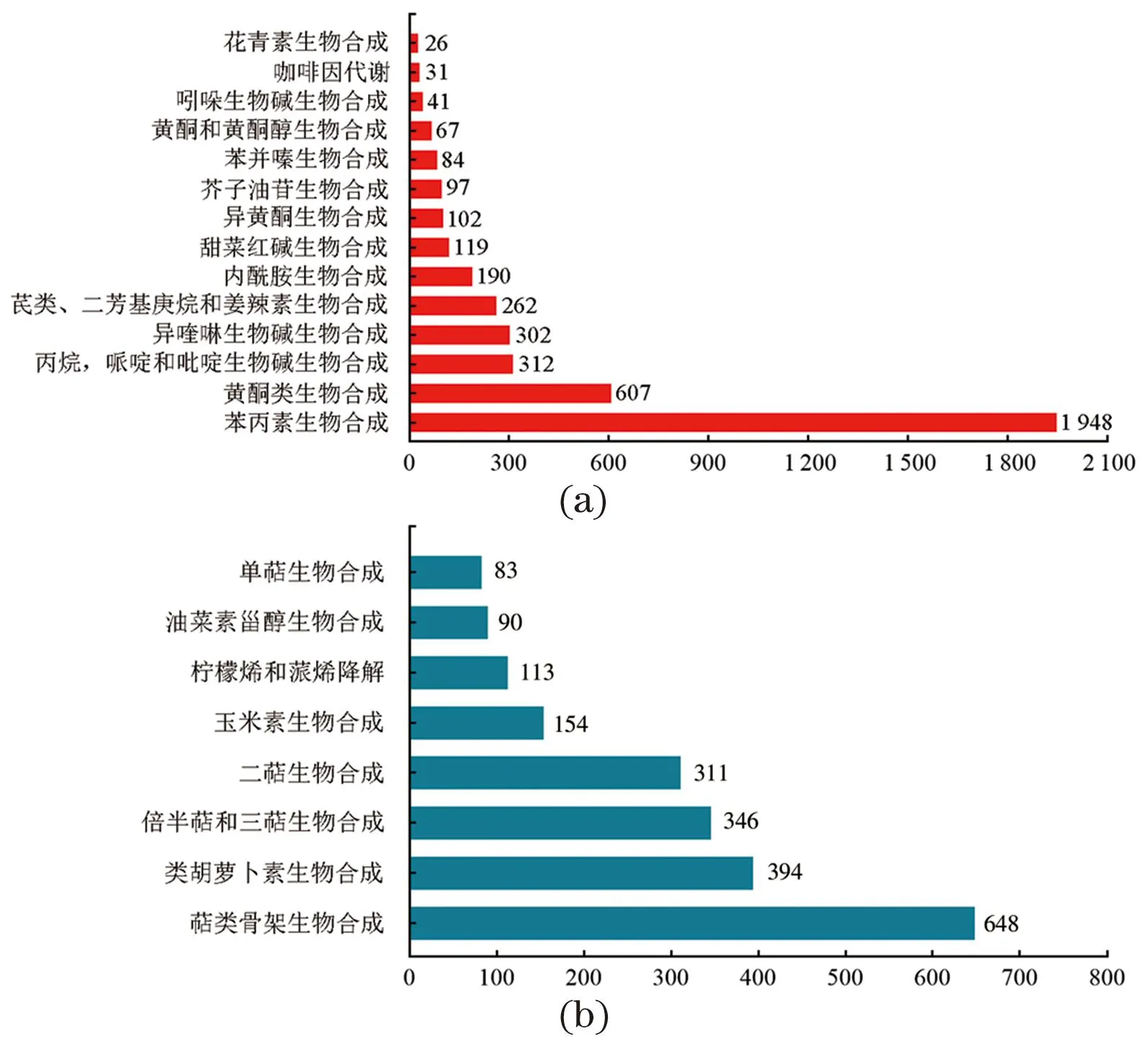
(a)其他次生代谢产物的生物合成途径分类及相关Unigenes数目;(b)羽扇豆醇生物合成途径分类及相关Unigenes数目。图5 兔儿伞Unigenes的KEGG生物合成途径分类Figure 5 KEGG biosynthetic pathway classification of S. aconitifolia Unigenes
以FPKM>1及Q值<0.05为筛选条件,在MVA途径中分别有6、3、6、2、3、3、4条Unigenes编码AACT、HMGS、HMGR、MVK、PMK、MVD和IPPI,在MEP途径中分别有3、3、2、3、1、3、3、4条Unigenes编码DXS、DXR、MCT、CMK、MDS、HDS、HDR和IPPI,而在生成羽扇豆醇的过程中有4、6、2条Unigenes分别编码FPPS、SS和SE。以上关键酶的Unigenes在4个组织中基因表达水平的差异分别以热图形式呈现(图6)。
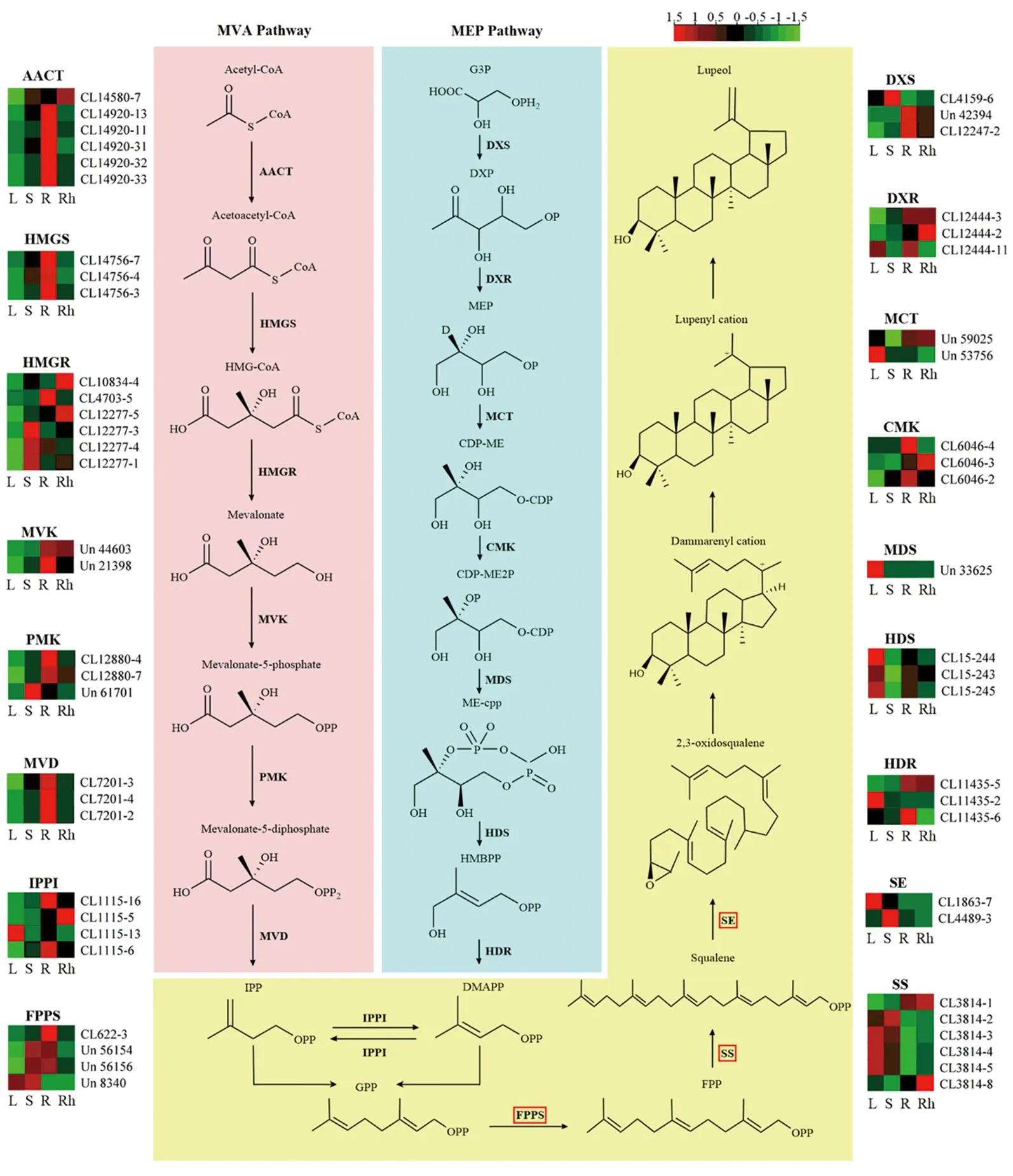
粗体字表示羽扇豆醇生物合成途径中涉及的关键酶;热图表示编码关键酶的基因在4个组织中的表达水平,红色和绿色分别代表基因表达水平的高和低;L、S、R、Rh分别表示叶、茎、根、根茎4个组织。图6 兔儿伞羽扇豆醇生物合成途径Figure 6 Biosynthesis pathway of lupeol in S. aconitifolia
2.7 SaFPPS、SaSS和SaSE的序列和结构分析
本研究在兔儿伞转录组数据库中发掘了羽扇豆醇生物合成途径中4个SaFPPS、6个SaSS和2个SaSE的基因序列,分别选择了其中具有完整读码框且表达量较高的基因(CL622-3、CL3814-1和CL1863-7)为研究对象,分别以杜仲(Eucommiaulmoides)的FPPS晶体结构(PDB ID: 7bux.1)[23]、人类的SS晶体结构(PDB ID: 3vj8.1)[24]和人类的SE晶体结构(PDB ID: 6c6n.1)[25]为模板构建了SaFPPS、SaSS和SaSE的空间结构模型。
SaFPPS的空间结构是同源二聚体,其单体以α螺旋为主要元件,包含5个保守区域(Motif I~Motif V),具有典型的异戊烯基转移酶保守功能域即富含天冬氨酸的酶活性中心,分别是“93DDIMD97”和“232DDYLD236”(图7)。
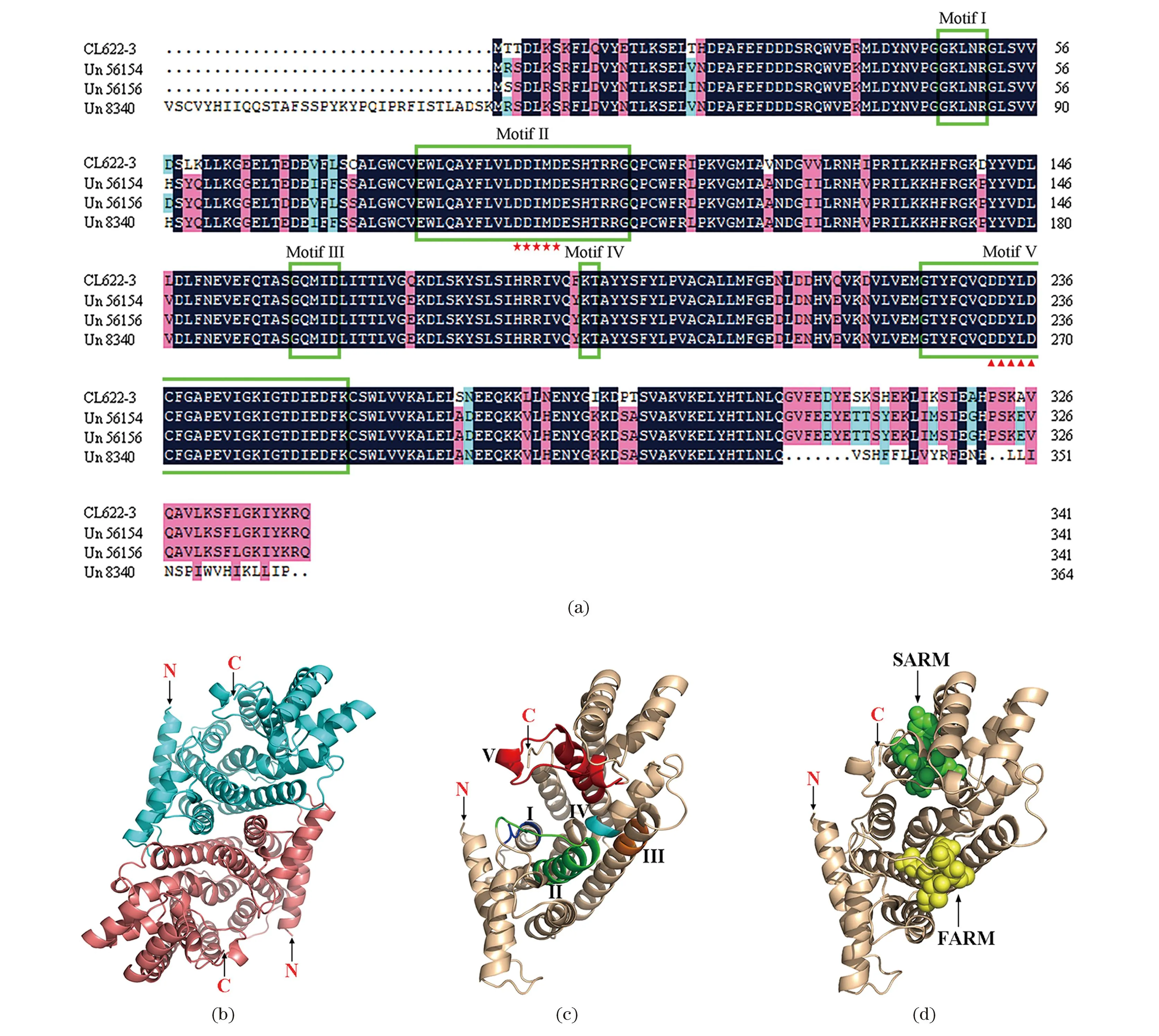
(a)4个SaFPPS基因的氨基酸序列比对(绿色方框示意保守结构域Motif I~Motif V、五角星示意FARM第1个天冬氨酸富含区、三角形示意SARM第2个天冬氨酸富含区)。(b)SaFPPS同源二聚体。(c)和(d)SaFPPS单体[(c)中深蓝色、绿色、橙色、荧光蓝和红色分别示意保守区域Motif I~Motif V;(d)中黄色和绿色球形结构分别示意93DDIMD97、232DDYLD236酶活性位点]。图7 SaFPPS氨基酸序列比对及蛋白空间结构模型Figure 7 Sequence alignment and structure model of SaFPPS
SaSS是一个单体球状蛋白,活性中心位于以α螺旋环绕所构成的中央疏水区域,含6个保守区域(Motif I~Motif VI),“47VSRSF51、77DTVED81、213DYLED217、R225”4个酶活性相关位点位于保守区域内(图8)。

(a)6个SaSS基因的氨基酸序列比对(红色方框示意保守结构域Motif I~Motif VI、五角星示意47VSRSF51、77DTVED81、213DYLED217、R225 4个酶活性相关位点)。(b)~(d)SaSS单体[(c)中深蓝色、绿色、红色、黄色、荧光蓝和橙色分别示意保守区域Motif I~Motif VI;(d)中绿色、紫色、荧光蓝、橙色球形结构分别示意47VSRSF51、77DTVED81、213DYLED217、R225酶活性相关位点]。图8 SaSS氨基酸序列比对及蛋白空间结构模型Figure 8 Sequence alignment and structure model of SaSS
SaSE空间结构模型是一个呈“U型”结构的同源二聚体,每个SaSE单体含有两个保守结构域(Motif I、Motif II),分别为“81DVIIV…VIER110”的NAD[P]结合域和“359PGALL…IVLL389”的底物结合域(图9)。
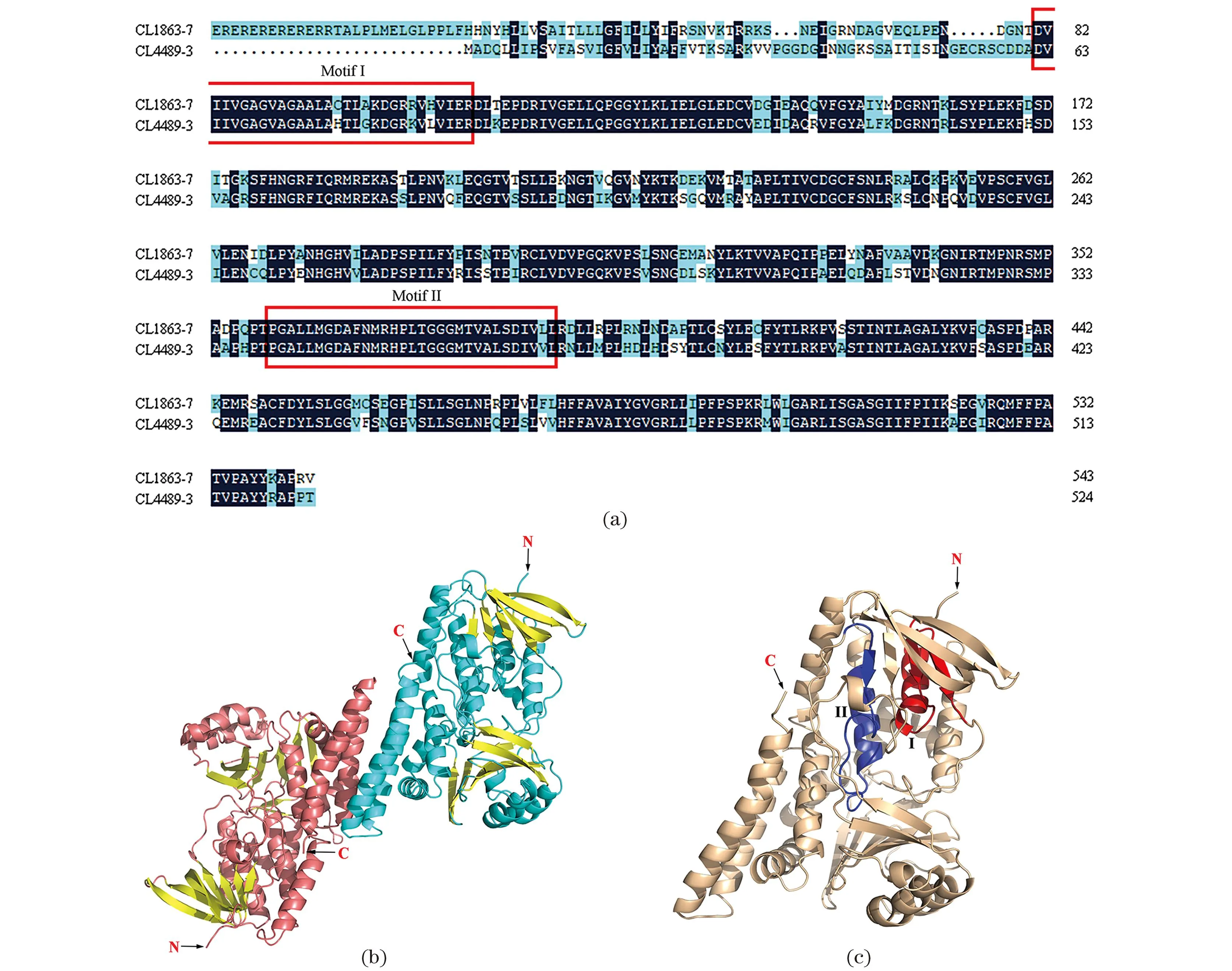
(a)两个SaSE基因的氨基酸序列比对(红色方框示意保守结构域Motif I、Motif II);(b)SaSE同源二聚体;(c)SaSE单体(红色和深蓝色分别示意“81DVIIV…VIER110”的NAD[P]结合域和“359PGALL…IVLL389”的底物结合域)。图9 SaSE氨基酸序列比对及蛋白空间结构模型Figure 9 Sequence alignment and structure model of SaSE
3 讨论与结论
五环三萜类物质羽扇豆醇是中草药兔儿伞内的活性成分,含有丰富的生理活性,如抗炎、抗癌及抗肿瘤[26-27]等,在中药研究领域备受关注。目前对兔儿伞的研究主要是在其有效成分的提取、鉴定及药理作用等方面,而未见有对兔儿伞转录组及功能基因的研究报道,这一定程度上限制了兔儿伞基因资源的研发与利用。本研究通过高通量测序技术获取了兔儿伞中叶、茎、根及根茎的转录组数据,并利用功能基因注释进一步发掘兔儿伞羽扇豆醇生物合成途径相关酶基因,结果显示,有160 534条(83.81 %)Unigenes成功获得了功能注释,但因目前缺乏兔儿伞基因组信息,其中,31 007条(16.19 %)Unigenes未能获得注释,故兔儿伞转录组数据中仍存在少数Unigenes功能未知,有待进一步挖掘。
运用Map Man软件分析兔儿伞FPKM>1的Unigenes,发现它们主要富集在次生代谢通路中的萜类、黄酮类、苯丙素类代谢途径。GO分析显示与兔儿伞羽扇豆醇生物合成相关的Unigenes主要聚集于生物过程中的“代谢过程”和分子功能中的“催化活性”功能,这些Unigenes的富集可为后期研究兔儿伞羽扇豆醇生物合成途径提供相应的基因信息。
兔儿伞中羽扇豆醇生物合成途径的395条Unigenes编码17个关键酶,参与了此途径中的各个关键步骤,其中,FPPS、SS和SE是兔儿伞羽扇豆醇生物合成下游阶段起始端的关键酶。本研究对这3个关键酶进行了序列及结构分析,为进一步阐明兔儿伞羽扇豆醇化合物生物合成的分子机制及其关键酶的功能和调控机制奠定基础。根中与羽扇豆醇生物合成代谢途径有关的特异性差异表达基因的发现,很可能对兔儿伞羽扇豆醇产量的调控研究具有重要意义。
FPPS是羽扇豆醇合成起始阶段的关键酶,可催化IPP和GPP合成转化为FPP,其催化活性中心由一个大的中心腔构成[28]。酿酒酵母FPPS保守结构域中的天冬氨酸残基发生突变,会显著降低FPPS的催化活性[29]。青蒿中的FPPS基因进行高表达可增加转基因青蒿植株中青蒿素的产量,而通过对人参发根中的FPPS过表达则可提高人参总皂苷的产量[30-31]。以上表明FPPS酶对代谢产物的合成起着关键作用。SaFPPS中Motif Ⅱ内的FARM基序有决定链长(chain length determination,CLD)的作用,Motif V内SARM基序上游含有一个保守序列(命名为FQ),FQ氨基酸位于底物结合腔中,维持GPP与IPP缩合所需的适当构象[32]。
SaSS能够催化FPP转变为SQ,其两个富含天冬氨酸的区域是与Mg2+的结合位点,主要结合异戊烯磷酸基团,是催化2分子FPP缩合为SQ的关键活性位点[33]。通过正向诱导刺激人参[34](Panaxginseng)、刺五加[35](Eleutherococcussenticosus)中SS的酶活性,使得植物中三萜类物质的含量显著提高。SaSE可催化反式角鲨烯于“C=C”双键中插入1个氧原子形成2,3-氧化鲨烯,是三萜类物质生物合成的第一个氧化反应。SaSE中的NAD[P]结合域内含有三萜及甾醇类物质合成必需的催化活性位点[36]。对人参SE基因进行诱导使其高表达时发现三萜类物质产量明显增加[37]。在解脂耶氏酵母中通过对SE和SS进行过表达,羽扇豆醇的产量能提高两倍左右[38]。由此可知,FPPS、SS、SE这3个关键酶在羽扇豆醇生物合成中均发挥着重要作用,它们的酶蛋白氨基酸序列具有高度保守的结构域和活性位点,很可能在药用植物中调控着五环三萜类物质的合成与积累。
本研究建立了兔儿伞叶、茎、根及根茎的转录组数据库,并对其功能基因进行了深入解析,通过分析其羽扇豆醇生物合成途径,挖掘此途径中的关键酶基因,为揭示羽扇豆醇合成的分子机制及关键酶结构和功能的进一步研究提供了依据,为未来利用基因工程技术提高羽扇豆醇化合物的产量奠定了基础。
