来源于Pseudomonas多巴脱羧酶的异源表达、纯化及酶学性质研究
2024-02-27周耀林孙登岳曾志雄
周耀林, 孙登岳,2, 曾志雄, 李 霞,2
(1. 齐鲁工业大学(山东省科学院)生物工程学部, 济南 250000; 2. 齐鲁工业大学(山东省科学院)生物基材料与绿色造纸国家重点实验室, 济南 250000)
多巴胺(3,4-二羟基苯乙胺,DOPA) 是一种广泛存在于人类和动物脑中的重要神经递质,在哺乳动物大脑中含量最为丰富,其约占大脑中儿茶酚胺总量的80%[1]。多巴胺生理功能在60多年前被发现[2],此后人们一直在努力揭示多巴胺在生物体中的作用及其相关的分子作用机制,研究发现,多巴胺参与调节一系列的机体行为调节过程,包括运动、药物成瘾、长时程增强(LTP)、食物摄入和激素分泌等[3-9];多巴胺还与生理过程的调节有关,如在大脑外周作为心血功能、血管张力、胃和胃肠道功能的调节剂[10]。此外,多巴胺浓度的变化与一些疾病密切相关,如帕金森病、精神分裂症、阿尔茨海默病和朊病毒病等[11-13]。
多巴脱羧酶(DODC)于1938年首次在哺乳动物肾脏组织中被发现[14],是酪氨酸合成黑色素代谢途径中的关键转化酶[12],可以催化左旋多巴(L-DOPA)脱羧生成多巴胺[15-16]。多巴脱羧酶广泛存在于哺乳动物、昆虫和植物中。在哺乳动物中,多巴脱羧酶常见于中枢及外围组织的神经元内,在肺部、肝部、肾、肾上腺和胃肠道等组织内也有较高的表达,参与机体调节。在昆虫中,多巴脱羧酶合成的多巴胺和5-羟基色氨作为一种帮助角质层硬化的前体物质,对昆虫的行为和发育起着重要的作用[17-18]。在植物中,多巴脱羧酶与植物的激素合成和成熟相关,此外,还能产生作为药物活性分子前体的芳香族生物碱[19]。
本研究对来源于Pseudomonas的DODC蛋白进行异源表达、纯化,对其酶学性质进行研究,通过同源序列对比和系统发育树对DODC的家族属性进行分析,确定了催化活性的关键位点,为以后该酶的利用及其改造提供一定的理论基础。
1 材料与方法
1.1 材料
大肠杆菌BL21(DE3)、DH5α和CV6-pGEX-6P-1质粒(N-端带GST标签)等都是本实验室保藏。酵母提取物、胰蛋白胨、NaCl等耗材均购自国药集团化学试剂有限公司(上海,中国);质粒提取试剂盒购自赛默飞公司;Glutathione Sepharose 4B树脂、离子交换色谱柱购自美国GE公司;限制性核酸内切酶SacⅠ、EcoRⅠ、连接酶SolutionⅠ和DNA Polymerase Prime STAR Max均购自Takara Bio公司(北京,中国);超滤管购自Millipore公司。
凝胶成像系统(Analytik Jena公司),SDS-PAGE系统(Hitachi公司),高速冷冻离心机(Hitachi公司),超声波破碎仪(美国SONICS公司),蛋白纯化仪(美国GE公司),高效液相色谱仪(日本岛津公司),PCR仪(德国Eppendorf公司)。
1.2 方法
1.2.1 DODC载体构建
DODC蛋白的基因序列(GeneBank No.WP 010953480.1)在金唯智公司(天津,中国)合成,以该基因为模板设计引物Primer F:CCGGAATTCATGGCCACCCCGGAACAGTTC;Primer R:TTCCGCGGCCGCTATGGCCGACGTCGACCTAGCCCTTAATAACATCTTGCAG。通过PCR扩增目的基因。扩增体系为25 μL,循环参数:98 ℃预变性30 s;98 ℃变性10 s,54 ℃退火15 s,72 ℃延伸5 s,运行30个循环;72 ℃保温10 min。扩增的目的基因和载体CV6-pGEX-6P-1用限制性内切酶EcoRⅠ和SacⅠ进行双酶切,然后进行切胶回收,用SolutionⅠ在16 ℃连接25 min。再用热激法转化至DH5α感受态细胞中,挑单菌落,分别进行菌落PCR和双酶切验证,最后送样进行验证。
1.2.2 重组蛋白表达与纯化
将构建好的重组质粒转化到BL21感受态细胞中过夜培养,挑取转化子转接到5 mL试管LB培养,再转接到1 L摇瓶LB中培养,待OD值达到0.6~0.8,加入异丙基β-D-1-硫代半乳糖苷(IPTG)至终浓度为0.1 mmol/L,诱导蛋白表达,16 ℃过夜培养12~16 h,4 ℃条件下4 000 r/min,离心15 min收集菌体。菌体置于裂解缓冲液[50 mmol/L Tris-HCl,pH 8.0,10%(体积比)甘油,0.4 mol/L氯化钠]中,并加入80 μL 50 mg/mL的溶菌酶,40 μL 1 mol/L的PMSF和10 μL β-巯基乙醇混匀。随后用超声波破碎仪在低温条件下破碎细胞,设置条件:超声破碎3 s,间隔5 s,功率40%(总500 W),时间10 min。破碎液于4 ℃、13 000 r/min离心60 min。取上清液与已平衡好的Glutathione Sepharose 4B树脂在混合仪上4 ℃温育2 h,随后将结合目的蛋白的树脂加入一次性层析柱中,用裂解缓冲液洗去杂蛋白,最后用洗脱缓冲液洗掉目的蛋白。用本实验室纯化3C蛋白酶于4 ℃过夜酶切去除GST标签蛋白,最后通过Source Q柱进一步纯化。
1.2.3 DODC酶学性质测定
以左旋多巴为底物,采用液相色谱法测定DODC的酶活性。反应体系(500 μL):100 mmol/L PBS缓冲液(pH 7.5),2 mmol/L左旋多巴底物,9.6 nmol/L多巴脱羧酶。在40 ℃条件下反应5 min后,于沸水浴孵育5 min终止反应。每组实验数据均重复3次,并设置对照组(将酶液替换成缓冲液,其余条件不变)。高效液相色谱条件:ZORBAX Eclipse Plus C18色谱柱(3 μm,4.6 mm×250 mm),流动相:2%乙酸溶液-甲醇(90∶10);流速0.5 mL/min;柱温:室温;检测波长280 nm;进样量40 μL。单位(U)被确定为每分钟1 μmol产物的生成量。
(1)最适反应温度和温度稳定性。在pH 7.0 PBS缓冲液(100 mmol/L)中,将反应体系分别置于20~65 ℃条件下进行测定[20]。将酶液分别置于20~65 ℃条件下保温30 min、1 h和2 h ,然后冰浴10 min,测定残余酶活性,以4 ℃下酶液活性为100%。
(2)最适反应pH及pH稳定性。选择pH 5.5~9.0(100 mmol/L)的缓冲液;MES缓冲液pH 5.5~6.5;PBS缓冲液pH 6.0~9.0; HEPES缓冲液pH 7.0~9.0;Tris-HCl 缓冲液pH 7.0~9.0。在40 ℃条件下进行测定,其中以酶活最高者为100%。将酶置于上述不同pH的缓冲液中,4 ℃条件下保温1 h后测定酶活,其中酶活最高者为100%。
(3)金属离子对DODC酶活的影响。选择Ca2+、Cu2+、Mg2+、Mn2+、Zn2+、Fe2+、Ni2+和Al3+等8种金属离子,终浓度为0.5 mmol/L,在4 ℃条件下与酶孵育10 min后加入底物,测定酶活[21-23]。以不加金属离子组作为对照组。
(4)底物特异性。以多巴、色氨酸、酪氨酸、5-羟基色氨酸作为底物,在40 ℃、 pH 7.0下反应5 min,测定酶活。以多巴、酪氨酸、5-羟基色氨酸为底物的检测波长为280 nm,以色氨酸为底物的检测波长为275 nm[24]。
2 结果与分析
2.1 载体构建及双酶切验证
构建好的重组质粒,用菌落PCR的方法初步验证,获得1条单一条带,结果见图1(a),条带约为1.4 kb,这与目的基因的长度一致;利用限制性内切酶EcoRⅠ和SacⅠ对重组质粒DODC-CV6进行酶切验证,获得2条大小分别为1.4 kb和5 kb的条带[图1(b)],5 kb的条带与载体的长度一致,1.4 kb的条带与目的基因的长度一致;经验证序列正确,说明重组质粒构建成功。
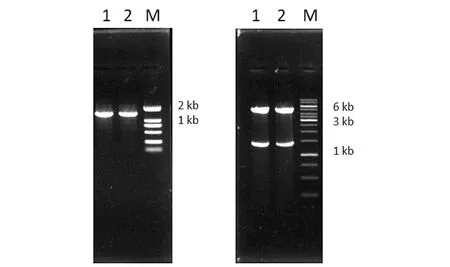
(a)1、2: PCR产物;M:DNA Marker;(b)1、2:双酶切验证;M:DNA Marker。图1 DODC菌落PCR和双酶切验证Figure 1 Enzyme digestion and colony PCR of DODC-CV6
2.2 DODC表达纯化
利用生物信息学软件DANMAN分析DODC核酸序列,预测其分子质量约为51.5 ku,GST标签的大小为26 ku,所以GST-DODC融合蛋白理论值为77 ku。通过聚丙烯酰胺凝胶电泳(SDS-PAGE)分析[图2(a)],15 mmol/L谷胱甘肽的洗脱缓冲液中含有较多的目标蛋白,说明DODC与Glutathione Sepharose 4B树脂亲和力较强,且蛋白分子质量和预测值大致一样。
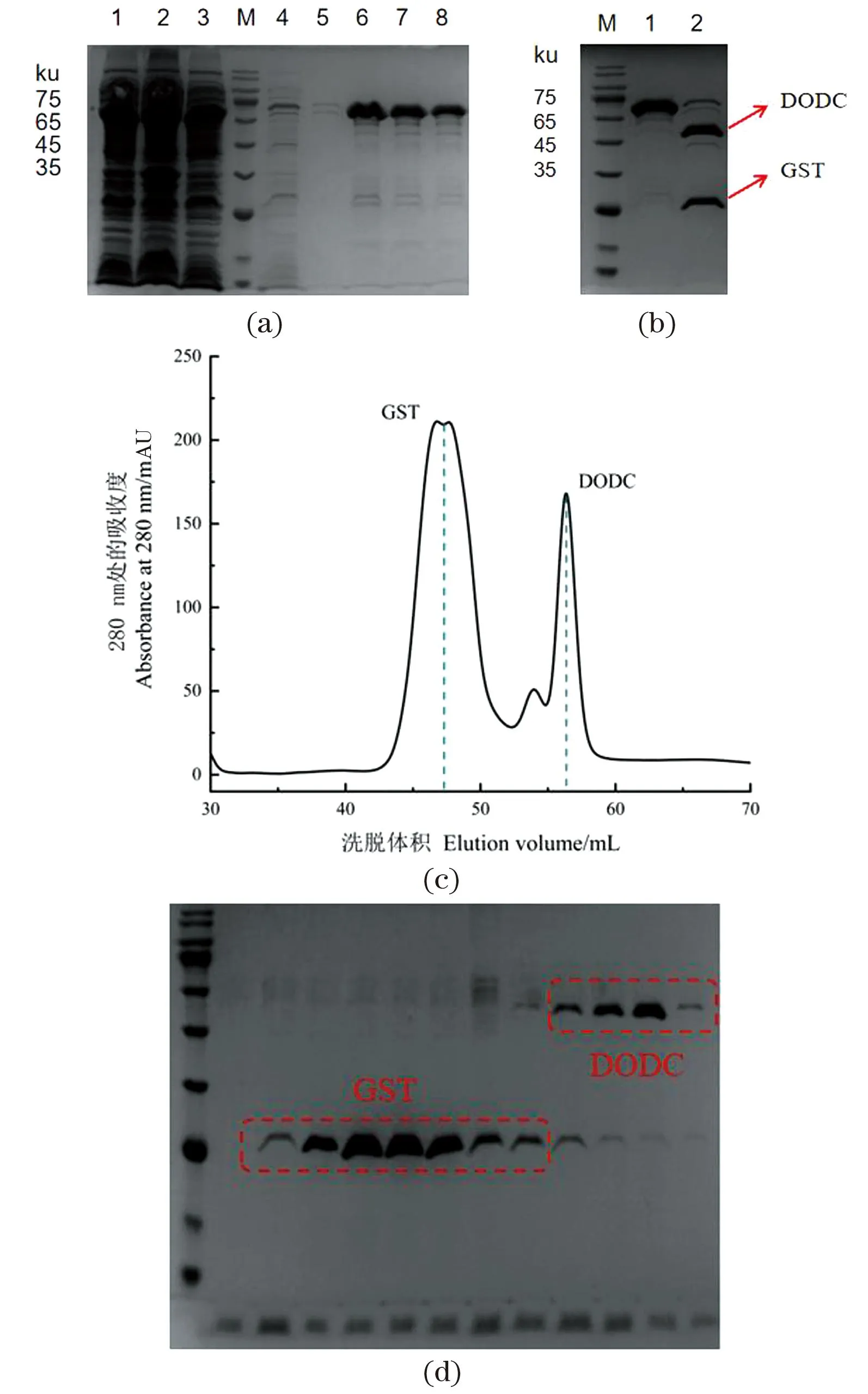
(a)GST-DODC纯化蛋白SDS-PAGE分析[ 1:超声样;2:上清样;3:流穿样;4、5:洗涤样;6~8:洗脱样(15 mmol/L 谷胱甘肽)]。(b) 酶法去掉融合标签GST(1:酶切前;2:酶切后)。(c) GST-DODC离子交换层析及SDS-PAGE结果。图2 DODC蛋白纯化示意图Figure 2 Purification of DODC
通过亲和层析后获得较纯蛋白,直接以质量比50∶1的比例加入3C蛋白酶,4 ℃过夜酶切,从SDS-PAGE 图[图2(b)]可以看出,GST-DODC融合蛋白被切分为51.5 ku的DODC蛋白和26 ku的GST标签。
通过Source Q阴离子吸附层析柱,利用 GE Healthcare的 AKTApure蛋白纯化仪对蛋白进一步进行离子吸附层析纯化。从阴离子吸附层析图[图2(c)]中可以看出,GST标签在47 mL流出,DODC蛋白在56 mL流出。结合SDS-PAGE图分析能够得到纯度较高的目的蛋白,可以用于蛋白浓度的测定和酶活测定。
2.3 酶学性质分析
2.3.1 温度对DODC催化活性及稳定性的影响
温度对酶活性具有较大影响。随着温度的升高,底物分子热运动加快,分子碰撞的机会增加,从而提高了酶的活性。但温度过高会导致蛋白质的变性失活。由图3(a)可得,DODC最适催化温度为40 ℃。在35~45 ℃时,相对酶活保持70%以上;当温度高于45 ℃时酶活急剧下降,在65 ℃时酶活低于40%,因此DODC在体外的最适催化温度范围为35~45 ℃。
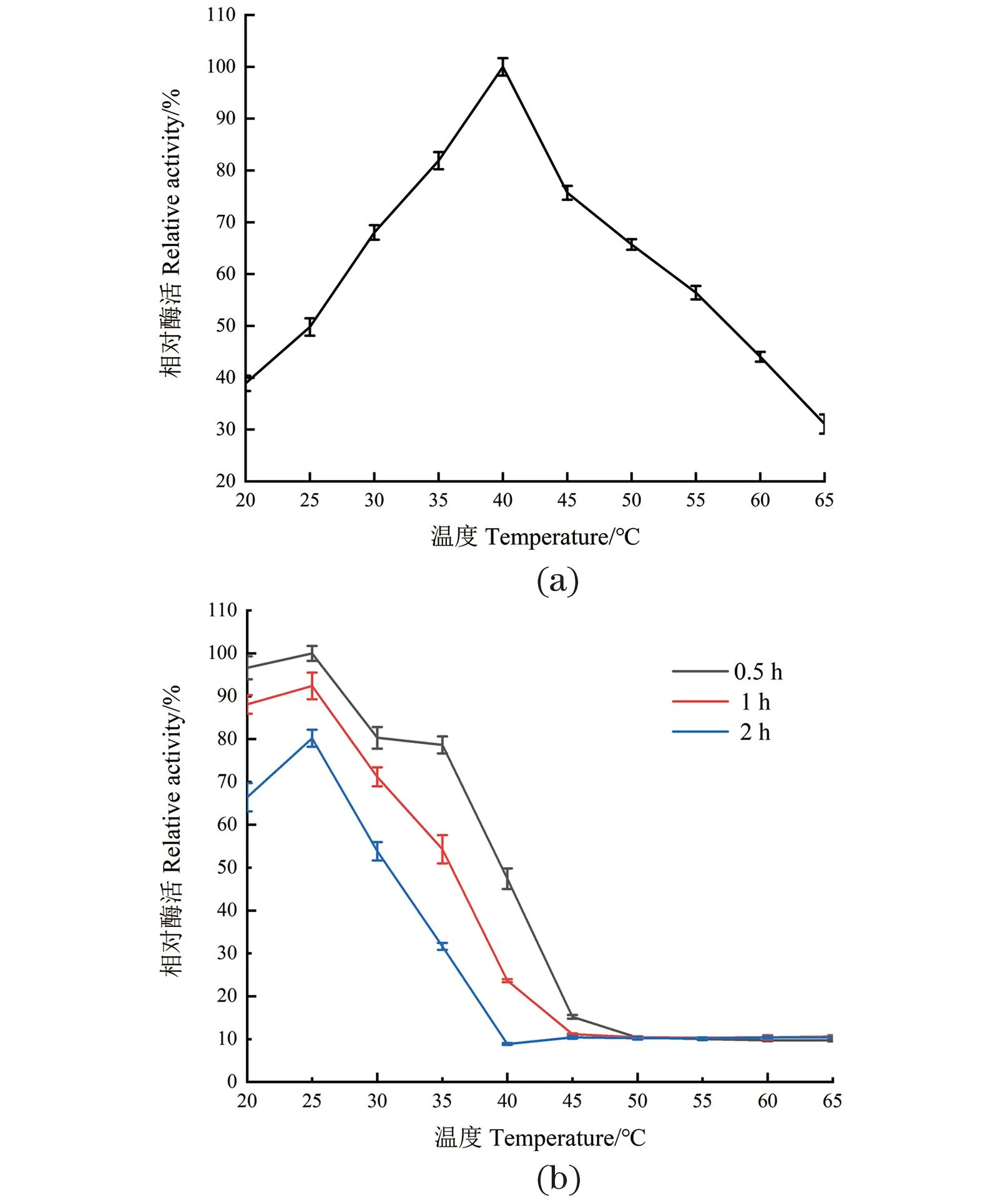
(a) 温度对DODC酶活的影响;(b) DODC的热稳定性。图3 温度对DODC酶活和热稳定性的影响Figure 3 Effect of temperature on DODC enzyme activity and thermal stability
由图3(b)可知,随着保温时间增加,酶活性不断下降,并且温度越高、保存时间越长其活性下降程度越大。DODC在20~30 ℃,保温2 h的情况下,酶活性保留50%以上,当保存温度高于35 ℃时,随着保存时间的增加,活性下降幅度越大。因此,DODC对温度较为敏感。
2.3.2 pH对DODC催化活性及稳定性的影响
pH是影响酶活性的另一个重要因素。当酶处于过酸或者过碱的环境时,都会造成酶不可逆的失活。由图4(a)可知,DODC催化反应的最适 pH 缓冲液为 PBS(pH 7.5),在pH值小于7.5时,酶活性随着缓冲液pH的增加逐渐升高;当pH值大于7.5时,酶活性随着缓冲液pH增加逐渐降低。在同样pH条件下,与Tris-HCl和HEPES 缓冲液相比较,PBS缓冲液更适合DODC的催化反应。极端pH条件如pH 6.0及以下,DODC的相对酶活低于30%。因此,DODC最适缓冲液是 PBS且最适pH值为7.5。由图4(b)可知,在pH 6.0~7.5时,酶活仍可以保留80%以上活性,在pH 6.5时,DODC最稳定;在pH 8.0~9.5时,酶活性已经低于50%。
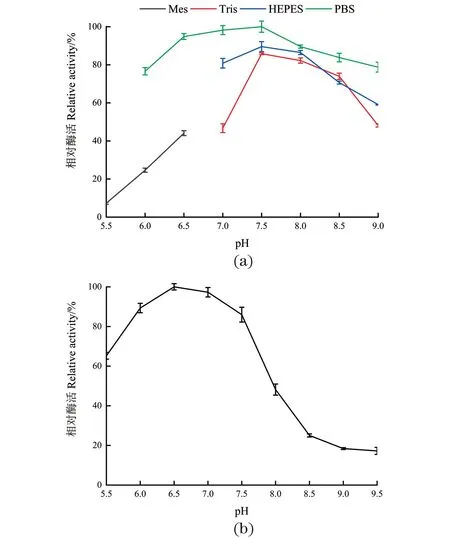
(a) pH对DODC酶活的影响;(b) DODC的pH稳定性。图4 pH对DODC酶活和催化稳定性的影响Figure 4 Effect of pH on the DODC activity and stability
2.3.3 金属离子对DODC酶活的影响
由图5可知,在一系列阳离子中,Cu2+、Zn2+、Ni2+、Al3+对DODC酶活均有抑制作用,其中,Cu2+的抑制作用最明显,相对酶活为80%。Mg2+、Mn2+、Fe2+对DODC酶有促进作用,其中,Ca2+在这8种阳离子中对酶活促进作用最为明显,使酶活提高10%。
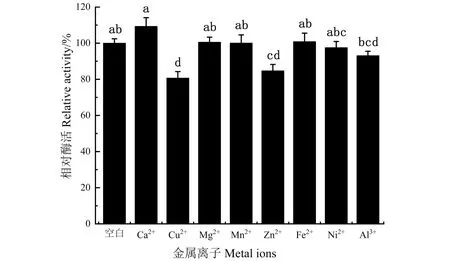
不同小写字母表示具有显著性差异(P<0.05)。图5 不同阳离子对DODC酶活的影响Figure 5 Effect of different cations on the activity of DODC
2.3.4 酶动力学参数和底物特异性
以浓度为0.5~12 mmol/L左旋多巴作为底物测试酶动力学参数,用GraphPad 8.0.2的Michaelis-Menten方程非线性拟合处理数据,得到DODC对左旋多巴的动力学参数Km为1.013 mmol/L,kcat为37.76 s-1,kcat/Km为37.76 s-1mmol/L-1)。
实验分别测定了DODC对酪氨酸、5-羟基色氨酸、左旋多巴和色氨酸的底物特异性。由图6(a)可知, DODC对左旋多巴的酶活最高,其次为酪氨酸和5-羟基色氨酸,对色氨酸几乎没有活性。从4种底物的结构分析可知,酪氨酸与左旋多巴的结构较为相似,仅苯环3号C位多了一个羟基,因此,DODC对酪氨酸的催化活性仅次于左旋多巴,相对酶活可达79.8%。DODC对色氨酸几乎没有活性,5-羟基色氨酸与色氨酸结构较为相似,但在苯环5号C位多了一个羟基,故DODC对5-羟基色氨酸的相对酶活也极低,仅为7.2%。因此,DODC的最适底物为左旋多巴。此外,进一步分析左旋多巴的催化产物,由图6(b)液相色谱图可知,DODC催化左旋多巴的产物峰在6.81 min出现,产物为多巴胺。
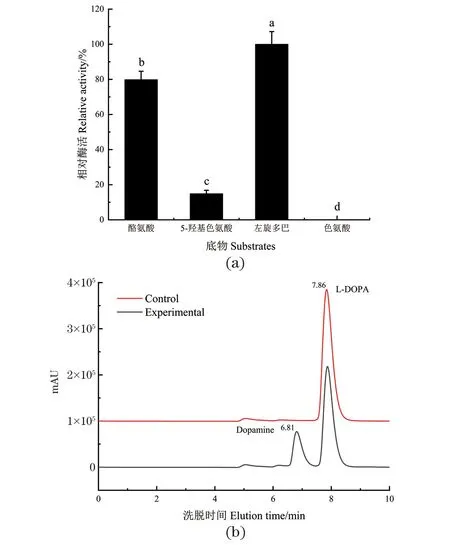
(a)不同底物DODC的酶活性;(b)高效液相色谱法检测左旋多巴的催化产物。不同小写字母表示具有显著性差异(P<0.05)。图6 DODC的底物特异性Figure 6 Substrate specificity of DODC
2.4 DODC 的序列同源性分析
利用NCBI数据库,通过BLAST功能获得与DODC氨基酸序列相近的其他来源的多巴脱羧酶氨基酸序列,采用Clustal X 进行序列比对,然后用Espript 3.0进行着色美化,结果见图7。结果显示来源于Pseudomonassp. FW305-E2 、Pseudomonassp. USTB-Z 、Pseudomonassp. BP6 、Pseudomonassp. PNP、Susscrofa的脱羧酶的相似度较高,其中,与来自Pseudomonassp. FW305-E2的多巴脱羧酶相似度为99%。将获得的不同来源的脱羧酶序列采用MEGA 11软件构建系统进化树,如图8所示。结合序列对比分析,DODC属于AAT-Ι 超家族,其保守的催化结合位点为Thr 241,这也与报道的Pseudomonassp. PNP DOPA decarboxylase是一致的[25-26]。
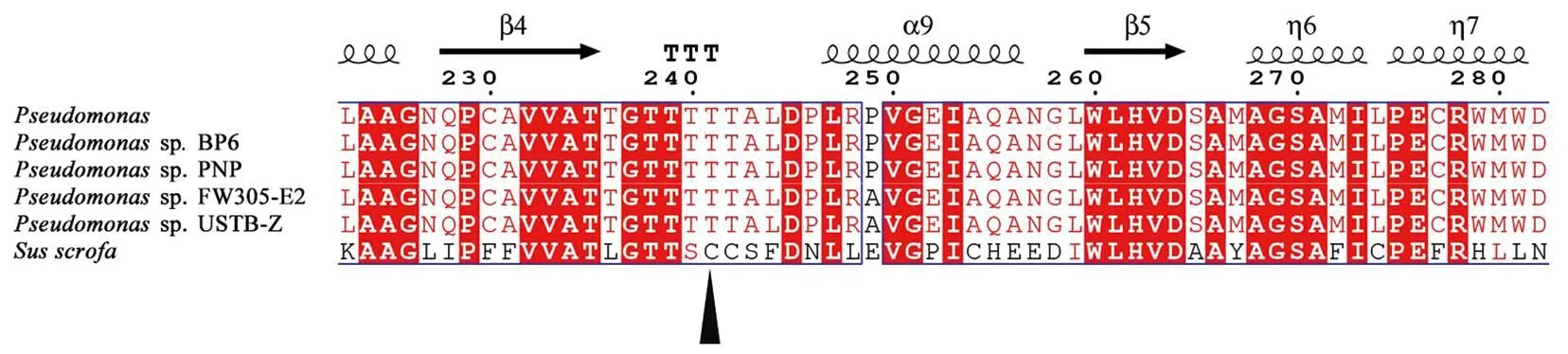
图7 DODC氨基酸序列比对Figure 7 Sequence alignment of DODC
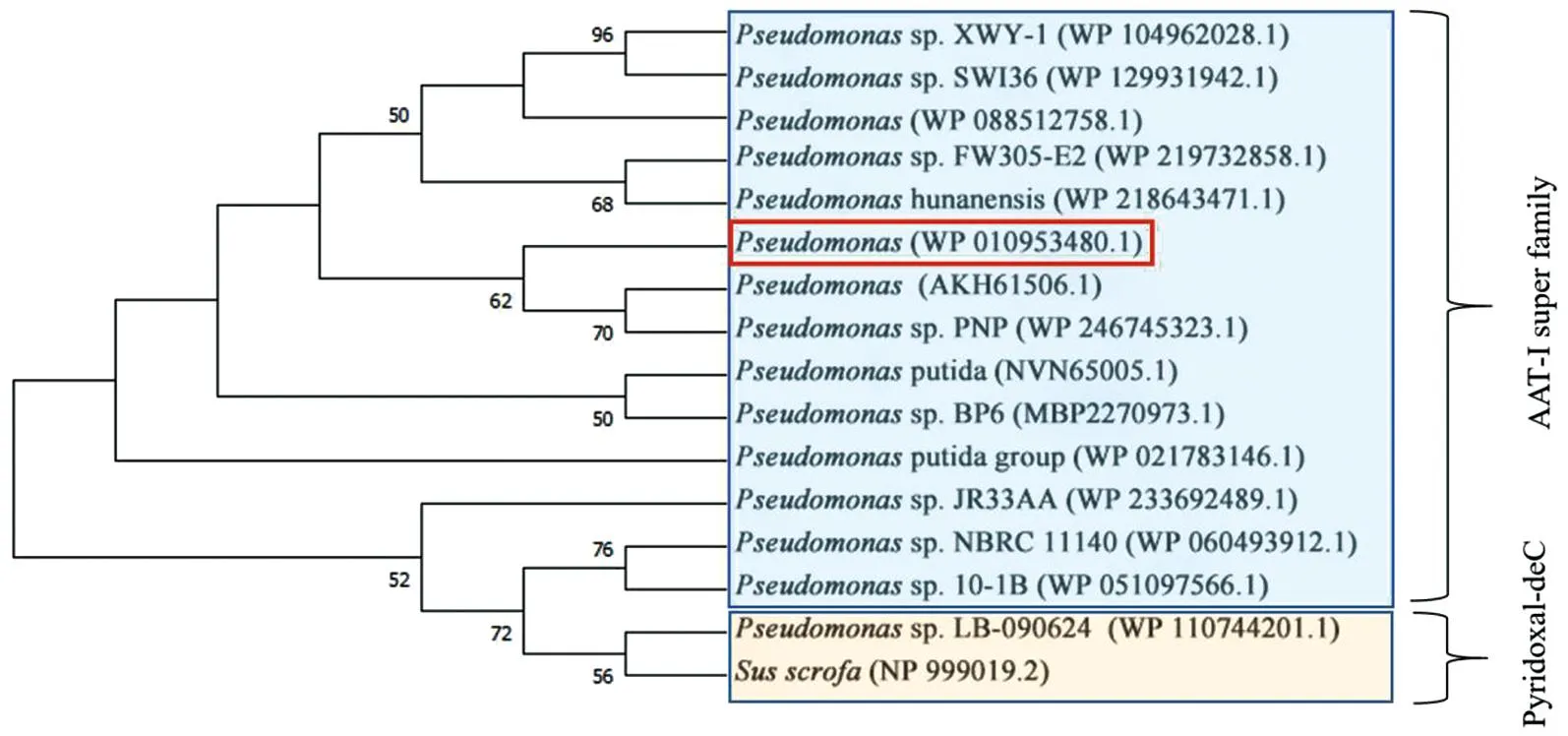
图8 DODC系统树分析Figure 8 Phylogenetic analysis of DODC
3 结论
多巴脱羧酶属于芳香族氨基酸脱羧酶,可以将左旋多巴催化产生多巴胺。多巴胺作为一种重要的神经递质,能够调节神经元功能,预防高等动物的精神病和神经退行性疾病。此外,多巴脱羧酶已被确定为癌细胞神经内分泌标志物。研究表明DODC基因的表达有助于肿瘤和癌细胞的鉴别诊断,其酶活性是体外区分小细胞肺癌(SCLC)与其他肺癌类型的重要标志物。肿瘤患者中DODC蛋白水平高者比水平低者更容易康复。因此,多巴脱羧酶对癌细胞类型的鉴别诊断,以及人类癌症的治疗都有重要的意义。
本研究将多巴脱羧酶(DODC)在大肠杆菌E.coliBL21(DE3)中进行异源表达,经过GST-树脂亲和层析、3C蛋白酶切和离子交换层析,获得了纯度在95%以上的DODC纯化蛋白,这为以后的蛋白结晶以及结构解析提供了前提条件。与此同时,还测定了DODC蛋白的酶学性质,实验发现DODC酶的最适温度为40 ℃;最适pH 7.5,已报道DODC(WP 088512758.1)的最适温度为55 ℃;最适pH 8.0,两种酶性质较为接近[27]。金属离子Ca2+对DODC酶具有较强的促进作用,酶活提高了10%,Cu2+对DODC酶的抑制作用最为明显,相对酶活为对照组的80%,相较已报道的DODC(WP 088512758.1),来源于Pseudomonas的DODC酶对金属离子的耐受性更强。DODC的特异性底物为左旋多巴,催化产物为多巴胺。kcat/Km与酶的催化效率成正比,与酶的活性有直接关系,而DODC对左旋多巴的kcat/Km为37.76 s-1mmol/L-1,是DODC(WP 088512758.1)的1.76倍,所以DODC比DODC(WP 088512758.1)有更好的应用前景[27]。通过序列同源性分析,确定DODC属于AAT-Ι 超家族,预测了该酶的催化位点为Thr 241,这为后续酶的定向改造和催化机制解析提供了条件。本研究对DODC的理化性质进行基础研究,为以后该蛋白晶体结构解析和催化机理的解析提供了一定理论基础。
