铜铝双金属材料对硝基苯废水的还原降解研究*
2024-02-27来文艳葛保鑫来文娟张大磊齐元峰
任 鹏 刘 旭 来文艳 葛保鑫 徐 畅 来文娟 张大磊 齐元峰,#
(1.青岛理工大学环境与市政工程学院,山东 青岛 266525;2.潍坊市青州生态环境监控中心,山东 潍坊 261000;3.苏州根基科技有限公司,江苏 苏州 215131;4.中化环境设备工程(江苏)有限公司,江苏 无锡 214214)
硝基苯因具有强电子吸收基团而呈现较高的稳定性,为硝基苯废水的高效处理带来较大难度[1]。零价金属还原法降解硝基苯是一种低成本、高效的处理方法,近年来得到了广泛的研究和应用。零价铝(Al0)具有价格低、分布广泛、还原电位高等优势[2-3],成为废水还原降解的热点材料。
Al0虽然是一种高效的还原金属,但由于其表面容易氧化形成致密的钝化膜[4-5],阻碍了Al0持续释放电子的能力,从而极大影响了Al0的还原效果。通过向Al0还原体系引入惰性金属铜形成铝铜双金属(Cu@Al0)还原体系[6-7],组成的电偶原电池可诱导Al0的电子释放,有助于提高Al0的持续反应能力[8]。樊金红等[9]采用铝铜刨花直接耦合的形式对活性艳红染料废水进行还原脱色,反应90 min后染料去除率达96.4%,活性艳红降解产物苯胺生成率为33.8%,验证了Cu@Al0体系对于偶氮结构有机物的还原降解能力。然而,直接加铜的方式成本较高,并且相对较小的接触面积也降低了铜的利用效率[10]。为解决以上弊端,可以尝试通过化学镀铜的方式在Al0表面形成Cu@Al0复合材料,不仅可以使阴阳两极间接触更为紧密,有效降低两极间的欧姆阻抗,且Cu@Al0表面的铜过渡金属催化还原体系更有利于污染物的降解[11],有助于提高污染物降解效率。
铝箔作为一种日常生活中常见的材料,具有较大的表面积,能够为化学镀铜层提供较多的沉积点位用于污染物降解[12],且其原材料廉价易得,应用安全性较高、易于回收。为此,本研究以厨余垃圾废旧铝箔为原料,以化学镀铜的方式制备Cu@Al0,通过X射线衍射(XRD)、扫描电子显微镜(SEM)、能谱仪(EDS)等测试手段对Cu@Al0材料进行表征,并采用紫外可见吸收光谱(UV-Vis)、气相色谱(GC)等测试方法深入考察了Cu@Al0降解硝基苯的机理,为硝基苯及类似难降解废水提供一种新的处理手段,也为铝箔材料的回收利用、以废治废提供了一种新思路。
1 材料与方法
1.1 材料与药剂
本研究所用铝箔为包装食物的废弃铝箔,厚度0.015 mm,经清洗、酸洗后采用重物压平,随后裁剪为5.0 mm×5.0 mm方块。实验所用的硝基苯、苯胺、亚硝基苯、五水合硫酸铜(CuSO4·5H2O)、乙二胺四乙酸二钠(EDTA-2Na)等均为分析纯,氮气纯度≥99.999%。H2SO4、NaOH溶液摩尔浓度均为1 mol/L,实验用硝基苯废水采用无氧去离子水配置。
1.2 实验仪器
采用GC9720 Puls型GC分析硝基苯及其降解产物的浓度,测试条件为:进样口温度260 ℃,进样方式为无分流进样,进样量1.0 μL,载气为氮气,载气流量为1.00 mL/min;Al3+浓度按照《铝试剂分光光度法》(GB 8538—2016)采用DR6000紫外可见光分光光度计(美国哈希)进行测定;通过Sigma 300型SEM-EDS(德国CARL ZEISS)对Cu@Al0样品微观形貌及表面元素含量进行分析。通过X-pert型XRD(荷兰帕纳克)测试材料的矿物组分,测试条件为:Cu/Kα放射源,加速电压40 kV,电流30 mA,扫描角度2θ在30°~90°,扫描速度8°/min。
1.3 Cu@Al0的制备
将铝箔完全浸渍于60 ℃的H2SO4溶液中1 h去除表面的油脂与氧化膜,随后采用无氧去离子水多次冲洗预处理后的铝箔至中性,此时得到的铝箔即为Al0,将其转移至250 mL镀液(根据实验要求,由CuSO4·5H2O与EDTA-2Na按一定比例配置)中进行化学置换镀铜。镀铜条件为:反应温度(25±2) ℃,反应时间2 h,镀液初始pH=12。镀铜铝箔采用大量无氧去离子水多次冲洗,并于-30 ℃的冷冻干燥机中进行冷冻干燥处理,最终得到Cu@Al0。
1.4 硝基苯废水降解实验
将200 mL一定初始浓度的硝基苯模拟废水置于500 mL锥形瓶中,调节废水初始pH至一定值,以30 mL/min的速度通入高纯氮气10 min以去除废水中游离态O2,加入定量Cu@Al0,将锥形瓶放置于转速为120 r/min的恒温振荡器中,反应过程中保持氮气曝气,定时取样测定硝基苯浓度、Al3+浓度,每个处理重复3次,取平均值作为最终测试结果。
2 结果与讨论
2.1 Al0与Cu@Al0的矿物组成与微观结构
对酸洗后的Al0与Cu@Al0进行XRD测试,结果见图1。Al0的XRD图谱只在(200)、(220)、(311)晶面出现Al衍射峰,并无其他杂峰;而Cu@Al0除了含有Al衍射峰外,在(111)、(200)、(220)晶面处出现了Cu衍射峰,说明铝箔表面存在一定量的铜。对比可以看出,Cu@Al0的Al衍射峰的强度相较Al0材料有所降低,这表明在XRD扫描范围内的铝含量因铜的覆盖有所降低。
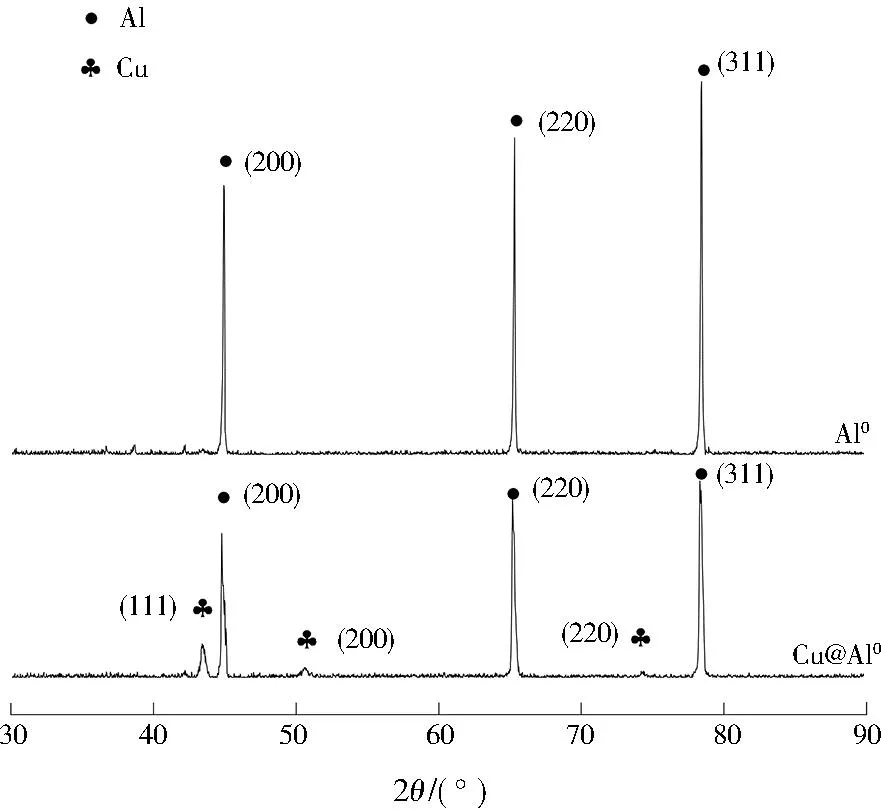
图1 Al0与Cu@Al0的XRD图谱Fig.1 XRD pattern of Al0 and Cu@Al0
Al0和Cu@Al0的微观形貌分析见图2。未经镀铜处理的Al0表面接近光滑,经镀铜处理后,Cu@Al0表面的粗糙程度显著增大。同时通过EDS测试发现,Al0的表面Al质量分数为99.26%,而经过镀铜处理的Cu@Al0表面以Cu为主(质量分数81.29%),Al含量大幅下降(质量分数12.38%),这缘于Cu在铝箔表面的沉积覆盖,此外O含量也有明显上升(质量分数6.33%),这可能与测试过程中Al被氧化生成Al2O3有关。XRD、SEM结果均表明铜成功覆盖在铝箔表面制成Cu@Al0。

图2 Al0与Cu@Al0的SEM图Fig.2 SEM image of Al0 and Cu@Al0
2.2 Cu@Al0降解硝基苯废水
2.2.1 镀铜率对Cu@Al0降解硝基苯的影响
通过调整初始镀液CuSO4·5H2O质量浓度分别为2、6、10 g/L,得到镀铜率(以Cu在Cu@Al0中的质量分数表征)分别为2.48%、3.43%、5.02%的Cu@Al0材料。根据1.4节硝基苯废水处理的方法,调节硝基苯废水初始pH为7,硝基苯初始质量浓度为100 mg/L,向模拟废水中分别加入0.50 g不同镀铜率的Cu@Al0反应180 min,取样计算硝基苯的去除率。结果表明,未进行镀铜的Al0对硝基苯的降解率仅为23.2%,当镀铜率为2.48%、3.43%时,硝基苯的降解率逐步提高到59.8%、87.2%,继续提高镀铜率至5.02%,硝基苯降解率发生了明显的下降(78.5%)。由此可见,在一定范围内提高镀铜率能够显著提升Al0对于污染物的降解性能,这是由于阴极铜含量的增加能够加快Al0的腐蚀速度,进一步增强了其失电子能力[13],但当镀铜率过高时可能会导致铜层过于致密,使Cu@Al0材料的活性点位堵塞,造成污染物降解能力的下降。
采用一级动力学方程(见式(1))对硝基苯降解数据进行拟合,探究不同镀铜率对Cu@Al0活性的影响,结果见图3。
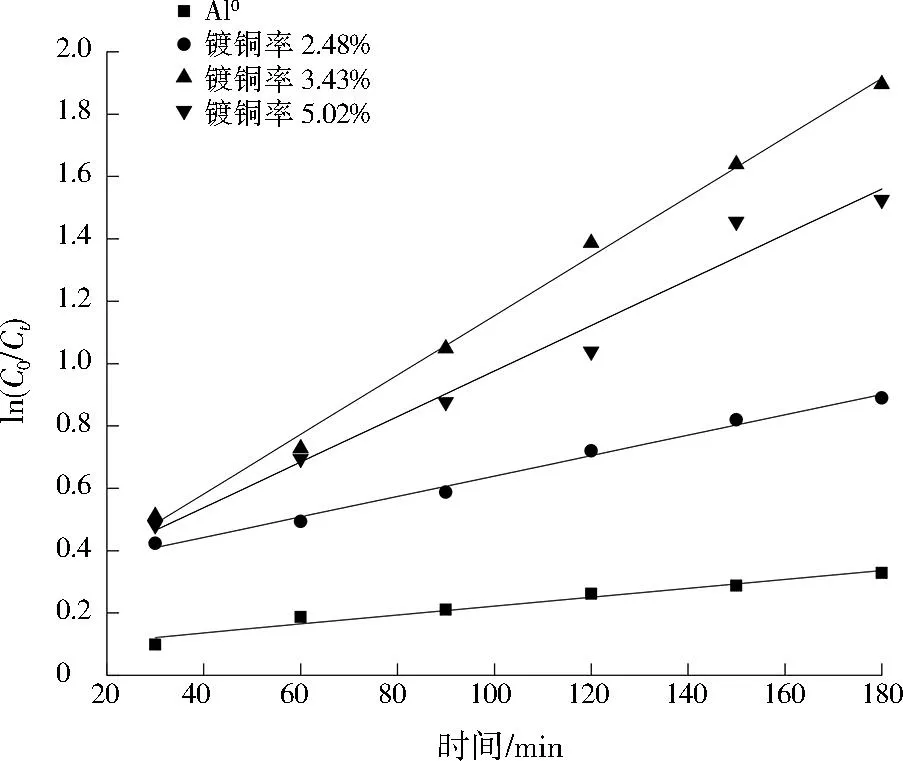
图3 不同镀铜率的Cu@Al0对硝基苯的降解动力学Fig.3 Reduction kinetics of Cu@Al0 with different copper plating rates for the removal of nitrobenzene
ln(C0/Ct)=kobst
(1)
式中:C0、Ct分别为实验初始及反应tmin时硝基苯的质量浓度,mg/L;kobs为一级反应速率常数,min-1;t为反应时间,min。
由图3可知,Cu@Al0对硝基苯的降解数据与一级反应动力学曲线拟合较好[14],镀铜率为2.48%、3.43%、5.02%的Cu@Al0降解硝基苯的kobs分别为0.003 28、0.009 52、0.007 30 min-1,均明显高于Al0的0.001 71 min-1,Cu@Al0在镀铜率为3.43%时具有更高的反应活性。因此,选取镀铜率为3.43%的Cu@Al0作为后续实验材料。
2.2.2 初始pH对Cu@Al0降解硝基苯的影响
为探究初始pH对Cu@Al0降解硝基苯的影响,调节废水初始pH为2~12,控制硝基苯初始质量浓度为100 mg/L、Cu@Al0投加量0.50 g、反应时间为20 min,硝基苯降解率变化见图4。随着废水初始pH的升高,Cu@Al0对硝基苯的降解效果呈先降低后升高的趋势,在强酸(pH=2)、强碱(pH=12)条件下均获得了显著的降解效果,硝基苯降解率分别为99.2%、99.7%。随着初始pH由3提升到10,硝基苯降解率由88.4%逐步降低到20.6%,而初始pH为11时,硝基苯降解率又迅速提升至80.6%。由以上结果可以看出,Cu@Al0在强酸、强碱条件下对硝基苯具有更高的处理效能,而在弱酸、中性和弱碱性条件下对硝基苯的降解效果相对较差,这可能是源于中性条件下,阳极铝的失电子情况远低于强碱、强酸条件,同时也不能排除在相对中性的条件下Cu@Al0表面Al0发生钝化导致降解效果下降。此外,在强酸和强碱条件下Al3+浓度显著高于其他对照组,这印证了硝基苯的降解主要缘于Cu@Al0的腐蚀电解,且降解率与阳极铝的失电子率基本呈正比。综合考虑成本和降解效果等因素,废水初始pH宜为3。
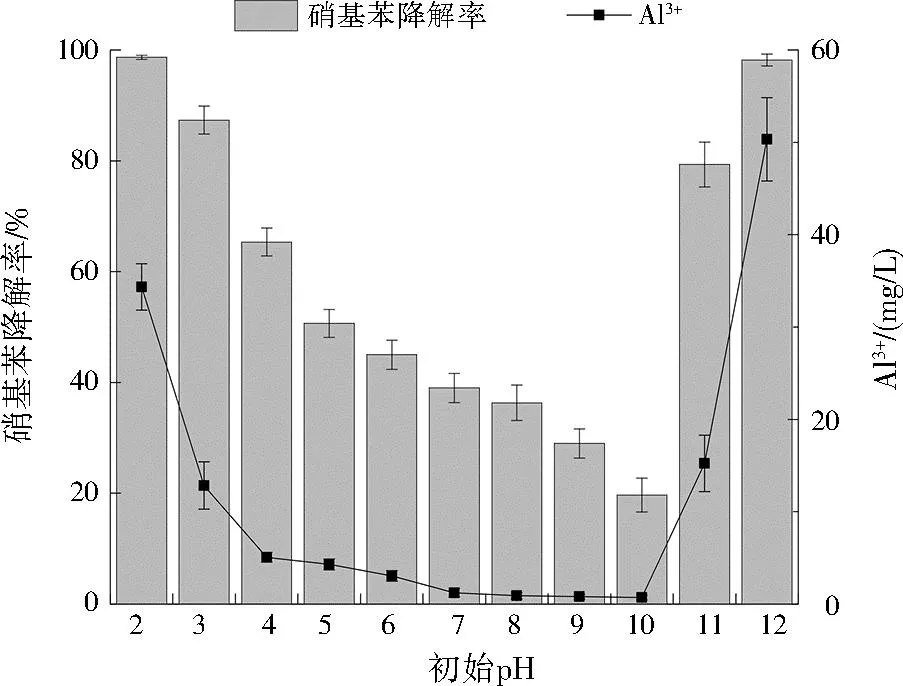
图4 不同初始pH对硝基苯的降解及Al3+的影响Fig.4 Effect of different initial pH on nitrobenzene degradation and Al3+ concentration
2.2.3 Cu@Al0投加量对硝基苯降解效果的影响
Cu@Al0的投加量通常会影响污染物的处理效率[15],调节Cu@Al0投加量分别为0.25、0.50、0.75、1.00 g,硝基苯初始质量浓度为100 mg/L、初始pH=3、反应时间为60 min,探究不同Cu@Al0投加量对硝基苯去除率的影响,结果见图5。Cu@Al0对硝基苯的去除效果随投加量的增加而升高,当Cu@Al0投加量增大到一定程度后,硝基苯去除率的增幅不再明显。这可能是由于Cu@Al0对硝基苯的还原降解是硝基苯在Cu@Al0表面活性点位的扩散传质过程[16],属于表面还原反应,初期增加Cu@Al0投加量能够有效增加还原表面,有助于硝基苯的还原降解,而当Cu@Al0投加量继续增大,Cu@Al0的互相堆积掩盖了有效的活性点位,Cu@Al0用量增大带来的Al表面增加效果被部分抵消,综合考虑处理成本及处理效果,Cu@Al0投加量宜为0.50 g。
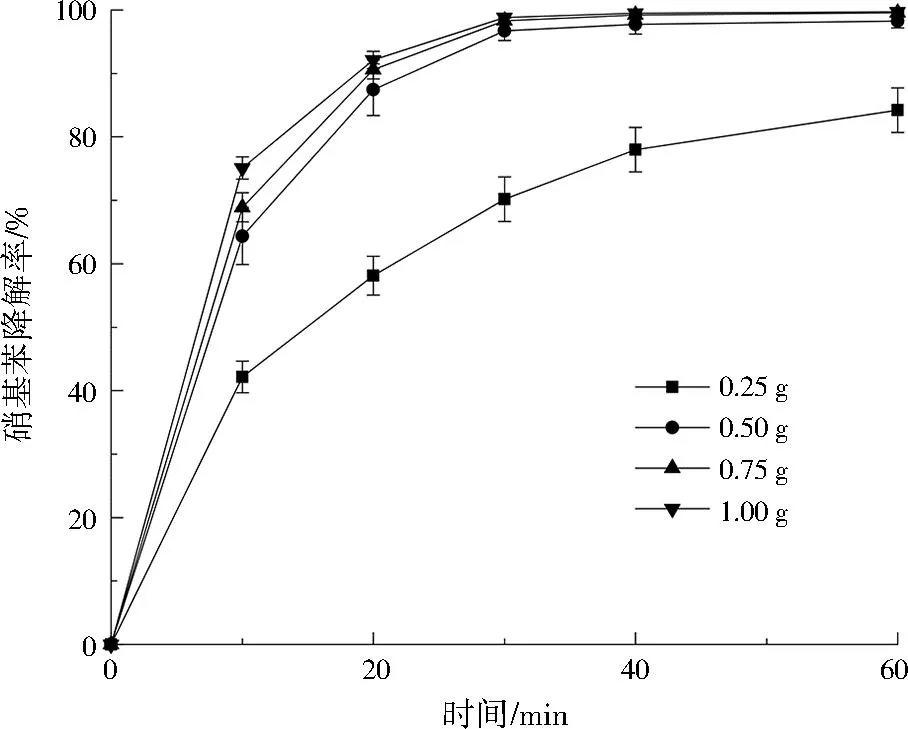
图5 Cu@Al0投加量对硝基苯降解效果的影响Fig.5 Effect of Cu@Al0 dosage on nitrobenzene degradation
2.2.4 初始硝基苯浓度对降解效果的影响
调节硝基苯初始质量浓度为50、100、200、300、400 mg/L,Cu@Al0投加量为0.50 g,初始pH=3,反应时间为60 min,探究硝基苯初始质量浓度对其去除率的影响,结果见图6。可以看出,Cu@Al0对硝基苯的降解效果随其初始浓度的升高而降低,这是因为高浓度硝基苯溶液中硝基苯分子间会竞争固定的反应活性点位,同时使Cu@Al0表面产生更多的中间体占据活性点位,对硝基苯的降解产生抑制作用。由于硝基苯初始质量浓度为50、100 mg/L时硝基苯溶液降解效果差距不大,为最大限度地利用Cu@Al0,硝基苯初始质量浓度宜为100 mg/L。
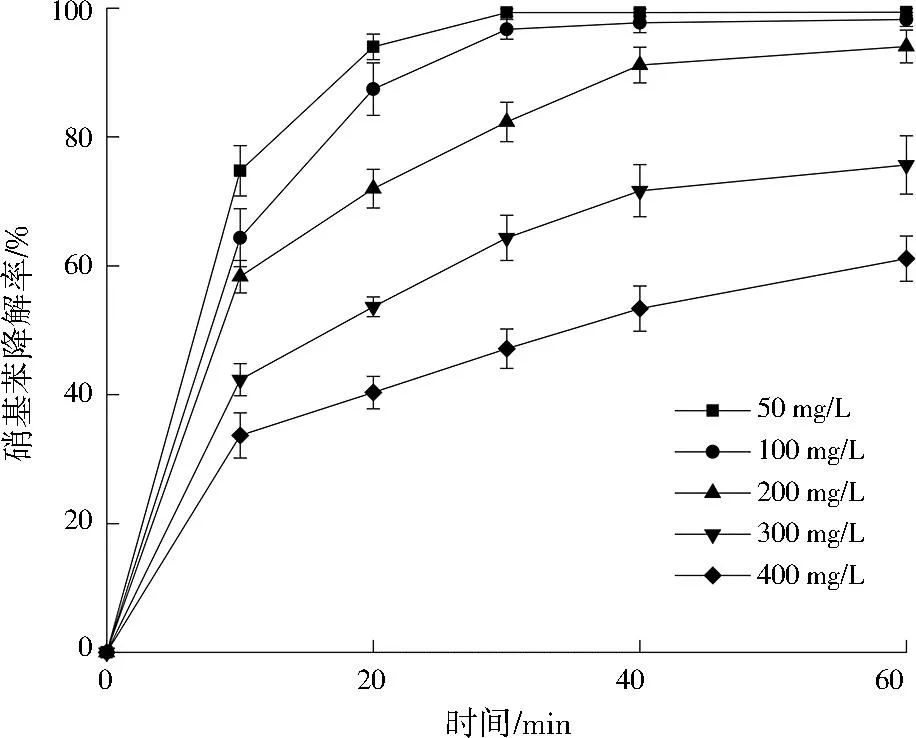
图6 硝基苯初始质量浓度对硝基苯降解效果的影响Fig.6 Effect of the initial nitrobenzene mass concentration on nitrobenzene degradation
2.2.5 材料的循环利用性能测试
为测试Cu@Al0循环利用过程中对硝基苯降解效能的变化,在前文得到的最佳条件下进行循环降解实验,一个循环反应周期为60 min,每个周期结束后过滤分离Cu@Al0,清洗干净真空冻干后进行下一周期实验,实验结果表明,Cu@Al0在前3个循环中对硝基苯的降解率均能达到99%以上,在4~6个循环降解效果略有下降,维持在90%以上,在第7次循环实验中出现明显的下降,但最终硝基苯降解率仍能够维持在80%以上。因此,Cu@Al0对水体中的硝基苯降解有较好的循环利用性能。
2.3 Cu@Al0降解硝基苯的机理
Cu@Al0主要通过双金属原电池的阳极腐蚀原理降解硝基苯,然而Cu@Al0降解硝基苯是个复杂的过程,鉴于酸性、中性和碱性条件下Cu@Al0对硝基苯降解率不同,因此本研究对初始pH为3、7、11时对硝基苯的降解过程进行深入分析。
对硝基苯原水水样以及初始pH为3、7、11时处理20 min的水样进行UV-Vis检测,同时采用GC对反应过程中的挥发气体进行分析,结果见图7。未进行反应的原水水样UV-Vis光谱仅在268 nm存在强烈的吸收峰,是硝基苯的特征吸收峰[17],而3种pH条件下反应20 min后,水样268 nm处的硝基苯特征吸收峰均有所减弱,尤其是酸性、碱性条件下,已经难以检测到硝基苯的特征吸收峰,取而代之的是在229、280 nm处形成明显的苯胺特征吸收峰,这表明反应过程中硝基苯得电子的还原产物为苯胺,对比之下,pH为7时水样UV-Vis光谱更为复杂,此时水样中仍有一定含量的硝基苯未完成向苯胺的转化。结合图7(b)的GC图谱,发现碱性条件下作为中间产物的亚硝基苯含量更多,这可能是由于当pH较高时,溶液中的H+浓度较低,阻碍了中间产物还原为苯胺的过程,导致中间产物大量累积,无法完全还原为苯胺。
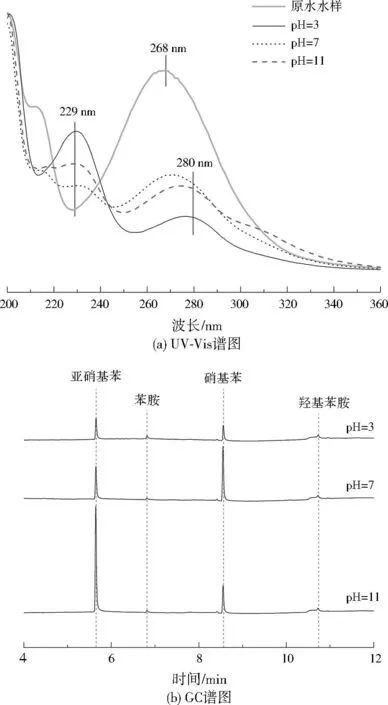
图7 不同初始pH下硝基苯废水的UV-Vis分析及挥发气体GC谱图Fig.7 UV-Vis analysis of nitrobenzene wastewater after degradation under different initial pH and GC spectra of volatile gas
进一步采用GC对初始pH=3时反应过程中挥发气体的成分进行分析,结果见图8。可以发现,随着反应的进行,挥发气体中的主要成分由硝基苯向亚硝基苯进行转变,随后亚硝基苯的含量又逐渐降低,苯胺的含量逐渐升高,其中硝基苯的特征吸收峰强度逐渐减弱,并最终消失,而亚硝基苯特征峰的强度先迅速升高随后减弱至最终消失,而最终的挥发产物中仅可观察到苯胺。此外,反应过程中一直存在一定含量的羟基苯胺,推测其可能作为中间产物参与了硝基苯的降解过程。综合以上分析,并结合以往的研究结果[18],认为Cu@Al0降解硝基苯的过程主要是硝基苯先被还原为亚硝基苯,亚硝基苯再被还原为羟基苯胺,羟基苯胺最后被还原为苯胺(见图9)。
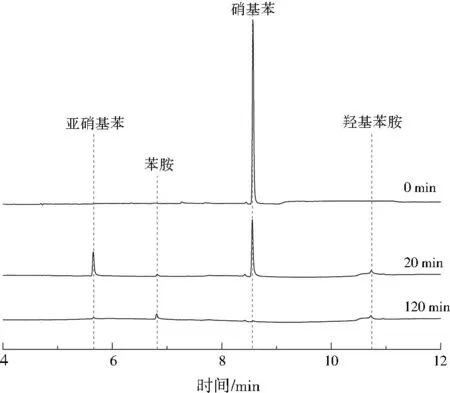
图8 初始pH=3时硝基苯降解过程挥发气体的GC谱图Fig.8 GC spectra of volatile gas produced during nitrobenzene degradation under initial pH=3
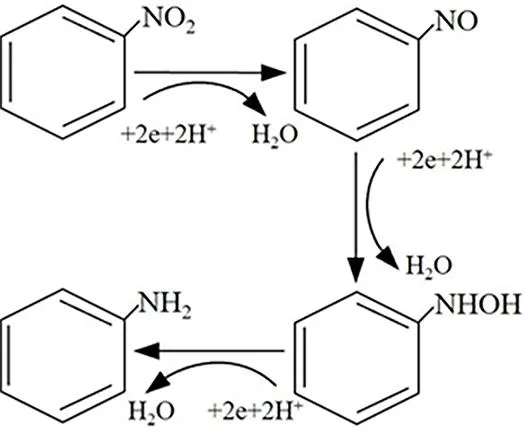
图9 硝基苯的还原降解过程 Fig.9 Reductive degradation of nitrobenzene
3 结 论
1) 采用化学镀铜的方式在铝箔表面镀铜,XRD、SEM、EDS分析结果均表明Cu成功镀覆在铝箔表面,可通过此方法获得双金属材料Cu@Al0。
2) Cu@Al0对硝基苯废水的处理性能明显优于Al0,其中镀铜率为3.43%的Cu@Al0对硝基苯的降解率最高,比Al0的硝基苯降解率高64.0百分点,硝基苯的降解率随初始pH的升高呈先下降后升高的趋势。Cu@Al0投加量越大、硝基苯初始浓度越低,硝基苯降解效果越好,且Cu@Al0具有较好的循环利用性能。
3) Cu@Al0首先将硝基苯还原为亚硝基苯,再被还原为羟基苯胺后最后被还原为苯胺,较高的pH会阻碍中间产物亚硝基苯向最终产物苯胺的还原。
