安罗替尼联合信迪利单抗治疗老年非小细胞肺癌患者的临床效果研究
2024-02-27吴鹏


作者简介:吴鹏,大学本科,主治医师,研究方向:肿瘤免疫靶向治疗。
【摘要】目的 探讨安罗替尼联合信迪利单抗治疗老年非小细胞肺癌(NSCLC)的效果和安全性,为临床提供参考。方法 回顾性分析2020年7月至2023年5月枞阳县人民医院收治的66例老年NSCLC患者的临床资料。根据治疗方案的不同分为试验组(33例,给予安罗替尼联合信迪利单抗治疗)和对照组(33例,仅给予安罗替尼单药治疗)。比较两组患者的客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、炎症及免疫指标[肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、白细胞介素-10(IL-10)及自然杀伤细胞(NK细胞)活性]水平及不良反应发生情况。结果 试验组患者ORR、DCR均高于对照组(均P<0.05)。试验组患者中位PFS、中位OS均长于对照组(均P<0.05)。两组患者治疗后IL-2水平和NK细胞活性与治疗前比较,差异无统计学意义(P>0.05);试验组患者治疗后血清TNF-α和IL-10水平均低于治疗前和对照组(均P<0.05)。试验组患者不良反应发生率高于对照组(P<0.05),两组患者的不良反应均为1~2级,无3~4级不良反应发生,且患者均可耐受。结论 安罗替尼联合信迪利单抗治疗老年NSCLC患者效果较好,能延长PFS和OS、有效改善机体免疫功能和炎症反应,虽存在一定的不良反应,但患者均可耐受,仍值得临床应用。
【关键词】安罗替尼;信迪利单抗;老年非小细胞肺癌
【中图分类号】R979.1 【文献标识码】A 【文章编号】2096-2665.2024.01.0019.04
DOI:10.3969/j.issn.2096-2665.2024.01.007
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的恶性肿瘤之一,占肺癌的80%以上[1]。随着人口老龄化的加剧,老年NSCLC患者日益增多,且老年患者多伴有基础疾病,对化疗的耐受性较差,不良反应较多[2]。因此,寻找一种安全、有效且适合老年NSCLC患者的治疗方案是临床上亟待解决的问题。安罗替尼是一种多靶点小分子酪氨酸激酶抑制剂(TKI),能够抑制肿瘤血管的生成,对多种恶性肿瘤的疗效良好,但单药治疗老年NSCLC的效果仍有待提高[3]。信迪利单抗是一种免疫检查点抑制剂,能够解除T细胞功能的抑制,增强免疫应答,其联合一线化疗方案治疗晚期NSCLC的效果显著[4]。基于此,本研究探讨安罗替尼联合信迪利单抗治疗老年NSCLC患者的效果和安全性,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年7月至2023年5月枞阳县人民医院收治的66例老年NSCLC患者的临床资料。根据治疗方案的不同分为试验组(33例,给予安罗替尼联合信迪利单抗治疗)和对照组(33例,仅给予安罗替尼单药治疗)。试验组患者中男性18例,女性15例;年龄65~79岁,平均年龄(71.12±4.08)岁;病理类型:腺癌23例,鳞癌10例;病理分期[5]:ⅢA期5例,ⅢB期10例,Ⅳ期18例。对照组患者中男性19例,女性14例;年龄65~79岁,平均年龄(71.24±4.21)岁;病理类型:腺癌23例,鳞癌10例;病理分期:ⅢA期8例,ⅢB期9例,Ⅳ期16例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经枞阳县人民医院医学伦理委员会批准。纳入标准:①符合NSCLC的诊断标准,且经组织学或细胞学检查确诊[6];②年龄≥65岁;③均为晚期(ⅢB或Ⅳ期)NSCLC或不能采用手术切除的局部晚期(ⅢA期)NSCLC[5];④表皮生长因子受体(EGFR)基因、间变性淋巴瘤激酶(ALK)基因、c-ros癌基因1(ROS1)驱动基因等无突变;⑤美国东部肿瘤协作组体力状态(ECOG-PS)评分0~2分[7];⑥无严重心、肺、肾功能不全或出血倾向。排除标准:①接受过靶向药物或免疫治疗者;②合并其他恶性肿瘤者;③合并严重感染或其他并发症者;④对安罗替尼或信迪利单抗过敏或不耐受者。
1.2 治疗方法 试验组患者给予安罗替尼胶囊[正大天晴药业集团股份有限公司,国药准字H20180004,规格:按安罗替尼(C23H22FN3O3)计,12 mg/粒]联合信迪利单抗[信达生物制药(苏州)有限公司,国药准字S20180016,规格:100 mg(10 mL)/瓶]治疗,具体方案如下:口服安罗替尼,12 mg/次,1次/d,连用2周后停药1周,以3周为1个化疗周期;取200 mg信迪利单抗溶于100 mL的0.9%氯化钠溶液中行静脉滴注,于30~60 min滴注完毕,每3周1次。对照组患者给予安罗替尼单药治疗,用药方案同试验组。当患者连续用药直至病情进展或出现不可耐受的不良反应予以停药,随访截至2023年8月。
1.3 观察指标 ①比较两组患者疗效。治疗2个化疗周期后评估疗效。完全缓解(CR):所有肿瘤靶病灶消失,无新病灶出现,至少维持4周;部分缓解(PR):与基线相比,所有可测量靶病灶的最大直径总和缩小≥30%,至少维持4周;疾病进展(PD):所有可测量靶病灶的最大直径总和增加≥20%,或出现新病灶;疾病稳定(SD):所有可测量靶病灶的最大直径减少程度未达PR,增加程度未达PD[8]。客观缓解率(ORR)=[(CR+PR)例数/总例数]×100%,疾病控制率(DCR)=[(CR+PR+SD)例数/总例数]×100%。②比较两组患者中位无进展生存期(PFS)和中位总生存期(OS)。从治疗开始至PD或死亡(以先发生者为准)的时间为PFS,从治疗开始至死亡的时间为OS。中位PFS:50%患者发生PD或死亡的生存时间;中位OS:50%的患者达到的生存时间。③比较两组患者炎症及免疫指标水平。于治疗前及治疗2个化疗周期后采集患者静脉血5 mL,分别取2.5 mL置于含有乙二胺四乙酸(EDTA)和不含抗凝剂的试管中;将含有EDTA的试管用高速离心机(Thermo Fisher Scientific,国械备20180583号,型号:Sorvall ST 16)以1 500 r/min离心10 min(離心半径为9.5 cm),分离血浆和血细胞,将血细胞转移到含有密度梯度离心液的15 mL离心管中进行密度梯度离心,分离出单个核细胞,置于-80 ℃冰箱待检,以放射性释放法(RRA)测定自然杀伤细胞(NK细胞)活性。将无抗凝剂的试管放置于室温中,自然凝固30~60 min,用台式离心机以3 000 r/min离心15 min(离心半径9.5 cm),分离血清,置于-80 ℃冰箱待检;以酶联免疫吸附法(ELISA)测定肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)及白细胞介素-10(IL-10)水平。④比较两组患者不良反应发生情况。记录患者不良反应(高血压、手足皮肤反应、蛋白尿及甲状腺功能减退)的发生率并评估分级[1级(轻度)、2级(中度)、3级(重度)、4级(危及生命)和5级(死亡)][9]。不良反应总发生率=各项不良反应发生例数之和/总例数×100%。
1.4 统计学分析 采用SPSS 22.0统计学软件进行数据分析。计数资料以[例(%)]表示,组间比较采用χ2检验或Fisher精确概率法;计量资料以(x)表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank χ2检验。以P<0.05为差异有统计学意义。
2 结果
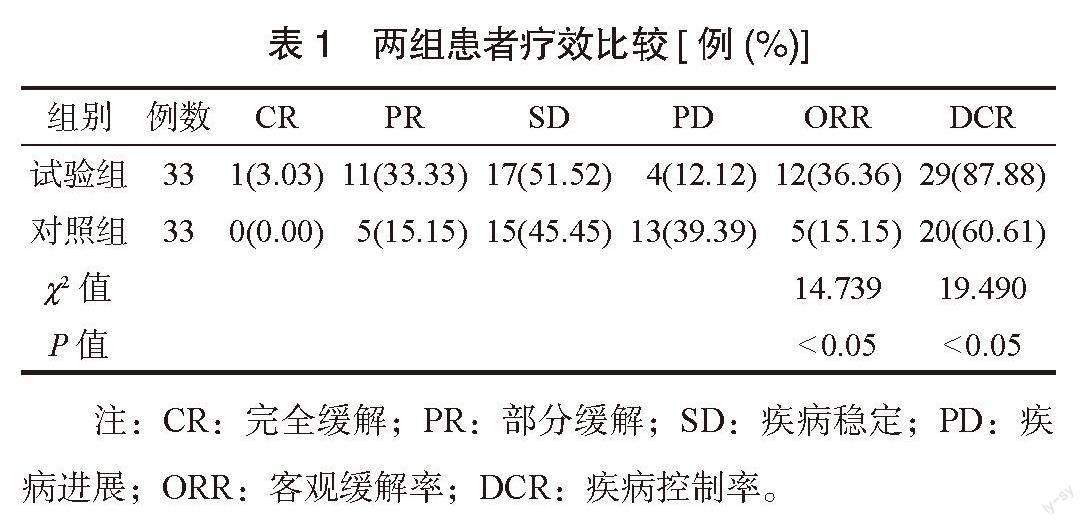
2.1 两组患者疗效比较 试验组患者的ORR、DCR均高于对照组,差异均有统计学意义(均P<0.05),见表1。
2.2 两组患者中位PFS和中位OS比较 试验组患者的中位PFS为7.82个月,中位OS为14.18个月;对照组患者的中位PFS为3.57个月,中位OS为8.00个月。试验组患者的中位PFS、中位OS长于对照组,差异有统计学意义(Log-rank χ2值=28.471,P<0.05),见图1。
图1 两组患者的Kaplan-Meier生存曲线
2.3 两组患者炎症及免疫指标水平比较 两组患者治疗前TNF-α、IL-2、IL-10水平及NK细胞活性比较,差异均无统计学意义(均P>0.05)。两组患者治疗后IL-2水平和NK细胞活性与治疗前比较,差异均无统计学意义(均P>0.05);试验组患者治疗后TNF-α和IL-10水平均低于治疗前和对照组,差异均有统计学意义(均P<0.05),见表2。
2.4 两组患者不良反应发生情况比较 试验组患者不良反应发生率为63.64%(21/33),对照组患者不良反应发生率为39.39%(13/33)。试验组患者不良反应发生率高于对照组,差异有统计学意义(χ2值=11.723,P<0.05);两组患者的不良反应以高血压、手足皮肤反应、蛋白尿及甲状腺功能减退等为主,均为1~2级,无3~5级不良反应发生,且患者均可耐受。
3 讨论
安罗替尼和信迪利单抗具有不同的抗肿瘤作用机制,因此,将两者联合使用可能产生协同或增效的效果,同时降低化疗的毒性[10]。
本研究结果显示,试验组患者ORR、DCR高于对照组,中位PFS、中位OS长于对照组,提示安罗替尼联合信迪利单抗治疗老年NSCLC的效果优于安罗替尼单药治疗。这可能与两种药物对肿瘤微环境的改善有关,安罗替尼能够抑制肿瘤血管的生成,发挥抑制肿瘤生长的作用;同时,安罗替尼也能够增加肿瘤细胞表面的程序性死亡配体1(PD-L1)表达水平,从而增强信迪利单抗对T细胞功能的恢复作用[11]。
NK细胞能抑制癌细胞附近新血管的形成,从而限制肿瘤生长;IL-2是一种重要的细胞因子,可有效维持和控制T 细胞反应;TNF-α是一种炎性细胞因子,能够诱导肿瘤细胞的凋亡,也能够促进肿瘤的血管生成和转移。IL-10是一种抗炎性细胞因子,能够抑制辅助性T细胞1(Th1细胞)的分化和活化,抑制巨噬细胞和树突状细胞的功能[12]。本研究结果还显示,两组患者治疗后IL-2水平和NK细胞活性与治疗前比较,差异无统计学意义;试验组患者治疗后血清TNF-α和IL-10水平低于治疗前和对照组,提示安罗替尼联合信迪利单抗治疗能够降低机体的炎症反应。本研究结果显示,试验组患者不良反应发生率高于对照组,但两组患者的不良反应均为1~2级,无3~5级不良反应发生,患者均可耐受。对于老年NSCLC患者而言,不良反应发生率的可接受性是相对的,需要根据药物的治疗效果、风险收益比、替代药物的可用性、不良反应的严重程度、可预防性、可逆性等因素进行综合评价。一般来说,如果药物的治疗效果明显,风险收益比较高,替代药物较少,不良反应较轻微或可预防、可逆,但由于这些药物能够延长患者的生存期,改善患者的生活质量,而且没有更好的替代方案,所以这些不良反应仍在可接受的范围内[13]。
综上所述,安罗替尼联合信迪利单抗治疗老年NSCLC患者具有较好的疗效和可接受的安全性,值得临床应用。
参考文献
DUMA N, SANTANA-DAVILA R, MOLINA J R. Non-small cell lung cancer: Epidemiology, screening, diagnosis, and treatment[J]. Mayo Clin Proc, 2019, 94(8): 1623-1640.
吴慧娟,吴红波,邹宏志,等.老年晚期非小细胞肺癌的临床特点及对化疗的耐受性和疗效[J].中国老年学杂志, 2016, 36(3): 632-634.
李雪晴,徐志勇.安罗替尼联合个体化护理对晚期非小细胞肺癌患者的疗效分析[J/CD].现代医学与健康研究电子杂志, 2023, 7(9): 106-108.
邵茜,叶斌,黄贵祥.免疫检查点抑制剂在老年非小细胞肺癌患者免疫治疗中的疗效观察[J].实用医院临床杂志, 2023, 20(2): 88-92.
许长春,李海芝,朱焰.非小细胞肺癌临床分期的确定[J].临床肺科杂志, 2003, 8(4): 326-328.
中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2019版)[J].中华肿瘤杂志, 2020, 42(4): 257-287.
QUINN S E, CRELL C E, BLAKE M E, et al. The correlative strength of objective physical assessment against the ECOG performance status assessment in individuals diagnosed with cancer[J]. Phys Ther, 2020, 100(3): 416-428.
EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
皋文君,刘砚燕,袁长蓉.国际肿瘤化療药物不良反应评价系统:通用不良反应术语标准4. 0版[J].肿瘤, 2012, 32(2): 142-144.
邵茜,叶斌,黄贵祥.免疫检查点抑制剂在老年非小细胞肺癌患者免疫治疗中的疗效观察[J].实用医院临床杂志, 2023, 20(2): 88-92.
高航,殷俊,李燕舞.安罗替尼联合PD-1抑制剂治疗晚期非小细胞肺癌患者的近期临床疗效及对血清VEGF、MMP-2水平的影响分析[J].中国临床新医学, 2023, 16(7): 716-720.
张妍蓓,刘荣玉,汪伟民,等.非小细胞肺癌患者血清中IL-10水平的临床意义[J].安徽医科大学学报, 2003, 38(2): 127-129.
姜惠琴,刘天舒.抗癌药物评定标准:统计学差异还是临床获益[J].中国临床医学, 2018, 25(4): 655-658.
