基于PI3K/AKT/mTOR信号通路探讨大黄煎剂对轻微型肝性脑病大鼠脑组织炎症损伤的保护机制
2024-02-26张广发蔡颖莹张荣臻陈月桥黄良江蓝艳梅乐滢玉毛德文
张广发, 蔡颖莹, 林 龙, 付 蕾, 姚 凡, 王 萌, 张荣臻, 陈月桥, 黄良江, 王 涵, 苏 运,蓝艳梅, 乐滢玉, 毛德文, 姚 春
1 广西中医药大学研究生院, 南宁 530200
2 广西中医药大学附属瑞康医院科研部, 南宁 530011
3 广西中医药大学第一附属医院 a. 肝病科, b. 脾胃科, c. 分子生物学实验室, d. 肿瘤科, 南宁 530023
肝性脑病(hepatic encephalopathy,HE)是急慢性肝功能障碍的常见并发症,以代谢紊乱和神经精神异常为主要特征。其主要机制以氨中毒学说为主导,与炎症反应损伤协同促进HE 的发生发展。研究[1]表明,轻微型肝性脑病(minimal hepatic encephalopathy,MHE)的发病机制与HE 的发病机制无明显差异,只是程度不同。炎症中的炎性细胞因子和氨等有毒物质破坏血脑屏障进入脑组织,导致脑实质改变及脑功能障碍[2]。磷脂酰肌醇3-激酶(PI3K)通过经活化后的蛋白激酶B(AKT)激活底物哺乳动物雷帕霉素靶蛋白(mTOR),起到调控下游细胞增殖和炎症靶基因表达的作用[3]。研究[4]发现,PI3K/AKT/mTOR 信号通路是机体炎症反应的重要调节途径,能够抑制脑损伤后的神经炎性反应及细胞凋亡,发挥一定的脑组织保护作用。
大黄煎剂是中医药治疗MHE 的经验处方,临床与科研应用十余年,卓有成效。本团队研究[5-6]发现,大黄煎剂保留灌肠后,可以显著改善HE 患者的临床症状,降低内毒素水平,减少肠道细菌过度增长,调整肠道菌群失衡,发挥显著的保肝护脑的疗效。近期的网络药理学研究[7]亦证实,PI3K/AKT 信号通路可能是大黄煎剂治疗MHE 的作用靶点通路之一。综上,本研究旨在探讨大黄煎剂对MHE 大鼠模型学习认知能力的影响及其“通腑开窍”理论的作用机制。
1 材料与方法
1.1 实验动物与分组 清洁级、雄性成年SD大鼠60只,6~8 周龄,体质量200~220 g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证编号:SYXK(湘)2019-0004,实验动物使用许可证:SYXK(桂)2019-0001。
按照完全随机方法取6只大鼠作为空白组(CON组),剩余54只大鼠构建慢性肝硬化模型,经Morris水迷宫实验测试符合MHE症状大鼠40只,造模成功率为76.9%。将40 只大鼠采用完全随机方法分为模型组(MOD 组)、乳果糖组(LT 组)、大黄煎剂低剂量组(RD1 组)、大黄煎剂中剂量组(RD2 组)及大黄煎剂高剂量组(RD3 组),每组8只。
1.2 主要药品与试剂 大黄煎剂:醋大黄30 g,乌梅30 g(天江药业有限公司提供,机配免煎颗粒),CCl4(麦克林,C13385752),ELISA试剂盒(武汉华美),ALT(X22039295)、AST(X23039296)、IL-1β(Z19031282)、IL-6(Z20031283)、TNF-α(X21039294)、ZOL(200 mL)RNA 提取通用(德国MACHEREY-NAGEL,740404),PI3K、AKT、mTOR mRNA引物由生工生物工程(上海)股份有限公司合成,RIPA高效裂解液(索莱宝科技,HY-K0022),BCA 蛋白定量试剂盒(博士德生物,14J29C46),三鹰生物技术:PI3K(60225-1-Ig)、mTOR(66888-1-Ig),AKT(Cell Signaling,C67E7)。
1.3 仪器 图像采集软件Leica Application Suite V4(德国Leica 公司),Mastercycle Nexus PCR 循环仪(Eppendoff 公司),LightCycler®480Ⅱ实时荧光定量PCR仪(罗氏公司)。
1.4 实验方法
1.4.1 慢性肝硬化大鼠模型的建立 本实验参考文献[8]建立慢性肝硬化模型,将CCl4(分析纯)、橄榄油按2∶3混合后于大鼠皮下注射(最初8次1.5 mL/kg,而后每次2 mL/kg),每隔3 d 注射1 次,持续12 周;CON 组注射等量生理盐水。构建慢性肝硬化模型的54 只大鼠在造模期间死亡2 只,余52 只大鼠中随机取3 只用以观察造模后大鼠肝功能和血氨水平是否显著升高,肝组织是否符合慢性肝硬化病理改变,方法为尾静脉采血0.25 mL,按照说明书操作,离心15 min(2 000 r/min),提取血清,用ELISA 试剂盒检测大鼠血清ALT、AST 水平;提取0.2 mL血浆,全自动生化检测仪快速检测大鼠血氨水平;同时,取大鼠肝组织进行HE染色。
1.4.2 MHE 判定 慢性肝硬化造模成功后结合Morris水迷宫测试结果判定MHE,符合下列3 项条件则可认为MHE 模型构建成功:(1)慢性肝硬化大鼠模型的Morris水迷宫测试值大于CON组;(2)在整个实验造模过程中,大鼠未出现显性肝性脑病症状,包括自主活动减弱、反应迟钝、运动失调、昏迷等;(3)血氨水平高于CON组。
1.4.3 干预方法 (1)CON 组和MOD 组:用生理盐水保留灌肠,2 mL/只,1 次/d,持续10 d。(2)LT 组:用乳果糖按22.5%剂量保留灌肠,2 mL/只,1 次/d,持续10 d。(3)RD1 组、RD2 组、RD3 组:分别用大黄煎剂按2.5、5.0、7.5 g/kg 三种剂量保留灌肠,2 mL/只,1 次/d,持续10 d。
1.4.4 检测指标
1.4.4.1 Morris水迷宫逃避潜伏期 所有大鼠治疗10 d后,进行Morris 水迷宫测试,分析大鼠的空间学习记忆能力。将水池分为1、2、3、4 共四个象限,分别让大鼠面向缸壁入水,寻找并记录爬上平台时间(逃避潜伏期),取每一组次的平均值。
1.4.4.2 肝及脑组织HE 染色 肝、脑组织于4%多聚甲醛固定24 h后进行包埋、切片及染色。
1.4.4.3 ELISA 法检测大鼠动脉血的肝功能和炎性细胞因子的表达 按照说明书操作,提取血清,用ELISA试剂盒检测大鼠血清ALT、AST、IL-1β、IL-6 和TNF-α 的表达水平。
1.4.4.4 定量聚合酶链式反应(qPCR)检测大鼠脑组织PI3K、AKT 及mTOR 的mRNA 表达 取20~30 mg 脑组织,加入400 μL 裂解液研磨2 min 后,再加入600 μL裂解液。4 ℃冰箱放置15 min,常温离心机瞬离10 s,加入200 mL 氯仿,震荡混匀,室温静置5 min。离心(4 ℃,12 000×g,15 min),吸取上水相0.45~0.50 mL。加入异丙醇0.5 mL,颠倒混匀,离心后的沉淀物即为RNA。加入1 mL 的75%乙醇溶液,混匀后离心(4 ℃,12 000×g,10 min),得到白色黏附物。加入75%的乙醇980 μL 洗涤3次,晾干加入50 μL无酶水,混匀后备用。
按试剂盒说明书进行反转录(SYBR Green qPCR法),配置qPCR 反应体系,随后置入LightCycler®480Ⅱ仪器中进行检测,反应结束后确认qPCR 的溶解曲线和扩增曲线,进行定量、作RNA标准曲线等。其中,目的基因的相对表达量应用2-ΔΔCt法计算结果。以β-actin 作为内参,检测脑组织PI3K、AKT、mTOR mRNA相对表达量。引物设计由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.4.4.5 蛋白质印迹法(Western Blot)检测大鼠脑组织PI3K、AKT 及mTOR 的蛋白表达 取30 mg 脑组织,加入200 μL RIPA高效裂解液提取组织蛋白,BCA法检测蛋白浓度。后续电泳上样体积为5 μL,蛋白量为30 μg。使用快速凝胶试剂盒配制7.5%电泳凝胶,将样本转移至PVDF膜,TBST洗膜及封闭,一抗4 ℃孵育过夜[抗体稀释比例:β-actin(1∶800),PI3K(1∶2 000),AKT(1∶1 000),mTOR(1∶4 000)]。TBST洗膜,加入对应的二抗(1∶10 000)室温孵育2 h,TBST 洗膜,加入ECL 显影液避光反应5 min,显影后计算相对蛋白表达量。
1.5 统计学方法 应用SPSS 23.0统计软件进行数据分析,Graphpad Prism 7.0 软件进行绘图。计量资料多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝功能和血氨水平比较 与CON 组相比,MOD 组大鼠ALT、AST 和血氨水平均显著升高(P值均<0.01);与MOD 组相比,各治疗组大鼠ALT、AST及血氨水平均明显降低(P值均<0.01)。此外,RD3组大鼠的AST水平显著低于RD1组(P<0.01)(图1)。
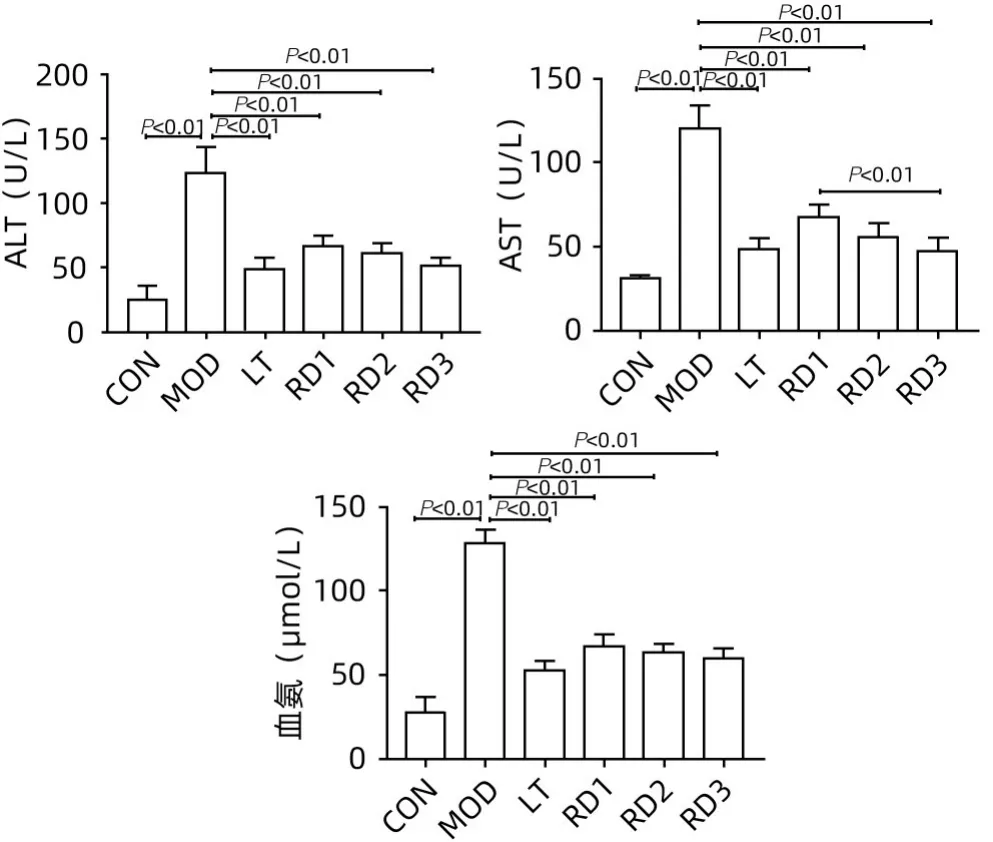
图1 各组大鼠肝功能和血氨水平比较Figure 1 Comparison of liver function and blood ammonia levels among groups of rats
2.2 Morris 水迷宫测试结果 与CON 组相比,MOD 组大鼠的逃避潜伏期时间显著增加(P<0.01);与MOD 组相比,各治疗组大鼠的逃避潜伏期时间均明显减少(P值均<0.01)。此外,LT 组和RD3 组大鼠的逃避潜伏期时间显著少于RD1组(P值均<0.05)(图2)。

图2 各组大鼠药物干预后的逃避潜伏期比较Figure 2 Comparison of escape latency after drug intervention in each group of rats
2.3 肝组织及脑组织病理观察
2.3.1 肝组织病理 与CON 组相比,MOD 组大鼠肝组织病理损伤严重,可见多个完整的肝小叶结构破坏,肝细胞大面积变性坏死,结构排列紊乱,细胞核深染,肝索排列不规整,肝窦扩张明显,伴有出血和大量纤维组织增生,假小叶形成。与MOD 组相比,各治疗组大鼠的肝组织病理损伤得到改善,小部分肝细胞变性坏死,结构排列紊乱减少,细胞核染色较浅,肝索排列稍不规整,肝窦扩张及出血症状减轻或消失,可见少量纤维组织,其中以LT组和RD3组效果较好(图3)。

图3 光镜下各组大鼠肝组织HE染色结果(×200)Figure 3 Light microscopy results of HE staining of rat liver tissue in each group (×200)
2.3.2 脑组织病理 与CON 组相比,MOD 组大鼠脑皮质与海马区内神经元结构模糊,排列稀疏,形状、大小不规则,数量减少,染色浅,可见较多的神经元变性和核固缩,大量炎症细胞浸润。与MOD 组相比,各治疗组大鼠的脑皮质与海马区内神经元改变较轻,形态排列较规则紧密,细胞略微肿胀,形状与大小稍不规则,数量较少,染色较深,可见少量的神经元变性、核固缩及炎症细胞浸润,其中以LT组和RD3组效果较好(图4)。
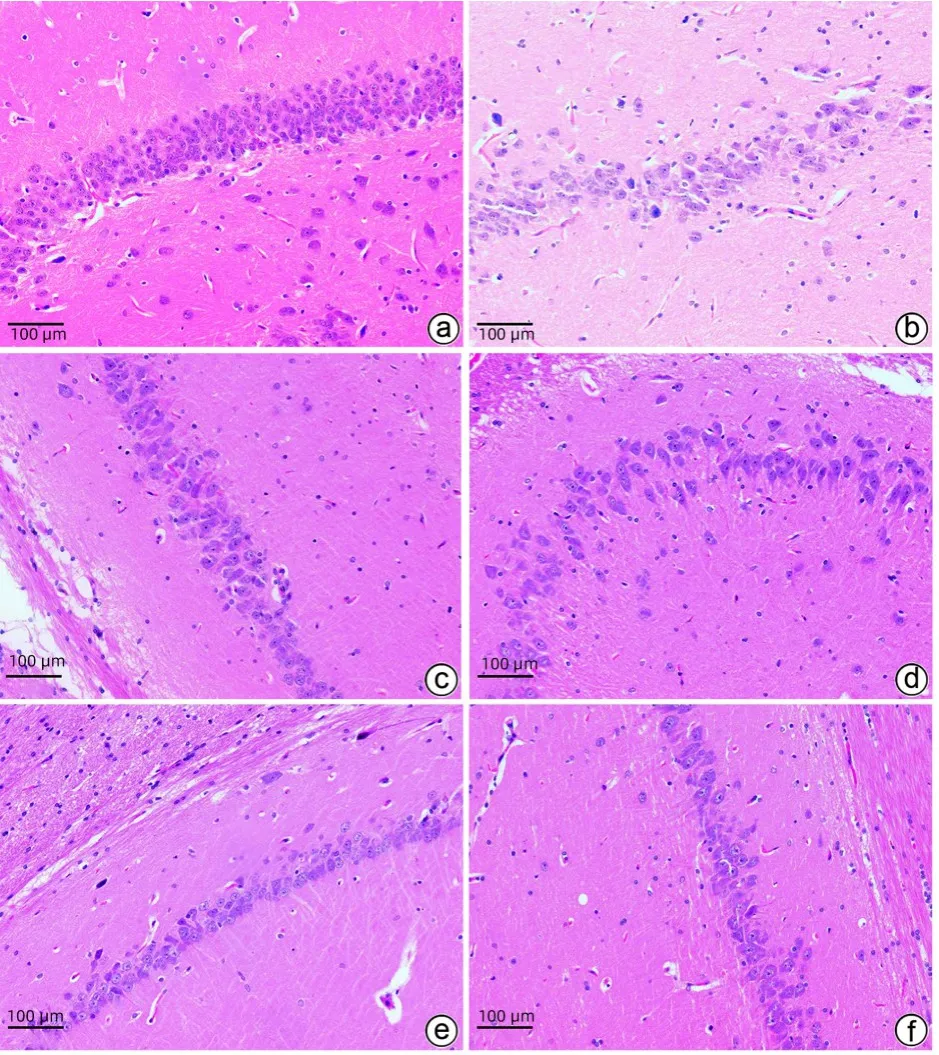
图4 光镜下各组大鼠脑组织HE染色结果(×200)Figure 4 Light microscopy results of HE staining of rat brain tissue in each group (×200)
2.4 各组大鼠血清炎性细胞因子表达水平比较 与CON组相比,MOD组大鼠血清炎性细胞因子IL-1β、IL-6、TNF-α 的表达均明显升高(P值均<0.01);与MOD 组相比,各治疗组大鼠血清炎性细胞因子IL-1β、IL-6、TNF-α的表达均显著降低(P值均<0.01)。此外,与RD1 组相比,LT组的TNF-α水平、RD2组的IL-1β水平以及RD3组的IL-1β和IL-6水平均明显降低(P值均<0.05)(图5)。
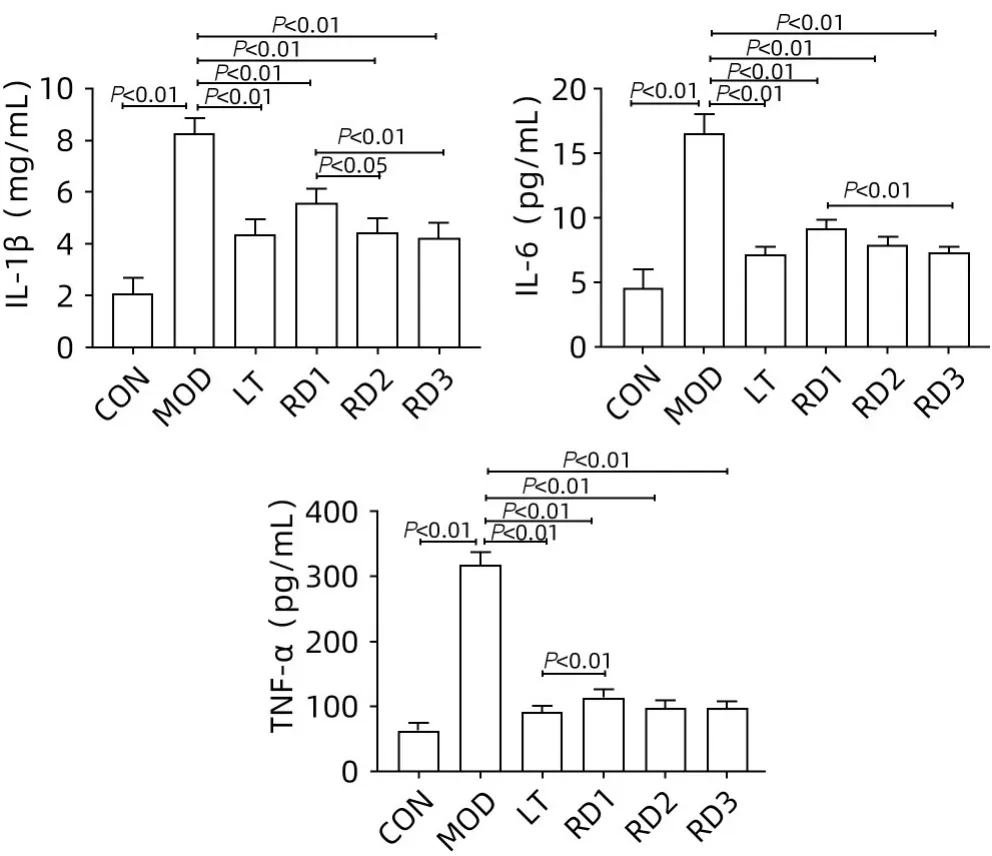
图5 各组大鼠相关炎性细胞因子水平比较Figure 5 Comparison of levels of relevant inflammatory cytokines among groups of rats
2.5 各组大鼠脑组织PI3K、AKT、mTOR 的mRNA 表达水平比较 与CON 组相比,MOD 组大鼠脑组织PI3K、AKT、mTOR的mRNA表达量均显著升高(P值均<0.01);与MOD 组相比,各治疗组大鼠脑组织PI3K、AKT、mTOR的mRNA 表达量均显著降低(P值均<0.05)。此外,LT组、RD2 组和RD3 组大鼠脑组织PI3K、AKT、mTOR 的mRNA 表达量均明显低于RD1组(P值均<0.05);RD3组大鼠脑组织PI3K、AKT、mTOR的mRNA表达量明显低于RD2组(P值均<0.05)(图6)。

图6 各组大鼠脑组织中PI3K、AKT、mTOR的mRNA相对表达量比较Figure 6 Relative mRNA expression of PI3K, AKT and mTOR in the brain tissue of rats in each group
2.6 各组大鼠脑组织PI3K、AKT、mTOR 蛋白表达水平比较 与CON 组相比,MOD 组大鼠脑组织PI3K、AKT、mTOR的蛋白表达量均显著升高(P值均<0.01);与MOD组相比,各治疗组大鼠脑组织PI3K、AKT、mTOR 的蛋白表达量均显著降低(P值均<0.01)。此外,LT 组、RD2 组和RD3 组大鼠脑组织PI3K、AKT、mTOR 的蛋白表达量均明显低于RD1 组(P值均<0.01);LT 组、RD3 组大鼠脑组织PI3K、AKT、mTOR 的蛋白表达量均显著低于RD2组(P值均<0.05)(图7)。

图7 各组大鼠脑组织中PI3K、AKT、mTOR的蛋白免疫印迹结果及蛋白表达量比较Figure 7 Comparison of protein expression of PI3K, AKT,and mTOR in brain tissues of rats from various groups
3 讨论
有研究[9]通过正电子发射型计算机断层显像技术发现,HE 患者脑部相关区域的胶质细胞11C-PK11195和18F-DPA-714 结合显著增加,这为HE 存在脑神经炎症反应提供了直接的影像学证据。神经炎症级联反应持续存在诱导神经元细胞凋亡,影响神经递质传递,造成星形胶质细胞水肿/脑水肿等脑神经病理改变,这与HE的临床特征性症状重叠[10]。因此,深入研究脑神经炎症出现的原因及其诱发MHE 的机制,将为慢性肝硬化并发MHE的防治提供新的思路及手段。
传统医学并无与HE 相对应的病名,根据其临床表现可归属“肝厥”“神昏”等范畴。此病的核心病机是腑气不通,蒙蔽神窍,治法多用通腑开窍,方选大黄煎剂[5]。大黄煎剂由醋大黄和乌梅两味中药组成,方中醋大黄善泻下凉血、清热解毒,乌梅有涩肠生津止渴之效。二者共奏酸苦涌泄之妙,荡涤肠胃,逐邪外出,增加脑氧供应,以达到通腑开窍之效[6]。
本研究结果显示,大黄煎剂改善MHE 大鼠肝功能主要表现在:与模型组比较,大黄煎剂低、中、高剂量组大鼠肝脏中肝细胞变性坏死、炎性细胞浸润、组织增生程度均得到不同程度改善,ALT、AST 水平均显著降低。大黄煎剂改善MHE 大鼠脑功能表现在:与模型组比较,大黄煎剂低、中、高剂量组大鼠Morris 水迷宫逃避潜伏期时间均明显缩短,血清中炎性因子IL-1β、IL-6、TNF-α水平显著降低,这可能与大黄化学成分及单体化合物具有显著的抗神经炎症,穿透血脑屏障发挥抗炎功能,减轻炎症反应,抑制白三烯B4,减少炎性因子IL-6、TNF-α的释放,下调血小板激活因子,抑制白细胞、促炎因子基因的甲基化等有关[11-13]。脑组织病理结果显示,大黄煎剂低、中、高剂量脑神经元形态排列紊乱、肿胀坏死、炎症细胞浸润减轻,且脑组织相关PI3K/AKT/mTOR 炎症通路的mRNA 与蛋白表达水平均显著低于模型组,以大黄煎剂高剂量组效果最佳。有研究[14-15]表明,多种药物可激活PI3K/AKT/mTOR 通路以减轻相关疾病的神经炎症。类似的,本研究结果表明,大黄煎剂可能激活PI3K/AKT/mTOR 通路,抑制MHE 大鼠脑组织炎症,有效改善脑组织炎性损伤。
综上,大黄煎剂可以降低MHE 大鼠脑内炎症反应,改善MHE的神经精神症状,这些保护作用可能通过调节PI3K/AKT/mTOR信号通路进而减少炎性细胞因子IL-1β、IL-6 和TNF-α 合成及释放来实现。大黄煎剂是含有多种有效成分的中药复方,未来笔者团队将继续探究并筛选出复方中治疗MHE的主要有效成分。
伦理学声明:本研究方案于2022年4月10日经由广西中医药大学动物伦理委员会审批,批号:DW20220410-133,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:张广发负责拟定写作思路,撰写文章;蔡颖莹、林龙负责设计论文框架;付蕾、姚凡、王萌负责指导实验技术;张荣臻、陈月桥负责推进实验进度和实验质量;黄良江、王涵、苏运负责构造动物模型;蓝艳梅、乐滢玉负责行为学实验。姚春、毛德文负责研究选题,指导文章撰写和修改。
