放大内镜联合窄带成像诊断早期胃癌的研究进展
2024-02-26南毓婷赵天成
南毓婷,张 昊,赵天成
(吉林大学中日联谊医院 胃肠内科(内镜中心),吉林 长春130033)
在最新公布的全球癌症统计报告中,据估计2020年大约有100万胃癌新病例,以及769 000人因胃癌死亡。胃癌发病率为5.6%,死亡率为7.7%,是全球第五大最常见的癌症,也是癌症相关死亡的第四大原因[1]。同时,胃癌是我国第四大高发癌症,也是癌症死亡的第三大原因[2],结合人口老龄化的趋势,预计未来新病例的数量将会增加[3-4]。由于胃癌在早期阶段症状并不典型,所以80%以上的胃癌患者确诊时已是晚期,总体5年生存率为35%左右[5]。倘若胃癌在早期或可切除阶段被诊断时,其5年生存率接近95%~99%,远高于晚期胃癌。因此,提高生存率的关键在于胃癌的早期诊断和治疗[6-7]。
日本胃肠病学和内镜学会定义早期胃癌(early gastric cancer,EGC)为癌变仅局限在胃黏膜层及黏膜下层,而不论其是否伴有淋巴结转移[8]。目前,EGC的治疗以胃镜下超微创治疗技术为主导,因此对病变范围及深度的评估需要更加精细、全面,放大内镜(magnifying endoscopy,ME)便是崭露头角的新技术之一。它是将黑帽固定在内镜顶端,从而与黏膜保持大约2 mm的距离,在此基础上通过电子放大技术实现80~160倍的放大效果。窄带成像(narrow-band imaging,NBI)是将光的波长和带宽修改为(415±30) nm和(540±30) nm的双波长窄带成像技术。白光是红、绿、蓝三原色的混合,当被投照到物体表面时,每种原色都会发生不同程度地吸收和反射。如果仅用能被血红蛋白特异吸收的光线进行投照,人们看到的血管就会呈现高对比度的黑色。415 nm和540 nm是血红蛋白的吸收高峰。把上述光投照到黏膜表面时,因为中心波长为415 nm的蓝光在组织中的传播浅而范围窄,所以被血红蛋白强吸收后只有表浅的微血管呈现出高对比的深黑色。因为中心波长为540 nm的绿光在组织中传播的相对深,范围相对宽,所以被血红蛋白强吸收后只有位于中间层较细的集合静脉呈现出高对比度的深黑色。同时,将光谱带宽从50~70 nm缩小到20~30 nm,有助于提高血管成像的对比度。但在实际应用中,医师们需要内镜显示器呈现彩色图像,因此将窄带光形成的灰阶图像分配给特定的成像通路,进一步合成彩色图像。最终,毛细血管的颜色为深棕色而集合静脉为青色[9]。当窄带成像与放大内镜(magnifying endoscopy with narrow-band imaging,ME-NBI)联合使用时,可以根据黏膜毛细血管和表面结构来描述EGC组织的特征,从而实现对病变更加全面、准确的评估。
1 ME-NBI对EGC定性诊断的临床价值
在ME-NBI模式下,正常的黏膜呈现为规律排列的小而圆的凹坑,周围有聚集的静脉和蜂窝状的上皮下毛细血管网[9]。2009 年YAO等[10]为了用ME-NBI判断病灶是否癌变,提出了血管加表面(vessel plus surface,VS)分类的方法。该方法是以微血管(microvascular,MV)模式和微表面(microsurface,MS)结构为基础,对胃黏膜进行微观解剖观察。具体而言,VS分类方法根据胃黏膜毛细血管和表面结构的形态、分布和排列进行评估,从而将MV及MS分为“规则的”、“不规则的”和“缺失的”三种模式。
2016年MUTO等[11]提出了基于VS分类的放大内镜下早期胃癌简易诊断方法(magnifying endoscopy simple diagnostic algorithm for gastric cancer,MESDA-G),得到了日本胃肠病协会、日本胃肠内镜协会、日本胃癌协会和世界内镜组织的认可。在MESDA-G(图1)中,内镜医师首先密切观察黏膜颜色变化(偏白或偏红)以及形态变化(平坦、凹陷或隆起)。发现上述可疑病灶后,用ME-NBI来确定病变和背景黏膜之间是否存在一条清晰的分界线(demarcation line,DL)。DL被定义为病变区和非病变区之间MV或MS 的形态、分布和排列的突然变化。如果没有DL,则诊断为非癌性病变。如果DL存在,则继续评估DL内病变是否存在不规则的MV(irregular microvascular pattern,IMVP)和(或)不规则的MS(irregular microsurface pattern,IMSP)。如果二者均未发现,则诊断为良性病变;如果存在IMVP和(或)IMSP,则诊断为癌性病变。相较于白光内镜(conventional white light imaging,C-WLI),该方法已被证明是诊断EGC,尤其是尺寸≤5 mm的小癌变以及0-IIb型EGC的一种简单而有用的诊断方法,具有较高的准确性、高阳性预测值和高阴性预测值,分别为95%、79%和99%。
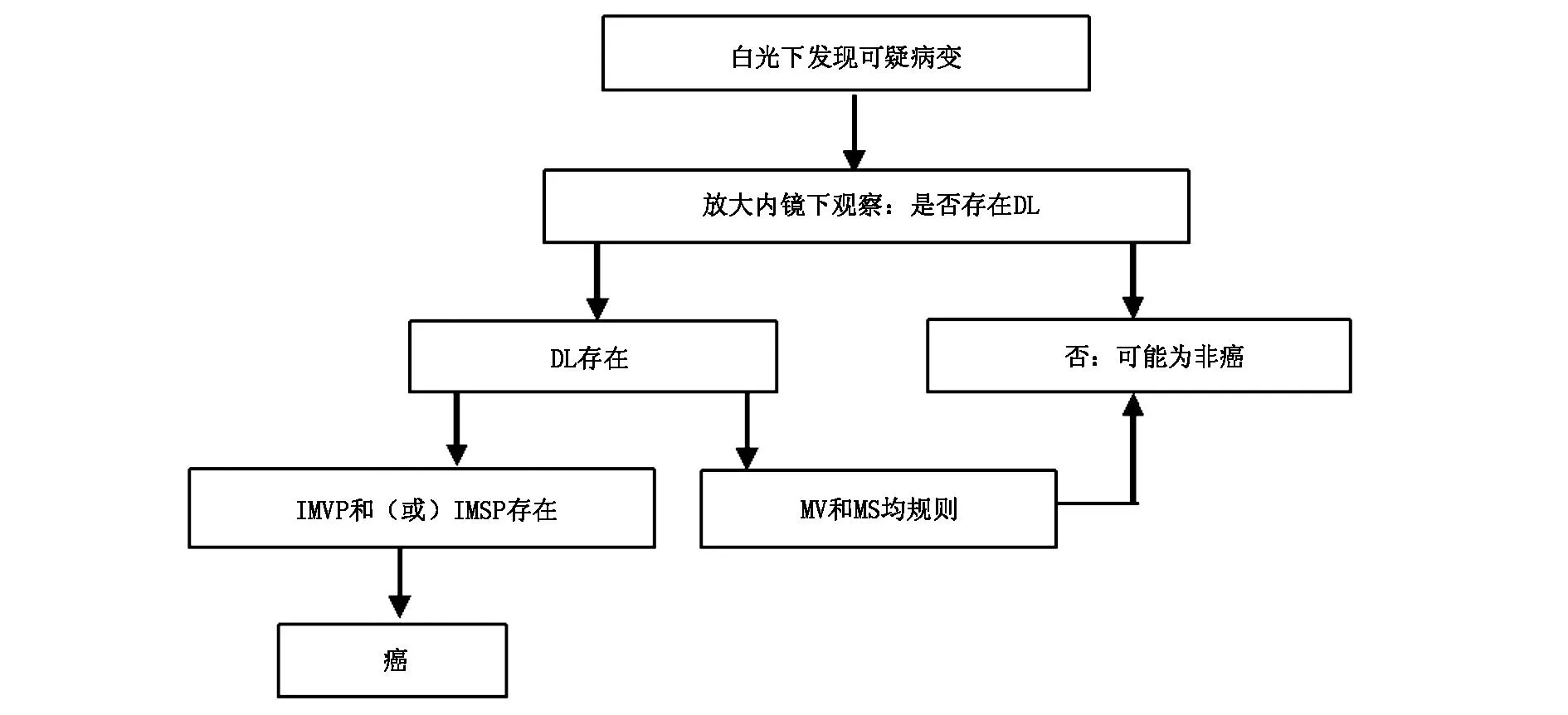
注:DL:病变区和非病变区之间的分界线;IMVP:不规则的微血管形态;IMSP:不规则的表面微结构;MV:微血管;MS:表面微结构
在MESDA-G的基础上,TAMURA等[12]首次发现了ME-NBI 有助于辨别C-WLI 难以区分的黏膜内癌和腺瘤,减少癌症的漏诊,同时也可以避免不必要的活检。活检由于技术本身特点,往往无法代表整体病变,且反复活检会导致黏膜下发生纤维化改变,给后续内镜治疗造成了一定程度的困难。YOSHIMIZU等[13]对 3 763例EGC患者进行回顾性分析,发现放大组的胃活检率明显低于非放大组(29% vs 41%,P<0.001),阳性预测值放大组比非放大组(5.5% vs 2.5%,P<0.001)明显高,也进一步证实了ME-NBI对降低活检次数方面的应用价值。但MESDA-G是基于大量分化型胃癌图像提出的诊断方法,在应用时有一些局限性[11]。YAO[9]指出ME-NBI判断未分化型EGC和某些分化型EGC的DL时有困难,需结合活检进一步明确诊断。
近些年,人工智能(artificial intelligence,AI)作为一项新兴技术,是基于包含大量图像及其相应标签的数据集上训练计算机,再通过神经网络使用这些学到的函数对给定的图像进行分类。可以从大量的图像数据中自动学习病变特征。在不同的AI模型中,卷积神经网络(Convolutional neural network,CNN)最常用于图像识别。它是一种从大量的图像数据集中自动学习特征的算法,是内镜图像识别的理想选择。2020年,HORIUCHI等[14]发现CNN系统对ME-NBI图像的准确性为85.3%,敏感度为95.4%,特异度为71.0%,总体测试速度为0.02秒/幅。研究表明带有CNN的ME-NBI可以在短时间内区分EGC和胃炎,具有较高的敏感度和阴性预测值。该研究是在非临床环境中使用静态图像进行设计,并不能充分模拟现实生活经常遇到的图像质量差等情况。因此,HORIUCHI等[15]在上述静态图像研究的基础上,进一步探索CNN应用于ME-NBI视频诊断EGC的性能,同时与专家诊断能力做对比。研究表明CNN系统的曲线下面积为0.8684,准确性、敏感度、特异度分别为85.1%、87.4%、82.8%。表明CNN系统使用ME-NBI视频诊断EGC的总体表现是良好的,相当于或优于一些专家的诊断。
不同于上述回顾性研究,LI等[16]使用386张非癌症的ME-NBI图像和1702张EGC的ME-NBI图像对CNN进行训练后,前瞻性地选取了341张内镜图像作为测试数据集,研究表明CNN 系统诊断EGC的准确性、敏感度、特异度分别为90.91%、91.18%、90.64%。CNN系统的诊断敏感度明显高于专家和非专家医生,特异度和准确性与专家内镜医生相当。HU等[17]研究发现,在AI协助下,初级内镜医生的ME-NBI平均诊断能力有明显提高(P<0.05),且接近高级内镜医师的诊断能力。这对经验不足的ME-NBI医师来说是非常重要的。此外,UEYAMA等[18]使用热图技术发现AI关注的区域似乎是分布密集、直径不均匀的血管区域,因此推断AI以类似于内镜医生的方式进行诊断。这为AI辅助ME-NBI进行EGC诊断作出了可解释性的探索[19]。LI等[20]开发了一个使用ME-NBI诊断EGC的基于特征外显的逻辑拟人诊断系统(a logical anthropomorphic artificial intelligence diagnostic system,ENDOANGEL-LA),能简单直观地将提取的特征指数和诊断结果显示在屏幕上作为诊断参考,从而提高内镜医生的准确性和一致性。具有解释能力的ENDOANGEL-LA有望改善人机协作,确保人工智能临床应用的安全性。这系统的另一项突破是基于专家们给定的诊断逻辑,不需要大量的EGC图像来学习和总结EGC和非癌症之间的区别,可以减少训练样本量。
2 ME-NBI在划定EGC边界方面的表现
在内镜黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗前确定病变的水平边界(horizontal margin,HM)可以减少局部复发,增加完全切除的可能性[21-22]。HORII等[23]使用330例EGC来比较ME-NBI与组织病理学在确定HM方面的诊断准确性,先使用ME-NBI确定整个EGC病变的HM,再从病变外的非癌组织中至少取4个活检组织进行组织病理学确认,研究发现EGC的总体活检阴性率和HM阴性率分别为96.7%和 97.9%,ME-NBI划分病变边界准确性较高。HU等[24]的一项荟萃分析也指出ME-NBI对EGC的HM划分的准确性为92.4%。MAKAZU等[25]对ME-NBI 能够明确划分早癌HM的因素进行探究,发现ME-NBI主要通过上皮下毛细血管数量增加和深度变浅来辨别HM,尤其是针对0-IIb型分化型(differentiated-type,DT)早癌。
临床工作中,划定EGC边界时也常用到色素内镜(chromoendoscopy,CE)。CE是借助染色剂增加表面黏膜对比度以提高内镜诊断能力的一项技术。NAGAHAMA等[26]开展了一项多中心、随机、对照研究,纳入343例接受内镜或手术切除并且病灶≥10 mm的EGC患者,比较了ME-NBI和CE划定EGC边界的准确性(88.0% VS 85.7%,P=0.63),明确了二者对EGC边界的划定效果是相似的。但与ME-NBI相比,CE仍有许多缺点。NBI可通过快速切换内镜模式进行光学染色,而CE则需要根据各种染色剂的特性和特定组织的染色特征进行操作。且染色剂有使患者发生过敏反应的风险。目前,大多数研究都推荐在划分EGC边界时使用ME-NBI。
但ME-NBI在划定EGC边界时也有一定的局限性。HORII等[23]研究发现ME-NBI 对EGC 的HM评估效果在高分化腺癌和大小低于20mm的病变中是非常好的,而对于中分化和低分化腺癌则需要通过结合组织病理学来确认边界。NAGAHAMA等[26]研究发现内镜对部分早癌HM划分不准确对应的组织学原因主要为:(1)未分化型(undifferentiated-type,UDT)腺癌向下浸润,表面覆盖正常黏膜上皮;(2)分化型腺癌与正常黏膜上皮混合;(3)低异型性的分化型腺癌。同时,该研究表明幽门螺杆菌感染状态并不影响ME-NBI划定病灶HM的准确性。此外,AI辅助ME-NBI划定EGC边界也取得了非常好的效果。KANESAKA等[27]开发了一个使用ME-NBI图像评估EGC的计算机辅助诊断系统,以协助内镜医生识别和划定EGC。AI与专家对癌区划分面积的一致率达到73.8%,处理每张图像的速度仅0.49s,效率远高于内镜医师。
3 ME-NBI对评估EGC分化程度的临床价值
EGC的分化程度是淋巴结转移的独立风险因素,未分化型EGC常向黏膜下浸润生长,且具有更高的淋巴结转移风险[28-29]。我国早期胃癌治疗规范研究专家组[30]提出EGC内镜下切除的适应证为:1).绝对适应证:(1)无合并溃疡的DT黏膜内癌;(2)病灶大小≤3 cm、有溃疡的DT黏膜内癌;(3)胃黏膜高级别上皮内瘤变。2).扩大适应证:病灶大小≤2 cm、无溃疡型的UDT黏膜内癌。无法进行腹腔淋巴结清扫是目前内镜治疗技术的短板之一,不符合上述适应证的EGC需根据具体情况选择外科手术、放疗、化疗等其他治疗方案。正因为EGC分化程度在患者首次治疗决策中占有极大比重,所以在治疗前进行分化程度的评估是十分重要的[21,30-31]。研究显示,ME-NBI对EGC分化程度的评估效果较好。林波等[32]研究发现ME-NBI对EGC分化程度判断的总体准确率达到92.3%,与手术后病理判断基本一致。
在临床工作中,ME-NBI相对于活检来说能够对病变的整体进行全面评估。如果仅通过活检可能无法正确诊断出混合型(mixedhistological-type,MT)胃癌,因为MT胃癌同时具有DT和UDT的成分。据日本胃癌治疗指南(Japanese Gastric Cancer Treatment Guidelines,JGCTG),分化型为主的混合型胃癌(DT-predominant mixed-type,D-MT)被视为分化型胃癌,未分化型为主的混合型(UDT-predominant mixed-type,UD-MT)胃癌被视为未分化型胃癌[20]。如果活检对分化类型诊断失误,会导致在内镜治疗后进行额外手术的可能增加,而ME-NBI有助于发现DT和UDT的特征,帮助内镜医师制定合理的治疗策略。HORIUCHI等[33]研究发现在ME-NBI指导下进行活检所得到的结果的准确性、敏感度和特异度都明显高于单独活检,可以避免因误诊其分化类型而进行额外手术的情况。INUYAMA等[34]的研究也发现,在ME-NBI指导下进行活检有助于提高诊断的准确性,尤其是对于UDT胃癌来说。
为了进一步明确ME-NBI在评估D-MT和UD-MT早期胃癌之间的差异,HORIUCHI等[33]通过对156例D-MT和36例UD-MT病变进行分析,发现在ME-NBI模式中,D-MT病变的微血管形态以细网状为主,UD-MT以螺旋状为主。由于未分化型EGC具有向黏膜下浸润生长的特点,OZEKI等[35]主张在ME-NBI下发现UDT成分时,应怀疑UDT占优势的可能性,这为ME-NBI评估EGC分化程度提供了新的诊断思路。此外,WU等[36]开发和验证了一个基于深度学习的系统(artificial intelligence for diagnosing early gastric cancer,ENDOANGEL),可以识别EGC,并评估EGC的入侵深度和分化状态。这是一项多中心、前瞻性、实时、竞争性的比较诊断研究,ENDOANGEL和来自中国19个省44家医院的46名内镜医生使用100个实时ME-NBI视频进行诊断性能的比较。这是第一个使用外部前瞻性视频测试AI辅助EGC诊断系统的研究,也是第一个使用医疗视频的实时人机竞赛。系统诊断EGC的准确性、敏感度和特异度分别为89%,100%,82.54%。敏感度明显高于内镜医生。在ME-NBI图像中,该AI系统预测分化状态的准确性为78.57%,与内镜医生相当。基于上述结果,该系统有望成为临床实践中协助内镜医生诊断EGC的工具。遗憾的是,该研究中预测浸润深度用的是白光内镜视频影像,目前暂没有AI辅助ME-NBI在静态图像或视频中预测EGC侵袭深度的研究。LING等[37]也开展了一项人机竞赛,AI辅助ME-NBI正确预测了EGC的分化状态,显著优于专家。上述两项研究均表明AI在辅助ME-NBI预测分化程度方面取得了较好的效果。
综上,胃癌的早期诊断以及治疗前全面评估对提高患者生存率,改善患者生活质量具有至关重要的作用。ME-NBI通过精细观察病灶表面的DL、MV及MS进行EGC的诊断和HM划分。同时,ME-NBI判断EGC分化程度的总体准确率高,尤其是对于分化型EGC来说。AI作为近些年的新兴技术,广泛应用于医学图像诊断领域。目前,AI辅助ME-NBI在EGC诊断、HM划分及分化程度判断方面已取得较理想的结果,且能克服ME-NBI主观、专业经验依赖性强的弱点,帮助初级内镜医师作出与专家相同水平的诊断。在AI投入到实际临床应用之前,仍需要更多的研究来进一步探索其有效性及局限性。总之,EGC诊断及治疗前评估对患者治疗决策及预后十分重要。对于白光内镜下可疑病变,需进行ME-NBI精查,必要时在ME-NBI指导下进行活检,使EGC诊断及评估更准确、更全面。
