长链非编码LncHECW1-IT1对滑膜间充质干细胞成软骨分化的调控机制
2024-02-26范世珍郭艳玲林松青
王 彬,范世珍,郭艳玲,赵 硕,林松青*
(1.广州中医药大学深圳医院(福田),广东 深圳518034;2.深圳市福田区妇幼保健院)
骨关节炎(osteoarthritis,OA)是临床上常见的年龄相关性退行性关节疾病,它多发生于中老年人,是老年人群中慢性疾病的主要原因,其特点是关节软骨的退变和滑膜炎,可引起疼痛,甚至残疾。最近的一项流行病学研究显示:全世界约3.03亿人患有骨关节炎,给患者和社会造成巨大负担。然而,骨性关节炎的发病机制尚不清楚,现有的治疗只能缓解症状,一种有效的临床治疗骨关节炎的药物或方法仍不确定。因此,更好地了解骨关节炎的发病机制,对于探索新的骨关节炎治疗方法具有重要意义。
对于骨关节炎,软骨自我修复和重塑能力有限,因此,其治疗必须涉及关节软骨的修复,而基于细胞的治疗是一种潜在的治疗策略[1-2]。间充质干细胞(MSCs)存在于骨髓、脐带、脂肪组织和滑膜中[2-3],它们具有多线性分化和自我更新能力,已成为许多不治之症的理想治疗选择,如急性肾损伤[4]、肾缺血/再灌注损伤[5]、OA[6]和肝细胞癌[7],与其他来源的骨髓间充质干细胞相比,滑膜骨髓间充质干细胞(SMSCs)含量丰富,具有最大的软骨生成潜力,它们逐渐成为干细胞研究的热点,近年来被认为是OA治疗中软骨修复的理想干细胞[8-10]。但是,了解SMSCs形成软骨的潜在分子机制还需要进一步的阐明。
长链非编码RNAs(lncRNAs)是一类长度为200nt的非编码RNA;它们在分子结构上类似于信使RNA(mRNAs),已被发现在细胞分化、增殖和凋亡[11-12]等过程中发挥重要的调控作用。lncRNAs还与多种疾病的发生发展密切相关,包括心血管疾病[13]、癌症[14]、代谢综合征相关疾病和OA[15]。此外,它们已被发现在SMSCs的软骨生成分化中发挥重要作用,如lncRNAMEG3和lncRNA DANCR[16]。然而,lncrna在SMSCs成软骨分化中的作用迄今尚未完全阐明。
在本研究中,我们分离了SMSCs,并通过高通量RNA测序分析了SMSCs软骨分化诱导后lncRNAs和mRNA的不同表达水平,lncRNAHECW1-IT1(LncHECW1-IT1)和激活转录因子2(ATF2)在SMSCs的软骨分化中被鉴定出来。接下来,我们研究了LncHECW1-IT1对SMSCs软骨生成分化的影响,随后的实验表明:LncHECW1-IT1通过上调ATF2的表达,促进了人SMSCs的软骨生成分化,LncHECW1-IT1-ATF2轴是一种调控SMSCs成软骨分化的新机制,我们的发现可能为骨性关节炎的治疗提供新的见解。
1 材料和方法
1.1 材料
Dulbecco改良的Eagle培养基F-12,胎牛血清,青霉素与链霉素双抗溶液均购买自美国Gibco公司。SMSCs表面抗原的抗体,包括CD105,CD31,CD34和CD90均购买自美国eBioscience公司。阿利新蓝染色液购买于北京索莱宝生物科技公司。TRIzol购买于美国MRC公司。PCR的引物序列由广州英潍捷基合成,逆转录试剂盒Moloney Murine Leukemia Virus(M-MLV) Reverse Transcriptase与荧光定量PCR试剂盒GoTaq qPCR Master Mix由美国Promega公司提供。转染试剂EndoFectin Max与LncHECW1-IT1的干扰片段均由广州复能基因有限公司提供。一抗collagen II,SOX9,MEF2C,WNT11均购买自英国abcam公司。Aggrecan购买于美国Santa公司,ATF2购买于美国CST公司,GAPDH购买于中国proteintech公司。Peroxidase AffiniPure Goat Anti-Rabbit IgG(H+L)和Peroxidase AffiniPure Goat Anti-Mouse IgG(H+L)购买于美国Jackson公司。BCA试剂盒购买于美国Thermo Fisher公司。
1.2 方法
1.2.1SMSCs的分离与鉴定 所有实验均经广州中医药大学深圳医院(福田)伦理委员会批准,所有滑膜组织捐赠者均获得书面知情同意,按照标准化程序从滑膜组织中分离,并按照之前报道的进行培养[17]。它们在杜尔贝科改良的Eagle培养基F-12(目录号C11330500BT;Gibco)中培养,该培养基补充有10%胎牛血清(目录号040011ACS;BI)和1%青霉素/链霉素(目录号15140122;Gibco)。采用流式细胞仪分析SMSCs的表面标志物,相相应的抗体包括CD105(分类号85-12-1057-41;eBioscience)、CD34(分类号85-11-0349-41;eBioscience)、CD31(分类号85-11-0319-41;eBioscience)和CD90(分类号85-11-0909-41;eBioscience),用冷磷酸盐缓冲液(PBS)洗涤收获的SMSCs,用1%牛血清白蛋白封闭,然后在4℃下与抗体孵育30 min,用PBS洗涤3次后,使用流式细胞仪分析所有细胞。
1.2.2转录组分析 将SMSCs暴露于软骨分化诱导液中(诱导组),按照制造商的说明,在第14天使用TRIzol(目录号TR118-500;MRC)提取总RNA;然后,通过高通量RNA测序表征差异表达的lncRNA(DElncRNA)和mRNA(DEmRNA)谱,dDElncRNAs和DEmRNAs通过log2倍变化确定≥1和错误发现率≤0.001作为使用R包的标准。分别使用ggplot2、先家图和核倍图进行火山图、热图和染色体图,以获得lncrna和mRNA的表达谱概述,采用基因本体论(GO)分析和《京都基因和基因组百科全书》(KEGG)通路分析来预测所有DEmRNA的潜在功能。
1.2.3软骨分化 SMSCs的播种密度为5×105每孔的细胞在六孔板中,有细胞爬升;如前所述,用软骨诱导培养基整夜培养2周,随后在37℃下培养14天分化,每3天更换诱导培养基。在初始诱导后,通过对阿利新蓝的免疫化学染色来评估软骨形成的分化。
1.2.4阿利新蓝染色 SMSCs的播种密度为5×105每孔细胞放在6孔板中,细胞爬升,然后在杜尔贝科改良的Eagle培养基F-12或软骨分化诱导培养基中培养14天,用PBS洗涤3次,每次5 min后,在室温下用4%多聚甲醛固定30 min,再用PBS洗涤3次,然后将其与Alcian酸化工作溶液(目录号G2542;Solarbio)(Alcian酸化溶液/蒸馏水=1∶2)在室温下孵育5分钟,并在Alcian染色溶液中浸泡30分钟。随后,用自来水冲洗SMSCs,用乙醇梯度脱水,并用二甲苯清除。最后,用中性胶密封染色细胞,并在相差显微镜下观察。
1.2.5RNA分离与实时定量聚合酶链反应 使用TRIzol试剂(目录号TR118-500;MRC)从培养细胞中提取总RNA,使用莫洛尼小鼠白血病病毒逆转录酶(目录号M1705;Promega)合成互补DNA。使用GoTaq-qPCR主混合物(分类号A6002;Promega)进行实时定量聚合酶链反应(RT-qPCR)分析;使用StepOnePlus qPCR系统(Applied Biosystems)进行RT-qPCR,一式三份。比较循环阈值(2-ΔΔCt)方法进行分析,结果归一化为U6或甘油醛-3-磷酸脱氢酶的表达。RT-qPCR引物列于表1中。

表1 RT-qPCR引物序列
1.2.6细胞转染 使用小干扰RNAs敲除靶lncRNAs。简单地说,将SMSCs置于6孔板中,并在转染前在37℃下培养24 h。当SMSCs的密度达到80%时,使用EndoFectin Max(目录号EF004;GeneCopoeia)将200 pmol si-LncHECW1-IT1-2、si-LncHECW1-IT1-3或阴性对照小干扰RNA转染SMSCs,转染后的细胞用于后续实验;采用RT-qPCR方法检测转染效率。
1.2.7蛋白质印迹 在含有1%蛋白酶抑制剂苯甲磺酰氟和磷酸酶抑制剂的放射免疫沉淀分析缓冲液中裂解细胞,并使用BCA蛋白质分析试剂盒(目录号23225;Thermo Fisher)定量总蛋白质;总变性蛋白(20 g)经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并转移到聚偏氟乙烯膜上。用5%脱脂牛奶溶液在室温下封闭细胞膜1 h,然后与一抗在4℃下孵育过夜。使用了以下一级抗体:胶原蛋白Ⅱ(1∶1 000;分类号ab34712;Abcam),SRY相关高迁移率族盒9(SOX9)(1∶1 000;分类号ab26414;Abcam),聚集蛋白聚糖(1∶500;分类号sc25674;Santa),甘油醛-3-磷酸脱氢酶(1∶10 000;分类号60004-1;蛋白质),ATF2(1∶1 000;分类号9226;CST),心肌细胞增强因子2C(MEF2C)(1∶1000;分类号ab191428;Abcam),和Wnt家庭成员11(WNT11)(1∶1 000;分类号ab31962;Abcam)。随后在室温下将印迹与辣根过氧化物酶结合的二级抗体孵育1 h(1∶5 000;目录号111-035-003和115-035-003;Jackson)。使用Tanon 5200化学发光成像系统检测条带。
1.3 统计分析
所有测量均进行3次,所有定量值均绘制为平均±标准差。所有数据均采用SPSS 23.0进行分析。两组间和多组间的差异分别采用t检验和单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 SMSCs的分离与鉴定
流式细胞术的结果显示分离出的SMSCs高表达CD90和CD105,CD31和CD34低表达(图1A)。实时定量逆转录聚合酶链式反应结果显示collagen II (COL2A1)、Aggrecan和Sox9的表达水平在诱导14 d后的细胞中明显高于对照组(*P<0.05,**P<0.01,***P<0.001,and ****P<0.0001)(图1B);相对于对照组,蛋白免疫印迹法检测到collagen II (COL2A1)、Aggrecan和Sox9的蛋白表达水平在诱导组中明显上调(图1C)。此外,与对照组相比,诱导组中阿利新蓝的染色强度明显增加(图1D)。这意味着我们成功的将SMSCs诱导为软骨了[18]。
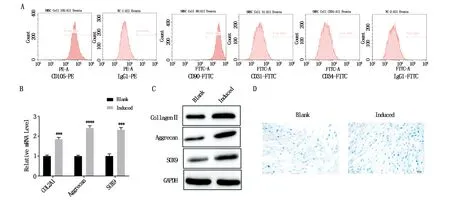
图1 SMSCs的分离与鉴定
2.2 mRNAs在SMSCs软骨分化中的差异表达
接下来通过高通量测序研究了差异表达的mRNAs(即DEmRNAs)和差异表达的lncRNAs(即DElncRNAs)。首先,上调的DEmRNAs分布在染色体上的数量最多的前三条染色体分别为chr1、chr2和chr3,下调的DEmRNAs分布在染色体上的数量最多的前三条染色体分别为chr1、chr11和chr2 (图2A)。总共发现2539个DEmRNAs,其中1458个上调,1081个下调 (图2B-2C)。接着对这差异基因进行了GO和KEGG分析。图2D显示出这些DEmRNAs参与了cellular process,binding,biological regulation,以及metabolic process。图2E显示出丝裂原活化蛋白激酶(MAPK)和Wnt信号通路在软骨形成分化过程中显著富集。提示DEmRNAs在SMSCs成软骨分化中有重要作用。

图2 软骨分化过程中信使核糖核酸的表达谱
2.3 lncRNAs在SMSCs软骨分化中的差异表达
此外,通过高通量测序研究了差异表达的lncRNAs(即DElncRNAs)。测序得到的大部分lncRNAs的长度集中在300~1 000 bp (图3A)。上调的DElncRNA分布在染色体上的数量最多的前三条染色体分别为chr1、chr15和chr17,下调的DElncRNA分布在染色体上的数量最多的前四条染色体分别为chr16、chr1、chr12和chr17 (图3B)。诱导组共121个DElncRNAs,其中68个上调,53个下调(图3C-3D)。提示DElncRNAs可能参与SMSCs的成软骨分化。

图3 在软骨分化过程中的lncRNA表达谱
2.4 lncHECW1-IT1和ATF2在SMSCs软骨分化中的鉴定
通过生物信息学分析选择了参与MAPK和Wnt信号通路的五个上调的DEmRNAs(WNT11、DKK2、FGF1、ATF2和MEF2C)进行表达验证。实时定量逆转录聚合酶链式反应结果显示,与对照组相比,FGF1的表达在诱导组是显著下调的(P<0.05),DKK2的表达无明显变化(P<0.05),WNT11、ATF2和MEF2C的表达在诱导组中是上调的(P<0.05)(图4A)。对WNT11、ATF2和MEF2C进行蛋白免疫印迹检测,与对照组相比,只有ATF2的表达在诱导组中是上调的(图4B)。因此根据竞争的内源性RNA机制,生物信息学分析了ATF2可能结合到的microRNAs,受DElncRNAs调控的microRNAs,并根据这两个的集合绘制了网络图(图4C)。选择图中的5个在测序中表达上调的lncRNAs进行表达验证,包括HECW1-IT1、RP11-713C5.1、AF131215.3、RP11-815M8.1和CTD-2201E9.1。实时定量逆转录聚合酶链式反应结果显示诱导组较对照组上调的lncRNAs包括了HECW1-IT1、AF131215.3和CTD-2201E9.1,与测序的结果一致((P<0.05,图4D)。而诱导组中RP11-713C5.1和RP11-815M8.1的表达相较于对照组是上调的(*P<0.05、**P<0.01、***P<0.001、****P<0.0001)(图4D)。其中lncRNA HECW1-IT1在诱导组中的上调倍数大于AF131215.3和CTD-2201E9.1,因此选这个lncRNA用于功能验证。
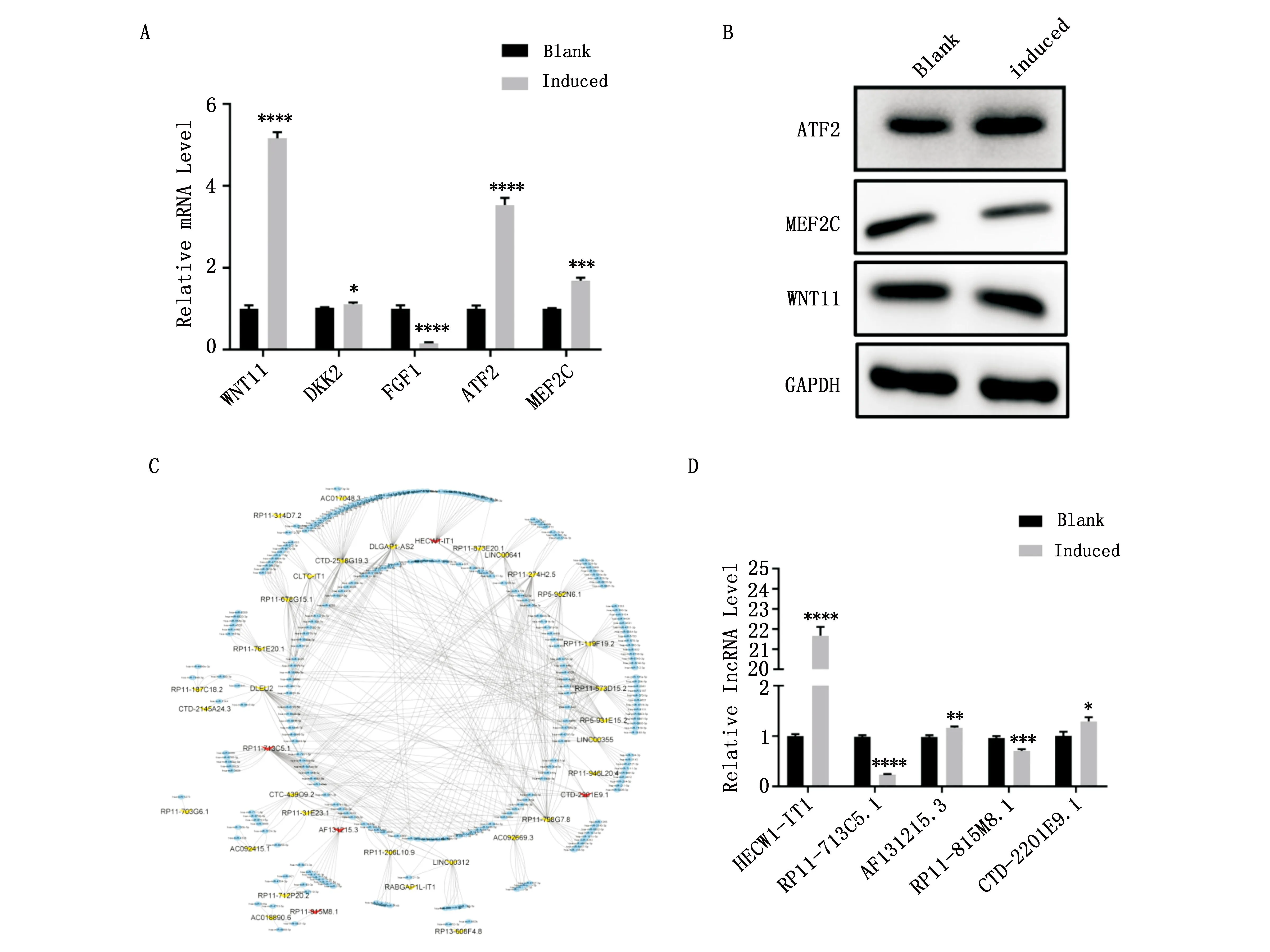
图4 差异表达mRNAs和lncRNAs在滑膜间充质干细胞软骨分化中的鉴定
2.5 敲除LncHECW1-IT1可减弱SMSCs的成软骨分化
为了研究LncHECW1-IT1在SMSC软骨分化中的作用,我们在SMSCs中转染si-LncHECW1-IT1-2和si-LncHECW1-IT1-3,以敲除LncHECW1-IT1的表达。RT-qPCR分析显示,转染si-LncHECW1-IT1-3后,显著下调了LncHECW1-IT1的表达,转染效率80%(*P<0.05、**P<0.01、***P<0.001、****P<0.0001,与对照组比较)(5A)。因此,在进一步的研究中,我们使用si-LncHECW1-IT1-3来敲除LncHECW1-IT1的表达。然后我们使用RT-qPCR检测关键基因ATF2和软骨分化标记基因(Ⅱ胶原蛋白、聚合聚糖和Sox9)后14天的软骨分化诱导,分析显示的表达水平低于控制,WB对相应蛋白表达有相同的趋势(*P<0.05、**P<0.01、***P<0.001、****P<0.0001,与对照组比较)(图5B、C)。为了进一步确定LncHECW1-IT1对软骨生成分化的相对贡献,我们分析了软骨生成分化诱导后的阿利新蓝染色。结果显示,与阴性对照组相比,转染干扰si-LncHECW1-IT1不仅降低了软骨细胞的碱性磷酸酶染色(比例尺=100 μm),而且还降低了基质蛋白聚糖的产生(图5D)。这些数据表明,LncHECW1-IT1在SMSC的软骨分化中发挥重要作用,转染干扰si-LncHECW1-IT1可以抑制SMSCs的软骨分化。
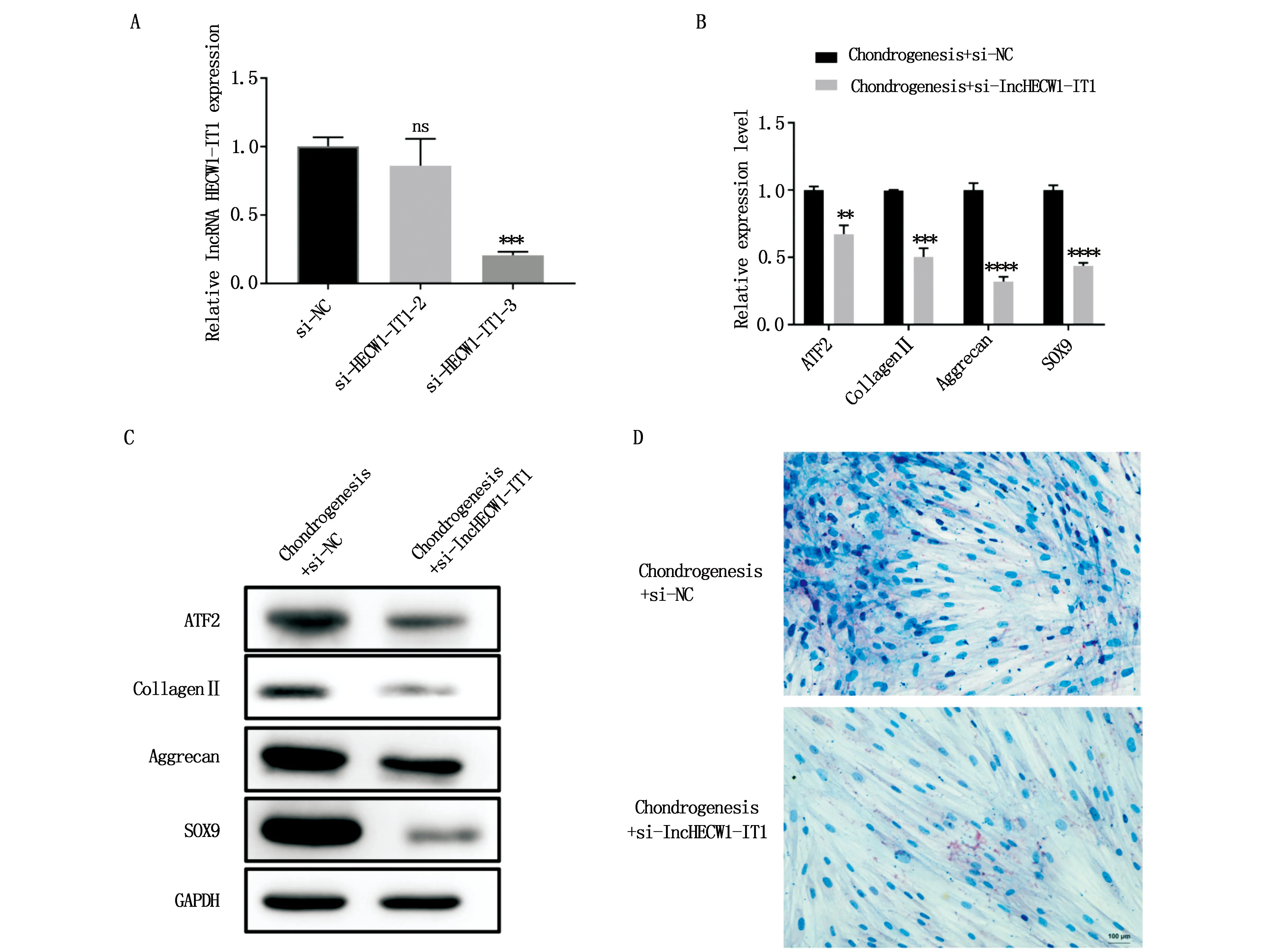
图5 LncRNA HECW1-IT1的下调抑制了滑膜间充质干细胞的软骨分化
2.6 LncHECW1-IT1通过正向调控ATF2的表达来促进SMSCs的软骨分化
根据上述结果,LncHECW1-IT1影响了SMSCs的软骨生成分化。此外,生物信息学分析显示,LncHECW1-IT1上调了ATF2的表达。为了进一步验证LncHECW1-IT1是否调控ATF2,我们首先使用RT-qPCR和WB检测了ATF2的过表达效率(图6A,B)。然后,我们检测了si-LncHECW1-IT1干扰对ATF2的影响,结果显示,si-LncHECW1-IT1干扰后,ATF2、II型胶原、聚集聚糖和Sox9的mRNA表达显著降低,而共转染si-LncHECW1-IT1和ATF2的mRNA表达部分减轻了这一现象,同样,WB对相应的蛋白表达量也表现出相同的趋势(*P<0.05、**P<0.01、***P<0.001、****P<0.0001,与对照组比较)(图6C、D)。同时,转染干扰si-LncHECW1-IT1不仅降低了软骨细胞的碱性磷酸酶染色(比例尺=100 μm),而且还降低了基质蛋白多糖的产生,而过表达ATF2显著逆转了si-LncHECW1-IT1的作用(图6E)。综上所述,这些结果表明,ATF2是LncHECW1-IT1在SMSCs成软骨分化过程中的下游靶点。
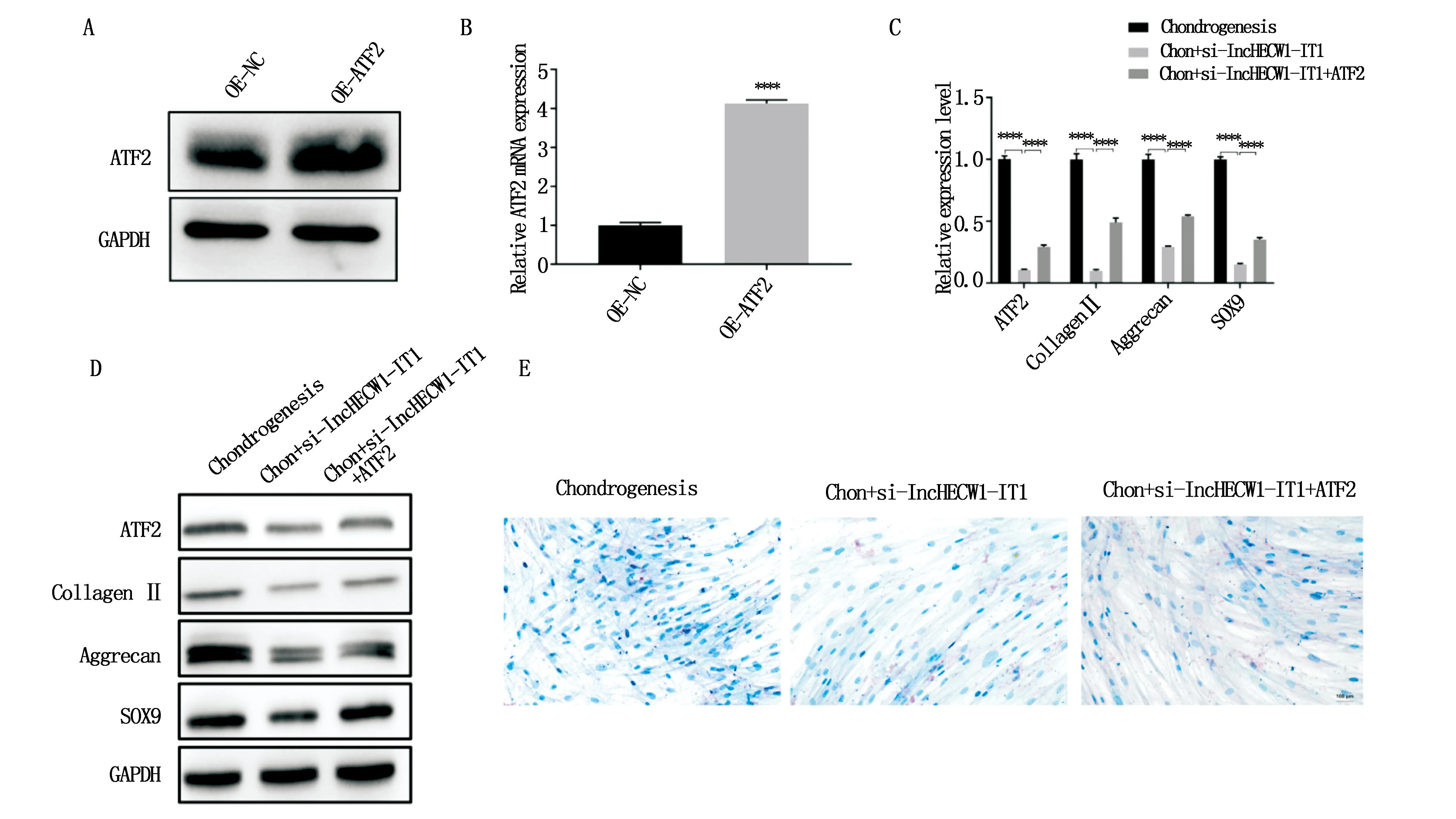
图6 过表达ATF2减弱了干扰lncRNA HECW1-IT1表达对滑膜间充质干细胞成软骨分化的抑制作用
3 讨论
骨关节炎是一种由关节退变、软骨损伤引起的骨关节疾病,目前临床上仍没有十分有效的治疗方法。因此,研究其发病机制和寻找新的治疗方法是目前的研究工作的热点及重点。SMSCs由于其强大的软骨生成潜力,被认为是修复受损和病变关节软骨的合适细胞来源,但SMSCs成软骨分化的机制尚不清楚。我们的研究首次确定并证实了LncHECW1-IT1在SMSCs成软骨分化中的作用。
我们首先从供体的滑膜组织中分离出SMSCs,并通过流式细胞术、RT-qPCR和WB鉴定出SMSCs。我们还通过阿利新蓝染色分析了SMSCs的高软骨分化能力。为了更彻底地阐明lncRNA在SMSCs软骨分化中的作用,我们采用高通量RNA测序技术分析了软骨分化诱导后lncRNA和mRNA的不同表达水平。最终共发现121个lncRNA和2539个mRNA。这些在SMSCs软骨分化中富集的DElncRNAs和DEmRNAs可能是SMSCs的重要调控因子。为了进一步研究DEmRNAs在SMSCs软骨分化中的调控作用,我们对所有DEmRNAs进行了GO富集和KEGG通路分析。我们发现MAPK和Wnt信号通路在软骨分化过程中显著富集。值得注意的是,这些通路与OA密切相关。多个信号通路参与了OA的发生过程,如c-Junn端激酶、Akt、MAPK、信号转换器和转录激活因子6、Wnt/-连环蛋白和雷帕霉素通路[19]的机制靶点。
MAPK作为调控细胞增殖、稳态和发育的关键信号分子,MAPK信号通路参与形态发生和组织模式,在骨骼发育中,特别是软骨形成中发挥重要作用[19]。最近的证据表明,Wnt和MAPK信号通路在OA病理中的作用。MAPK信号通路,包括c-Junn-末端激酶、p38 MAPK和细胞外信号调节激酶1/2通路,参与了OA的发病机制。c-Junn-末端激酶和p38 MAPK信号通路与OA软骨细胞的凋亡相关[20],而p38 MAPK和细胞外信号调节激酶信号通路与骨软骨串扰相关[21-22]。Wnt信号通路是发育、生长、稳态和疾病中细胞和分子过程的关键调节因子和激活因子,特别是在关节和骨中。在OA的发展过程中,典型的和非典型的Wnt信号通路都被过度激活。增加表达Wnt信号表达激动剂在人类OA软骨可能加速软骨降解上调基质金属蛋白酶和聚集酶[23]各种成员Wnt信号通路在滑膜的过表达,包括Wnt和wnt1诱导信号通路蛋白,这可能导致OA的病理过程[24]。滑膜中Wnt信号通路(WNT8A和WNT16)的增加可能会有效地诱导OA[25]的进展。MAPK和Wnt信号都是OA治疗的很有希望的靶点[20,24]。
我们分析了与软骨生成分化相关的MAPK和Wnt信号通路中的DEmRNA,通过构建ceRNA网络,预测了能够调控这些DEmRNAs的lncRNAs,并选择了前5个基因,包括ATF2、MEF2C、WNT11、Dickkopf2和WNT11。我们通过RT-qPCR和WB进一步验证了其mRNA和蛋白的表达,并确定ATF2为后续研究的关键基因。然而,ATF2是否促进sMSCs的软骨分化还有待进一步研究。lncRNA在染色质的组织、转录和转录后水平上调节基因的表达。我们进一步选择了通过ceRNA网络上调ATF2的前5个lncRNAs(HECW1-IT1、RP11-713C5.1、AF131215.3、RP11-815M8.1和CTD-2201E9.1)。通过RT-qPCR验证其表达,只有HECW1-IT1的结果与测序结果一致。LncHECW1-IT1的生物学功能在其他研究中尚未得到阐明。LncHECW1-IT1是否促进SMSCs的软骨分化有待进一步研究和验证。
研究了LncHECW1-IT1对SMSCs软骨生成分化的影响。我们的研究表明,LncHECW1-IT1通过抑制ATF2的表达来抑制SMSCs的软骨生成分化。据报道,lncRNA在许多生物过程中发挥重要的调控作用,包括软骨分化[26]。相比之下,只有少数lncRNA被报道特异性参与了SMSCs[26]的软骨生成分化。我们首先鉴定了LncHECW1-IT1是SMSCs软骨生成分化中的一个新的阳性调控因子。ATF2是激活蛋白1超家族的一员,它参与了响应细胞应激、炎症细胞因子和生长因子的多种通路的转录调控,它可与其他调节细胞分化和存活的转录因子异二聚,并在滑膜组织中发挥重要作用[26]。此外,有研究表明,ATF2通过调控pRB基因的表达[27],对骨生长、软骨增殖和分化以及骨骼发育均有显著影响。这一发现提示ATF2可用于预防OA,这与本研究的结果一致。
我们的研究发现了一种新的SMSCs成软骨分化的调控机制。结果表明,LncHECW1-IT1通过上调ATF2的表达,作为SMSCs成软骨分化的关键启动子,也为OA的治疗提供了新的证据。然而,我们的结论是基于体外实验的。LncHECW1-IT1是否促进体内软骨分化有待进一步研究和验证。LncHECW1-IT1与ATF2在SMSCs中相互作用的分子机制也有待进一步研究。
4 结论
据我们所知,这是第一个发现LncHECW1-IT1,并证实其在SMSCs软骨分化中作为一种新的正调节因子的功能的研究。LncHECW1-IT1通过上调ATF2的表达来促进SMSCs的软骨生成分化。该LncHECW1-IT1-ATF2轴是一种调控SMSCs成软骨分化的新机制。我们的发现可能为骨性关节炎的治疗提供新的见解。
