科罗索酸调控FGF15逆转NAFLD抑制ALPPS诱导肝再生的研究
2024-02-26石佳成叶方旺赵金伟
邢 琳,石佳成,叶方旺,赵金伟
(吉林大学第二医院 肝胆胰外科,吉林 长春130022)
联合肝脏分隔和门静脉结扎二步肝切除术(ALPPS)是肝脏外科领域的新技术,为剩余肝体积(FLR)过小的病人提供再次手术机会,改善了手术的制约性[1]。脂肪肝病人经历肝脏大部切除术后肝脏体积恢复较慢,发生并发症及死亡率的风险较高[2],另外,动物实验研究表明,非酒精性脂肪肝(NAFLD)降低了ALPPS术后肝脏再生能力[3]。研究表明,成纤维细胞生长因子(FGFs)可维持胆汁酸代谢平衡,增加胰岛素的敏感性,降低血清胆固醇及甘油三酯水平,降低体重,可通过增加糖原及蛋白质合成来调节细胞能量代谢,也可增强细胞增殖和肝脏再生。肝部分切除术后胆汁酸减少,上调肠源性细胞因子FGF15(鼠源性)或FGF19(人源性)对肝脏再生有明显的损伤作用[4]。科罗索酸(CA)目前已作为治疗和预防肥胖和II型糖尿病的药物,在动物实验和临床试验中取得了极佳的效果。因此,我们推测,CA可通过调控FGFS逆转NAFLD抑制ALPPS诱导肝再生作用。本文采用建立NAFLD大鼠ALPPS模型,探讨CA上调FGF15改善NAFLD,进而促进ALPPS诱导肝再生。
1 材料与方法
1.1 实验动物
实验动物采用56只4~6周龄(体重180~200 g)雄性SD大鼠,购于吉林大学实验动物中心,按照动物的标准饮食(SD)及高脂饮食(HFD):42% 脂肪,14%蛋白质和44%糖类) 及饲养条件饲养6周。
1.2 实验方法
1.2.1麻醉、手术及分组 SD大鼠采用0.3%戊巴比妥钠1 ml/kg行腹腔注射麻醉,麻醉生效后,常规腹部脱毛消毒,正中切口开腹,分离肝周韧带,游离肝脏。分别分离结扎右肝叶门静脉支,分离结扎左外侧叶和左中叶的门静脉支共干,切除尾状叶,执行中肝叶沿着缺血线原位劈离,完成ALPPS操作。每组12支大鼠分别于术后第3天,第10天腹腔注射0.3%戊巴比妥钠1 ml/kg麻醉下处死大鼠,针刺心脏采血,肝脏标本称重后并留取部分肝脏组织标本,保存于-80℃冰箱,备用。部分肝脏组织浸泡于4%福尔马林溶液24 h,心脏穿刺收集血液标本,血清保存于-80度冰箱中,保存备用。第3组大鼠术后第三天起,按20 mg/kg给予CA,腹腔注射给药,隔日给药。所有实验在手术显微镜下完成,肝脏实质离断采用双极电凝刀完成。实验分为3组:(1)标准饮食SD大鼠ALPPS组(12只);(2)HFD大鼠ALPPS组(12只);(3)HFD大鼠ALPPS+CA组(12只)。
1.2.2肝脏再生率 建立NAFLD模型后,标准饮食及高脂饮食大鼠各10支麻醉后处死,离体取出FLR,使用实验微量电子秤称重(Ohaus Corporation,Pine Brook,NJ USA).肝脏右中叶再生率(HRR)采用如下公式计算:HRR=(WA-WI)/WI×100%,WA:死亡时右中叶的实际重量WI:手术前右中叶的初始重量,右中叶的初始重量采用如下公式计算:WI=体重×0.97%(0.85%)。
0.97%;0.85%分别代表10只标准饮食SD雄性大鼠(体重240~290 g)右中叶与体重平均百分比和10只高脂饮食SD雄性大鼠(体重410~500 g)右中叶与体重平均百分比。
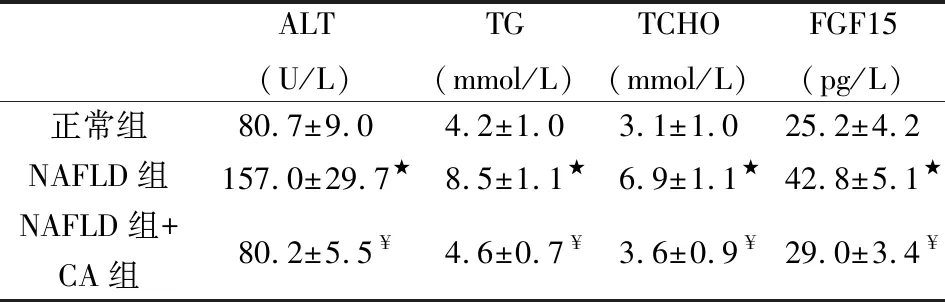
表1 正常大鼠,NAFLD大鼠及CA治疗后大鼠相关因子及生化指标水平变化
1.2.3生化分析 TCHO,TGs,AST,ALT采用血清生化分析仪,使用商用检测试剂盒检测(南京建成生物公司)。FGF15(ABclonal,A1013)浓度使用ELISA 试剂盒检测。
1.2.4组织化学分析 福尔马林浸泡后的组织标本采用石蜡处理,使切片成4 μm并经脱蜡处理,采用处理程序进行脱蜡及水化处理:使用降浓度的乙酸(100% 95% 75%)处理后于二甲苯内20 min,然后采用双蒸馏水进行洗脱,拉伸修复,采用商用试剂盒提供的缓冲液处理,切片使用3%过氧化氢溶液和含有5%小牛血清进行封闭。试剂盒购于AB公司,为鉴定坏死组织区域,肝脏组织采用HE染色。所有切片均由有经验的病理学专家评估。

2 结果
2.1 大鼠NAFLD的诱导及CA(CA)的治疗作用
在NAFLD大鼠肝脏可见小泡状脂肪沉积,伴散在大泡状脂质沉积,CA治疗10天后脂肪沉积减少(如图1所示);NAFLD大鼠血清FGF15,AST,TCHO 和 TG水平明显高于普通饮食大鼠,而应用CA后,血清FGF15,AST,TCHO 和 TG水平下降接近普通饮食大鼠的水平(如表1所示)。
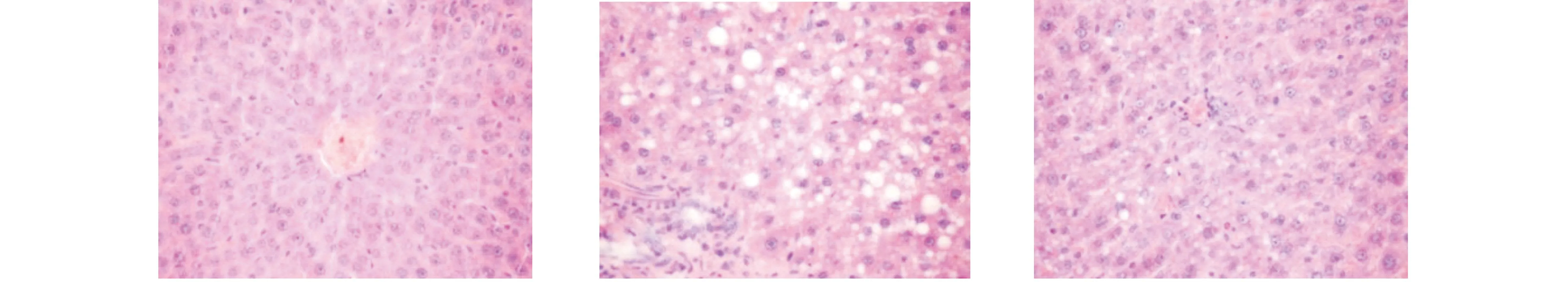
图1 正常大鼠,NAFLD大鼠及CA治疗后大鼠肝脏组织学变化(HE×200)
2.2 经历ALPPS手术后的各组大鼠FLR的HRR
如图2所示,正常组和NAFLD组及CA干预组大鼠ALPPS模型中,在术后(POD)3天(1),NAFLD组的肝细胞增值率(HRR)明显低于正常组,但应用CA干预后,HRR升高,与正常组无明显差异,提示CA可逆转NAFLD所致的肝再生延迟(如图3所示);同样在POD7(2),NAFLD组的HRR明显低于正常组,但应用CA干预后,HRR升高,与正常组无明显差异,二者相比,差异显著,P值均小于0.05.(如图3所示)。
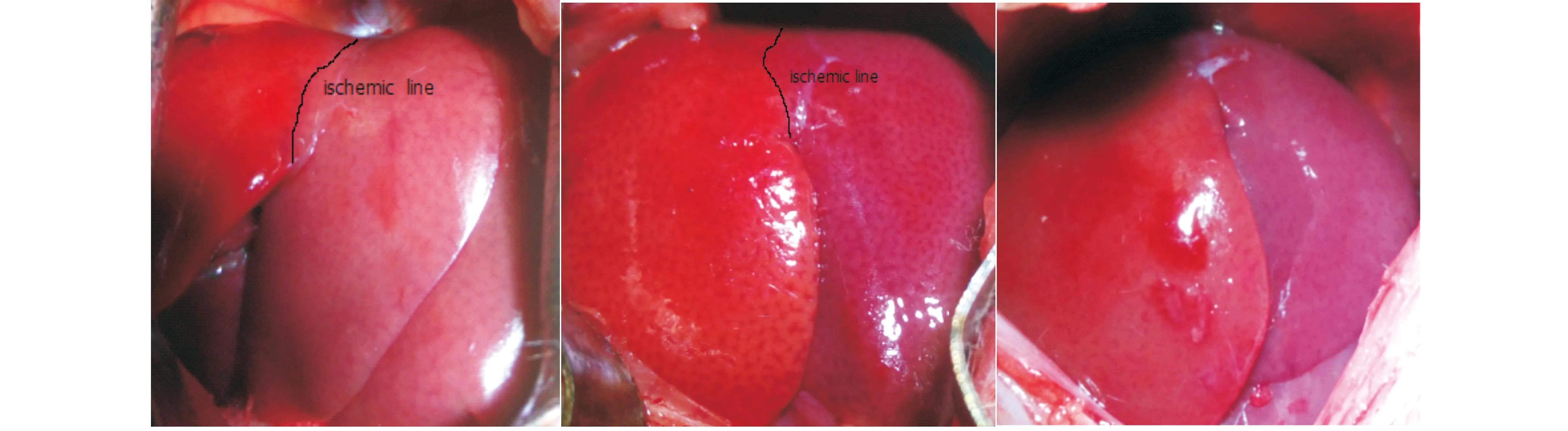
图2 正常和NAFLD及CA干预组大鼠ALPPS模型

图3 经历ALPPS的正常和NAFLD及CA干预组大鼠HRR比较
3 讨论
采用高脂饮食诱导SD大鼠NAFLD模型发现,NAFLD大鼠血清FGF15水平明显低于正常大鼠血清FGF15水平,NAFLD大鼠血清胆固醇及甘油三酯水平明显高于正常大鼠,CA的干预可逆转肝脏脂肪沉积及下调血清胆固醇及甘油三酯水平及FGF15水平,提示CA可通过下调血清FGF15改善肝脏脂肪沉积。通过建立NAFLD大鼠ALPPS模型发现:脂肪沉积使ALPPS诱导的肝脏再生能力下降 CA可减少NAFLD大鼠的脂肪沉积并改善ALPPS诱导肝脏再生延迟;另外,CA逆转FLR增殖延迟与血清FGF15水平变化相关。
研究表明,成纤维细胞生长因子19(FGF19)是一种回肠源性肠因子,成纤维细胞生长因子(FGFs)可维持胆汁酸代谢平衡,增加胰岛素的敏感性,降低血清胆固醇及甘油三酯水平,降低体重,可通过增加糖原及蛋白质合成来调节细胞能量代谢,也可增强细胞增殖和肝脏再生。肝部分切除术后胆汁酸减少,上调肠源性细胞因子FGF15(鼠源性)或FGF19(人源性)对肝脏再生有明显的损伤作用[4]。最近的数据表明FGF19在人类的代谢紊乱中发挥一定的作用,具有代谢综合症的病人血清FGF19水平可下降65%,同时FGF19也是代谢综合症的危险因素[5]。基于FGFs与代谢综合症的相关性,我们采用动物实验也证实了NAFLD大鼠的FGF15水平明显下降。我们前期的研究结果表明,NAFLD可延迟大鼠ALPPS诱导的肝再生[6],推测NAFLD大鼠肝再生能力下降可能与FGF15相关。科罗索酸,作为治疗和预防肥胖和Ⅱ糖尿病的药物在动物实验和临床试验中取得了极佳的效果,本实验采用CA干预NAFLD大鼠,发现CA减少了大鼠的脂肪沉积,下调外周血胆固醇及甘油三酯水平,随之血清FGF15水平较用药前明显升高,这提示CA抑制大鼠NAFLD可能与上调FGF15水平密切相关。
为了进一步验证CA逆转NAFLD 延迟大鼠ALPPS诱导肝再生的能力,我们建立了NAFLD大鼠的APLLS模型,并采用CA予以干预治疗,结果发现,术后第3天及第10天,ALPPS诱导肝再生的HRR在药物治疗组明显高于非用药组,提示CA可提高NAFLD大鼠的肝再生能力,可能与上调体内FGF15水平密切相关。
综上所述,NAFLD大鼠血清FGF15水平下降,CA可逆转大鼠的血脂水平及FGF15水平,提示CA可通过上调血清FGF15浓度来逆转NAFLD进而促进ALPPS诱导肝再生的能力。本课题为CA治疗NAFLD的临床及基础研究奠定了良好的实验基础。
