基于数据挖掘和网络药理学探究海洋中药治疗乳腺增生的用药规律及作用机制
2024-02-26张婉悦杨旭杰
张婉悦,杨旭杰
河北中医药大学基础医学院,石家庄 050020
乳腺增生是由乳腺纤维和上皮组织增生引起的退行性疾病,临床表现以两侧或单侧乳房出现硬结肿块为主,多伴疼痛,本病病情与月经周期及情绪变化相关,好发于25~44岁的女性[1]。乳腺增生具有发病率高、难治愈、易复发的特点,近年来,乳腺增生的发病率逐年上升,且发病有年轻化的趋势,本病具有一定的恶变倾向,其中重度乳腺增生、非典型乳腺增生和囊性乳腺增生患者的乳腺癌发病率较高[2]。中医药治疗乳腺增生具有历史悠久、经验丰富的特点,已上市的中成药如乳康片、乳癖消片等均具有较好疗效。
海洋中药是传统中药的重要组成部分,指在中医学理论指导下,来源于海洋且用于防治疾病的天然药物,海洋中药多生长在海域、海滩、滨海湿地、盐土等受海水浸润影响的滨海地带[3],独特的生长环境使海洋中药具有独特的药用价值[4]。目前已上市的海洋来源药物种类较少,且相关药物的研发成功率较高,使得海洋中药具有较大的发展空间。
专利文献是知识产权的重要组成部分,囊括了全球90%以上的最新技术情报,能够反映发明创造的技术特征[5]。新颖性、创造性、实用性是影响专利能否获得授权的重要因素,专利经多次审核后,只有符合规定、质量较优的专利申请案能够获得授权。本研究以治疗乳腺增生为主要目的的授权专利组方为研究对象,旨在挖掘含海洋中药的专利组方的用药规律及核心药组发挥疗效的作用机制,以期为相关专利的申请及相关药物的开发利用提供参考。
1 资料与方法
1.1 资料来源
以国家知识产权局网站(http://pss-system.cnipa.gov.cn/)作为数据来源,获取1993年1月31日至2022年9月30日间治疗乳腺增生的专利文献,此外本研究还选择了专利事务所、知识产权机构、中医药企业、高校等单位作为信息来源,以保证数据的查全率。
1.2 纳入标准
①以治疗乳腺增生为主要目的的专利文献;②已获得授权的专利文献;③含海洋中药的专利文献。
1.3 排除标准
①排除治疗仪器、熏洗装置等不含中药成分的专利文献;②排除重复的专利文献;③排除公开、驳回、撤回等其他法律状态下的专利文献。
1.4 建立数据库与数据标准化
1.4.1 建立数据库
将以上数据录入WPS Excel建立数据库,由双人两台计算机录入并复查,对差异数据进行修改。
1.4.2 数据标准化
药物名称优先依据2020版《中国药典》进行规范,未收录者依据《中华本草》《中药大辞典》规范。如将“川军”规范为“大黄”,“二花”规范为“金银花”,“坤草”规范为“益母草”;海洋中药的确认及名称标准化依据《中华海洋本草》进行。
1.5 数据分析
运用WPS Excel中数据透视表对药物进行频数统计;运用SPSS Statistics 21.0对频数≥40的药物进行聚类分析;运用SPSS Modeler18.0建模,进行Apriori关联规则分析。
1.6 网络药理学分析
1.6.1 药物成分的筛选与靶点信息获取
在TCMSP数据库,以口服生物利用度(oral bioavailability,OB)≥30%,类药性指数(drug likeness,DL)≥0.18为条件,筛选柴胡、当归的主要成分,在BATMAN-TCM数据库以Score cutoff≥20,P-value<0.5的条件,筛选牡蛎的主要成分,结合文献补充药物的靶点信息,在Pubchem数据库中获得药物成分的分子结构图,将分子结构图导入Swiss ADME平台中,参考相关文献,对胃肠吸收(GI absorption)为high、药物相似性中有两个及两个以上“yes”的成分予以纳入,对于未纳入的药物成分,参考相关文献,若为主要成分或作用明显者仍予以纳入。在Pharm Mapper数据库中获取药物成分的潜在靶点。利用uniprot数据库,获取已验证的人类靶点基因名称。将上述信息录入WPS Excel表格,运用Cytoscape3.8.0软件绘制药物-成分-靶点网络图。
1.6.2 乳腺增生相关靶点的获取
以“hyperplasia of mammary glands”为关键词,在GeneCards数据库及OMIM数据库进行检索。为获取相关性较高的疾病靶点,计算GeneCards数据库中疾病靶点的相关度分数(relevance score)中位数,记为M,筛选相关度分数>2M的基因靶点,与OMIM数据库中获取的靶点合并去重后,录入WPS Excel表格。
1.6.3 蛋白质互作(PPI)网络的构建与核心靶点获取
使用微生信网站绘制药物-疾病Venn图。将Venn图中药物-疾病的交集靶点导入String数据库,设置蛋白种属为人类、medium confidence>0.4,构建PPI网络。运用Cytoscape3.8.0软件中的CytoNCA计算其拓扑参数,筛选核心药组中治疗乳腺增生的关键靶点。
1.6.4 核心成分获取
运用Cytoscape3.8.0软件,将药物-疾病的交集靶点导入药物-成分-靶点网络图中进行筛选,绘制成分-靶点网络图,并运用CytoNCA计算其拓扑参数,获取网络中的核心成分。
1.6.5 GO生物功能分析与KEGG通路富集分析
利用Metascape数据库进行GO生物功能分析和KEGG通路富集分析,利用微生信网站绘制GO生物功能条目图和KEGG通路富集气泡图。
1.7 分子对接
利用Pubchem数据库获取配体信息,运用OpenBabel-2.4.1软件将文件格式转换为mol2格式,运用AutoDuckTools-1.5.7软件对配体加氢、分配电荷、设置扭转键。利用PDB数据库获取受体信息,运用Pymol软件去除受体中的水及配体,运用AutoDuckTools1.5.7对受体加氢。将上述文件保存为pdbqt格式,导入AutoDuckTools-1.5.7软件,运行autogrid4、autodock4将受体配体对接,所得结果运用Pymol进行可视化。
1.8 动物实验
1.8.1 动物
雌性SD大鼠60只,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010,本实验经河北中医学院伦理委员会审批(编号:DWLL2018059),实验动物的相关操作符合实验动物管理条例。
1.8.2 主要试剂与仪器
枸橼酸他莫昔芬(上海复旦复华药业有限公司,批号:200905);黄体酮注射液(批号:B210205)、苯甲酸雌二醇注射液(批号:B210206)(宁波三生生物科技有限公司);ChemiDOC XRS型凝胶成像分析系统、S1000型逆转录仪、CFX96型Optics Module PCR仪、10705型酶标仪、CG05型实时荧光定量聚合酶链式反应(Real-time PCR)仪、BJYX2017002型逆转录仪(美国Bio-Rad公司)。
1.8.3 药物制备
实验所需中药饮片购自北京广安门医院中药房,经承德医学院中药研究所苏占辉副教授鉴定均为正品。药组中柴胡10 g、当归10 g、牡蛎30 g,常规浸泡1 h,煎2次,每次文火煎煮30 min,得到药液浓缩至每毫升药液含生药1 g,冷却后置4 ℃冰箱备用。
1.8.4 分组与给药
按照随机数字表法随机选取大鼠10只作为正常组,剩余大鼠随机分为5组,分别为模型组、枸橼酸他莫昔芬组、中药组合物高、中、低剂量组。中药组合高、中、低剂量组每日分别给予12、6、3 g/kg中药组合物药剂灌胃,枸橼酸他莫昔芬组每日给予4 mg/kg枸橼酸他莫昔芬灌胃,等效剂量按人与动物体型系数折算。正常组和模型组每日给予等量蒸馏水灌胃,持续干预30 d。
1.8.5 标本采集
于末次灌胃给药后,各组大鼠禁食不禁水24 h,采用1%戊巴比妥钠按1 mL/kg腹腔注射进行麻醉后,常规观察大鼠一般症状、体征。实验过程中观察各组大鼠一般生存状况(体质量、性情、毛发等)和大鼠乳头形态(形态、皮色等)。
1.8.6 大鼠乳头形态学测定
大鼠麻醉后,将大鼠第二对乳头周围脱毛,腹部向上置于超声操作台,使用医用胶带固定其四肢,用游标卡尺测量乳头直径和高度。
1.8.7 血清中雌激素及孕酮含量测定
麻醉大鼠后取血,使用高速冷冻离心机离心10min,取上层血清,采用ELISA法检测大鼠血清中雌二醇(estradiol,E2)、孕酮(progesterone,PG)含量。
1.8.8 乳腺组织中PTEN、PI3K、Akt mRNA表达
使用Real-time PCR法,取乳腺组织0.1 g,提取试剂盒抽提组织中总RNA,测定RNA浓度(吸光度A260/A280,1.8~2.0)。RNA反转录为cDNA以备扩增,引物(宝生物工程有限公司)以GAPDH作为内参基因(引物序列见表1),扩增(95 ℃预变性5 min,94 ℃变性10 s、60 ℃退火30 s、60个循环)。获取目的基因和内参基因的循环阈值(Ct),2-ΔΔCt计算目的蛋白mRNA相对表达量。

表1 引物序列
1.8.9 统计学方法
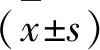
2 结果
2.1 数据挖掘结果
2.1.1 中药频数统计
检索得乳腺增生授权专利共计387篇,筛选后纳入含海洋中药的专利组方157首,涉及中药398味,用药频数共计2 437次,单首专利组方中用药最多55味、最少2味。海洋中药的用药频数共计257次,涉及22味海洋中药。专利组方中使用频数≥40的中药有13味,其中高频海洋中药三味:牡蛎(83次,52.87%)、海藻(72次,45.86%)、昆布(57次,36.31%),高频非海洋中药有柴胡(83次,52.87%)、当归(70次,44.59%)、夏枯草(67 次,42.68%)等(见表2)。
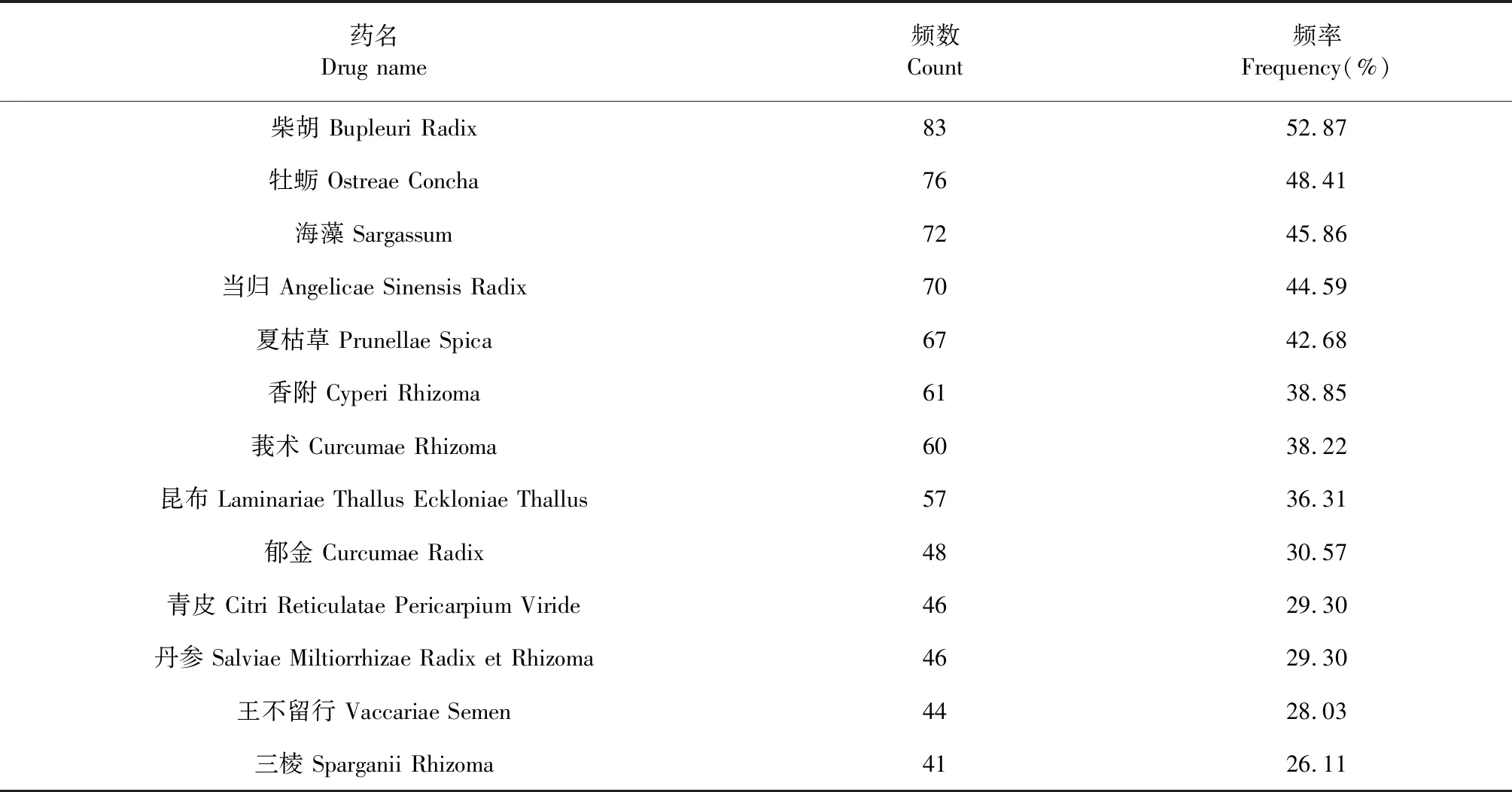
表2 含海洋中药专利组方治疗乳腺增生的高频药物
2.1.2 聚类分析
运用SPSS Statistics21.0,选取使用频数≥40的药物,聚类方法设置为组间聚类,度量标准设置为Pearson相关性进行系统聚类分析,并绘制树状图(见图1)。当组间距离为23.5时,可将药物分为三类。类别A:莪术、三棱、海藻、昆布;类别B:香附、青皮、丹参、柴胡、牡蛎、郁金、当归、王不留行;类别C:夏枯草。

图1 聚类分析图
2.1.3 中药的关联规则分析
将专利组方导入SPSS Modeler18.0软件,运用Apriori模型,设置支持度≥10%,置信度≥80%进行关联规则分析。关联规则较强的药物组合有柴胡-牡蛎+当归、没药-乳香、柴胡-夏枯草+牡蛎、柴胡-郁金+牡蛎、柴胡-青皮+牡蛎(见表3)。选取其中支持度、置信度最高的药组柴胡-牡蛎+当归,进行网络药理学研究。
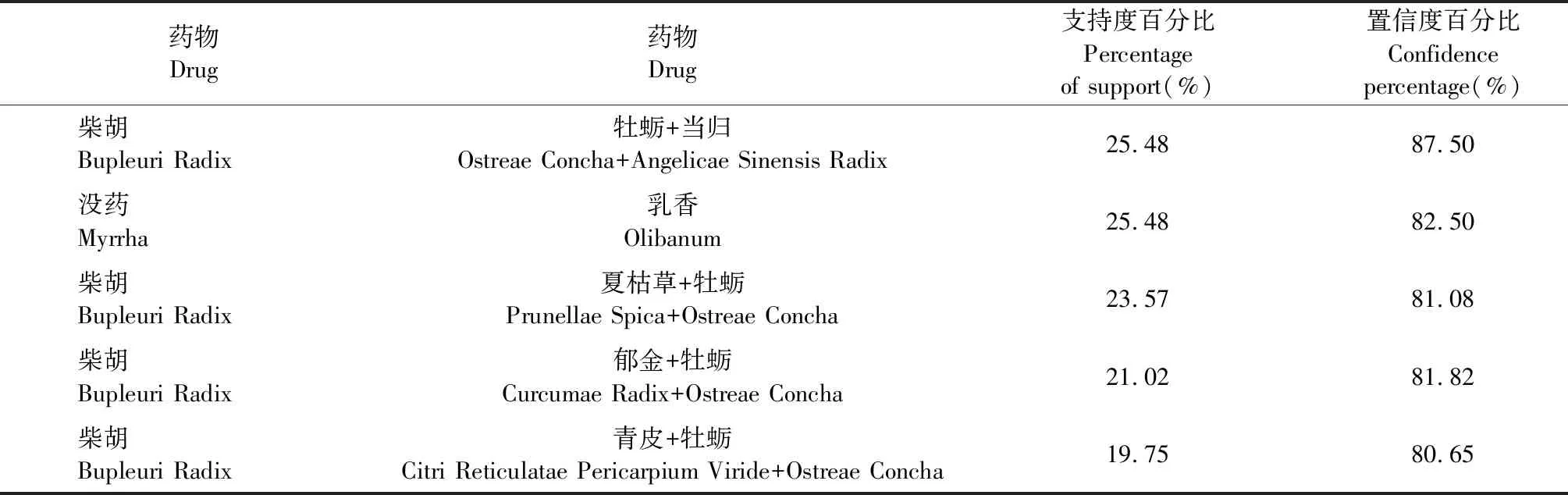
表3 关联规则分析
2.2 网络药理学分析结果
2.2.1 核心药组的药物作用靶点获取及疾病靶点筛选
综合数据库及文献查阅结果[6-9],共纳入37个药物成分,其中柴胡21个,当归7个,牡蛎9个(见表4),整理药物成分的作用靶点,去除重复值后获得靶点317个。
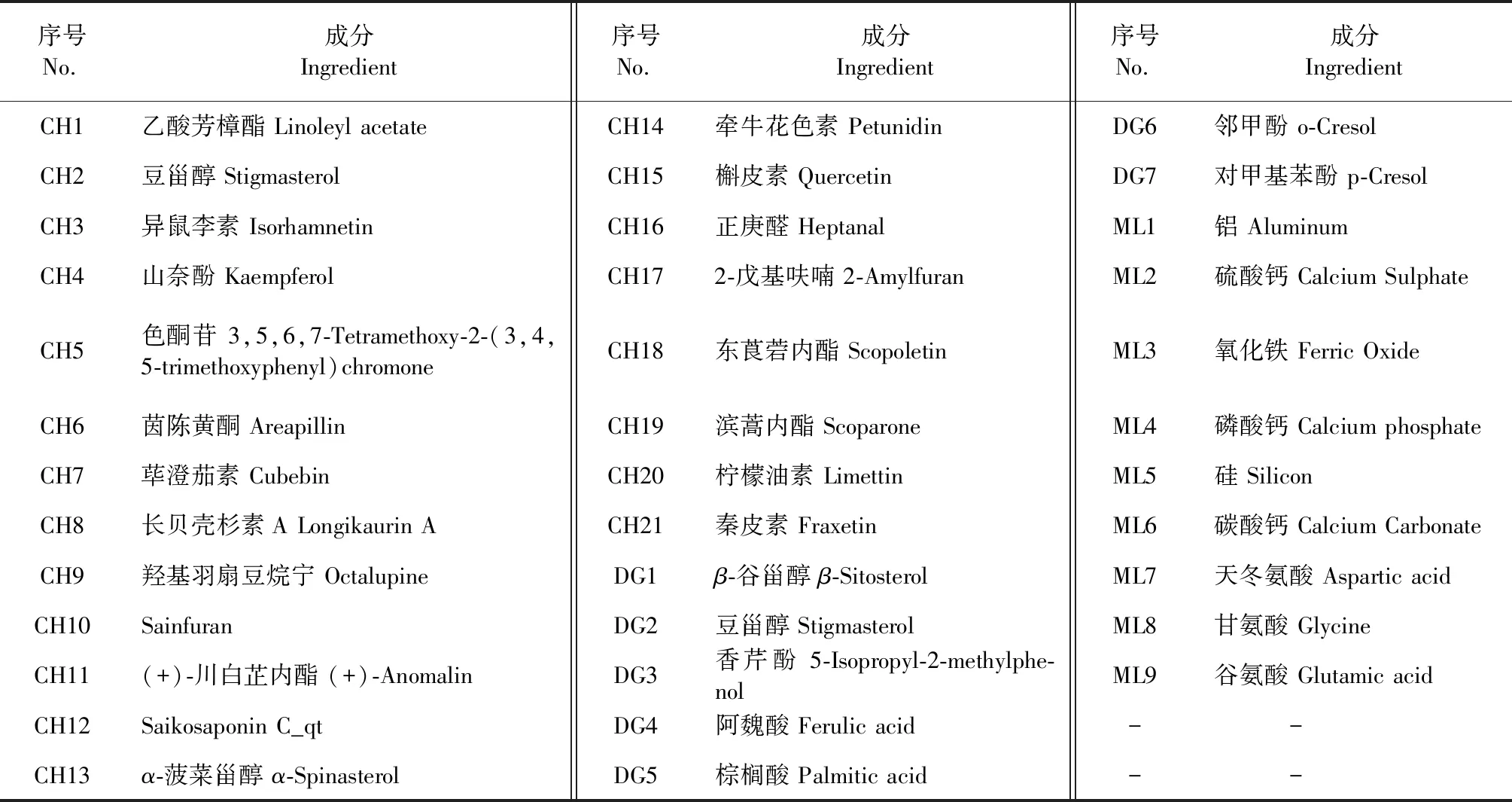
表4 核心药组成分
在GeneCards数据库、OMIM数据库中输入“hyperplasia of mammary glands”检索乳腺增生疾病靶点,分别检索得4 832个、462个乳腺增生的潜在靶点。为去除相关性低的疾病靶点,计算GeneCards数据库中相关度分数中位数,记为M,取相关度分数>2M的靶点。整理去重后共获得潜在靶点1 386个。运用Cytoscape3.8.0软件绘制成分-靶点网络图(见图2)。
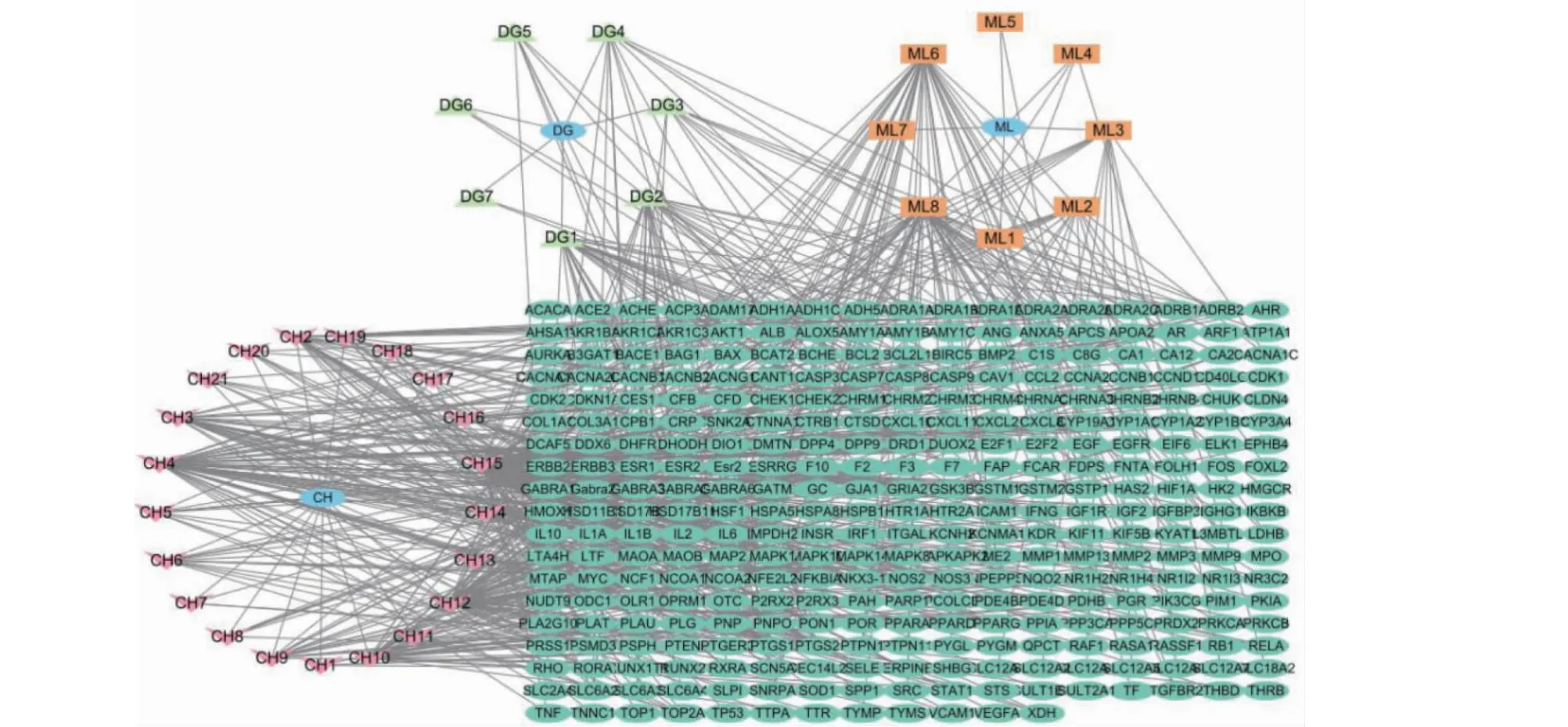
图2 药物-成分-靶点网络
2.2.2 药物-疾病共同靶点获取及PPI网络的构建结果
取药物与疾病的共同靶点绘制Venn图(见图3),将交集靶点导入String数据库构建PPI网络,使用Cytoscape3.8.0软件进行可视化(见图4),计算网络中节点的拓扑参数(见图5),其中TP53的拓扑值最高,推测是相关药物发挥治疗作用的重要靶点,此外AKT1、ALB、ESR1等靶点也相对重要。
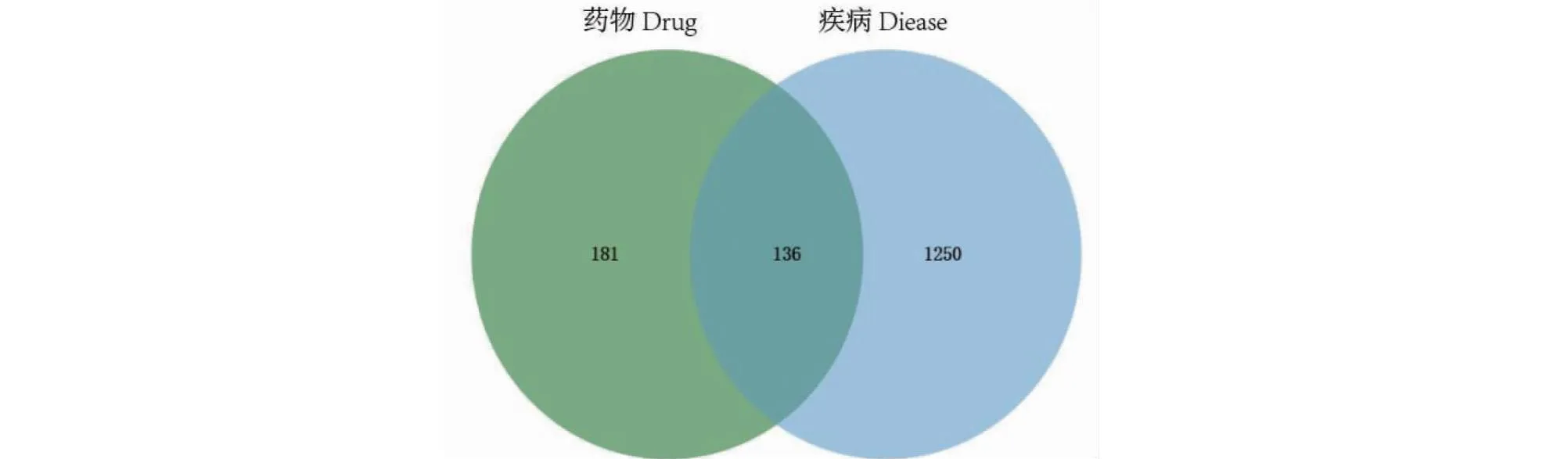
图3 药物-疾病靶点Venn图
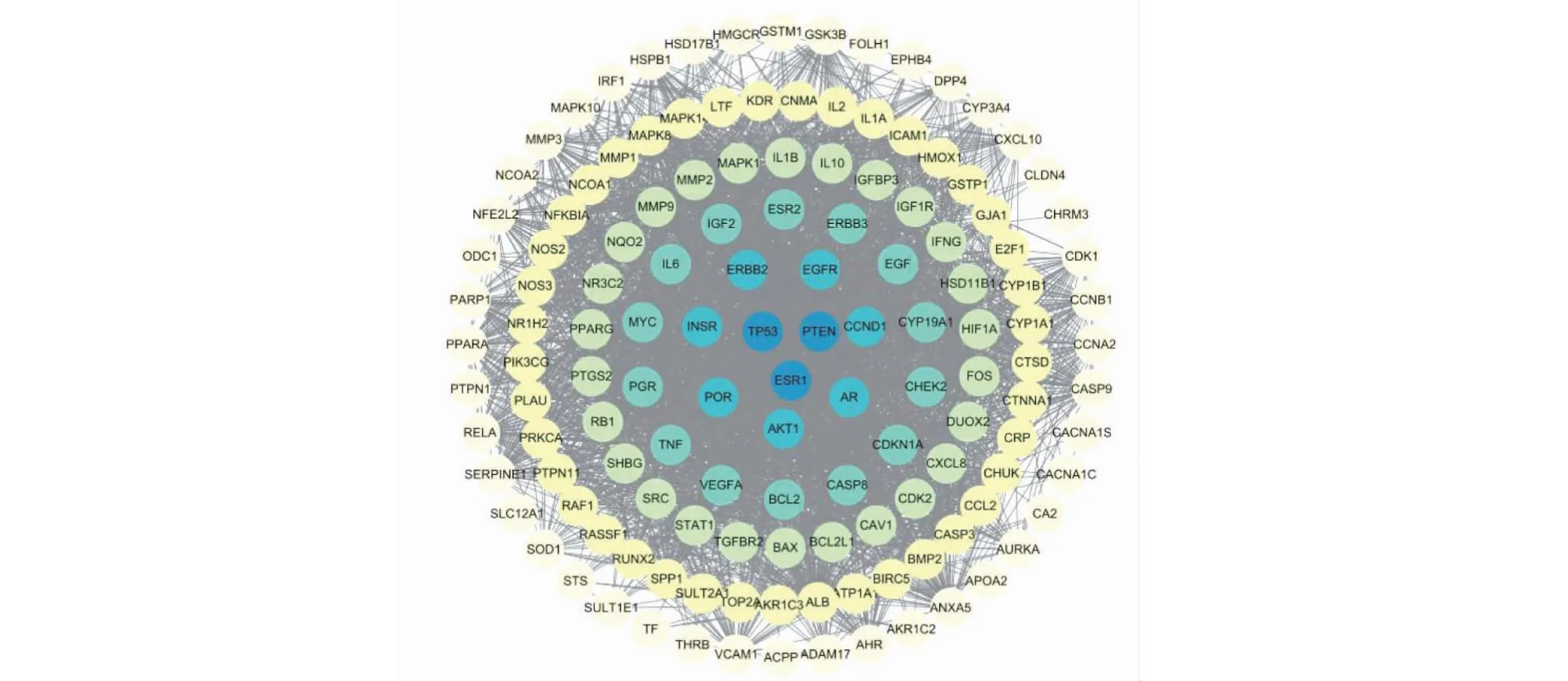
图4 PPI网络
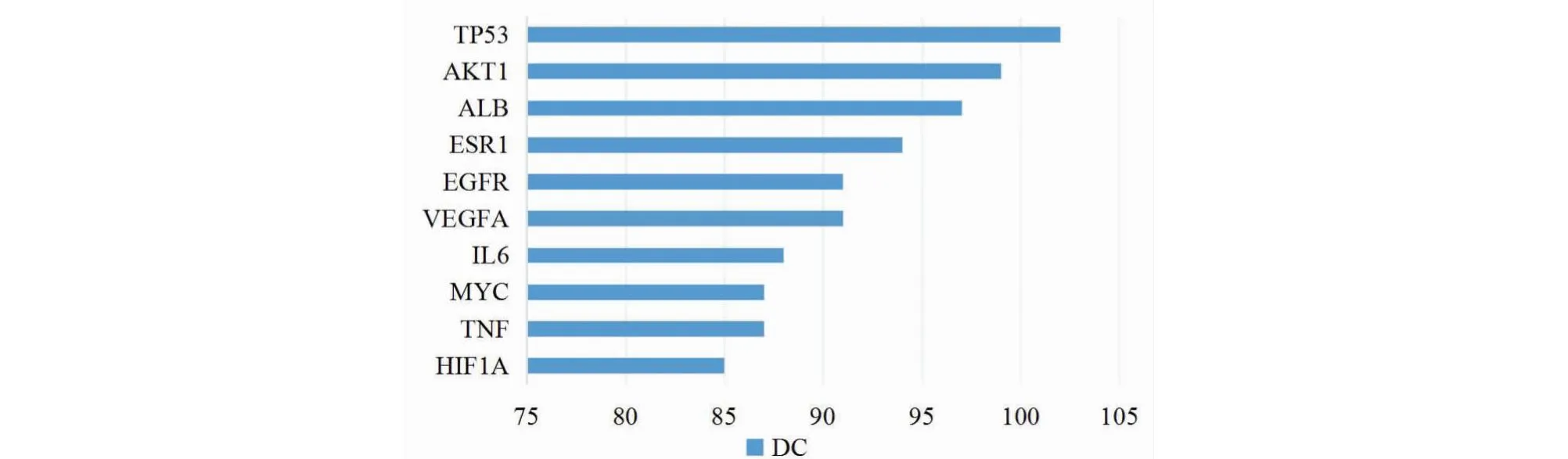
图5 重要靶点统计条目图
2.2.3 核心成分获取
运用Cytoscape3.8.0软件,绘制成分-靶点网络图(见图6),并运用CytoNCA分析网络的拓扑参数,计算参数中度中心性(degree centrality,DC)、紧密中心性(closeness centrality,CC)、特征向量中心性(eigenvector centrality,EC)、中介中心性(between centrality,BC)的平均数,取大于平均值的成分作为核心成分(见表5),筛选后共获得四个成分,其中槲皮素拓扑值最高,推测其为高频药组发挥疗效的主要成分,此外,山奈酚、异鼠李素、β-谷甾醇也较为重要。

图6 成分-靶点网络
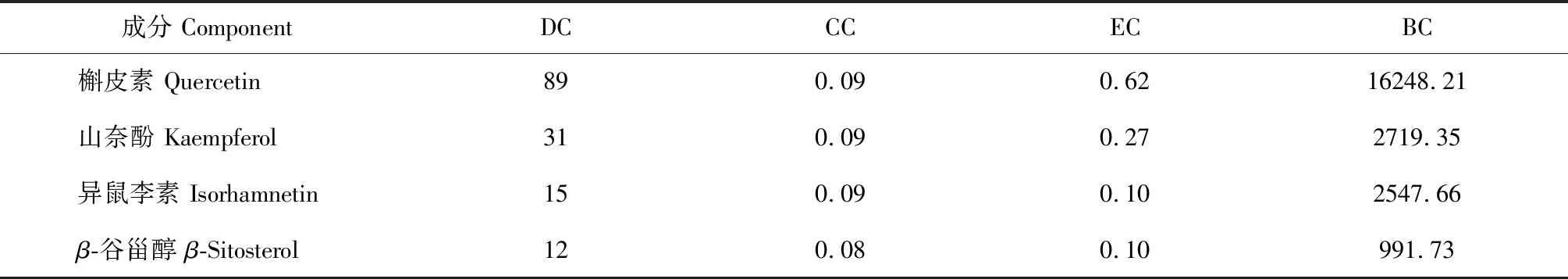
表5 成分拓扑值
2.2.4 GO富集分析与KEGG通路富集分析结果
利用Metascape数据库,在P<0.01的条件下,进行GO富集分析与KEGG通路富集分析,利用微生信网站绘制GO富集分析条目图(见图7)及KEGG通路富集条目图(见图8)。结果显示核心药组参与的生物学过程主要涉及激素反应(response to hormone)、对无机物质的反应(response to inorganic substance)、细胞对脂质的反应(cellular response to lipid)等;细胞组分涉及膜筏(membrane raft)、转录调节复合物(transcription regulator complex)、质膜蛋白复合物(plasma membrane protein complex)等;分子功能可能与DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白激酶活性(protein kinase activity)、激酶结合(kinase binding)相关。KEGG通路富集分析获得197条通路,按照P值由小到大排序,选取排名前20的条目绘制气泡图(见图8),发现与核心药组治疗乳腺增生关系较为密切的通路有P13K-ATK信号通路、TNF信号通路、内分泌抵抗等。

图7 GO生物功能条目图
2.3 分子对接结果
选取靶点TP53(PBDID:1aie)、AKT1(PBDID:6hhg)、ALB(PBDID:7vr0)、ESR1(PBDID:1sj0)与核心成分槲皮素、山奈酚、异鼠李素、β-谷甾醇进行分子对接。结合能越低,说明成分与蛋白靶点间的结合越紧密[10],核心成分与靶点间的对接能在-5.86 kcal/mol至-10.32 kcal/mol间(见表6),提示成分和靶点间对接情况良好。以槲皮素与靶点间的构象关系为例,进行可视化展示(见图9)。
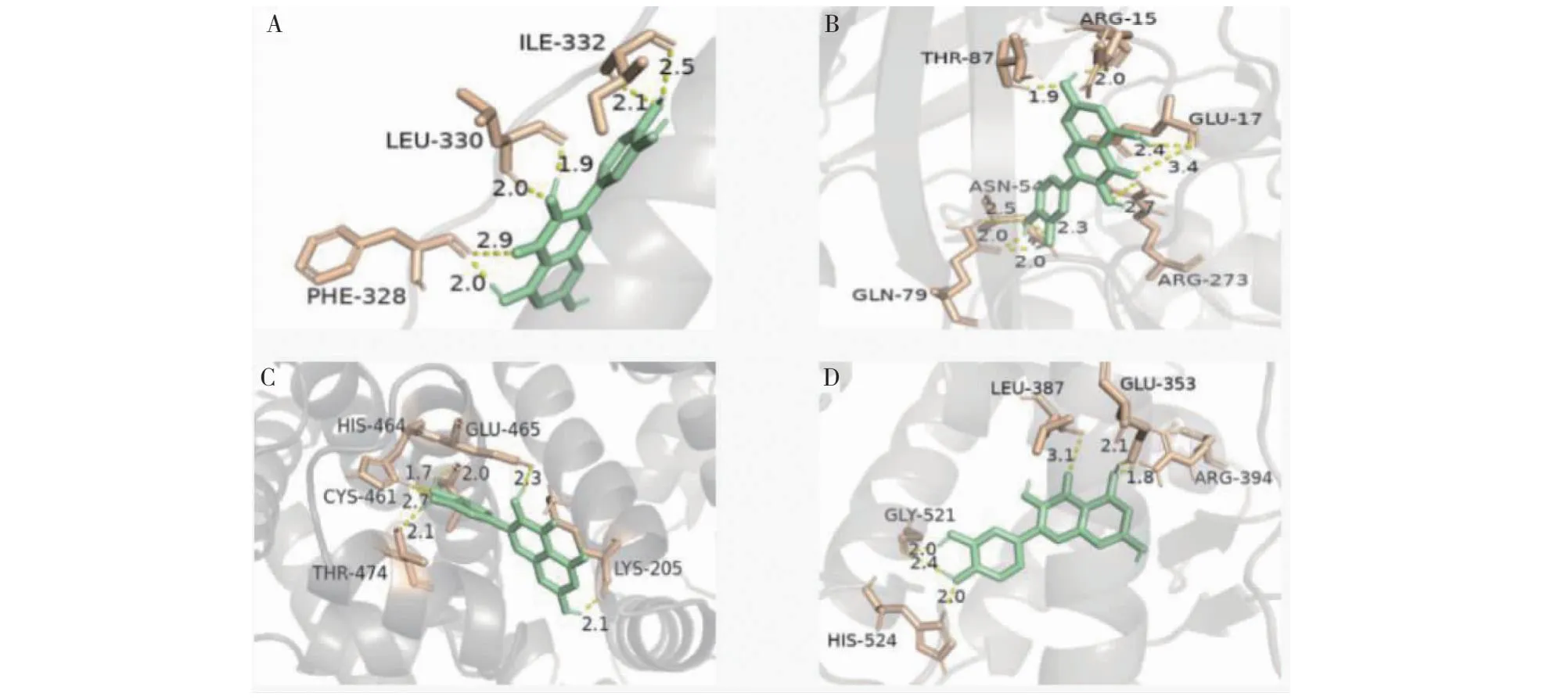
图9 分子对接模式图
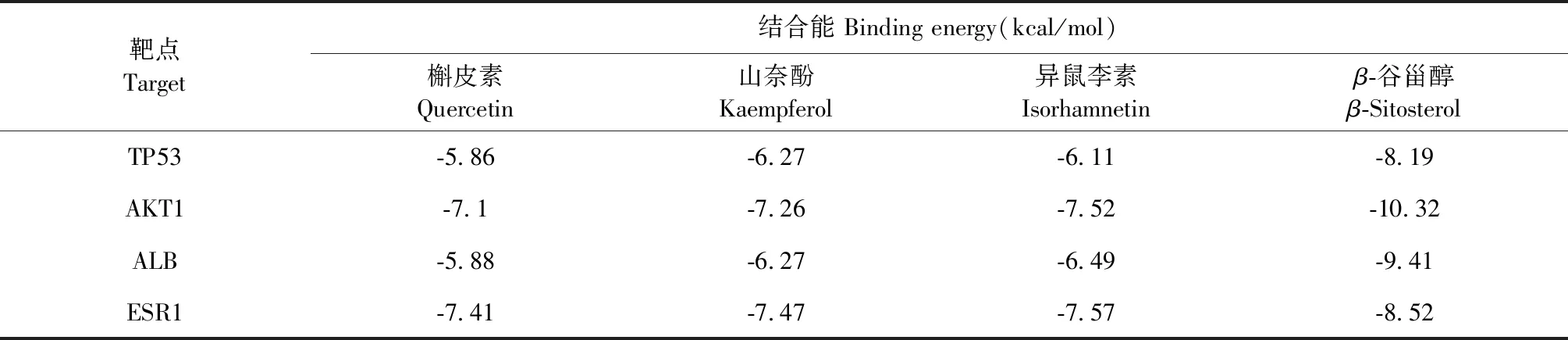
表6 分子对接结果
2.4 实验验证
2.4.1 中药组合对大鼠乳头直径和高度的影响
与正常组比较,模型组大鼠的乳头直径明显缩小、高度明显降低(P<0.05);与模型组比较,各给药组大鼠乳头直径明显缩小、高度明显降低(P<0.05)(见表7)。
表7 核心药组对大鼠乳头直径和高度的影响
2.4.2 中药组合对大鼠血清E2及PG表达的影响
与正常组比较,模型组大鼠血清中E2水平显著升高、PG水平显著降低(P<0.05);与模型组比较,各给药组中的大鼠血清中E2水平降低、PG水平升高(P<0.05),以高剂量中药组合效果最佳(见表8)。
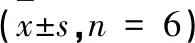
表8 核心药组对大鼠血清E2及PG表达的影响
2.4.3 中药组合对大鼠乳腺组织中PTEN、PI3K、Akt mRNA表达的影响
模型组与正常组比较,大鼠乳腺组织中的PTEN mRNA明显下降(P<0.05),PI3K、Akt mRNA明显升高(P<0.05);与模型组相比,高剂量组的PTEN mRNA明显升高,PI3K、Akt mRNA明显下降(P<0.05),表明中药组合对P13K-ATK信号通路具有抑制作用(见表9)。
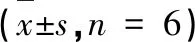
表9 核心药组对大鼠乳腺组织中PTEN、PI3K、Akt mRNA的影响
3 讨论与结论
中医学将乳腺增生归属“乳癖”范畴,《外科正宗》载:“忧郁伤肝,思虑伤脾,积想在心,所愿不得志者,致经络痞涩,聚结成核。”指出本病起病多由情志不遂、七情过极而损伤肝脾,导致肝失疏泄、脾失健运;或因肝肾亏损、冲任失调,导致痰凝、瘀血郁滞乳络,凝滞成核,遂成本病。
对含海洋中药的授权专利组方进行数据挖掘,发现专利组方中治疗乳腺增生的海洋中药以牡蛎、海藻、昆布为主。牡蛎能潜阳补阴、软坚散结,具有抗氧化、抗炎、抗肿瘤等功能,牡蛎水解物能产生强烈的免疫刺激作用,且具有抗肿瘤活性[11];海藻性寒、味苦咸,能软坚散结,是临床常用治疗乳腺增生的药物,《本草备要》认为海藻“咸润下而软坚,寒行水以泄热,能消坚聚”;昆布性寒、味咸,功效类似于海藻,药理研究显示昆布具有调节免疫、抗肿瘤的作用,此外,昆布能够下调Bcl-2基因蛋白表白,增加异常增殖的乳癌细胞对化疗药物的敏感性[12]。非海洋药物中,柴胡是治疗乳腺增生的常用药物,柴胡能条达肝气、疏肝解郁、调节气机,擅治肝气郁结型乳腺增生;当归为“补血之圣药”,既能补血,又能活血行滞,具有抗炎、抗肿瘤、调节免疫等作用[13];夏枯草既能清肝经火,又能散结消肿,其治疗乳腺疾病的作用首载于《神农本草经》,迄今千年有余,疗效广经验证。研究证实,夏枯草通过调控激素代谢水平,抑制乳腺增生;另一方面,夏枯草可以调节免疫功能,清除体内病变细胞[14]。
对高频药物进行聚类分析,类别A中莪术、三棱可活血行气止痛,海藻、昆布能软坚散结,本组药物的功效以活血散积止痛为主;类别B中香附、柴胡能疏肝理气、条达郁滞,二药是柴胡疏肝散的组成部分,具有理气解郁的作用,郁金行气化瘀、青皮破气疏肝,王不留行、丹参能活血,当归补血活血,牡蛎软坚散结,本组药物功效以疏肝理气活血为主;类别C中夏枯草能清泻肝火、散结消肿。三类药物组合功效各有侧重,可依据患者具体证型灵活应用。关联规则分析结果表明柴胡-牡蛎-当归药组关联性最高,柴胡疏肝理气、当归补血活血,二药相合既能理气疏肝,又能补血养肝,再配以海洋药物牡蛎,既能软坚散结,又能防止疏肝药物宣散太过,本药组能理气活血疏肝,有助于宣通乳络,促进气血运行恢复正常,查阅文献发现,柴胡-牡蛎-当归药组多应用于临床,且具有较好的临床效果[15]。乳头直径和高度能从形态学上直观反映乳腺增生的增生程度[16]。E2的升高及PG降低,导致乳腺实质过度增生,在乳腺组织的病变过程中起主导作用[17]。实验表明柴胡-当归-牡蛎药组能缩小乳头直径、降低乳头高度,且能降低血清中E2表达、提高PG表达水平,能改善乳房形态,抑制乳腺增生。
运用网络药理学对核心药组进一步分析,发现槲皮素、山柰酚、异鼠李素、β-谷甾醇度值最高。槲皮素的结构与雌激素类似,具有雌激素效能,对雌激素具有双向调节作用,此外,槲皮素能下调Bcl-2蛋白表达、上调Bax蛋白表达,从而诱导细胞凋亡,治疗乳腺增生[18,19];山柰酚是一种黄酮类化合物,具有抗肿瘤、抗炎和抗氧化等作用,山柰酚可以活化半胱天冬酶,促使细胞凋亡,抑制细胞增生[20];异鼠李素具有抗氧化活性,可由AKT和ERK信号通路介导,抑制细胞增殖、促进细胞凋亡[21];β-谷甾醇具有抗炎作用,能调控多种细胞信号通路,具有抑制细胞增殖和血管生成的作用[22]。
本研究共筛选出317个药物潜在作用靶点,依据拓扑参数,推测TP53、AKT1、ALB、ESR1是核心组方治疗乳腺增生的核心作用靶点。研究表明,TP53在Nedd4介导下调节Spy1蛋白,当TP53突变时,Spy1蛋白积聚,导致乳腺增生[23];在小鼠模型中,雌激素受体过表达时,MMTV启动子启动AKT1,AKT1驱动成纤维细胞转化,促进乳腺管腔上皮细胞的存活和迁移[24];ALB是白蛋白的基因表达,白蛋白来源于肝脏,能有效抑制中性粒细胞诱捕网(NETs)的生成[25],NETs参与了细胞杀伤、无菌性炎症、组织损伤,且能在一定程度上促进肿瘤细胞增殖,在乳腺癌的疾病进程中起重要作用[26],乳腺增生存在癌变可能,结合相关文献,推测ALB可能是预防乳腺增生癌变的重要靶点;乳腺组织中早期遗传缺陷、环境条件等因素可能导致ESR1突变,其中XbaⅠ位点的变异增加了乳腺增生的发病风险[27]。
通过GO功能富集分析,发现高频药组可能于膜筏等部位发挥治疗乳腺增生的作用,膜筏是由蛋白或类球蛋白所组成的细胞膜微结构域,参与如血管壁细胞凋亡、免疫细胞活化等生物学功能的调节[28]。药组发挥治疗作用的生物学过程主要涉及激素反应、对无机物质的反应、细胞对脂质的反应等,与DNA结合转录因子结合、蛋白激酶活性、激酶结合等方面的分子功能密切相关。
本研究发现,P13K-ATK信号通路可能是柴胡-牡蛎+当归药组治疗乳腺增生的重要通路。P13K-ATK信号通路与细胞增殖、迁移、分化、凋亡密切相关[29],乳腺上皮细胞中P13K-ATK信号通路被激活后,对雌激素的生长抑制具有抑制作用,从而导致乳腺上皮细胞的增生性改变。实验表明,核心药组具有抑制P13K-ATK信号通路的作用。拓扑值排名前十的核心靶点中,AKT1、TP53、EGFR、VEGFA、MYC、IL6均位于P13K-ATK信号通路,推测可能是核心药组抑制P13K-ATK信号通路的重要媒介。此外,抑癌基因PTEN能够抑制P13K-ATK信号通路,从而抑制细胞增殖、促进肿瘤细胞凋亡[30]。KEGG通路富集分析结果显示,药物靶点较多作用于癌症相关通路,提示中药组方在治疗乳腺增生同时,具有减缓疾病发展进程、延缓甚至阻止乳腺癌发生的可能性。核心药组还能作用于动脉粥样硬化、乙型肝炎、丙型肝炎等通路,体现中医理论中异病同治的思想,为相关申请人后续申请乳腺增生复方专利,拓宽专利权保护范围提供参考。
综上所述,本文运用数据挖掘、网络药理学及动物实验,以授权专利组方为研究对象,从理论层面探究其中海洋中药治疗乳腺增生的用药规律及核心药组治疗乳腺增生的作用机制。本文的研究结果对进一步开发海洋中药,促进相关专利的申请具有积极意义。
中药牡蛎多去肉,以壳入药,目前牡蛎壳成分的测定年代较早,公知有效成分主要是矿物质,此类物质可查的作用靶点较少,导致相关成分的拓扑参数较小,在网络中排名较为靠后,但牡蛎作为治疗乳腺增生的临床常用药物,其治疗作用不容忽视。本研究揭示出对牡蛎成分、靶点等方面的研究不够充分这一现状,为相关的系列研究提供了新思路。本研究团队已经设计了牡蛎潜在成分深入挖掘的相关实验,并且密切关注同行的药理研究进展,随着牡蛎有效成分的不断公开,牡蛎治疗乳腺增生的药理机制必将有新的突破。
