房山紫堇地上部分化学成分及其抗乳腺癌细胞增殖作用研究
2024-02-26邓卫芳贺金亮朱一栋邓超凡南泽东
邓卫芳,贺金亮,朱一栋,邓超凡,南泽东*
1山西中医药大学第一临床学院,晋中 030619;2北方民族大学化学与化学工程学院 化工技术基础国家民委重点实验室,银川 750021
房山紫堇Corydalisfangshanensis为罂粟科(Papaveraceae)紫堇属一年生草本植物,主要分布在北京房山、山西、河南、河北等地,生于海拔500~1 600 m的石灰岩多石山坡上[1]。紫堇属药材多以全草入药,性味以甘、寒为主,具有清热解毒之功效,多用于治疗感冒发热、疮疡痈肿、溃烂等症[2]。前期研究发现该属植物含有生物碱、黄酮、香豆素、有机酸等化学成分,其中生物碱是主要药理活性成分[3]。现代药理学研究发现该属生物碱类成分具有抗肿瘤、抗炎症痛、抗心肌缺血、抗菌、保肝等多种活性[4]。2020版《中华人民共和国药典》收录紫堇属中延胡索C.yanhusuo、夏天无C.decumbens、苦地丁C.bungeana等药用植物,复方延胡索片、夏天无注射液等药物在临床都有应用[5]。目前,由于生长环境、产量等原因,对房山紫堇的化学成分或药理活性研究鲜有报道,阻碍了其药用成分的发掘。为此,本研究对采自山西左权县的房山紫堇进行系统的化学成分及体外抗乳腺肿瘤细胞毒活性的研究,采用多种色谱分离技术,对80%乙醇粗提物进行系统分离,并对分离得到的化合物进行乳腺肿瘤细胞抑制作用测试,以期为该药材抗乳腺癌应用及其后期质量控制研究提供依据。
1 材料与方法
1.1 材料
Bruker AV-600、500、400型核磁共振仪(德国Bruker公司);Bruker micrOTOF QⅡ高分辨质谱仪(美国Bruker Daltonics公司);Waters Xevo TQD低分辨质谱仪(美国Waters公司);Spectrum 100 FTIR红外光谱仪(美国PerkinElmer公司);Agress1100型高效液相色谱仪(大连依利特分析仪器有限公司);Hanon P850型旋光仪(济南海能仪器公司);Thermo BDS-C18(10 mm×250 mm,5 μm)半制备色谱柱(美国Thermo Fisher公司);KS-240超声机(深圳市洁康洗净电器公司);CO2细胞培养箱(美国Thermo Fisher公司);DMILLED型荧光倒置显微镜(德国Leica公司);EnSpire型全波长酶标仪(美国Perkinelmer公司);BCV-4S1超净工作台(上海一恒有限公司)。
正相硅胶(200~300目,批号2321030026,青岛海洋化工厂;300~400目,北京伊诺凯科技公司);Sephadex LH-20凝胶(批号17-0090-02,瑞典Pharmacia公司);Rp-C18硅胶(批号F1855900505,德国默克公司);GF254型薄层色谱板(烟台江友硅胶开发有限公司);甲醇和乙腈(色谱级,纯度>99.9%,美国迈瑞达公司);其余化学试剂均为分析纯(批号:天津大茂化学试剂厂);MCI-gel(CHP20P,75~150 μm,日本三菱公司,批号:7H801);DMEM培养基(批号:11960-069,美国Thermo Fisher公司);胎牛血清(批号:E510008-0100,上海生工生物工程公司);MTT及DMSO化学试剂(纯度≥99.8%、99.7%,美国Sigma-Aldrich公司);阳性对照药注射用顺铂(冻干型,批号:2H0344B03,山东齐鲁制药有限公司)。
房山紫堇药材2018年9月采自山西左权县,由四川省食品药品学校秦运潭副教授鉴定为房山紫堇Corydalisfangshanensis,标本存于北方民族大学化工学院(No.CF20180901)。抗肿瘤活性测试所用的乳腺癌细胞MCF-7、MDA-MB-231购于中国科学院上海细胞库。
1.2 方法
1.2.1 提取分离
房山紫堇药材3.5 kg,切碎后用80%乙醇超声提取3次(30 min/次),合并提取液并减压浓缩,得浓缩浸膏180 g。将其分散到蒸馏水中,依次用石油醚、乙酸乙酯和正丁醇萃取,最后得到石油醚、乙酸乙酯和正丁醇三个部位量分别为36.0、23.0和32.0 g。
乙酸乙酯部位浸膏(23.0 g),经正相硅胶柱色谱分离(200~300目,0.8 kg),以二氯甲烷-甲醇(20∶1→1∶1,V/V)梯度洗脱,薄层色谱检测合并得到5个粗流分FZB1~FZB5。FZB2经Sephadex LH-20色谱分离,以二氯甲烷-甲醇(1∶1,V/V)洗脱得流分FZB2-1。FZB2-1经正相硅胶(300~400目)柱色谱分离,用石油醚-二氯甲烷-甲醇+0.5%甲酸(20∶20∶1→3∶3∶1,V/V)梯度洗脱,得到化合物1(8.0 mg)、5(5.2 mg)和6(10.0 mg);FZB3经MCI色谱分离,以甲醇-水(20%→80%,V/V)梯度洗脱得到三个主要流分FZB3-1~FZB3-3。FZB3-1经硅胶(300~400目)柱色谱分离,以石油醚-二氯甲烷-甲醇+0.5%甲酸(5∶5∶1,V/V)等度洗脱,依次得到化合物3(5.0 mg)、4(6.0 mg)和2(4.0 mg);FZB3-2经制备薄层色谱分离,并经Sephadex LH-20色谱分离,以二氯甲烷-甲醇(1∶1,V/V)洗脱得到化合物7(6.0 mg)和8(10.0 mg);FZB3-3经硅胶(300~400目)柱色谱分离,以氨水饱和的石油醚-二氯甲烷-甲醇(8∶8∶1,V/V)等度洗脱,得到化合物12(12.0 mg)和11(5.0 mg);FZB4经Sephadex LH-20色谱分离,以二氯甲烷-甲醇(1∶1,V/V)洗脱得流分FZB4-1。FZB4-1经硅胶(300~400目)柱色谱分离,以氨水饱和的石油醚-二氯甲烷-甲醇(5∶5∶1,V/V)等度洗脱,得到化合物9(3.0 mg)和10(4.0 mg);FZB5经硅胶(300~400目)柱色谱分离,以二氯甲烷-甲醇系统(10∶1→3∶1,V/V)梯度洗脱,得到化合物13(3.5 mg)。
正丁醇浸膏(32.0 g),经正相硅胶柱(200~300目,1.0 kg)色谱分离,用二氯甲烷-甲醇系统(15∶1→2∶1,V/V)梯度洗脱,最终合并得到6个粗流分FZD1~FZD6。FZD1经MCI柱色谱分离,以甲醇-水(20%→80%,V/V)梯度洗脱得到FZD1-1流分。FZD1-1经半制备高效液相色谱分离,以甲醇-水(35∶65,V/V)系统洗脱得到化合物16(8.0 mg,tR=18.96 min)和17(9.0 mg,tR=19.34 min);FZD2经Sephadex LH-20色谱分离,以二氯甲烷-甲醇(1∶1,V/V)洗脱,得流分FZD2-1。FZD2-1经薄层色谱分离,以二氯甲烷-甲醇(4∶1)为展开剂,得到化合物14(8.0 mg);FZD5经正相硅胶(300~400目)柱色谱分离,以乙酸乙酯-甲醇(10∶1→3∶1,V/V)梯度洗脱,得到化合物15(4.2 mg)。
1.2.2 活性检测
采用MTT法[6]测试化合物1~17对两种人乳腺癌细胞MDA-MB-231和MCF-7增殖抑制作用。将所测化合物均用DMSO溶解后配成浓度为10 mmol/L储备液,保藏于4 ℃冰箱备用。临用前,加入培养基液稀释成所需浓度,本实验配制为0.032、0.16、0.8、4.0、20.0、100.0 μmol/L等6种不同浓度。用含10%胎牛血清的DMEM培养液将乳腺癌细胞MDA-MB-231和MCF-7配成细胞悬液,并于37 ℃、5% CO2培养箱中培养,将对数生长期的细胞悬浮液接种于96孔板中(约4.5×104个/mL),每孔100 μL。培养24 h后,再加入上述不同浓度的含药培养基,同时设置空白组和阳性顺铂(DDP)对照组,37 ℃继续培养48 h,然后避光条件下每孔加入20 μL的MTT溶液,继续孵化4 h后弃去培养液,每孔加入150 μL的DMSO后用酶标仪(λ=570 nm)测定其吸光度A值。根据公式计算抑制率:抑制率=(A对照-A加药)/(A对照-A空白)×100%。实验重复3次,然后用SPSS软件(23.0版本)计算IC50值。
2 结果
2.1 结构鉴定
化合物1白色固体粉末;碘化铋钾显紫红色;(+)-HR-ESI-MS:m/z272.089 7 [M+Na]+(calcd for C13H15NO4Na,272.089 3)。红外光谱显示特征的羰基吸收峰(1 753、1 650 cm-1)及苯环吸收峰(923 cm-1);1H NMR(见表1)显示有两个对位苯环氢信号7.73(1H,s,H-8)、6.70(1H,s,H-5),说明该化合物有一个1,2,4,5四取代苯环结构;1H-1H COSY(见图1)给出一个-CH2CH2-片段,结合氢谱3.54(2H,t,J=6.6 Hz,H-3)可知其中一个亚甲基连N原子,通过13C NMR还得到酰胺羰基信号164.0(C-1),通过分析以上NMR数据推测该化合物具有异喹啉骨架,通过HMBC(见图1)实验中H-4与C-5相关,以及H-8与C-1相关进一步证实该化合物的母核为一个异喹啉。之外,通过1H和13C NMR(见表1)得到一个连氮甲基信号3.11(3H,s,N-CH3),一个乙酰基信号2.30(3H,s,-COCH3),一个甲氧基信号3.58(3H,s,-OCH3)。在1D-NOE实验中,甲氧基与H-5相关证明甲氧基连到C-6上,乙酰基与H-8相关证明乙酰基连到C-7上。自此,化合物1的结构确定为7-acetyl thalifoline,检索Scifinder、中国知网等数据库显示该结构曾在2002年通过合成的方法得到[7]。因此,本文中该化合物作为天然产物首次报道。

表1 化合物1的氢谱和碳谱(600 MHz and 150 MHz,CDCl3)
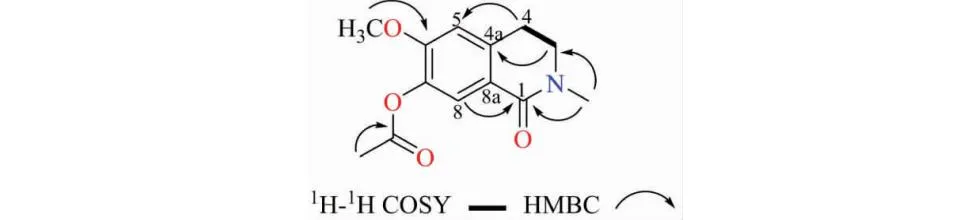
图1 化合物1的1H-1H COSY和主要HMBC相关
化合物2白色无定型粉末,碘化铋钾呈阳性;ESI-MS:m/z192.2 [M]+;1H NMR(500 MHz,CD3OD)δ:8.79(1H,s,H-1),7.18(1H,s,H-5),7.08(1H,s,H-8),4.02(3H,s,6-OCH3),3.98(2H,t,J=8.5 Hz,H-3),3.71(3H,s,N-CH3),3.21(2H,t,J=8.5 Hz,H-4);13C NMR(125 MHz,CD3OD)δ:166.5(C-1),50.8(C-3),26.0(C-4),131.9(C-4a),112.2(C-5),157.9(C-6),147.9(C-7),119.9(C-8),118.7(C-8a),57.1(6-OMe),47.3(N-CH3)。以上数据与文献[8]报道一致,故确定该化合物为pycnarrhine。
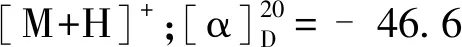
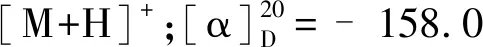
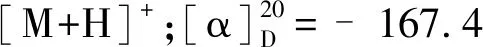
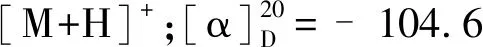


化合物10为淡黄色固体粉末,碘化铋钾呈阳性;ESI-MS:m/z336.1 [M]+;1H NMR(500 MHz,CD3OD)δ:9.71(1H,s,H-8),7.99(1H,d,J=9.0 Hz,H-12),7.90(1H,d,J=9.0 Hz,H-11),7.36(1H,s,H-1),6.93(1H,s,H-4),6.48(2H,s,-OCH2O-),4.76(2H,t,J=6.0 Hz,H-6),3.95(3H,s,3-OCH3),3.12(2H,t,J=6.0 Hz,H-5),2.99(3H,s,13-CH3);13C NMR(125 MHz,CD3OD)δ:115.6(C-1),146.5(C-2),150.9(C-3),115.9(C-4),132.2(C-4a),28.5(C-5),58.8(C-6),143.6(C-8),119.6(C-8a),146.5(C-9),148.9(C-10),120.5(C-11),121.4(C-12),133.3(C-12a),134.7(C-13),138.0(C-14),112.9(C-14a),57.0(3-OCH3),106.2(-OCH2O-),18.8(13-CH3)。以上数据与文献[16]报道一致,故确定该化合物为脱氢甲卡维丁。
化合物11为白色无定型粉末固体,碘化铋钾呈阳性;ESI-MS:m/z265.2 [M+H]+;1H NMR(500 MHz,CD3OD)δ:7.43(1H,d,J=16.0 Hz,H-7),7.12(1H,d,J=2.0 Hz,H-2),7.02(1H,dd,J=8.0,2.0 Hz,H-6),6.79(1H,d,J=8.0 Hz,H-5),6.42(1H,d,J=16.0 Hz,H-8),3.88(3H,s,3-OCH3),3.33(2H,t,J=6.0 Hz,H-1′),3.21(2H,t,J=6.0 Hz,H-4′),1.63(4H,m,H-2′,3′);13C NMR(125 MHz,CD3OD)δ:128.2(C-1),111.6(C-2),148.5(C-3),149.3(C-4),118.2(C-5),123.3(C-6),142.2(C-7),116.5(C-8),169.4(C-9),42.1(C-1′),27.8(C-2′),27.2(C-3′),39.7(C-4′),56.4(3-OCH3)。以上数据与文献[17]报道一致,故确定该化合物为feruloylputrescine。
化合物12为白色固体粉末,碘化铋钾呈阳性;ESI-MS:m/z193.1 [M+H]+;1H NMR (500 MHz,CD3OD)δ:7.86(1H,d,J=9.5 Hz,H-7),7.10(1H,s,H-1),6.76(1H,s,H-4),6.19(1H,d,J=9.5 Hz,H-6),3.91(3H,s,3-OCH3);13C NMR(125 MHz,CD3OD)δ:109.9(C-1),147.1(C-3),104.0(C-4),164.1(C-5),112.5(C-6),146.1(C-7),151.5(C-8),153.1(C-8a),56.8(3-OCH3)。以上数据与文献[18]报道一致,故确定该化合物为木黄酮。
化合物13为白色固体粉末;ESI-MS:m/z207.2 [M-H]-;1H NMR(500 MHz,CD3OD)δ:7.60(1H,d,J=16.0 Hz,H-7),7.19(1H,d,J=2.0 Hz,H-2),7.06(1H,dd,J=8.5,2.0 Hz,H-6),6.81(1H,d,J=8.5 Hz,H-5),6.35(1H,d,J=16.0 Hz,H-8),3.89、3.77(各3H,s,2×OCH3);13C NMR(125 MHz,CD3OD)δ:127.7(C-1),111.7(C-2),149.4(C-3),150.6(C-4),115.2(C-5),124.1(C-6),146.8(C-7),116.5(C-8),169.7(C-9),56.5(3-OCH3),52.0(4-OCH3)。以上数据与文献[19]报道一致,故确定该化合物为二甲基咖啡酸。
化合物14为白色固体粉末;ESI-MS:m/z357.1 [M+H]+;1H NMR(500 MHz,CD3OD)δ:7.70(1H,d,J=16.0 Hz,H-7),7.20(1H,d,J=2.0 Hz,H-2),7.09(1H,dd,J=8.0,2.0 Hz,H-6),6.81(1H,d,J=8.0 Hz,H-5),6.38(1H,d,J=16.0 Hz,H-8),5.56(1H,d,J=7.5 Hz,H-1′),3.89(3H,s,3-OCH3);13C NMR(125 MHz,CD3OD)δ:124.4(C-1),111.9(C-2),149.4(C-3),150.9(C-4),116.5(C-5),127.6(C-6),148.2(C-7),114.8(C-8),167.7(C-9),95.8(C-1′),74.1(C-2′),78.1(C-3′),71.1(C-4′),78.8(C-5′),62.4(C-6′),56.5(3-OCH3)。以上数据与文献[20]报道一致,故确定该化合物为4-羟基-3-甲氧基桂皮酰基-β-D-葡萄糖苷。
化合物15为黄色固体粉末;ESI-MS:m/z625.2 [M+H]+,结合13C NMR数据得到分子式为C28H32O16;1H NMR(500 MHz,CD3OD)δ:7.94(1H,d,J=2.0 Hz,H-2′),7.62(1H,dd,J=8.5,2.0 Hz,H-6′),6.90(1H,d,J=8.5 Hz,H-5′),6.42(1H,d,J=2.0 Hz,H-8),6.21(1H,d,J=2.0 Hz,H-6),5.22(1H,d,J=7.0 Hz,H-1′′),4.52(1H,d,J=1.5 Hz,H-1′′′),3.94(3H,s,3′-OCH3),1.08(3H,d,J=6.5 Hz,H-6′′′);13C NMR(125 MHz,CD3OD)δ:158.5(C-2),135.5(C-3),179.4(C-4),163.1(C-5),99.9(C-6),166.1(C-7),94.9(C-8),158.9(C-9),104.4(C-10),123.0(C-1′),114.6(C-2′),148.3(C-3′),150.9(C-4′),116.1(C-5′),124.0(C-6′),56.8(3′-OCH3),104.4(C-1′′),75.9(C-2′′),77.4(C-3′′),71.6(C-4′′),78.2(C-5′′),68.5(C-6′′),102.5(C-1′′′),72.1(C-2′′′),72.3(C-3′′′),73.8(C-4′′′),69.8(C-1′′′),17.9(C-6′′′)。以上数据与文献[21]报道一致,故确定该化合物为水仙苷。

化合物1~17的结构见图2。
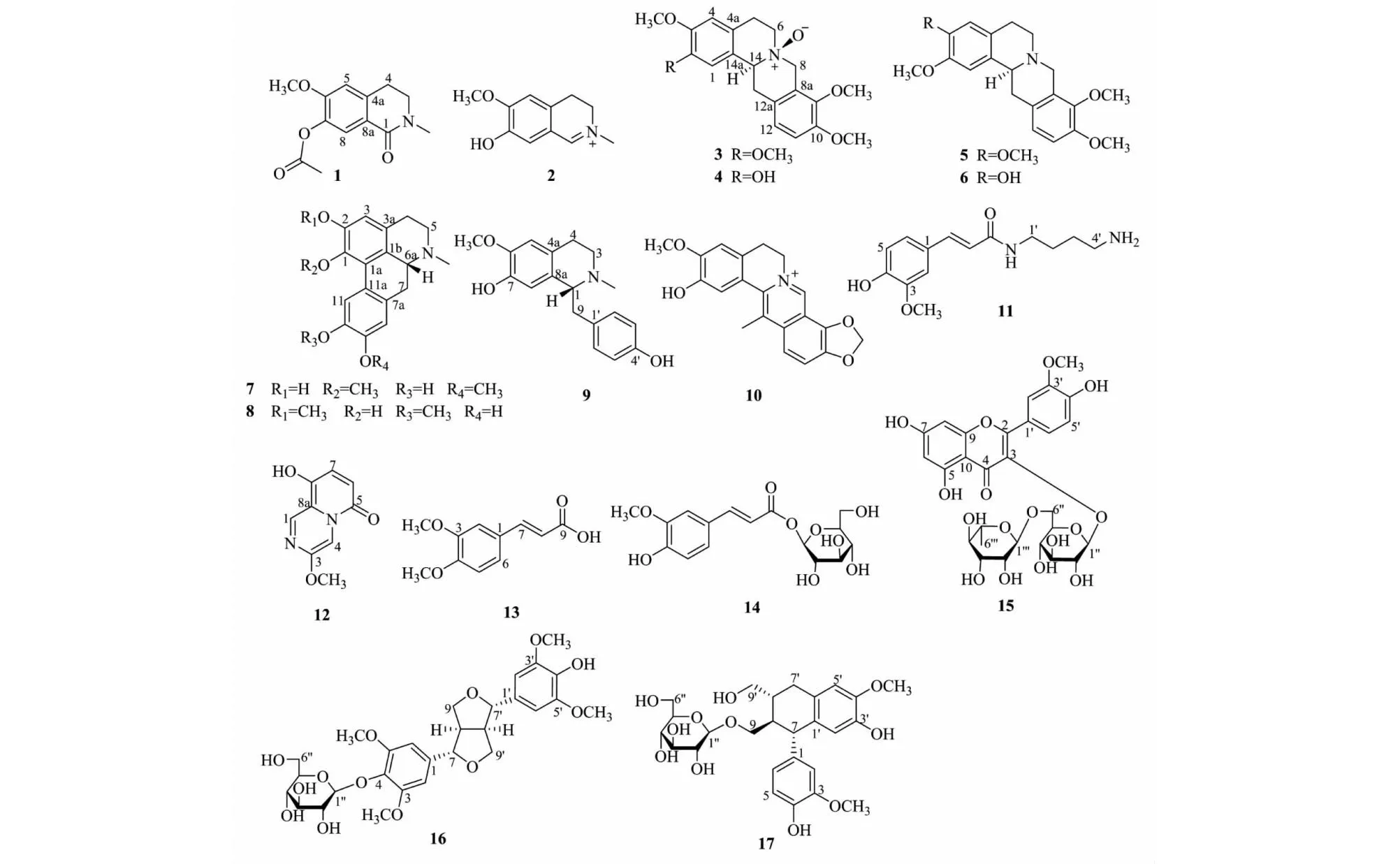
图2 化合物1~17的化学结构
2.2 活性测试
抗肿瘤活性测试(见表2)显示,化合物2~10、13、15~17对MDA-MB-231细胞有一定的抑制作用,其IC50值范围为8.00~79.99 μmol/L(顺铂IC50=3.54 μmol/L),化合物2~10、16、17对MCF-7细胞有抑制作用,IC50值范围为7.29~86.91 μmol/L(阳性对照顺铂IC50=23.02 μmol/L)。从抗乳腺癌肿瘤测试结果来看,大部分生物碱类成分对两种人乳腺癌细胞MDA-MB-231和MCF-7表现出不同程度的增殖抑制作用,苄基异喹啉生物碱3、4、10的抑制作用较显著,可能与其结构中含有氮正离子有关。此外,两种木脂素苷类化合物16和17对两种乳腺癌细胞抑制作用也比较明显。

表2 化合物1~17对乳腺癌细胞抑制活性
3 结论
本实验从房山紫堇80%乙醇提取物中(乙酸乙酯和正丁醇)共分离得到17个单体化合物,化合物1~10为异喹啉生物碱类成分,11、12为其他生物碱类成分,化合物13、14为苯丙素类成分,化合物15为黄酮苷类成分,化合物16、17为木脂素苷类成分。其中,化合物1作为天然产物首次报道,2~17是首次从房山紫堇中分离得到。上述分离得到的化合物与文献报道的紫堇属成分类型基本一致。体外抑制乳腺癌细胞增殖的活性测试结果显示,化合物3、4、7、10对MDA-MB-231具有明显的抑制活性,化合物4、17对MCF-7细胞具有明显的抑制活性,其他化合物对上述乳腺癌肿瘤细胞没有表现出抑制作用。活性测试结果来看,大部分苄基异喹啉生物碱类成分都有一定的抑制作用,但是分离得到的生物碱类化合物总体较少,很难对其构效关系进行有效的总结,后续工作可以对一些含量较高的苄基异喹啉生物碱类成分进行结构修饰,然后总结其构效关系。本研究结果对房山紫堇药材药效物质基础的阐明、质量控制及药理作用的进一步深入研究有一定的参考价值。
