外泌体及其在中枢神经系统中的功能*
2024-02-26王子源白宇轩曹罡戴金霞
王子源 白宇轩 曹罡 戴金霞**
(1)华中农业大学生命科学技术学院,武汉 430070;2)华中农业大学,农业微生物学国家重点实验室,武汉 430070;3)华中农业大学动物医学院,武汉 430070)
外泌体(exosomes)是一类由活细胞产生并分泌至胞外直径约40~160 nm的膜性囊泡,于1983年在培养绵羊网织红细胞的上清液中被首次发现[1]。早期的研究认为,外泌体是一类负责细胞废弃物排泄的“细胞碎片”,因此一直未被重视。随着研究的深入,1996年Raposo等[2]发现抗原递呈细胞分泌的外泌体膜表面存在着抗原肽-主要组织相容性复合体II复合物(major histocompatibility complex II with antigenic peptide(p),p-MHC-II)和共刺激分子,表明外泌体可以介导细胞间的信息交流。2007年Valadi等[3]发现,小鼠肥大细胞来源的外泌体可以被人肥大细胞吸收并将包含的mRNA翻译成蛋白质,表明外泌体除包含众多定位于内体、胞内的蛋白质或质膜受体分子外,还可以装载如miRNA、mRNA等核酸分子,这一成果为外泌体功能的研究翻开了新的篇章。2011年Lachenal等[4]通过体外原代培养的方式首次找到了胚胎皮质神经元释放外泌体的证据,提示外泌体在神经系统的功能调节中也发挥着重要的作用。
1 外泌体的生物发生及其组成成分
1.1 外泌体的生物发生
外泌体的自然发生过程涉及到细胞质膜的两次内陷及多囊泡体(multivesicular bodies, MVBs)的形成,并经由胞吐过程将MVBs内的外泌体释放至胞外[5]。细胞质膜的第一次内陷过程产生了早期胞内体(early-sorting endosome, ESE),其表面及内部分别含有质膜表面膜蛋白及存在于胞外环境中的可溶性蛋白。早期胞内体可以经质子泵介导的酸化成熟过程而转变为晚期胞内体(late-sorting endosome,LSE)[6],并随后在胞内体膜上发生第二次膜内陷产生多个腔内囊泡(intraluminal vesicles,ILVs),这些ILVs具有很强的异质性,直径40~160 nm不等,内容物也不尽相同。此时ILVs膜的拓扑取向与细胞膜完全一致,使其能够装载来自胞内的货物分子。MVBs可以与自噬体或溶酶体融合而降解[7],也可以经由细胞骨架运输至细胞质膜附近进而与细胞质膜融合,通过胞吐作用将ILVs释放至胞外成为外泌体。
目前关于外泌体的生物发生和货物分选机制存在两种模型(图1)。
第一种是依赖于转运所需内体分选复合物(endosomal sorting complexes required for transport,ESCRT)[7]的过程:首先由ESCRT-0复合体识别内体膜上临时泛素化修饰的蛋白质货物并招募ESCRT-Ⅰ、ESCRT-Ⅱ复合体进行膜泡出芽,随后由ESCRT-Ⅱ招募ESCRT-Ⅲ复合体在芽体颈部进行多聚化组装并通过缢缩使囊泡释放入胞内体腔中形成ILVs,最后由VPS4、VTA1蛋白组装成的AAA+-ATP酶通过水解ATP供能的方式使ESCRT-Ⅲ复合体解聚并回收再利用。在蛋白质货物最终分选进入ILVs的过程中,由ESCRT-Ⅲ复合体招募的一种泛素异肽酶AMSH(associated molecular with SH3 domain of STAM)催化的蛋白质去泛素化过程至关重要[8]。在ESCRT途径中,ESCRT-0亚基成分Hrs、STAM1,ESCRT-Ⅰ亚基成分Tsg101,ESCRT-Ⅲ亚基成分CHMP4,VPS4、VTA1以及ESCRT相关蛋白ALIX参与了MVBs的形成和外泌体的发生调节[9-11]。Tsg101、Vps4和ALIX介导了蛋白质或miRNA货物加载到外泌体的调节过程[12-14]。
第二种模型是ESCRT非依赖性的,由脂筏和神经酰胺诱导的内体膜出芽和货物分选途径。在这种模型中,胞内体表面的膜蛋白向膜内富含胆固醇、鞘磷脂和GPI锚定蛋白的脂筏结构域的转移使胞内体膜在局部形成弯曲和出芽,并进一步通过向脂筏的掺入使这些蛋白质货物分选进入ILVs中[15],最后通过外泌体释放至胞外。除脂筏成分外,鞘磷脂酶催化产生的鞘磷脂代谢产物神经酰胺也可以参与诱导MVB膜的出芽[16]及miRNA向ILVs的装载过程[17]。此外,同样为鞘磷脂代谢产物的鞘氨醇-1-磷酸(sphingosine-1-phosphate,S-1-P)也可以作为信号分子激活S-1-P受体,再通过激活小分子GTP结合蛋白Ras超家族中的Rho蛋白亚家族成员Cdc42和Rac1诱导微丝蛋白在胞内体膜上的聚合来促进货物的分选和MVBs的形成[18]。
关于MVBs的定向运输和外泌体释放调控机制的研究也是近年来外泌体研究领域的热点问题。最新研究表明,参与MVBs靶向质膜运输的小分子GTP结合蛋白Ras超家族的Rab蛋白亚家族成员如Rab11a、Rab27A/B、Rab37、Rab39等[19-20]和介导囊泡与靶膜融合过程的可溶性NSF连接蛋白受体(soluble NSF attachment protein receptor, SNARE)复合物[21]在外泌体分泌的时空调节和分泌量的调节过程中发挥了关键作用。
1.2 外泌体的基本组成成分及功能
1.2.1 核酸成分及其功能
外泌体中含有来源细胞特异性的mRNA和大量非编码RNA(non-coding RNA,ncRNA),这是外泌体与其他囊泡最大的区别。早期研究发现,外泌体中的转录本与外泌体供体细胞中的各种转录本丰度存在差异[3],表明RNA进入外泌体的过程受到某些分选机制的调节。外泌体中包含的mRNA转录本通常是具有功能的,可以通过转移至受体细胞中进行蛋白质翻译,从而影响受体细胞的转录组和蛋白质组状态,产生不同的表型。外泌体中的非编码RNA包括微RNA(micro RNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)等。外泌体的miRNA可以参与受体细胞内基因表达的转录后调控过程,对细胞和组织状态具有广泛的调节作用。例如,含有miR-132的外泌体可以转移至脑血管的内皮细胞中来调节血管的完整性[22],在外周神经元受损后分泌的miR-21可能有助于神经元与巨噬细胞间的通讯,调节炎症反应促进神经修复再生过程[23]。
除RNA外,外泌体也可以随机或选择性地包含一些DNA片段。通常,外泌体中包含的DNA片段较短,但现在发现也可以包含长达数千碱基长度的DNA序列。外泌体中的DNA片段可以调节细胞内稳态、肿瘤发生、肿瘤治疗和免疫记忆等过程。例如细胞可以通过分泌外泌体的方式去除胞质中有害的DNA片段,从而避免胞质中因DNA积累导致的cGAS-STING信号通路激活而诱导衰老样细胞周期停滞或细胞凋亡,进而维持细胞内稳态[24]。外泌体DNA还可以在肿瘤发生和肿瘤治疗中发挥重要作用,肿瘤细胞可以通过外泌体分泌一些肿瘤特异性突变的DNA片段,通过转移这些DNA元件产生外周细胞突变库[25],而在放疗法治疗肿瘤的过程中,肿瘤细胞的细胞质中会积累DNA片段并通过外泌体释放,免疫细胞如树突状细胞可以摄取这些含DNA片段的肿瘤细胞外泌体,激活胞内的cGAS-STING信号通路,刺激IFN-1的产生并募集更多的CD8+T淋巴细胞以杀伤肿瘤细胞,抑制肿瘤生长[26]。一项最新研究表明,抗原递呈细胞可以通过分泌外泌体向T淋巴细胞中转移端粒DNA和Rad51重组因子,从而延长T淋巴细胞染色质的端粒长度使其免于衰老并促进长期免疫记忆[27]。通过外泌体在细胞间转移DNA可能是一种普遍性的机制,关于其分布、功能和生物学意义值得进一步探索和研究。
1.2.2 标志性蛋白质成分及其功能
目前发现并收录在ExoCarta数据库[28]中的外泌体蛋白质达到了9 769种,其中包括细胞质膜蛋白、胞质蛋白、内质网相关蛋白和高尔基体相关蛋白等。不同细胞的外泌体发生途径基本一致,其中大多数外泌体蛋白均与外泌体发生途径相关,因此这些蛋白质为不同细胞分泌的外泌体所共有,也常被作为标志物来对外泌体进行检测和鉴定。
外泌体腔内最常见的一类蛋白质是小分子GTP结合蛋白Ras超家族的Rab蛋白亚家族成员,负责调节内体的运输和膜融合过程。除Rab蛋白外,外泌体还含有许多内体相关蛋白(endosomeassociated protein),这与MVBs的形成、外泌体蛋白货物分选和装载过程密不可分。外泌体膜上也存在着丰富的膜蛋白[29]:如协助跨膜运输和膜融合的膜联蛋白(annexin),包括膜联蛋白I、II、IV、V、VI、VII、IX;表面黏附分子如整合素(integrin)和四跨膜蛋白超家族(tetraspanin family),如CD9、CD63、CD81等[30-31];以及溶酶体相关膜蛋白(lysosomal-associated membrane protein,LAMP)等。除了上述经典的外泌体标志蛋白质外,一项新的研究发现,含EWI基序的免疫球蛋白超家族(IGSF8和PTGFRN)以及MARCKS蛋白质家族(MARCKS、MARKCSL1和BASP1)也在外泌体膜上大量富集[32],这些蛋白质的富集程度远高于一直以来被作为外泌体标志物的四跨膜蛋白家族。另一项新的研究通过定量蛋白质组学方法分析了不同类型人源细胞系外泌体的核心蛋白组,发现syntenin-1的丰度在不同来源的外泌体中始终处于最高水平[33],这表明syntenin-1蛋白有潜力被作为一种新的外泌体通用标志物。此外,外泌体中常见的非特异蛋白成分还包括各种代谢类酶、核糖体蛋白、一些信号转导因子、细胞骨架蛋白和泛素分子等,它们可能是通过非特异性分选机制被随机装载进入外泌体的细胞质成分,或是在特异性分选过程中发挥“标签”作用的物质如泛素分子。
1.2.3 神经外泌体的特征性内容物
除了前两节中所述外泌体含有的基本核酸或蛋白质成分外,由中枢神经系统的细胞如神经元和神经胶质细胞分泌的神经外泌体还含有一些特征性的内容物成分。例如:由神经元分泌的外泌体可以载有如神经肽类递质、人突触囊泡蛋白(synaptotagmin-4,Syt4)、AMPA型谷氨酸受体亚基、Wnt蛋白、细胞骨架调节蛋白(activity regulated cytoskeleton associated protein,Arc)等多肽或蛋白质成分,以及ARCmRNA、miR-218-5p、miR-132-5p、miR-690等核酸成分;由神经胶质细胞分泌的外泌体可包含如fiblulin-2、载脂蛋白 D(apolipoprotein-D,Apo-D)、热休克蛋白(heat shock proteins,HSPs)、synapsin I膜蛋白等蛋白质成分以及N-花生四烯酰乙醇胺(N-arachidonoyl ethanolamine,AEA)和2-花生四烯酰甘油(2-arachidonoylglycerol,2-AG)等内源性大麻素成分。关于上述神经外泌体特征性成分参与的生理功能将会在第3部分展开叙述。
2 神经外泌体与突触囊泡的比较
在生理或病理状态下,神经系统中的各类细胞如神经元和神经胶质细胞均可分泌外泌体,这些外泌体可以统称为神经外泌体。神经外泌体不仅存在于神经元与神经元的突触接头间,也广泛存在于脑脊液中。神经外泌体与神经元的突触囊泡(synaptic vesicle,SV)在形成、内容物成分及装载机制上存在许多相似和差异之处(图2),下面就这些方面展开比较。

Fig.2 Comparison of biogenesis and release of synaptic vesicles and neural exosomes图2 突触囊泡与神经外泌体在生物发生和释放方面的比较
2.1 神经外泌体与突触囊泡在生物发生上的差异
神经元中的SV在突触前膜处通过质膜的内吞作用产生,并在突触前膜反复回收再利用。目前,SV的发生过程有3种模型。a.“吻-逸”模型[34]:动作电位传导至突触前膜,触发SV与突触前膜融合形成瞬时融合孔,在内容物被部分或完全释放后可迅速关闭融合孔并回到胞质,使SV更新。b. 网格蛋白介导的内吞作用[35]:SV与突触前膜完全融合后,其成分可通过网格蛋白依赖性内吞作用重新回收,并转移至突触胞内体(synaptic endosome),并从胞内体再次出芽后通过SV表面的神经递质转运蛋白对内容物进行更新。c. 活性依赖性的大型内吞作用[36]:即突触在受到强烈刺激后,大片突触前膜通过形成深凹陷直接进行成团性内吞作用,在胞内形成瞬时的巨大胞内体(bulk endosome)结构,并在末端迅速通过出芽形成新的SV并装载新合成的神经递质。
外泌体的发生同样起源于内吞途径,以胞内体作为周转的“枢纽”。但其内吞形成的早期内体会再次发生凹陷,产生ILVs,然后成熟为MVBs。在这个过程中,蛋白质、核酸和其他生物活性分子被包装在ILVs中。随后与突触前膜质膜融合的MVBs释放腔内的ILVs,成为神经外泌体。
2.2 神经外泌体与突触囊泡在内容物装载机制上的差异
SV的生物发生过程和内容物装载是分步进行的,且其内容物装载是主动的耗能过程:回收的SV首先通过V型H+-ATP泵的活化而重新酸化,在囊泡内外形成H+电化学梯度,SV表面的神经递质转运蛋白利用这种梯度将神经递质分子转运至腔中,导致SV内容物的快速再填充[37-38]。
与SV不同,外泌体的生物发生过程与内容物装载是同步进行的,且内容物可以通过ESCRT依赖或非依赖的途径主动或被动地转移到ILVs中。在ESCRT途径中,如前所述,ESCRT-0与泛素化的待分选蛋白结合,并与ESCRT-I、II、III形成ESCRT复合物,介导ILVs内的蛋白质装载和囊泡出芽过程[7]。除主动装载外,MVBs膜上的四跨膜蛋白家族还可以与其他蛋白质互相作用,促进后者以不依赖于ESCRT的方式被动装载到ILVs中。例如有研究发现,金属蛋白酶CD10可以通过与CD9结合而被分选进入外泌体中,起到调节细胞外基质微环境的作用[39]。此外,一些具有特定基序的miRNA可以通过与分选入ILVs中的RNA结合蛋白,如AGO2的结合被选择性地装载到外泌体中分泌[40]。
2.3 神经外泌体与突触囊泡释放的异同
外泌体的释放主要取决于MVBs与突触前膜的融合,这个过程同所有膜泡靶向运输一样需要可溶性NSF连接蛋白受体(soluble NSF attachment protein receptor,SNARE)的参与[21]。研究发现,神经外泌体与SV的释放过程存在一些相似之处:SV表面的v-SNARE蛋白synaptobrevin[21]和MVB表面的v-SNARE蛋白cellubrevin[41]均通过与突触前膜上的t-SNARE蛋白(包括syntaxin和SNAP家族)形成SNARE复合物,从而将囊泡锚定在突触前膜处并促进膜融合而释放内容物[42-43]。在MVB靶向运输和突触前膜锚定的过程中,Rab GTPases(如Rab11、Rab27、Rab35和其他Rab家族成员)也起到了重要作用[19-20]。此外,正如SV膜上存在的突触结合蛋白(synaptotagmin)作为“Ca2+传感器”在诱导SNARE复合物解锁和SV释放过程发挥调控作用,使SV的量子式释放依赖于动作电位传导引发突触前膜处产生的Ca2+内流[44],神经细胞内的MVB膜上也同样存在着突触结合蛋白synaptotagmin-7作为“Ca2+传感器”触发MVB与质膜融合[45],从而释放神经外泌体。此前的研究表明,阻断神经元质膜上的离子型谷氨酸受体(如AMPA受体和NMDA受体)会抑制神经元外泌体的释放[4],这也印证了神经外泌体的释放是受到突触内Ca2+浓度调控的过程。
综上所述,神经外泌体的释放和SV与突触前膜的融合都依赖于轴突的电生理活动和Ca2+的释放,但神经外泌体是以囊泡形式存在于胞外且释放和作用的范围更加广泛。相比之下SV则是特化的、专一于突触接头处的“电-化学-电”信号转换过程且仅存在于突触前膜胞内的一种囊泡结构。
3 神经外泌体的功能
在中枢神经系统中存在着两类信号传递方式:布线传递(wiring transmission)和容积传递(volume transmission)。其中布线传递是细胞与细胞间点对点的精确联系,常通过化学突触或电突触的形式建立,神经元外泌体也在其中发挥了有限的作用。而容积传递是一种突触外渗漏的传递系统,以脑脊液或细胞外基质为媒介进行的远距离、弥散性的信息传递方式,其中神经元及神经胶质细胞的外泌体发挥了主要且关键作用[46]。
在信息或物质传递过程中,外泌体可以通过3种方式与受体细胞相互作用[47]:a. 通过与靶细胞质膜结合,激活特定的信号转导过程;b. 通过受体介导的内吞途径重新回到作为周转“枢纽”的胞内体,走向被溶酶体降解或与胞内体膜融合而释放内容物的命运;c. 外泌体直接与靶细胞质膜发生融合,释放蛋白质或核酸内容物进入胞质发挥调节功能。
神经外泌体的释放和作用范围广泛,其功能也十分多样。神经外泌体可以像传统神经递质那样介导神经冲动的传递,也可以通过外泌体膜和腔内装载的各种蛋白质或mRNA及miRNA货物介导细胞间传递信息或调节细胞生理状态。神经外泌体还在神经损伤、神经再生及神经退行性疾病等病理过程中发挥了重要作用。接下来将就神经外泌体这些方面的功能展开综述。
3.1 神经元外泌体介导的神经冲动传递
SV内的神经递质依种类和受体类型与分布的不同,可以直接与突触后膜的离子型受体(ionotropic receptor)结合调节离子跨膜流动,或与代谢型受体(metabotropic receptor)结合并通过激活信号转导产生胞内第二信使间接影响离子通道。目前的证据表明,神经元外泌体可以通过激活代谢型而非离子型受体介导突触后膜的电生理反应,并可能在其间扮演着“非经典神经递质”的作用[48]。我们认为这与外泌体的结构和组成成分是相关的:能够激活离子型受体的神经递质往往是乙酰胆碱、氨基酸或胺类等水溶性小分子物质,外泌体的脂双层膜性囊泡结构决定了这些分子只可能装载于外泌体腔内,而研究发现神经肽类神经递质具有能够与膜脂结合的特性[49],因此有可能通过结合在外泌体膜上并激活突触后膜的代谢型受体来引发较为持久的突触后反应。
本文以神经肽递质为例,提出一种通过外泌体介导的突触间信号传递的机制模型:先前释放的神经肽类递质可能会部分地与突触前膜表面结合并经内吞作用转移至胞内体,最后重新出现在新生ILVs(外泌体)膜的外表面。当突触接收到轴突传导来的电位信号后,这些神经元外泌体以Ca2+依赖的方式从突触前膜大量释放,其表面可能存在的神经肽类递质或其他可激活G蛋白偶联受体(G protein-coupled receptors,GPCRs)的配体分子便可以通过与神经元外泌体共分泌的方式结合并活化突触后膜上的相应代谢型受体,并通过激活G蛋白直接与离子通道作用产生兴奋或抑制性突触后电位,或通过第二信使及其下游的信号通路来介导如调节突触后膜受体数量、改变离子通道状态或诱导神经元内基因表达等长时程的反应。
3.2 神经外泌体的神经调质样功能
3.2.1 神经元外泌体的调质样功能
神经元分泌的神经外泌体除了可以引发突触后膜的电生理反应外,还可以通过膜结合激活信号传导或膜融合释放内容物进入上游或下游神经元的胞质发挥类似神经调质的功能。其中,外泌体介导的Syt4跨突触传递可增强突触的生长和突触前膜递质的释放[50],而AMPA型谷氨酸受体亚基的转运则可进一步促进接受外泌体的神经元兴奋性的增强[4],神经元释放的外泌体携带的Wnt配体也可以补充激活Wnt信号通路,从而帮助调节突触组装、神经递质释放和突触的重塑过程[51]。此外,近年来有几项研究同时表明,在果蝇或如小鼠、人类等哺乳动物的神经元外泌体中含有的细胞骨架调节蛋白(activity regulated cytoskeleton associated protein,Arc)可以通过自组装形成病毒衣壳样的结构并封装编码自身蛋白的ARCmRNA或非特异性地封装其他胞内的高丰度mRNA,并跨越突触接头在细胞之间进行运输,以介导突触成熟和活性依赖的突触可塑性调节过程[52-53](图3)。
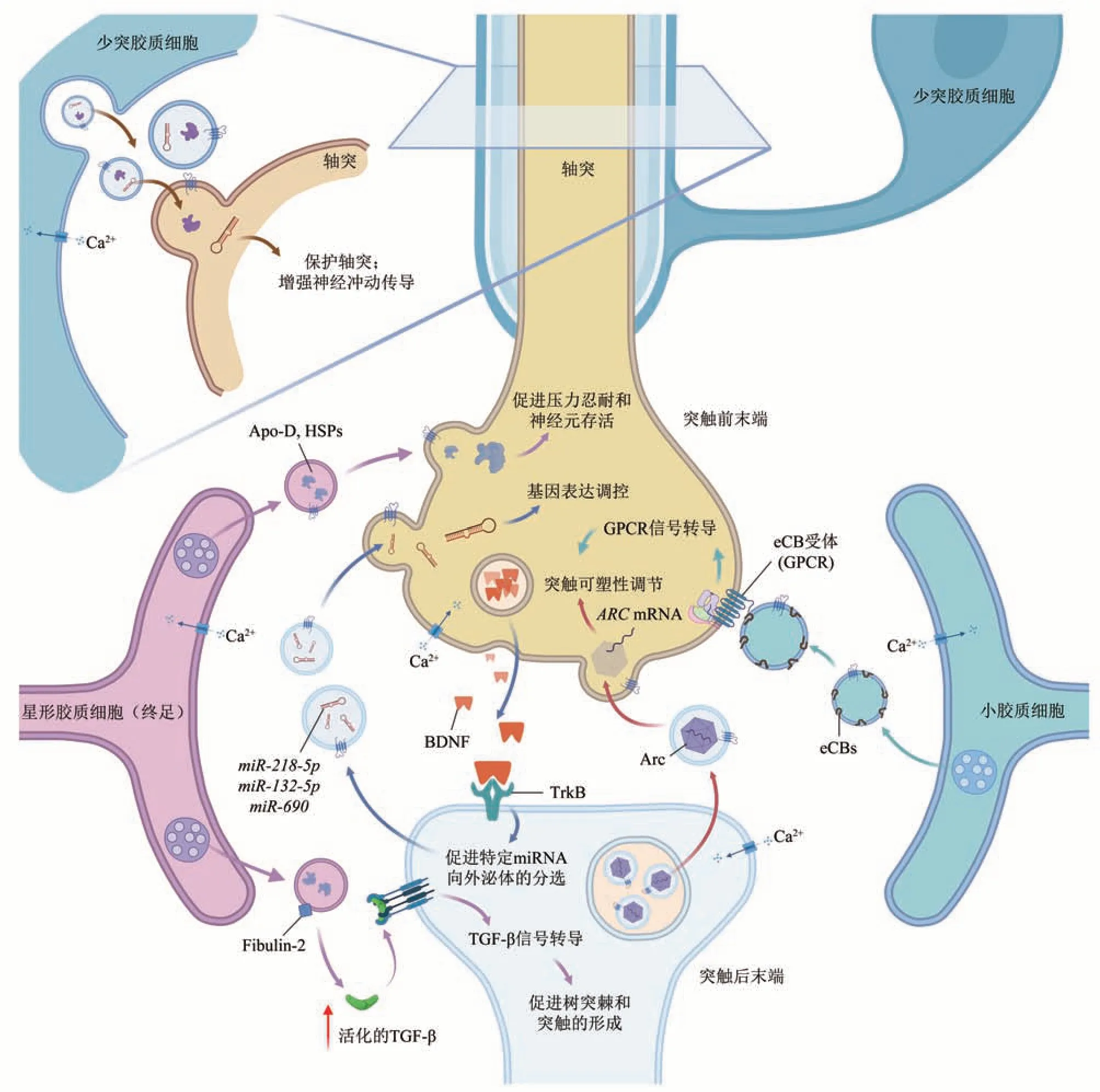
Fig.3 Summary of neuromodulator-like function of glial exosomes图3 神经胶质细胞外泌体的神经调质样功能总结
3.2.2 神经胶质细胞外泌体的调质样功能
神经胶质细胞分泌的外泌体主要对神经元或中枢神经系统内的其他胶质细胞起到支持和调节作用(图3)。星形胶质细胞(astrocyte)是中枢神经系统中分布最多且最普遍的胶质细胞类型,是中枢神经系统微环境的主要调节者和重要组成部分。星形胶质细胞在生理条件下分泌的外泌体表面携带的fibulin-2蛋白可以通过介导激活神经元中的TGF-β信号通路促进树突棘和突触的形成[54]。而在病理状态下,星形胶质细胞分泌的外泌体中包含的载脂蛋白D(Apo-D)和热休克蛋白(HSPs)可在神经元遭受氧化应激等不利于自身条件的状况时,起到保护神经元的作用:Apo-D可以促进细胞存活并保护神经元功能的完整性[55];HSPs除了通过发挥分子伴侣作用稳定未折叠蛋白并促进错误折叠蛋白降解来维持细胞内环境的稳定外,还可能通过与一些促凋亡蛋白结合,从而破坏凋亡复合物的形成以抑制细胞凋亡[56]。在神经元过度激活或氧化应激的情况下,星形胶质细胞分泌的外泌体表面会携带synapsin I膜蛋白,并通过调节神经胶质细胞和神经元之间的相互作用来促进神经突的生长和神经元存活[57]。此外,一项新的研究表明,星形胶质细胞分泌的外泌体还可以通过激活Nrf2信号通路来减少氧化应激和外伤性脑损伤(traumatic brain injuries,TBI)所诱导的神经元凋亡[58],对中枢神经系统起到保护作用。
小胶质细胞(microglia)分泌的外泌体膜表面携带并富集N-花生四烯酰乙醇胺和2-花生四烯酰甘油等内源性大麻素(eCBs),以帮助这些脂溶性信号分子更好地在胞外的水溶性环境中扩散,并作用于靶细胞表面的相应eCB受体来抑制突触前膜释放γ氨基丁酸或谷氨酸神经递质,从而改变兴奋性突触的密度和强度,调节突触活动和可塑性[59]。此外,小胶质细胞外泌体还在神经退行性疾病的发生和发展中起到了重要作用,这将在下一节进行综述。
少突胶质细胞(oligodendrocyte)分泌的外泌体主要参与对神经元轴突的营养、保护及神经冲动的增强。研究发现少突胶质细胞分泌的外泌体可以被神经元摄取并产生多种效应,如增加动作电位产生的频率,保护神经元免受氧化应激和饥饿并维持该条件下神经元轴突的运输能力等功能[60-61]。
3.3 神经外泌体与神经系统疾病
3.3.1 外泌体促进神经退行性疾病中的作用
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的一类与年龄相关的神经退行性病变,其病理特征主要是β淀粉样蛋白(amyloid β-protein,Aβ)导致的淀粉样斑块沉积和Tau蛋白过度磷酸化导致的神经原纤维缠结。有研究发现,淀粉样前体蛋白(amyloid precursor protein,APP)及其加工产物和Aβ蛋白可以通过神经元外泌体分泌至胞外[62-63],且外泌体中上述蛋白质的丰度与其在大脑中的含量呈正相关[64]。研究发现,抑制AD模型小鼠脑中神经元外泌体的分泌可以显著减少淀粉样斑块的出现[65-66],这表明异常的神经元释放的外泌体可以作为毒性蛋白Aβ蛋白运输的载体促进其在脑组织中的扩散分布[67],或通过类似朊病毒的“播种”作用[68]来启动Aβ聚集物的形成从而促进淀粉样斑块的形成和AD的发展。此外,还有研究发现,Aβ蛋白可以刺激星形胶质细胞分泌富含神经酰胺和前列腺凋亡反应蛋白4(proapoptotic ceramide and prostate apoptosis response 4,PAR-4)的外泌体,并通过诱导附近胶质细胞的凋亡来促进AD的发展[69]。不过也有研究发现,富含鞘糖脂的外泌体可以通过捕获脑内的Aβ蛋白并通过小胶质细胞的摄取清除来减轻对细胞的毒害作用[70],显示出这些神经外泌体在延缓AD病程进展方面也存在着一定程度上的积极作用。Tau蛋白与外泌体的作用关系与Aβ相似,研究发现,小胶质细胞可以通过对受损神经元的吞噬作用和外泌体的分泌来促进异常Tau蛋白在神经元之间的传播[71],而通过消耗小胶质细胞或抑制外泌体分泌可以显著抑制异常Tau蛋白的传播[72],这提示小胶质细胞神经外泌体的分泌调控或许可以作为AD治疗中一个重要的新靶点。
帕金森病(Parkinson’s disease,PD)也是一种常见的神经退行性疾病,其主要的病理特征是α突触核蛋白(α-synuclein,α-syn)在神经元中的异常积累和聚集形成包涵体(路易小体)。研究发现,异常的神经元可以释放含有α-syn寡聚物的外泌体[73-74],导致这些错误折叠的蛋白质聚集体在神经元间广泛传播扩散,可能在促进PD发生和诱导大面积神经元死亡方面起到了关键的作用。之前的研究已经表明,小胶质细胞在PD等神经退行性疾病中起到了复杂的调控作用:一方面通过吞噬死亡的神经元清除错误折叠的α-syn聚集体以维持多巴胺能神经元的正常存活,另一方面其过度的激活和慢性增生也可以引发脑部的炎症应激反应进一步诱导神经元的损伤和死亡[75]。最近一项研究发现,小胶质细胞分泌的外泌体也在促进PD发生过程中起到了重要的作用,即小胶质细胞分泌的CD11b+外泌体中存在着α-syn寡聚物,当这类外泌体被神经元摄取时可以显著诱导受体神经元内发生α-syn的聚集并导致神经元的变性[76]。
关于外泌体与神经退行性疾病的发生和发展的研究还存在着许多尚未解决的问题,例如神经外泌体是通过何种机制分选富集Aβ、Tau蛋白和α-syn寡聚物分子?含有这些异常成分的神经外泌体在疾病的发生、发展和转归方面还通过何种方式发挥了哪些积极或消极的作用?除上述内容物外,外泌体中还有哪些内容物参与到了神经系统退行性疾病的发生和发展?相信这些问题的深入研究和解决将会为神经退行性疾病的预防和治疗提供新的思路和作用靶点,也将进一步推动神经外泌体相关领域的研究。
3.3.2 外泌体与抑郁症发生的相关性
抑郁症是一种情绪障碍性精神疾病,对人类的身心健康具有严重的危害。最近的研究发现外泌体在抑郁症的发生和发展中发挥了关键的作用,这为研究抑郁症的发生和抑郁症的临床治疗提供了全新的角度和作用靶点。
研究发现,富含神经酰胺的外泌体可在应激时通过中性鞘磷脂酶2(sphingomyelinase 2)作用大量释放到血浆中,并通过抑制海马中磷脂酶D的活性降低海马中的磷脂酸含量,进而介导应激诱导的抑郁症的发生[77-78]。此外,外泌体中的miRNA内容物也在抑郁症的发生和发展中发挥着重要功能,研究表明外泌体来源的miR-139-5p丰度上调可能通过负调节神经元分化抑制了海马神经元的发生并诱导了应激状态下抑郁症的发生[79-80],该研究还发现来源于重度抑郁患者的外泌体经尾静脉注射可诱导健康小鼠产生抑郁样行为[79],这进一步说明诱导抑郁的相关因子可以借助外泌体进行传递和扩散。
最新一项研究指出,脑源性神经营养因子(brain derived neurotrophic factor, BDNF)可通过突触释放诱导下游神经元上调miR-218-5p、miR-132-5p和miR-690在外泌体中的分选富集[81],这种BDNF诱导的外泌体可以上调受体神经元中有关神经发育、胆固醇合成和轴突引导相关的基因,同时下调突触发生负调节因子等基因,这对于神经元突触活性增强和密度增加、树突形成以及神经环路的建立与维护等过程至关重要。本课题组发现,其中的miR-132和miR-218与抑郁样行为的发生和调节关系密切:有研究表明慢性的轻度压力能够下调甲基化CpG结合蛋白2(methyl-CpG binding protein 2,MeCP2)和BDNF的表达并增加miR-132的表达水平[82],临床和相关实验也表明,miR-132的高水平表达与抑郁症的发生密切相关[82-84];而miR-218被发现可以调控个体对压力的易感程度且与抑郁样行为呈负相关关系[85-87],前额叶皮层中miR-218的下调会导致小鼠更容易诱发抑郁样行为,而miR-218的过表达则可以防止因应激诱导的神经元形态学改变,促进抑郁样行为的恢复。
综上所述,我们猜想BDNF诱导的外泌体可能在抑郁症的易感性调节中发挥了一定的作用。此外,也提出以下问题:慢性的轻度压力所引起的BDNF表达下调是否会降低受其诱导的外泌体对miR-218-5p、miR-132-5p和miR-690的分选富集?这种机制的削弱或丧失是否在抑郁症的发生和发展中发挥作用?希望以上这些问题能够在后续的研究中得到解答。
4 外泌体在中枢神经系统疾病诊断和靶向治疗方面的应用
4.1 神经外泌体与中枢神经系统疾病的诊断
神经外泌体参与了多种神经退行性疾病的发生和进展,其中包含的一些标志性蛋白质或miRNA内容物可以灵敏地反映中枢神经系统中外泌体来源的亲本细胞的病理状态。更重要的是,研究表明,外泌体可以通过脑微血管内皮的转胞吞作用(transcytosis)而跨越血脑屏障(blood-brain barrier,BBB)[88]分布于外周体液。例如,有研究发现,血浆神经源性外泌体中溶酶体相关膜蛋白1(LAMP-1)和组织蛋白酶D(cathepsin D)的水平升高与AD的发生有着显著的相关性[89],也有研究通过检测血浆中神经元外泌体所含的α-syn寡聚物来进行PD的早期诊断或作为PD进展的预后标志物[90]。上述特点和相关研究表明,外周血中含有的神经源性外泌体能够与中枢神经系统的组织细胞状态具有强烈的相关性。因此,通过提取外周血中的外泌体并对其包含的miR-125b-5p、miR-19b、miR-454-3p等标志性miRNA[91-92]使用微阵列(microarrays)或逆转录PCR(reverse transcriptionpolymerase chain reaction,RT-PCR)进行检测[91],或对其中包含的Aβ、α‑syn、L1CAM、TIMP-1等蛋白质标志物通过免疫沉淀(immunoprecipitation,IP)或ELISA进行检测[93],可对PD[94]、AD[95-96]等中枢神经系统的退行性疾病或神经胶质瘤[97]等肿瘤疾病进行早筛和诊断。关于这些神经系统疾病诊断中具体的外泌体检测指标及其效率的问题已经在相关文献中做了具体描述,详细内容可参考上述引用文献做进一步了解。总的来说,将外周血中存在的神经外泌体作为样本进行检测,其最大优点就在于可以绕开组织活检或外科干预手段可能存在的困难和风险,能够在降低成本的同时实现更加快捷而准确的诊断。
4.2 中枢神经系统疾病的外泌体靶向治疗
除了临床诊断外,由于外泌体具有较大的内容物装载能力和良好的组织相容性以及跨越BBB进入脑部组织的能力,有望利用工程化的外泌体作为一种全新的递送载体,通过主动或被动、直接或间接的方式向外泌体腔中装载治疗性的核酸、蛋白质或小分子化学药物,同时通过在外泌体标志膜蛋白的外侧修饰具有受体细胞靶向性的配体肽[98-99],以取代如腺相关病毒(adeno-associated virus,AAV)等病毒载体、纳米颗粒(nanoparticle)或脂质体(liposome),可以进行更高效、更安全的药物脑部靶向递送。在众多装载方法中,间接载药是最具潜力的方式之一。这种方法是通过对外泌体来源的亲本细胞进行工程化改造使分泌的外泌体自然携带具备治疗目的的药物分子,通过将外泌体标志性膜蛋白如PTGFRN、BASP1[32]或四跨膜蛋白如CD9[100]、CD63[101-102]与货物蛋白(这些蛋白质可以是激活免疫的配体分子如IL7、CD40L等[32],或RNA结合蛋白如HuR[100]、AGO2[103]、L7Ae[102]等)进行融合表达,能够显著提高外泌体对货物蛋白或治疗性RNA分子的特异性富集和装载能力。
目前的研究表明,以外泌体为递送载体的新型药物递送工具及靶向治疗方式有望为神经退行性疾病、抑郁症、脑部肿瘤等多种中枢神经系统疾病提供全新的且更加有效的临床治疗策略。例如:装载有神经生长因子(nerve growth factor,NGF)并修饰RVG配体肽的工程化外泌体可以特异性靶向发生缺血性脑卒中(cerebral ischemic stroke)的受损大脑皮层,通过NGF的作用减轻脑卒中后的炎症反应并促进神经元存活[104];通过超声波共孵育方法装载槲皮素(quercetin,Que)的血浆外泌体施用后可以跨越血脑屏障靶向大脑,通过抑制细胞周期蛋白依赖性激酶5(cyclin-dependent kinase 5,CDK5)介导的Tau磷酸化过程减少神经原纤维缠结的形成而有效缓解AD的临床症状[105];通过间接载药方式装载有过氧化氢酶mRNA的工程化外泌体靶向脑部的递送能够有效缓解PD引起的神经炎症[102];向脑部递送装载有环状RNA分子circDYM的工程化外泌体可以通过小胶质细胞的摄取释放其内容物,并与受体细胞中的转录因子TAF1的结合导致下游靶基因表达降低,进而抑制小胶质细胞的异常活化,有效缓解抑郁样行为[106];施用表面修饰有c(RGDyK)环多肽并装载紫杉醇(paclitaxel,PTX)的胚胎干细胞来源的工程化外泌体能够显著提高PTX向脑部的靶向能力并改善其对胶质母细胞瘤的治疗效果[107]。
5 总结与展望
外泌体在发现早期被认为是一类细胞排泄代谢废物的方式。随着研究的深入,人们逐渐发现,外泌体是只有活细胞才能分泌的功能性亚细胞囊泡结构,它可以通过膜上存在的配体分子与靶细胞膜上受体相互作用,或通过其胞内携带的核酸及蛋白质内容物实现细胞间的物质和信息交流,来调节靶细胞的生理状态。如今,外泌体的发生机制已经基本厘清,但其调控过程仍存在许多未知。例如:细胞分泌释放外泌体的过程是否存在极性以及这种极性是如何控制的?细胞通过何种方式调节外泌体分泌的强度?细胞如何精确调控不同生理或病理状态下对于外泌体蛋白或核酸内容物的分选包装?随着多组学技术的发展和测序技术的迭代更新,这些问题有望得到进一步研究和解决。
从首次证明神经元具有分泌外泌体的功能到现在的十余年间,神经外泌体的发生、释放和功能得到了相对全面的研究。目前的研究表明,神经外泌体在发生、释放和功能方面与SV存在着许多相似和不同,因此将两者进行比较可以为人们更好地理解和研究神经外泌体的组成和功能提供新的视角和思路。近年来对于神经外泌体功能的研究表明,神经外泌体可以在化学突触接头的信号传导中发挥类似神经递质的作用,但最主要的还是通过容积传递(即突触外渗漏传递)的方式介导神经元与胶质细胞、胶质与胶质细胞间的互相作用。因此,对神经外泌体成分和分泌时空调节的进一步研究将有助于更好地理解神经外泌体在神经环路的建立、维持以及在中枢神经系统微环境调节方面的功能。
诸多证据和迹象表明,神经外泌体在众多神经系统疾病的发生和发展中发挥着重要的作用。因此,对于病理状态下神经外泌体特异性成分和功能的进一步研究将有助于人们寻找神经系统疾病治疗中的新靶点,同时也将为开发以血浆神经元源性外泌体为检测对象的更加准确灵敏的新型神经系统疾病诊断工具提供更多的思路。此外,随着靶向递送治疗方法的不断开发和应用,对外泌体进行工程化的改造和作为药物递送工具的相关研究也将进一步发掘以外泌体为载体的新型靶向递送工具的临床治疗潜力和应用价值。