基于上转换纳米材料的免疫检测技术应用*
2024-02-26黄惠威李丽华罗林沈玉栋雷红涛徐振林
黄惠威 李丽华 罗林 沈玉栋 雷红涛 徐振林**
(1)华南农业大学食品学院,广东省食品质量安全重点实验室,广州 510642;2)华南师范大学未来科技研究院,广州 510631)
免疫分析方法是指基于抗原抗体特异性结合建立的方法,主要检测与食品安全、人类健康和环境污染有关的小分子、大分子和病原体等目标物。与常规理化分析方法相比,免疫分析方法具有灵敏度好、特异性强、简单快捷、成本低、安全可靠和便于现场快速检测等优点[1-2],在医学、食品和环境等领域应用广泛。免疫分析方法与量子点、贵金属纳米颗粒和上转换纳米颗粒(upconversion nanoparticles,UCNPs)等信号增强材料结合可以显著降低检测限,提高灵敏度。UCNPs是由Bloembergen首次提出的一系列能将低能量的近红外光转化为高能量的紫外/可见光的发光纳米材料。与有机染料、量子点、荧光蛋白、金属复合物、半导体和贵金属纳米颗粒等传统纳米材料相比,UCNPs具有反斯托克斯位移宽、无自体荧光背景、组织穿透能力较强、生物低毒性和对样品损伤小等独特优势而引起广泛关注[3-5]。
UCNPs表面易修饰识别分子,具有高效的传感性能,常被设计为免疫检测传感器。构建UCNPs免疫检测传感器需要抗体、适配体、酶和有机分子等识别配体[6]。抗体对蛋白质、细胞或其他大分子物质具有高特异性,通常被修饰在UCNPs表面,广泛应用于医学、食品、环境等免疫检测领域。常见的抗体包括单克隆抗体和多克隆抗体,抗原结合片段、纳米抗体和单链抗体等基因工程抗体近几年也被修饰在UCNPs表面,但应用相对较少[7]。基因工程抗体具有高亲和力、高表达量、高稳定性以及较低生产成本等优点[8],有望成为下一代抗体识别配体。基于UCNPs的免疫检测传感器由于成本较低、灵敏度高、特异性强和操作简便等优势具备巨大潜力[9],主要的应用研究有荧光共振能量转移(fluorescence resonance energy transfer,FRET)、内滤效应(inner filter effect,IFE)、磁分离技术、上转化连接免疫吸附技术(upconversion-linked immunosorbent assay,ULISA)和上转换免疫层析技术。
本文简要介绍UCNPs的发光机制,阐述UCNPs的合成和表面修饰方法,重点综述基于UCNPs的免疫检测技术并对该技术所面临的挑战和前景进行总结和展望。
1 稀土元素掺杂的UCNPs发光机制
上转换发光一般是发生在有机或无机材料中,通过不同机制吸收两个或多个光子并发射比激发波长短的光的反斯托克斯发光过程[10]。上转换发光材料采用低频率(如近红外光)光子激发,而低频率光具有组织穿透性强、对生物组织低损伤和降低背景荧光干扰等优势,因此上转换发光材料广泛应用于生物医学、食品和环境检测等领域。稀土元素掺杂的UCNPs通常由敏化剂(Yb3+)、激活剂(Er3+、Ho3+、Nd3+和Tm3+等)和无机晶体基质构成[11],可能存在激发态吸收、能量转移上转换、光子雪崩、合作敏化上转换、合作上转换、交叉弛豫、能量迁移上转换和能量级联上转换8种上转换发光机制[12](图1)。本文将简述3种常见的上转换发光机制:激发态吸收、能量转移上转换和光子雪崩。激发态吸收是UCNPs最主要的发光机制,由单个Ln3+活性离子连续吸收两个低能光子,使激发态E2发生上转换发光,激发态E1的稳定性则决定了上转换发射效率,激发态E1越稳定上转换发光效率越高。除了连续吸收双光子模型的激发态吸收,连续离子间的能量转移也会产生高效的上转换发光。能量转移上转换发生在激发态E1的敏化剂离子和激活剂离子中。激活剂离子吸收敏化剂离子转移的能量后使敏化剂离子回到基态,而激活剂离子提升到激发态E2,实现高效的上转换发光。光子雪崩是由激发态吸收与交叉弛豫结合产生的一个环形过程。低激光功率下,离子2的激发态E1显示低效激发态吸收;高激光功率下,高效激发态吸收增加了离子2的激发态E2群体,因此离子2和离子1之间会发生高效的交叉弛豫。之后离子1将能量转移到离子2的E1态,形成完整循环。循环过程中基态的单个离子最终会生成两个离子,两个离子跃迁至E1态,像雪崩一样以指数方式产生离子,持续上转换发光。稀土元素掺杂的UCNPs可以提高上转换发光效率或强度,具有较长的能级寿命,因此具有较优越的发光性能。

Fig.1 Simplified energy level diagram of the upconversion luminescence mechanism图1 上转换发光机制简化能级图
2 UCNPs合成方法
UCNPs的尺寸、形状、晶体结构和单分散性等因素受合成方法的影响[13],因此选择合适的合成方法对提高上转换发光效率,探索其化学和光学性能以及在不同领域的潜在应用至关重要[14]。UCNPs的合成方法主要包括共沉淀法[15-17]、热分解法[18-20]、水热(溶剂热)法[21-24]、溶胶-凝胶法[25-27]、微乳法[28]和燃烧法[29-32]等,下面简述3种最常见的UCNPs合成方法:共沉淀法、热分解法和水热法。3种合成方法的优缺点对比如表1所示,期待研究人员未来能够取长补短,改善技术短板,促进UCNPs合成方法的发展。

Table 1 Advantages and disadvantages of commonly methods for the preparation of UCNPs表1 合成UCNPs的常用方法的优缺点
共沉淀法一般包括混合物形成、成核生长、沉淀、过滤和煅烧5个步骤,是将沉淀剂加入可溶性盐溶液,溶液中的全部不溶物被析出,再把不溶物进行洗涤、干燥和退火等处理得到所需材料[33]。由于共沉淀法具有简单、环保、低成本和高回收率等优点,在工业应用中是最有前景的合成方法之一[34-35]。但该方法常因为沉淀剂或其他离子局部浓度过高造成尺寸不均和形貌差异等问题,而且高温煅烧过程增加了实验风险,限制了该方法的广泛应用。因此常添加聚乙烯吡咯、聚乙烯亚胺或乙二胺四乙酸等稳定剂使沉淀物发生配位化合反应[36-37]控制UCNPs高效生长。
热分解法又称热解法,在无水厌氧环境添加油酸和十八烯等常用的高沸点有机溶剂制备稀土有机化合前体物,进而在短时间内合成尺寸和形状可控,单分散性好且发光效率高的油溶性UCNPs。但该方法存在反应温度高、反应时间长、需无水厌氧环境、成本高、风险高、会产生毒物和污染环境等缺点,因此期待研究人员未来改善这些技术短板,促进该方法的更广泛应用[6]。
与可以仅使用高沸点有机溶剂的热分解法相比,水热法是以水溶液为基础的一种著名合成方法,反应温度较低和对环境较友好。水热法是在水溶液中混合HF、NH4F、NaF、KF和NH4HF2等氟化物、氯化物、硝酸盐和氧化物等廉价的前体,密封后转移到高压灭菌器中加热到熔点或高于熔点合成UCNPs。水热法可通过调控反应时间、温度、介质pH值和反应物浓度等反应参数,控制UCNPs的形状、大小和晶体结构[38]。但该方法合成的UCNPs尺寸一般较大会影响灵敏度,且处于密闭环境,不便观测UCNPs晶体的生长。
3 UCNPs表面修饰方法
UCNPs合成方法不同会产生不同的表面特性造成表面修饰基团和修饰方法不同,修饰基团的差异则会影响修饰功能和表面识别配体的修饰效率。表面亲水性修饰和表面靶向性修饰是UCNPs的两大基本表面修饰方法[50]。表面亲水性修饰对提高疏水性配体覆盖的UCNPs偶联识别配体能力,进而高特异性结合目标物具有十分重要的意义。本文将详细阐述6种常用的表面亲水性修饰方法(图2),分别是配体交换法、配体去除法、配体氧化法、表面硅烷化法、两亲聚合物涂层法、逐层组装法。

Fig.2 Simplified surface hydrophilic modification method图2 简化的表面亲水性修饰方法图
3.1 配体交换法
UCNPs最常用的合成溶剂油酸[51]和油胺[52]会使其表面覆盖一层疏水基团,难以分散于水中。配体交换法属于最常用的修饰方法之一,是将UCNPs表面疏水基团替换成亲水基团,帮助改善亲水性。常用的亲水性配体有聚丙烯酸[53]、聚乙二醇[54]、聚乙烯吡咯烷酮[55]、聚乙二醇磷酸酯[56]、柠檬酸[57]、巯基癸酸[58]、巯基丙酸[59]、己二酸[60]、3-二巯基丁二酸[61]、聚酰胺胺[62]、葡聚糖[63]、壳聚糖[64]等。配体附带的功能团不仅会增强UCNPs亲水性,改善生物相容性,而且会极大提高识别配体的偶联率。但是小分子层的覆盖会增加颗粒厚度,降低UCNPs的发光性能,造成免疫检测灵敏度的降低。
3.2 配体去除法
与配体交换法相比,配体去除法会减少粒径或粒径增加较少,是一种简单、高效、低成本的UCNPs表面修饰方法[65]。为了去除表面疏水性配体,一般使用酸或乙醇进行搅拌或超声。但处理结束后的UCNPs易聚集,需要通过含有羟基、羧基、氨基和巯基等基团的水溶性新配体进行表面修饰。新配体能够直接附着在表面,能够很好偶联识别配体,获得特异性强、高质量和水溶性好的UCNPs传感器[66],对UCNPs免疫检测技术具有十分重要的意义。
3.3 配体氧化法
与其他表面修饰方法相比,配体氧化法对UCNPs的形态、相位、组成和发光性能不会产生明显影响,能够直接修饰生物分子。配体氧化法是利用强氧化剂选择性地将表面疏水性配体的碳碳双键氧化成亲水性羧基,成功解决UCNPs疏水性问题。Chen等[67]首次使用Lemieux-von Rudloff试剂将表面油酸配体氧化为壬二酸,表面存在的羧基,使UCNPs易于在水中分散且有助于生物分子的修饰,大幅度提高检测技术灵敏度和特异性。但该方法氧化反应时间长、产量低、易于聚集,仅适用未被氧化和表面含有碳碳双键的UCNPs,因此限制了该方法的广泛使用。
3.4 表面硅烷化法
表面硅烷化法是一种在UCNPs上覆盖硅壳隔绝水,防止发射猝灭的表面修饰方法,使UCNPs具有高亲水性、高透光性、低毒性、易功能化、良好的生物相容性等优点[68]。Stöber法[69]和反向微乳法[70]是两种常见的硅烷化方法,两种方法使用的试剂不同。Stöber法使用硅酸四乙酯、氨和乙醇发生化学反应,硅酸四乙酯在水解作用下会均匀的覆盖在UCNPs的表面形成二氧化硅层。反向微乳法则是利用硅酸四乙酯、氨、环己烷和表面活性剂发生化学反应,使二氧化硅均匀生长在疏水性UCNPs表面。但是二氧化硅包裹的颗粒容易聚集,影响颗粒溶解度和分散性,因此需要修改表面亲水基团,提高颗粒稳定性,进一步提高UCNPs-生物分子复合物偶联率。而且二氧化硅在水溶液的稳定性较差和增加UCNPs粒径,从而降低免疫检测技术的灵敏度,因此控制二氧化硅层的厚度从而控制复合物颗粒的粒径尺寸。
3.5 两亲聚合物涂层法
与表面硅烷化法相比,两亲聚合物涂层法不仅极大提高了UCNPs的亲水性,而且提高了UCNPs在水溶液中的单分散性和稳定性[71]。该方法是通过疏水相互作用使两亲聚合物的疏水端与UCNPs表面的疏水性配体结合,从而暴露亲水端。常见的两亲聚合物有聚己内酯-聚乙烯聚乙二醇、聚丙交酯-聚(乙二醇)、6-氨基己酸、聚(甲基丙烯酸-共十八烯)、聚(苯乙烯-顺丁烯二酸酐)等[72-74]。但是两亲聚合物一般难以制造和提纯,会增加成本和粒径,不利于建立免疫检测技术,因此需要科研人员未来改善该方法劣势,促进基于UCNPs的免疫检测技术的进步。
3.6 逐层组装法
逐层组装法是指不同电荷的聚合物分子间会相互吸引,然后自组装到UCNPs表面,具有操作简单、尺寸和形状可控等优点。但一些聚合电解质浓度会影响多层聚合物的形成和增加UCNPs厚度,例如依靠静电吸附作用力形成的逐层自组装颗粒在复杂样本中可能出现分子脱附造成修饰结构不稳定,因此与其他方法相比,逐层组装法应用较少。
4 基于UCNPs的免疫检测技术
通过掺杂不同的稀土元素可以调整UCNPs的发光性能。但是UCNPs需要实现高效的传感性能,表面需要进行生物功能性修饰,连接识别配体。常用的UCNPs识别配体有抗体、适配体、有机分子、分子印迹聚合物、酶、共价有机框架和金属离子等。抗体一般是指受到抗原刺激后由免疫细胞产生的保护性蛋白,可对某一特定对象表现出高特异性,主要有多克隆抗体、单克隆抗体和基因工程抗体。单克隆抗体具有高纯度、高特异性、高效力等优点,是最常用的UCNPs传感器识别分子[75]。近几年基因工程抗体修饰在UCNPs表面的方法也在发展,有望成为下一代广泛应用的抗体识别配体。本文基于UCNPs的5种典型免疫检测技术进行了总结(图3),分别是FRET、磁分离技术、ULISA、IFE和上转换免疫层析技术。

Fig.3 Strategies for the construction of upconversion based sensors图3 基于上转换传感器的构造策略
4.1 基于UCNPs的FRET
上转换免疫检测传感器的研究大部分是基于FRET原理。FRET是一种均相分析检测技术[76],指通过静电偶极-偶极相互作用将供体荧光体的能量转移到受体荧光体的非辐射性能量转移过程[77]。一般UCNPs作为能量供体,荧光染料、碳纳米材料、贵金属纳米材料和半导体纳米材料等作为能量受体。只有供体与受体距离足够近且供体发射光谱与受体吸收光谱重叠时才可以发生FRET[78]。Li等[79]首次基于特制的UCNPs和金纳米颗粒之间的FRET效应,开发了一种超快速、灵敏、现场检测严重急性呼吸综合征冠状病毒2(SARS-CoV-2)刺突蛋白的定性定量方法,检测限(LOD)低至1.06 pg/L,线性检测范围为2~32 pg/L。所建立方法优于以往报道的即时生物传感器,为未来的现场快速病毒筛查和即时诊断铺平了新的道路。更关键是这种设计可以扩展到其他抗原、抗体和蛋白质的检测(表2)。目前也有一些研究基于抗原结合片段、纳米抗体和单链抗体等基因工程抗体建立FRET,该技术的进步将为各种生物分析应用开辟新途径,包括检测蛋白质生物标记物、激素、滥用药物、食物和环境毒素等[80]。基于FRET的一步免疫分析适用于非专业终端用户,为开发用户友好、可靠的现场检测奠定良好基础。但传统的FRET方法无法实现高通量检测,因此Shan等[81]设计了一种基于均质FRET的酶联免疫吸附试验,它不仅具有相当简单的样品预处理操作和简单的一步孵化操作,而且具有灵敏度十分高和高通量的样品检测能力,检测速度快,可在35 min内检测出96孔板中的猪流行性腹泻病毒,检测限低至TCID50(组织培养感染剂量中位数)104/L,比胶体金试纸免疫检测技术的灵敏度高10倍。通过验证临床样品,也证明该方法准确性高、重复性高和特异性良好。该方法可很好用于现场检测,为猪流行性腹泻病毒的多样本现场检测提供了一种有前途的方法,在猪业领域具有巨大潜力。虽然基于FRET的酶联免疫吸附方法可以很好用于快速筛选和高通量检测,但由于该方法背景信号相对较高导致灵敏度有限,为了获得更高的灵敏度,未来可将单分子技术与FRET免疫分析法相结合,特别是可现场实施的技术,从而大幅度减少背景值,显著提高灵敏度。
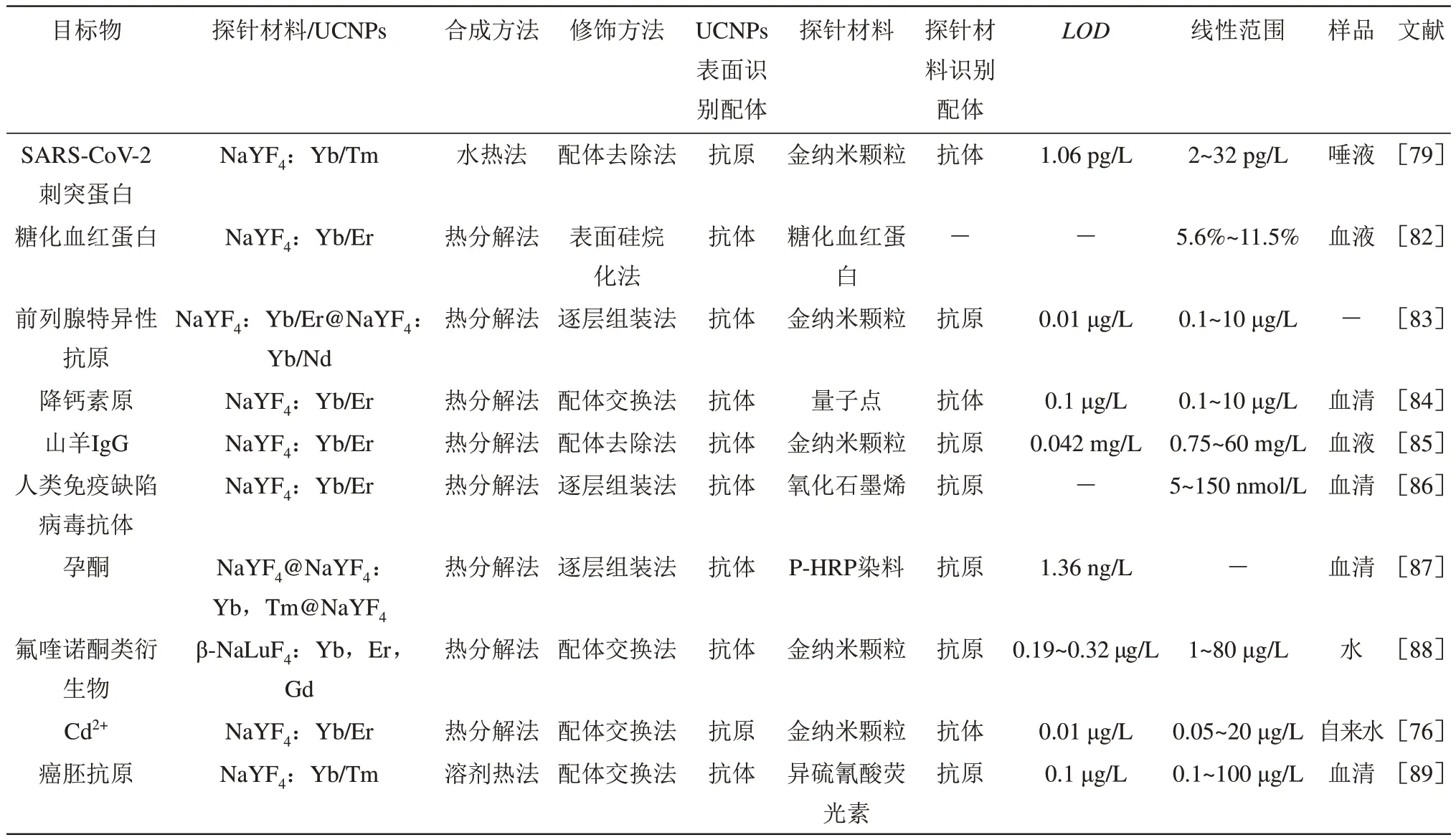
Table 2 Summary of the application of the FRET immunoassay sensor based on UCNPs表2 基于UCNPs的FRET免疫检测传感器的应用总结
4.2 基于UCNPs的IFE
IFE与FRET原理类似,供体激发和/或发射带和受体吸收带重叠时,可以猝灭荧光,但要求较低,供体受体间距离大于10 nm也会发生IFE,因此将荧光传感器探针功能化的复杂性降至最低。此外,因为没有新的化合物形成,在IFE过程中UCNPs的寿命不会改变[90]。Si等[91]基于抗体修饰的UCNPs和抗原修饰的金纳米颗粒间的IFE,建立了一种快速检测环境和食品样品中吡虫啉残留的灵敏均质免疫检测方法。LOD低至0.79 μg/L,恢复50%饱和信号的浓度(SC50)为18.7 μg/L,SC10~SC90的线性检测范围为1.39~335.81 μg/L。Chen等[92]采用同样的方法快速检测吡虫啉,SC50为4.3 μg/L,SC10~SC90的线性检测范围为0.47~21.37 μg/L,提高了灵敏度和改善了线性范围。上述高灵敏度的IFE方法是由传感器吸光度的变化转换为荧光强度的变化实现的,因此通过IFE对荧光变化的巧妙响应可应用于检测食品污染物,具有广阔的应用前景。IFE的出现大大拓宽了基于配体免疫检测技术的应用范围,而且要求相对较低。然而,IFE一般需要发生光化学反应,有机分子作为主要的识别配体,但这些分子大部分有毒性,所以迫切需要寻找更安全无毒或低毒的识别配体例如模拟表位肽检测食品和环境中的污染物。
4.3 基于UCNPs的磁分离技术
与FRET和IFE相比,磁分离没有改变光学特性,而是在外部磁场下实现UCNPs的富集或分散。磁分离免疫检测技术一般是以UCNPs和磁性纳米颗粒作为探针,当无目标分子时,UCNPs和磁性纳米颗粒通过识别配体偶联在一起,形成磁性纳米颗粒-识别配体-UCNPs夹心复合物,UCNPs被磁性纳米颗粒富集,导致溶液中的荧光减少;目标分子存在时会导致两种纳米颗粒分离,因此UCNPs没有被磁性纳米颗粒富集而被回收。磁性纳米颗粒作为新一代的吸附剂,具有磁性、低毒和生物相容性良好等优点[93],成为理想的生物分离和纯化材料[94],被广泛应用于食品检测[95-96]。磁分离技术与其他技术相比具有简单、高效、快速和灵敏等优点,成为快速检测食品和环境污染物的绝佳策略。基于磁性纳米颗粒的良好磁性,它在提高上转换传感器的特异性方面具有很大的潜力。Zhao等[97]在UCNPs上修饰拟除虫菊酯抗体,建立了一种检测拟除虫菊酯农药残留的上转换磁分离免疫分析方法,LOD均小于0.01 μg/L,回收率为83.4%~97.8%,表明该方法灵敏度高。上转换磁分离免疫荧光检测方法的建立,丰富了快速检测市场的技术手段,为拟除虫菊酯农药残留或其他农药残留的检测提供了理论支持。与酶联免疫吸附法相比,该方法准确度更高,灵敏度更好。与大型仪器检测法相比,该方法具有快速、方便、成本低的优点。但是磁分离技术需要高特异性的识别配体抗体,目前食品和环境污染物相应抗体较少,因此在未来研究中可开发更多目标物的抗体,也可通过研究目标物的特性开发出其他特异性好的识别配体。
4.4 基于UCNPs的ULISA
ULISA与酶联免疫吸附方法测定步骤相似,一抗固定在96孔板,二抗修饰UCNPs,目标物与一抗和二抗结合,在980 nm激光激发下产生的荧光信号反应了目标物浓度。但与传统酶联免疫吸附方法相比,ULISA灵敏度更好和检测范围更宽。这种利用UCNPs作为信号传感器的方法未来可能为探索酶联免疫吸附方法的临床应用开辟新道路。Hlaacek等[98]克服目前染色剂和荧光标记方法的缺点,使用链亲和素提高灵敏度,利用UCNPs建立模拟检测和数字检测两种综合ULISA法对前列腺特异性抗原进行检测,数字检测的LOD低至0.8 fmol/L,比传统荧光标签的信噪比高50倍。Makhneva等[99]采用链亲和素修饰的UCNPs建立ULISA法检测前列腺特异性抗原,LOD低至0.46 ng/L,结果表明UCNPs的使用可显著提高异质免疫分析灵敏度。Mickert等[100]采用链亲和素修饰的UCNPs建立模拟检测和数字检测两种综合ULISA法检测前列腺特异性抗原,数字检测比相应的模拟检测灵敏16倍,LOD低至23 pg/L。低浓度目标物采用数字检测会显著提高灵敏度,但该方法会受到泊松噪声影响,对高浓度目标物则需要进行模拟检测。与酶联免疫吸附方法相比,ULISA方法无需酶催化,缩短了检测时间,提高了灵敏度。此外,可进一步开发模拟表位肽或基因工程抗体修饰UCNPs,减少毒性和提高方法灵敏度,促进ULISA方法的发展。
4.5 上转换免疫层析技术
上转换免疫层析技术广泛应用于检测感染性细菌、病原体、病毒和食品中残留物以及肿瘤标志物等(表3)。上转换免疫层析技术一般是利用抗体修饰的UCNPs作为探针用于免疫层析的即时检测技术,具有简单、快速、低成本和易操作等独特优势[101]。相比传统的胶体金免疫层析技术,UCNPs具有光稳定性好和信噪比高的优势,使上转换免疫层析技术的灵敏度大幅度提高。但该方法无法通过颜色判读结果,需要外围设备分析实验结果,这些设备一般昂贵且笨重。Gong等[101]开发了一个小型化、便携式的定制设计的智能手机软件分析仪(UCNP-LFA分析仪)成功用于检测5种目标物(核酸、蛋白质、小分子、重金属离子和细菌),UCNP-LFAs平台的精度和准确度与胶体金标准方法相当,相关系数大于0.992,与临床临界值相比LOD降低至原来的1/5~1/10。UCNPs发光效率低、亲水性差和抗体连接效率低是应用于侧流免疫层析技术需要克服的挑战。Huang等[102]通过结合配体交换法和超分子自组装策略检测大肠杆菌和达诺沙星,成功解决上述问题,灵敏度提高40倍,检测范围扩大一个数量级,并将成本降低20%~40%。上转换免疫层析技术还广泛应用于同时检测两个或多个目标物,形成了多指标上转免疫层析技术,用于检测样品的各种分析物,具有很大的应用前景。
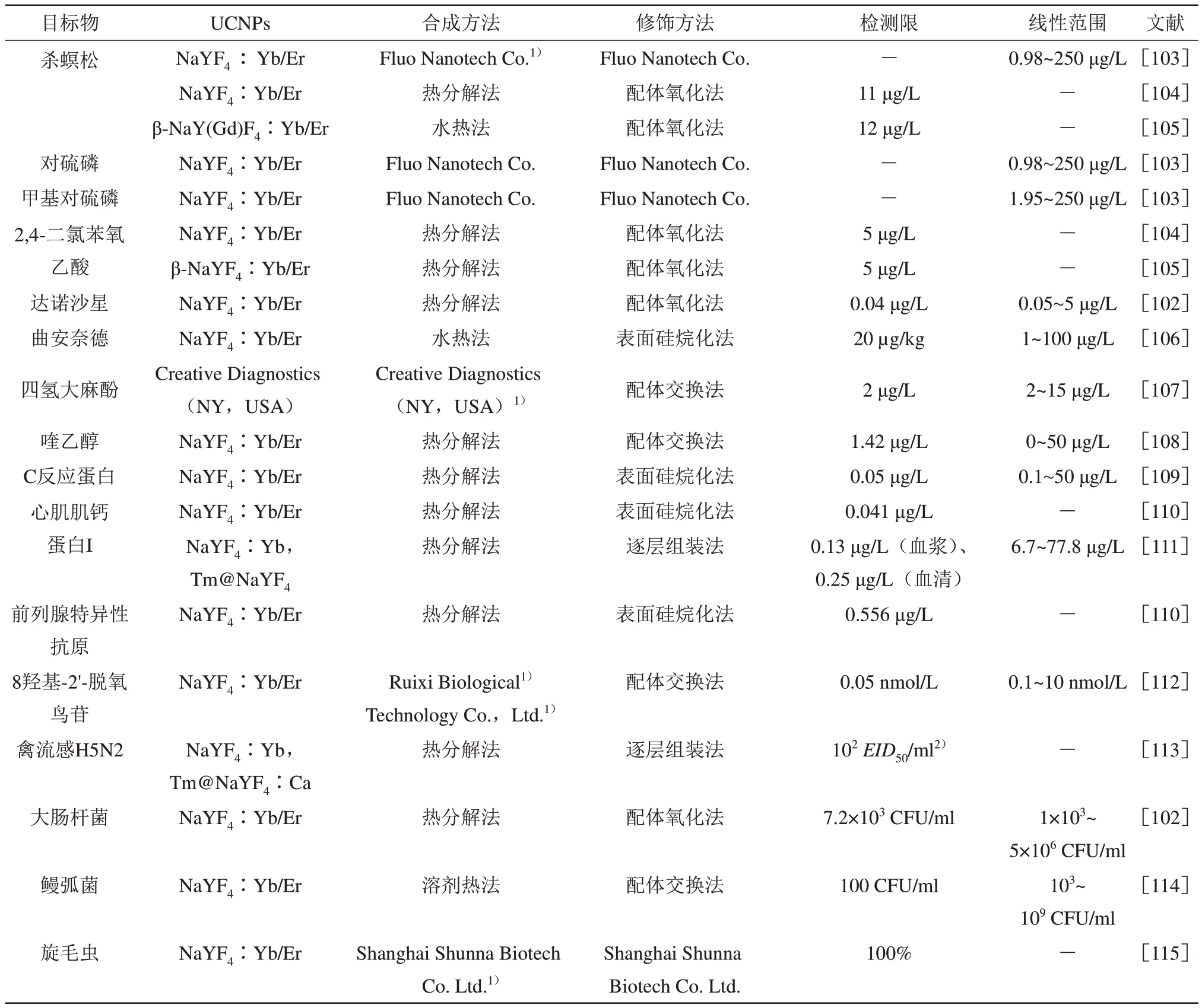
Table 3 Summary of the application of UCNPs-based upconversion immunochromatography表3 基于UCNPs的上转换免疫层析技术的应用总结
5 总结与展望
本文简要介绍了UCNPs的发光机制,并按照传感器的构造顺序材料合成和改性进行阐述,对基于UCNPs的免疫检测技术及其原理进行详细回顾。虽然基于识别配体抗体的UCNPs检测技术提供了生物毒性低、灵敏度高和特异性强的免疫检测方法,但是在实际应用中还应解决以下问题。a. 与传统荧光纳米材料相比,UCNPs在灵敏度和特异性方面具有显著优势,但还需进一步开展对它们的研究,尤其需要解决水溶性和分散度问题。可以合成粒径较小的UCNPs与亲水性配体结合或者去除疏水性表面配体,提高UCNPs的水溶性和分散度,促进UCNPs的生物功能化。b. 基于UCNPs的免疫检测模式普遍单一或者不能同时检测多个样品。可以开发多元检测技术平台和多模式同时检测平台,尽可能开发新型便携化、微型化、自动化的定性定量检测仪器,应用于现场快速高通量检测。c. 与成熟的免疫检测技术工业应用相比,UCNPs免疫检测技术的应用还处在雏形或实验室阶段,与实际的社会应用存在一定差距,尚未取得显著的社会和经济效益,许多技术瓶颈亟待研究人员解决,例如UCNPs的上转换发光效率难维持、合成方式复杂、表面修饰程度和功能化的难控制等问题。可以通过优化稀土掺杂物浓度和核壳结构提高上转换发光效率并延长高效的上转换发光时间,采用一步法简化合成程序,添加合适的稳定剂控制表面修饰程度。但本文所述成果已初步证明,UCNPs独特的光学性质及其表面修饰机制的灵活性,均为UCNPs作为纳米探针在免疫检测方面的应用开辟了广阔前景,值得广大研究者们去努力挖掘探索。