脑靶向寡核苷酸药物策略用于衰老相关脑部疾病治疗
2024-02-26杨灏颖刘润涵房梦珂刘洋郑蒙
杨灏颖 刘润涵 房梦珂 刘洋* 郑蒙*
(1)河南大学淮河医院转化医学中心,开封 475004;2)河南大学生命科学学院,河南省脑靶向生物纳米药物重点实验室,开封 475004)
1 寡核苷酸药物是生物技术药物的前沿
1.1 生物技术药物和核酸类药物的定义及分类
1.1.1 生物技术药物
新兴的生物技术(biotech)药物是基于创新生物技术开发的治疗药物,生物技术药物的开发致力于从实验室的生物技术转化出新的特异性高、针对性强的疗法[1]。传统小分子制药工业主要基于药物分子对靶蛋白的结合实现抑制/拮抗,现代药物发现小分子药物是应用最全面、发展最完善的药物形式,但是受限于靶蛋白和药物分子的结合模式,许多不含活性口袋的蛋白质较难使用小分子抑制剂/拮抗剂进行干预,对于精细的转录水平激活、蛋白质活性调节、基因突变矫正等,小分子药物的典型作用机制也较难实现[2]。目前已知的疾病靶点中约有40%靶点因不具有活性口袋或典型小分子药物作用机制被认为是不可成药的[3]。生物技术药物则以中心法则展开,在DNA-RNA-蛋白质层面分别通过生物技术进行干预,包括DNA水平的基因编辑,RNA水平的转录干扰、沉默、过表达,蛋白质层面的多肽、抗体、蛋白质等生物大分子药物对解决小分子药物的成药性难题和提高特异性上具有显著优势。
目前生物技术药物最成熟的是单克隆抗体(monoantibody)类药物,单抗类药物又向着更小分子质量、更高特异性、更多靶点的方向发展出了双/多特异性抗体、纳米抗体、单域抗体等[4]。目前,单抗类药物已广泛应用于肿瘤、免疫系统疾病的临床治疗,是国内外生物技术药物企业的主要盈利产品。单抗类药物对抗原的识别特异性与小分子药物相比极高,但单抗类药物通常仅能作用于细胞表面靶点,并且分子质量大,组织渗透能力较弱,是小分子药物的补充。
针对许多难成药靶点,核酸类药物理论上可以通过理性设计针对几乎所有mRNA和DNA序列,进而干预转录翻译和蛋白质表达,同时因核酸的碱基互补原则,其特异性也相对较高,可以通过序列优化实现较低的脱靶[5]。新兴的核酸(nucleic acids)类药物近10年发展迅速,其中寡核苷酸(oligonucleotide)药物以干扰小RNA(small interfering RNA,siRNA)/反义寡核苷酸(antisense oligonucleotides,ASO)为代表通过转录层面干预,已有多款药物率先应用于医疗市场,许多以规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及其衍生技术为基础的基因编辑工具也已进入临床试验评估阶段。自2019年新型冠状病毒感染(COVID-19)广泛传播以来,mRNA核酸疫苗也在全球多个国家和地区被首次应用,与此同时核酸类药物的递送工艺的成熟度和社会认可度也逐渐提高[6-7]。
除了特异性高以外,包括核酸类药物在内的生物技术药物还具有开发周期短、成本相对较低、实验室到临床转化速度快的优势,传统小分子制药工业依赖于高通量药物筛选、反复多轮结构改造和生物合成纯合/化学全合成,周期相对较长,技术难点多,以跨国药企罗氏制药为例,德勤统计称罗氏通常一个新药上市平均约需要14年时间和90亿人民币花费。生物技术药物通常来自生物内源机制,如应用最为广泛的单抗类药物、ASO药物、siRNA药物等,其特异性极高,并且靶点改造灵活,生产和制备周期短,药物筛选阶段相对较为容易,可以直接针对靶点进行结构和序列的设计。中国小分子药物工业起步较晚,主要以仿制药为主,小分子新药研发上相对薄弱,生物技术药物起步尽管也较晚,但生物技术药物发展周期短,有望在特定方向做出特色,例如,中国单抗类药物已经非常成熟。生物技术药物分子质量一般较大、结构复杂程度高,能够提高靶点特异性,但也导致一些应用上的瓶颈,如组织渗透能力差、靶器官生物利用率低,以及生物屏障穿越能力较差,同时生物大分子的储存条件相对苛刻,单剂生物技术药物的临床使用成本相比小分子药物较为昂贵[5]。寡核苷酸药物和传统小分子药物以及单抗类药物的特点对比见表1。
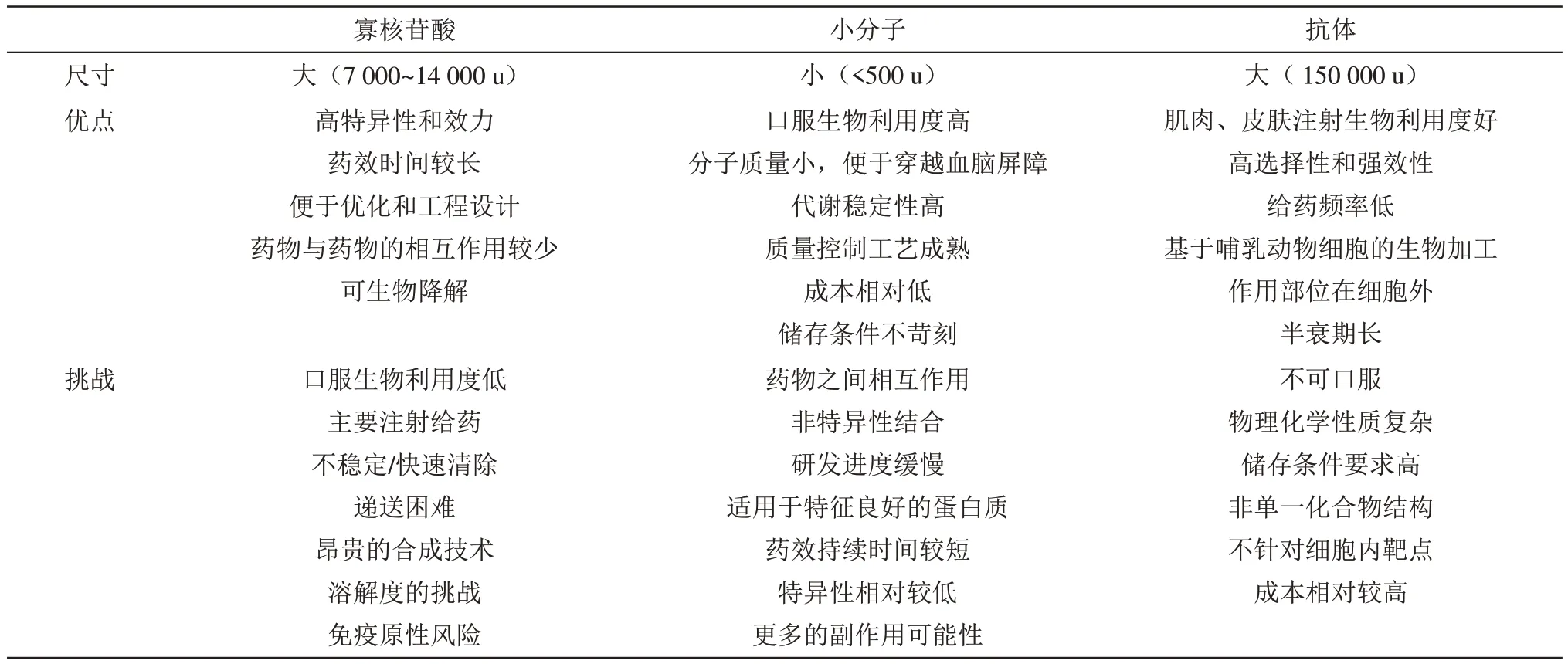
Table 1 Comparison of oligonucleotide drugs,small molecule drugs,and monoclonal antibody drugs,partially compiled from the reference[8]表1 寡核苷酸药物、小分子及单抗药物的比较,部分内容整理自参考文献[8]
1.1.2 核酸类药物
核酸类药物是新兴生物技术药物的一类,广义上包括核酸类似物和衍生物(如一些抗病毒药物)、寡核苷酸药物、长链mRNA、核酸参与的基因编辑工具、核酸适配体等[9]。其主要利用核酸和特定靶序列的反向互补进行识别,因此可以获得较高的特异性。干预机制则根据具体工具的形式各异,可实现RNA水平沉默(如siRNA/ASO),补充mRNA,DNA/RNA水平剪切、插入、替换(如CRISPR系统),蛋白质水平结合(如核酸适配体),利用编码蛋白诱发免疫反应实现疫苗效果等[10-11]。核酸类药物中以寡核苷酸药物的临床转化最为迅速,目前已有十余款ASO/siRNA疗法获美国FDA批准(表2),中国也有多款寡核苷酸药物进入临床试验。

Table 2 Nucleic acid drugs approved for marketing by the US FDA(compiled from references[18-19,22-23] and the FDA website)表2 美国FDA批准上市的核酸类药物(整理自参考文献[18-19,22-23]及FDA网站)
1.1.3 寡核苷酸药物的定义及分类
寡核苷酸药物也称小核酸药物,通常指经特殊设计的短链核酸,通过干预靶基因的表达,用于疾病治疗的目的[10]。寡核苷酸药物是目前研究较为广泛并且临床转化较为成熟的一类核酸类药物形式。其通常具有20个以下核苷酸构成,但并非严格定义,有时包括30个以上核苷酸残基组成的也被称为寡核苷酸,其组分可以为脱氧核糖核苷酸或核糖核苷酸。寡核苷酸疗法主要包括ASO、siRNA、microRNA(miRNAs)、核酸适配体(aptamer)、CpG寡核苷酸、ADAR(RNA-editing enzyme adenosine deaminase acting on RNA)等[9-10]。根据需要寡核苷酸类药物也可以进行修饰,以获得器官靶向能力或更好的血液循环表现。
ASO是较早开发的寡核苷酸药物,其为单链核酸,分子质量6~9 ku,ASO通过经典Watson-Crick碱基配对识别RNA序列,ASO的DNA序列与RNA结合产生异源双链体招募RNase H1导致目标RNA切割。ASO也可以干扰mRNA成熟的拼接机制,通过与pre-mRNA相互作用,调节可变剪接和增加目标蛋白表达,因此除了沉默目标RNA,具有入核能力的ASO也可以作用于pre-mRNA用于增加蛋白质活性。此外,ASO可以通过与特定起始密码子结合导致翻译停滞,mRNA表达下调进而目标蛋白下调[12]。
siRNA是双链RNA分子,分子质量约13 ku,与ASO不同,siRNA通过Watson-Crick碱基配对识别RNA序列招募RNA诱导沉默复合体(RNA-induced silencing complex,RISC),通过催化Argonaute家族的Ago2进行mRNA切割,siRNA被认为可以沉默任何编码蛋白质的基因表达[13-14]。
微RNA(microRNA,miRNAs)是真核生物内源性具有调控功能的非编码RNA,长约21~23碱基,广泛存在于真核生物中,通常由基因组转录而来,无法翻译成蛋白质,miRNA和靶基因mRNA碱基配对通过RISC降解mRNA或阻碍其翻译,作用机制类似于siRNA。miRNA类似物(mimics)也具有治疗潜力,而miRNA的拮抗物,理论上也可以通过抑制miRNA实现治疗效果[15]。
核酸适配体是人工设计、体外筛选获得的能特异结合蛋白质或其他分子的寡聚核苷酸,可以通过DNA或RNA的高级结构实现结合[16]。
siRNA和ASO是目前主要的寡核苷酸疗法,ASO发现较早,作用机制也较多,获批上市的较多,RNAi机制起步较ASO晚,但因安全性、长效性和效率优势目前热度较高。此外小激活RNA(small activating RNA,saRNA)也有候选药物进入临床试验阶段。寡核苷酸药物研发的里程碑见图1。
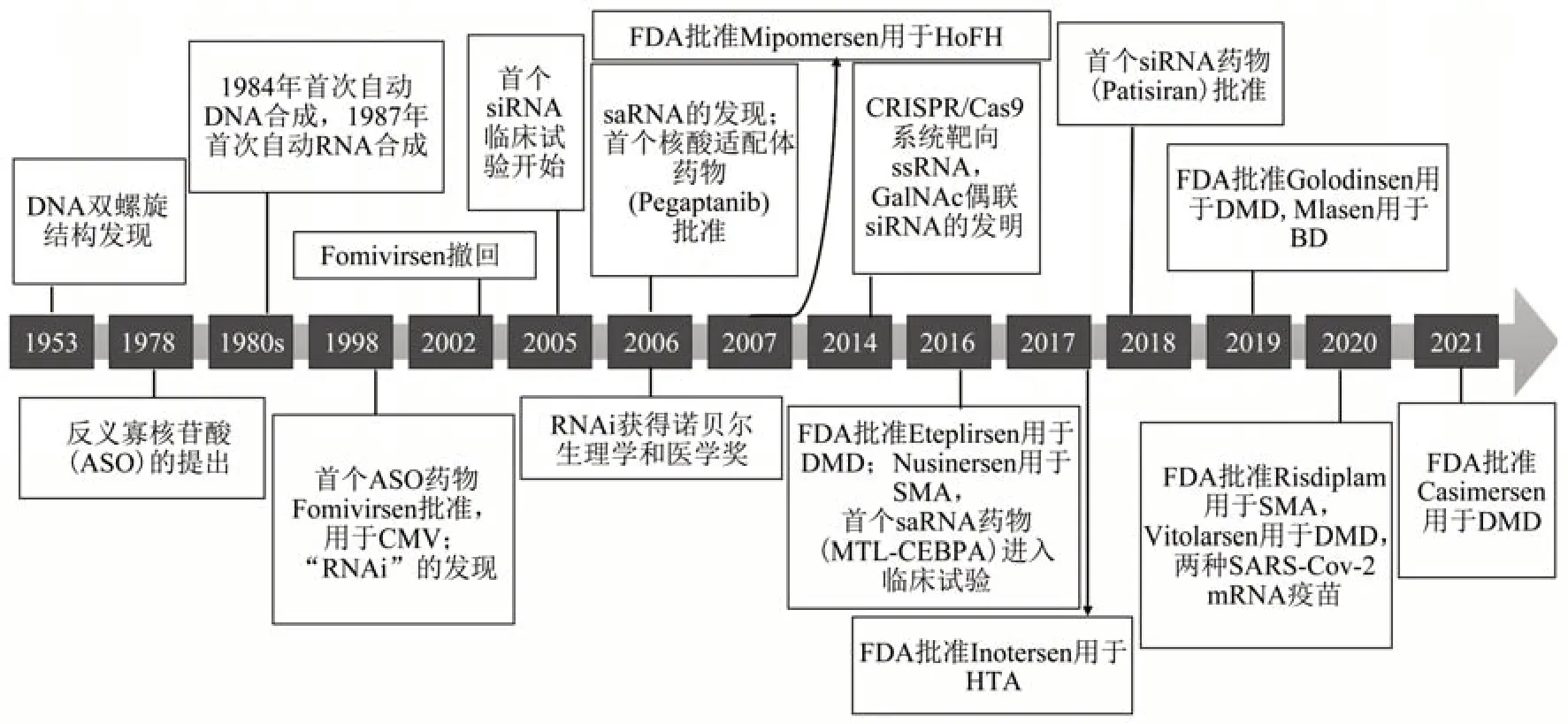
Fig.1 The development process and milestones of oligarchic drugs,some of which were compiled from the references[10,17]图1 寡核苷酸药物的发展历程和里程碑,部分内容整理自参考文献[10,17]
1.2 已进入市场的寡核苷酸类药物
近年来已有多款寡核苷酸药物进入医药市场,主要针对由基因突变导致的传统小分子药物难成药的罕见病(表2),当前研究热点已经覆盖了诸如病毒性肝炎、代谢系统疾病、神经退行性疾病(neurodegeneration diseases)、心血管疾病等常见病[18]。寡核苷酸药物自1998年首款ASO被美国食品药品管理局(US FDA,下文简称FDA)获批上市至今已有20余年,期间也经历了螺旋上升的发展阶段[19],2006年RNA干扰(RNA interference,RNAi)机制获得诺贝尔生理学和医学奖,工业界和学术界均认为其潜力巨大,但因多款RNAi药物临床试验也曾折戟,一度被认为是医药行业的一大泡沫,随着技术成熟多款siRNA药物成功获批上市,用于小核酸药物递送的脂质纳米颗粒(lipid nanoparticle,LNP)递送策略和GalNAC肝靶向策略也取得了突破性进展[20],加之自2019年COVID-19爆发后两款代表性基于LNP的mRNA疫苗广泛使用,工业界和学术界对核酸药物和其递送的兴趣达到了新的高度[21]。以AlnylamPharmaceuticals为代表的众多RNAi先驱企业也成长为市值百亿美元的生物技术药物巨头。
1.3 器官靶向的寡核苷酸类药物和非肝靶向核酸药物研究趋势
目前已上市的寡核苷酸类药物通常避免较为困难的递送环节,多采用直接病灶部位注射、皮下注射、肌肉注射等。研究中较为流行的器官靶向寡核苷酸类药物递送目前以肝脏靶向为主,尤其以N-乙酰半乳糖胺(GalNAC)偶联修饰的肝脏靶向[24]和LNP应用最为成熟[25](图2)。肝脏靶向寡核苷酸药物的成功,让学界和工业界的研究者对肝脏靶向以外的器官靶向寄予厚望,该方向是未来的重点研究方向之一[26]。其他器官的靶向策略目前较为罕见,当前器官靶向通常采用前药或纳米递送等策略,通过偶联能够识别靶器官高表达蛋白质的基团到寡核苷酸序列上或纳米载体表面,进而实现靶器官的富集。
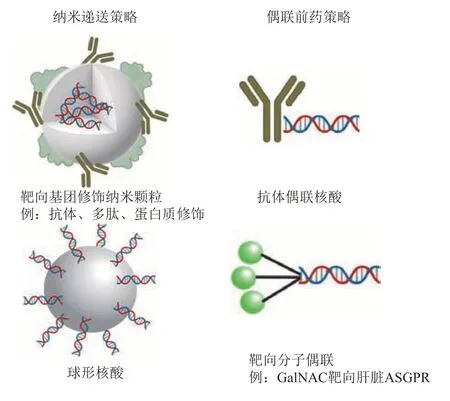
Fig.2 Mainstream organ targeted delivery strategies for oligonucleic acids图2 主流的寡核苷酸器官靶向递送策略
2 寡核苷酸药物在脑部疾病的应用
2.1 脑部疾病药物开发的挑战
脑部疾病的药物开发被认为较为困难,血脑屏障(blood-brain barrier,BBB)的存在、脑部生理结构以及脑组织构成细胞的特殊性是关键挑战。BBB系统是指脑组织-脑脊液-毛细血管血液之间的屏障系统,其能够进行营养物质交换,同时阻碍了大部分非脂溶性分子的通过和几乎所有大分子的通过,能够阻碍病原体和血液代谢物对脑部生理环境的影响。目前已知包括阿尔茨海默病(Alzheimer’s disease,AD)在内的许多脑部疾病的发生和BBB的破坏或不完整密切相关[27]。BBB的存在也导致大部分药物分子尤其生物大分子药物几乎无法通过,因此脑部疾病疗法开发相对其他系统较为滞后[28]。此外,脑部细胞与其他体细胞具有较大差异,其免疫、代谢、结构均较为特殊,一些其他体细胞内信号通路在脑部并非总是一致,这也是脑部疾病疗法开发的困难之一[29]。
脑部疾病包括脑胶质瘤、神经退行性疾病、运动神经元疾病、癫痫、脑外伤等疾病的疗法都十分有限,许多疾病只有妥协疗法,缺乏直接针对病因的疗法。随着研究的逐渐深入,研究者们意识到许多脑部疾病的病因和遗传风险密切相关,或因基因突变导致,因此针对致病基因采用寡核苷酸药物直接在转录水平干预被寄予厚望[30-31]。
当前已知的BBB交换主要分为:亲脂小分子自由扩散;水通道、离子通道;激素、核酸、氨基酸、糖等的转运体介导的运输途径;多肽、蛋白质的受体介导的运输途径,以及一些人工设计的主动靶向策略(图3)。
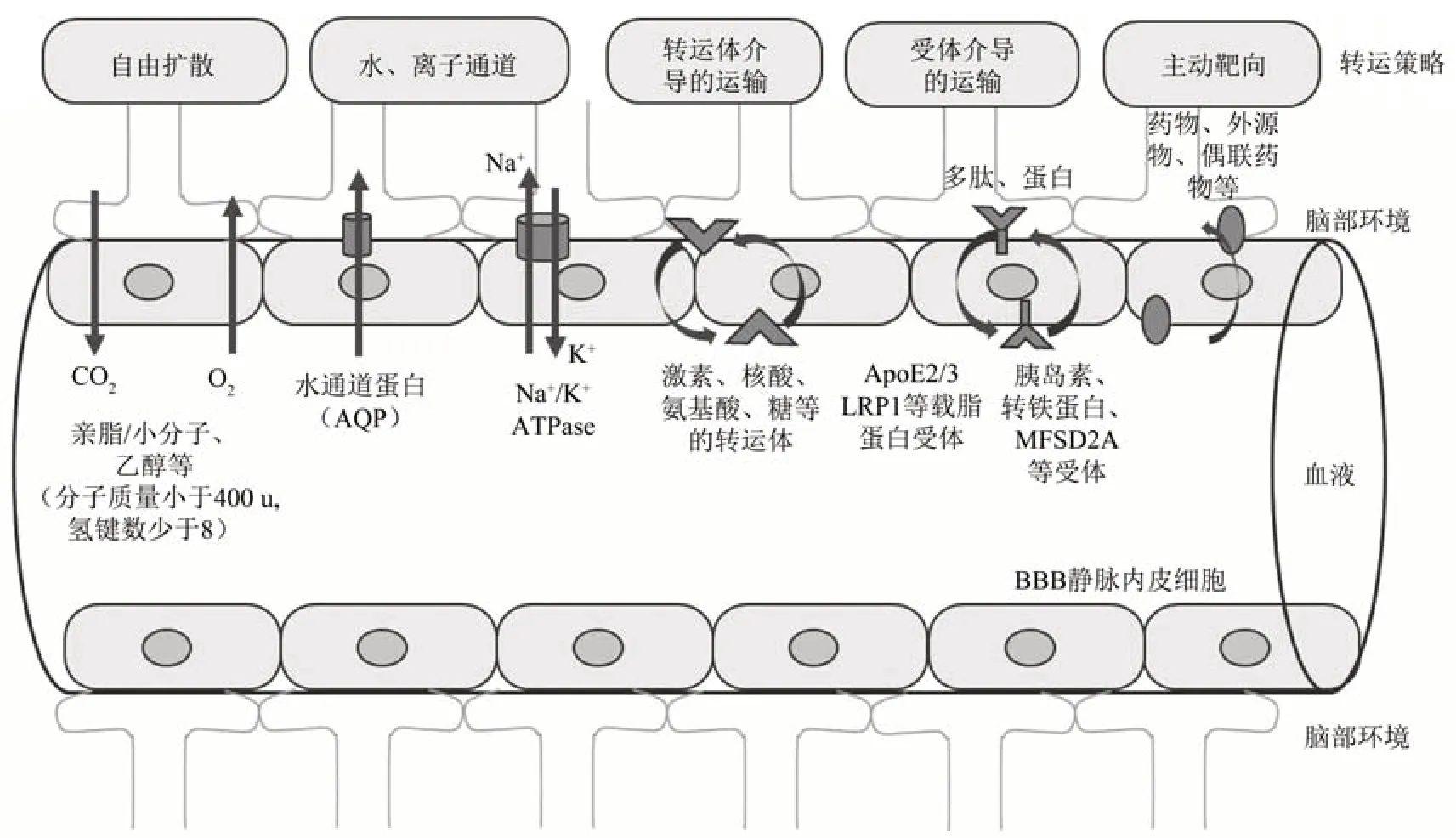
Fig.3 The main known pathways for substance exchange across the blood-brain barrier[32]图3 目前已知的主要跨血脑屏障的物质交换途径[32]
随着学术界对物质跨BBB交换途径认识的逐渐积累,一系列脑部递送策略应运而生(图4)。目前主要包括病毒载体、人工纳米粒子、外泌体等跨BBB的递送载体和一些辅助BBB穿越的物理、化学调节剂。当前基因治疗临床上应用最多的是腺相关病毒(adeno-associated virus,AAV)为载体的基因沉默和mRNA递送,其不同血清型有一定器官靶向能力,其中AAV9常常被用作跨BBB的基因疗法[33]。AAV病毒转染能力强,一般认为是非整合病毒载体,相比其他病毒载体整合基因组风险低,因而其遗传毒性被认为较低,但AAV病毒的有效荷载核酸有大小限制,一般装载不超过4.7 kb的核酸[34]。此外,尽管AAV病毒的转染效率高,但是仍然有报道称长期AAV治疗有基因组整合风险[35],并且病毒载体存在生物体机体自体免疫的限制,导致AAV反复给药耐药,多次给药成为困难[34]。除利用载体递送以外,聚焦超声、渗透破坏、磁场和小分子介导的机制也可以短暂地打开BBB,因有可能对组织器官造成损伤,该类策略通常用于辅助药物输送[36-37]。其中较为成功的案例是FDA批准的Lexiscan可通过调节细胞内肌动蛋白动力学,改变细胞骨架瞬时破坏细胞紧密连接(tight junction,TJ)完整性,增加脑毛细血管内皮细胞之间的细胞间隙进而促使药物通过BBB,此类辅助策略的可选对象非常少,并且短暂打开BBB缺乏对物质交换的选择性[38]。

Fig.4 The blood-brain barrier crossing strategy of mainstream drugs[39]图4 药物主流的血脑屏障穿越策略[39]
人工纳米颗粒相比病毒载体具有极高的灵活性,其表面可被修饰多种靶向分子或探针,研究中通过聚乙二醇(PEG)偶联抗体、多肽、小分子、核酸适配体等功能性分子在实验室中已经成功赋予了纳米颗粒靶向能力,也被广泛用于寡核苷酸药物的脑部递送研究。纳米载体主要包括脂质纳米载体、聚合物纳米载体、病毒纳米载体、生物膜来源纳米载体、外泌体、无机纳米载体等[40-41]。为了实现器官靶向和BBB穿越,转运体介导的内吞和受体介导的内吞被广泛地应用在纳米载体上。纳米载体穿越BBB的方式主要包括细胞紧密连接开放、受体介导的转胞吞作用(receptor-mediated transcytosis,RMT)、细胞介导的转运、载体介导的转运和吸附介导的转胞吞作用等,其中RMT是最常见的策略[42]。RMT借助脑部内皮细胞受体的识别作用,对一系列物质选择性地进行囊泡运输,从而实现BBB穿越,这些物质包括转铁蛋白、胰岛素、低密度脂蛋白(LDL)、瘦素等,均可以通过RMT进入脑部。目前认为配体修饰的纳米药物可以首先与内皮细胞表面的跨膜受体结合,形成细胞内囊泡并穿梭至内皮细胞另一侧发生胞吐作用,进而将纳米药物释放到脑实质中[42]。
目前研究者们已鉴定出一系列能够促进脑部积累、穿越BBB的靶向基团,包括多肽、转铁蛋白、葡萄糖、半乳糖、氨基酸等[43],以糖转运体为例,研究发现,将葡萄糖、半乳糖修饰在纳米载体或抗体表面后,修饰后的物质可以通过转运体介导的内吞途径穿越BBB,并且在短暂节食后给予血糖补充可以显著提高转运效率[44]。类似的一些本身具有BBB穿越能力的物质被修饰于递送载体表面也可以促进BBB的穿越,但值得一提的是,这些新的偶联物未必仅依赖其原有的受体或转运体进行内吞。当开发脑靶向递送系统时,受体介导的内吞是一种经典策略,借鉴“配体-受体”结合模式,将配体修饰在递送物表面,或将受体结合多肽/小分子等修饰于被递送物表面,已被用于开发多种脑靶向递送策略(图5)。由于多肽的合成和修饰工艺成熟、便于保存、反应条件要求不苛刻,使得靶向多肽成为了非常热门的修饰策略,研究者筛选出了相当多的脑靶向多肽用于促进被修饰物的脑部积累[45]。相比多肽,抗体用作靶向修饰则对反应条件温和程度要求较高,并且储存条件也更加苛刻,不过由于抗体对靶蛋白的亲和力极高,目前有不少研究者在通过纳米抗体、单域抗体等方式缩小抗体的分子质量以期待在靶向递送中能有更好的表现。此外,一些蛋白质本身也可以充当递送载体,如转铁蛋白由于其具有笼式结构也被用于工程化改造以促进所装载药物的脑部递送[39]。更多脑部特异性受体和转运体的发现会非常有助于脑部药物递送领域的发展。

Fig.5 Common surface modifications of nanoparticles and targeted receptors for crossing the blood-brain barrier[46-47]图5 纳米颗粒常见的表面修饰和用于穿越血脑屏障的靶向受体[46-47]
2.2 衰老相关脑部疾病的研究进展和核酸治疗靶点
寡核苷酸类药物目前已有十余款应用于医疗市场,众多在临床试验进行评估,其中通过皮下注射和静脉注射给药的疾病以肝脏疾病占比较高,原因之一是肝脏是最主要的代谢场所,药物具有较高的肝脏富集。为了实现寡核苷酸药物的脑部递送,需要首先针对BBB进行攻坚。
目前的主流策略主要分为靶向基团对寡核苷酸的直接修饰和纳米递送策略[48-49]。寡核苷酸理论上可以在特定位点(不限于末端)进行一系列修饰以实现脑部靶向,同时在靶向基团和寡核苷酸之间可以进行条件响应断裂基团的设计,以实现在病灶部位使寡核苷酸完全暴露并发挥作用,避免靶向基团对寡核苷酸产生空间位阻影响作用效果[50]。纳米递送策略则主要以纳米载体通过电荷装载核酸类药物,并通过纳米系统表面脑靶向修饰或其生物物理特性进行脑部递送。相关研究目前较为火热,但是目前脑部靶向递送策略在临床上仍然较为罕见。对于寡核苷酸药物递送包括本课题组在内的一些研究者采用了自组装球形核酸[51-53]结构,一项以金纳米颗粒为核心的球形siRNA核酸药物NU-0129[54],已经进入了早期一期临床试验,通过沉默BCL2L12基因用于评价复发性恶性脑胶质瘤的治疗效果(临床试验ID:NCT03020017)。这一临床试验是寡核苷酸药物脑部治疗较为前沿的探索。更多前沿研究案例和核酸治疗靶点,将在随后的具体疾病模型中展开综述(表3)。
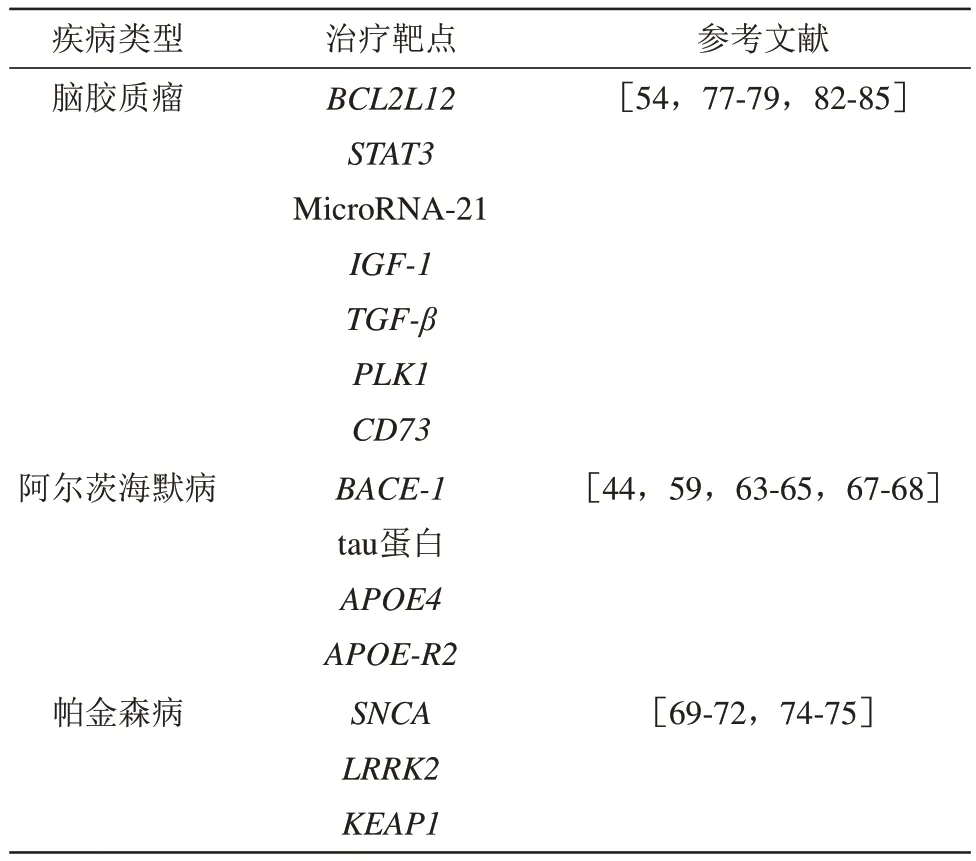
Table 3 Oligonucleotide treatment targets for different age-related diseases表3 不同衰老相关疾病的寡核苷酸治疗靶点
衰老相关脑部疾病的治疗靶点因疾病不同而异,目前主要的衰老相关脑部疾病主要包括神经退行性疾病和脑肿瘤[55-56]。最为常见的神经退行性疾病包括AD、帕金森病(Parkinson’s disease,PD)均与个体衰老密切相关,并且其有效的疗法极为有限。AD以神经元丢失、意识和记忆丧失为特征,是目前患病人群基数最大的神经退行性疾病,β淀粉样蛋白(β-amyloid,Aβ)堆积形成的斑块、Aβ前体蛋白的基因突变、tau蛋白的过度磷酸化、载脂蛋白E4(APOE4)的突变、神经炎症、细胞衰老均被认为是AD的重要原因[57]。在这些靶点中,以淀粉样蛋白假说研究最久、较为深入。Aβ肽的纤维沉积物形成的淀粉样蛋白斑块通常在AD患者脑内可见,也有研究表明淀粉样蛋白对神经元的毒性[58]。目前Aβ也是AD研究较为清楚的寡核苷酸药物可干预靶点,针对Aβ斑块形成过程中关键的β分泌酶1(β-secretase 1,BACE-1),有研究通过伪装半乳糖到聚合物纳米颗粒表面递送了BACE-1的siRNA并且缓解了Aβ转基因小鼠的AD病情[44],此外,通过一种具有脑靶向能力的CGN多肽修饰的一种荷载BACE-1siRNA的纳米载体也表现出了对AD小鼠模型的疗效[59]。近两年FDA批准了两款干预Aβ斑块形成的单抗,但其大规模人群上的疗效尚无确凿数据,并且也存在一定安全性的争议[60],寡核苷酸药物和单抗各有利弊(表1),目前单抗用于AD治疗的主要担忧是抗体带来的微血管出血和脑水肿风险[61],有较多研究聚焦在如何尽可能保留抗体功能性结构缩小分子质量,以降低安全风险,而寡核苷酸药物安全性的担忧主要是脱靶,不过由于寡核苷酸的序列多变,在优化上更加灵活。此外,AD的病因复杂、人群异质性高,针对Aβ形成的疗法未必适合所有患者,也有研究发现,一些AD患者的病情与Aβ并无直接关系[62],除Aβ假说外,APOE4风险等位基因,tau蛋白相关的纤维缠结以及神经炎症也是主流AD病因假说。tau蛋白相关的纤维缠结目前主要认为是tau蛋白的翻译后修饰问题[63],其促进了Aβ诱导的神经毒性[64];而APOE4作为最重要的AD遗传风险等位基因,被发现会损害Aβ的清除[65],也和BBB的完整性和神经炎症有关[66],目前有研究提示通过ASO调控载脂蛋白受体2(APOE-R2)的剪切变体对AD鼠有一定疗效[67],此外也有一项临床研究在评价通过ASO去降低tau的水平[68]。综上,尽管有一些研究案例和早期临床研究,目前还没有理想的寡核苷酸药物策略用于AD的治疗。由于AD的病理机制还存在大量未知,未来可能在病理机制逐渐清晰的过程中有更多寡核苷酸药物干预机会。
PD是最常见的衰老相关运动障碍,其特征是逐渐丧失多巴胺能神经元,并被发现与中脑中的α突触核蛋白(α-Synuclein,编码基因SNCA)的突变和α突触核蛋白异常积累密切相关。PD是一种严重的神经退行性疾病,目前可通过手术和小分子药物加以控制,但无法治愈。针对α突触核蛋白的寡核苷酸药物目前认为是较为有前景的策略。有研究者通过颅内原位注射SNCA的ASO[69-70]或原位注射聚乙烯亚胺包裹的SNCAsiRNA至PD小鼠脑内,发现对病情有缓解效果[71],另一组研究者通过鼻腔给药将ASO递送至小鼠脑内也取得了正向收益[72]。也有研究者通过脑靶向RVG多肽修饰的外泌体将SNCA的siRNA递送至小鼠脑内,也成功降低了α突触核蛋白表达量[73]。除了SNCA靶点,富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)的激活也和PD有关,有研究者通过对幼鼠原位注射ASO干预PD进程[74]。此外,针对神经毒性和氧化自由基压力,有研究者通过KEAP1的siRNA降低了脑部活性氧,并部分保护了经典PD造模神经毒性药物MPTP诱发的神经毒性[75]。综上,目前已经有一些研究通过纳米载体将SNCA的siRNA成功递送至脑内,但是目前研究者聚焦的挑战是PD治疗需要精准递送至病灶脑区和功能性细胞,即多巴胺能神经元的有效递送。
胶质瘤(glioma)是一种和年龄相关的恶性肿瘤,具有高复发、高死亡率,其标准疗法主要是手术结合放化疗。胶质瘤的一线药物主要是烷化剂类广谱抗肿瘤药物替莫唑胺,受限于BBB,胶质瘤的可用药物选择少,常面临耐药的问题[76]。针对药物选择少这一挑战,寡核苷酸药物在胶质瘤治疗中的研究具有一定优势,也产生了一系列具有代表性的针对热门肿瘤靶点进行的不同载体的寡核苷酸药物递送。外泌体作为生物相容性较高的纳米载体也被广泛应用于胶质瘤的寡核苷酸药物递送研究,比如有研究通过神经干细胞的外泌体递送了STAT3的ASO[77],也有研究者通过血红素加氧酶结合多肽修饰的装载了STAT3基因的siRNA的间充质干细胞来源外泌体用于耐药胶质瘤靶向[78],以及使用T7肽装饰的外泌体向大脑输送microRNA-21的ASO[79]。因外泌体可以来源于患者本身,而且具有一定病灶迁移能力,因而被认为是较为理想的低毒性个性化递送载体,在众多靶向递送策略中展现出优势[80-81]。实际上针对胶质瘤的寡核苷酸递送策略近些年非常火热,许多明星肿瘤靶点如胰岛素样生长因子1(IGF-1)受体也被用作寡核苷酸药物的靶点,并协同增强了T细胞的抗肿瘤反应[82],转化生长因子β(TGF-β)也被用作胶质瘤的寡核苷酸药物靶点[83]。研究者也在不断丰富递送载体的多样性,如通过聚合物载体设计活性氧响应性释放的寡核苷酸递送载体,用于PLK1基因的siRNA沉默[84]。此外,给药途径也有多重选择,如有研究通过阳离子纳米乳液作为CD73-siRNA的递送系统进行鼻腔给药[85],鼻腔给药在动物模型上经常取得优秀的表现,但是必须注意的是,小鼠的嗅球相对体重要远超人类,在人体中鼻腔给药能否达到理想的效果需要进一步的实验证据。综上,对于胶质瘤的寡核苷酸药物应用研究较为丰富,在载体形式、靶向递送基团、可控释放、给药途径等多方面均有研究,但是目前尚无进入晚期临床试验的胶质瘤寡核苷酸药物,主要挑战依然是提高递送载体安全性、提高病灶有效积累、降低肝脏积累、提高血液循环稳定性以及降低治疗成本。
2.3 衰老是脑部疾病的可干预对象
脑部疾病药物开发的挑战除了BBB和特殊的组织构成以外,其病因也极为复杂,不同病理之间相互影响,针对单一靶点进行药物开发因疾病在人群上的异质性导致疗效差异较大。随着研究的积累,个体衰老(ageing)和细胞衰老(cellular senescence)在近10年中被越来越广泛地研究,研究者意识到衰老本身是许多脑部疾病的诱因,并且在不同衰老相关疾病中有相似的生理病理过程[86-87]。高龄和细胞衰老在神经退行性疾病[88]和胶质瘤[89]中均被认为是风险因素。包括基因组不稳定、表观遗传改变、细胞通讯改变、干细胞耗竭、细胞衰老、线粒体功能失调、营养感受器失调、蛋白质稳态丢失、端粒损伤等衰老相关病理过程均在神经退行性疾病和胶质瘤发生发展中扮演重要角色(图6)[88]。这些病理改变产生了相当多的潜在靶点,也产生了相当多的小分子药物难成药靶点。小核酸药物针对这些难成药靶点展现出了成药性的优势。

Fig.6 Aging is a contributing factor to neurodegenerative diseases (with reference to the image from[88])图6 衰老是神经退行性疾病的诱因(图片参考文献[88])
尽管针对衰老相关疾病寡核苷酸药物展现出了靶点选择上的丰富性,但是当前针对衰老过程的可干预靶点仍然比较有限。已有较为充分的证据说明衰老是多种疾病的诱因,也细化了个体衰老和器官衰老中的一些典型分子事件,但因衰老是进行性、系统性的,也存在较大的人群异质性和器官异质性,衰老的生物学认识还有待深入研究。目前较为成熟的认识是随着个体衰老,衰老细胞的积累也会通过旁分泌持续性产生慢性炎症微环境,而慢性炎症本身也是衰老的诱因之一,也会诱发疾病的发生发展[90],因此针对炎症信号通路可以进行干预[91]。炎症因子以蛋白质形式在细胞通讯和调控生理状态中也扮演一定积极作用,因此需要短期调控炎症信号。目前针对急性炎症,通常选用单抗类药物,寡核苷酸药物的应用相对较少,但对于脑部疾病包括脑外伤在内,慢性神经炎症的贡献都被认为较大,因此寡核苷酸药物抗神经炎症方面也同样具有潜力[92-94]。炎症信号网络极为复杂,在不同疾病、甚至同一疾病的不同病程都有较大的异质性,而近期研究发现髓系细胞触发受体2(trigger receptor expressed on myeloid cells-2,TREM2)在神经炎症和退行性疾病中发挥了较为广谱的作用,TREM2激活会诱发神经炎症和神经元凋亡,也有研究表明,通过TREM2的沉默有助于改善神经炎症[95],因此提供了一个可干预靶点。
此外,衰老细胞的堆积也会导致器官功能的衰退,近期研究发现清除衰老细胞对缓解衰老相关脑部疾病有收益[96-97],因此衰老细胞本身也成为了较为新颖的可干预对象之一,并且针对衰老细胞杀伤药物的研究成为了近年的热点[98-99]。目前较为成熟的清除衰老细胞的策略是通过抑制衰老细胞抵抗凋亡的核心BCL2、BCL-xl/w等信号通路,诱发衰老细胞凋亡,此类靶点的寡核苷酸药物也有一定潜力[100]。但通过寡核苷酸药物杀伤衰老细胞缓解神经退行性疾病的研究尚少,对于慢性神经退行性疾病而言,此类疗法的收益和风险还需要谨慎讨论。此外,细胞衰老和衰老相关炎症因子对脑部衰老相关疾病的贡献是长期的,也和其他病理事件协同作用,因此多靶点干预的寡核苷酸药物的鸡尾酒疗法(cocktail therapy)也被认为在中枢神经系统疾病中具有潜力[101]。
3 挑战和展望
寡核苷酸药物理论上可以实现高特异性而且几乎所有核酸序列均可以被设计成为靶点,因此避免了小分子药物和单抗药物靶点的成药性限制。成功应用于医疗市场的寡核苷酸药物也给了研究者更多信心去开发更多靶点和更多器官靶向的寡核苷酸药物[102]。目前寡核苷酸药物应用于脑部疾病的挑战仍然存在,其相对较大的分子质量,携带的阴离子电荷,以及血液和组织中的核酸酶使得其进入细胞和发挥有效功能的效率较低。尽管递送系统的开发解决了部分问题,如病毒载体的和非病毒递送系统能够保护核酸免于被循环系统中的核酸酶降解,并最大限度地输送到靶细胞,尽量减少组织、细胞水平的脱靶,但仍然存在提高的空间。
病毒介导的递送疗法是当下临床试验中较为热门的选择,也已有多款AAV载体的基因治疗获批上市,病毒递送载体的细胞转染效率通常较高,并且AAV根据血清型有一定的组织特异性[103],因此也受到研究者的青睐,但病毒载体可能会由于预先存在的免疫导致失效或再次给药失效,并且存在随机整合至基因组上的安全风险,与此同时病毒载体也存在装载核酸的分子质量限制和造价昂贵的问题[9]。
非病毒递送载体在近些年随着技术成熟激发了学术界和工业界越来越多的兴趣[104],从早期的脂质体到包含可电离脂质(ionizable lipid)的脂质纳米颗粒[105-106],核酸药物包装效率和稳定性都得到了提高,脂质纳米颗粒曾经也经历了治疗窗口狭窄的问题,递送的药物剂量提高的同时,毒性也显著提高。以Alnylam为代表的一系列RNAi企业后续开发了一系列新型脂质分子,如MC3,一定程度上解决了治疗窗口窄的问题,并催生了首款获得FDA批准上市的RNAi疗法Patisiran[107]。肝脏以外组织的靶向递送是目前的研究难点和热点[108]。
除了LNP以外,GalNAC偶联的核酸药物在肝脏靶向上也取得了成功,目前全球寡核苷酸药物发展火热,相关递送技术核心专利如LNP和GalNAC-siRNA主要为美国企业所有,中国大陆也有少数药企和生物技术企业开发了拥有自主知识产权的递送技术平台,未来在器官靶向、更高的递送效率、材料的安全性方面中国企业有望实现差异化发展。在中枢神经系统中,Alnylam后续又开发了新的十六烷基(C16)脂质用于偶联siRNA以实现鞘内给药[109],这一策略也有望为寡核苷酸药物的脑部递送提供新的临床应用的机遇。此外,近期外泌体研究也较为火热,因外泌体是可从自体细胞获取的天然纳米颗粒,其生物相容性较高,而且一些细胞来源的外泌体本身也具有一定的BBB穿越能力和病灶部位迁移能力,因此解决生产上的质量控制和更高载药效率问题后,也是极有潜力的脑部递送载体[80-81]。
寡核苷酸药物除了靶向难题以外,临床转化中化学生产和质量控制(chemical manufacturing and control,CMC)过程也是难点之一,其大规模制备、质控、纯化是难点。小核酸药物合成过程中的不完整寡核苷酸,脱保护不完全的产物均较难纯化和分离,这些化学修饰、杂质也是毒性产生的原因之一[110]。小核酸药物的药效学、药代动力学、安全性评价也与小分子和单抗较为不同,目前没有统一的标准[10]。此外,尽管核酸类药物被认为特异性较高,但仍然存在安全性担忧,因药理作用放大而引起的在靶(on-target)毒性,以及序列和理化性质带来的脱靶(off-target)毒性以及递送系统的材料毒性都需要严谨评价,其毒理研究与生物制品或者化学药物的非临床安全性评价或有较大差异,此外也需要注意核酸类药物的遗传生殖毒性[111],这些挑战是当前继续攻坚的主要方向(图7)。

Fig.7 Research trends and application challenges in oligonucleotide drug delivery图7 寡核苷酸药物递送的研究趋势和应用挑战