曝气生物滤池对消毒副产物及其前体物的控制机制
2024-02-24王文冰张伟军
孙 鹏,王文冰,何 航,张伟军,4*
(1.宁夏环保集团有限责任公司,宁夏 银川 750004;2.中国地质大学(武汉)环境学院,湖北 武汉 430078;3.中国地质大学(武汉)长江流域环境水科学湖北省重点实验室,湖北 武汉 430078;4.中国科学院生态环境研究中心,北京 100085)
消毒能有效杀灭饮用水中的病原微生物,控制经饮用水途径传播的传染病的发病率,从而保障公共卫生安全[1]。因此,消毒已成为水处理系统中不可或缺的一部分[2-4]。但水中的溶解性有机质(dissolved organic matter,DOM)与消毒剂(氯、氯胺和二氧化氯等)反应时会不可避免地产生有毒有害的消毒副产物(disinfection by-products,DBPs)[5-7]。毒理学研究表明DBPs具有细胞毒性、遗传毒性和致突变性[8-10]。流行病学研究报道显示,城市人群膀胱癌发病率与自来水DBPs浓度具有一定的相关性[11]。因此,饮用水中DBPs的控制已成为环境工程与环境健康研究的热点问题[9]。
控制饮用水中DBPs的3种主要方法为源头控制、过程控制和末端控制,分别应用在消毒前、消毒中和消毒后[12]。其中,源头控制指的是通过去除DBPs前体物DOM来最小化DBPs的生成。常规的饮用水处理工艺包括混凝沉淀、介质过滤和消毒,但只有混凝沉淀能够去除一部分DOM,而出水中DOM的生物可利用有机物可能导致管网异养菌生长,从而危害水质安全。因此,曝气生物滤池(biological aerated filter,BAF)凭借着能够有效去除水中的生物可利用有机质和营养盐等优势,越来越广泛地被用于水处理系统中[13-16]。然而,BAF如何通过改变DOM分子组成从而影响出水中DBPs生成的机制仍不清楚。
传统的光谱法(如紫外可见光谱、三维荧光光谱)已被广泛地用于表征水处理过程中DOM的转化,但是这些方法不能从分子层面揭示DOM在水处理过程中的转化。常规的DBPs分析方法如气相色谱和气相色谱质谱联用等检测出的DBPs仅能解释浓度占比不到40%的总有机卤化物,有大约60%的DBPs的结构和分子组成仍然是未知的[17],这部分DBPs通常具有较高的极性[18-19],并不适合用常规的方法分析。傅里叶变换离子回旋共振质谱(FT-ICR MS)是目前分辨率最高的质谱技术,能够精准地鉴定DOM分子的分子式,这使得同时分析DBPs及其前体物的分子特征成为可能[20-21]。因此,FT-ICR MS已成功地被用于在分子水平上追踪DOM在不同水处理系统中的转化,包括饮用水厂[22]、城市污水处理厂[23]、再生水厂[3]和工业废水处理厂[24]。此外,结合FT-ICR MS和质量差网络分析可以从DBPs生成途径的角度来分析DBPs及其前体物[17,25],能够更清晰地阐明DBPs的生成机制。但是目前大多数研究仅关注了BAF对常规DBPs浓度的影响[12],未知DBPs 的分子组成和其前体物的转化途径尚不清楚。为此,本研究选择某水厂的BAF单元为研究对象,采用FT-ICR MS结合光谱技术和色谱质谱联用等方法探究BAF通过改变DOM的分子组成从而影响后续氯化消毒过程中DBPs生成的分子机制,并通过质量差网络分析揭示DBPs的生成途径,旨在为水处理过程中DBPs的控制和水质安全保障提供理论依据。
1 材料与方法
1.1 水样采集
2022年7月在浙江省义乌市某水厂取水样,该水厂进水为义乌江江水。饮用水处理工艺流程为:进水、BAF(填料为陶粒,停留时间为1 h)、氯化消毒、混凝沉淀(聚合氯化铝)、砂滤和出水。分别取水厂进水和BAF出水5 L,水样采集完立即用0.45 μm孔径的玻璃纤维滤膜过滤,随后避光保存在4 ℃的冰箱中以待后续分析。水样的基本水质参数见表1。

表1 水样的基本水质指标
1.2 消毒试验
首先向两组水样中投加一系列自由氯浓度的次氯酸钠溶液,确保氯化消毒1 d后水样中余氯浓度为(1±0.5) mg Cl2/L时所需的加氯量(见表1)。随后向250 mL水样中投加次氯酸钠溶液使液体充满棕色瓶,避光培养1 d。试验分为两组,分别用于常规DBPs测定和未知DBPs测定(FT-ICR MS)。培养结束之后测定余氯浓度,向用于常规DBPs测定的水样中投加1.5倍余氯浓度(摩尔比)的硫代硫酸钠淬灭余氯,向用于未知DBPs测定的水样中投加2.5%的甲酸溶液将pH值调至2左右,余氯在此期间也被淬灭。
1.3 固相萃取试验
首先依次用18 mL甲醇(LC-MS级)和18 mL 甲酸(LC-MS级)酸化的超纯水(pH值约为2)活化固相萃取小柱(安捷伦PPL柱,500 mg,6 mL);然后将水样以大约5 mL/min的速度泵入PPL小柱,上样结束后用20 mL酸化超纯水冲洗PPL小柱;最后用柔和的氮气流将柱内的水分完全去除,在确保PPL小柱充分干燥后,使用6 mL甲醇洗脱,用氮气吹干后避光保存在-18 ℃的冰箱中待FT-ICR MS分析。
1.4 分析方法
1.4.1 常规水质参数分析
溶解性有机碳(DOC)和在254 nm波长处的吸光度(UV254值)采用岛津公司的总有机碳分析仪(TOC-L)和紫外分光光度计(UV 2600)测定;水样中氨氮、总氮(TN)和总磷(TP)分别根据国标《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)、《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》(HJ 636—2012)和《水质 总磷的测定 钼酸铵分光光度法》(GB 11893—89)测定。游离余氯采用N,N-二乙基对苯二胺(DPD)分光光度法测定。
1.4.2 常规DBPs测定
三卤甲烷(trihalomethanes,THMs)采用岛津公司的气相色谱串联电子俘获检测器(GC-2010)测定;卤乙酸(haloacetic acids,HAAs)采用Waters公司的高效液相色谱-三重四极杆质谱联用仪(TQ-S micro)测定;卤乙腈(haloacetonitriles,HANs)和卤代硝基甲烷(halonitromethanes,HNMs)采用岛津公司的三重四极杆气相色谱质谱联用仪(TQ 8040)测定;总有机氯化物浓度(以Cl计)采用双活性炭柱吸附法结合总有机卤素分析仪测定(Multi X®2500,Analytik Jena)。将总有机氯化物浓度减去每种含氯DBP中Cl原子的当量浓度(以Cl计)得到未知总有机氯化物浓度[26]。
1.4.3 未知DBPs的FT-ICR MS测定
采用Bruker公司的SolariX 7.0 T FT-ICR MS对样品进行检测,离子源为负离子模式电喷雾。主要检测参数为:进样速度为120 μL/h,毛细管入口电压为-3.8 kV,离子累积时间为0.04 s,采集质量范围为100~1 000 Da,采样点数为4 M 32 位数据。检测前用10 mmol/L甲酸钠对仪器进行外部校正,检测后使用基于已知NOM化合物的内部参考质量表对谱图进行内部校准。
采用R软件中的MFAssignR包进行分子式匹配[27],具体流程如下:首先过滤含有13C和34S同位素质量的峰,以避免错误的单同位素分子式分配;然后初步匹配含C、H和O的分子式,并通过RecalList函数中的10个内部再校准序列对分子式重新校准;最后利用MFAssign函数进行分子式匹配。分子式匹配完成后,先通过基于Matlab的卤素提取代码对含氯分子式进行同位素验证[28],并剔除不合理的分子式;再去除样品中与程序空白和溶剂空白中的相同的分子式,得到的结果即为后续数据分析所需的质谱数据。通过Excel表的Countif函数对比BAF前后和消毒前后水样中DOM分子,仅存于处理前的水样中的DOM分子为被去除的DOM分子,仅存于处理后的水样中的DOM分子为生成的DOM分子,共存于处理前后水样中的DOM分子为未变化的DOM分子。
用于表征DOM不饱和度的等效双键当量(DBE)、表征芳香度的修正芳香性指数(AImod)[29]和指示DOM分子氧化还原状态的碳的名义氧化程度(nominal oxidation state of carbon,NOSC)[30]的计算公式如下:
DBE=(2nC+2-nH+nN)/2
(1)
Almod=(1+nC-0.5nO-nS-0.5nH)/(nC-0.5nO-nS-nN)
(2)
NOSC=4-(4+nH-2nO-3nN-2nS+5nP)/nC
(3)
式中:nC、nH、nN、nO、nS、nP分别代表C、H、N、O、S、P原子的数量。
根据DOM分子的AImod和氢碳比(H/C)值将其分为以下几类物质[31]:稠环多环芳烃(AImod> 0.66)、多酚类物质(0.66≥AImod>0.5)、高度不饱和类及酚类物质[AImod≤0.5和H/C≤1.5]、脂肪类物质(AImod≤0.5和2≥H/C>1.5)和饱和类物质(H/C>2)。
2 结果与讨论
2.1 BAF对水质和常规DBPs生成的影响
由表1可知:BAF处理对水样的pH值和电导率影响不大,而浊度降低了近90%,DOC和UV254值分别降低了约28%和16%,致使氯化消毒所需的氯剂量从7.4 mg Cl2/L降低到5.9 mg Cl2/L。但值得注意的是,水厂进水氨氮浓度仅为0.28 mg/L,这可能会导致滤池难以挂膜或生物膜脱落,使其对有机物的去除率降低。BAF处理和消毒前后水样的三维荧光光谱图,如图1所示。
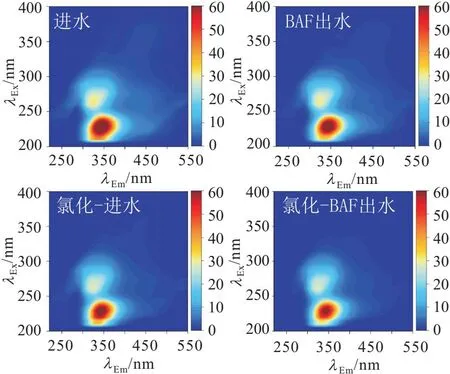
图1 BAF处理和消毒前后水样的三维荧光光谱Fig.1 Three-dimensional fluorescence spectra before and after BAF treatment and disinfection
由图1可以看出:BAF处理和消毒前后水样的三维荧光光谱的变化,经BAF处理后水样中溶解性微生物产物(soluble microbial products,SMPs)和类芳香蛋白质的荧光强度略微降低,说明这些物质易被滤池中的生物膜降解[32]。氯化消毒后水样中腐殖酸和类芳香蛋白质的荧光强度明显降低,这是由于氯会破坏有机物的芳香环[33],并将大分子腐殖酸氧化成小分子物质[34]。
BAF处理前后水样中常规DBPs浓度的变化,如图2所示。
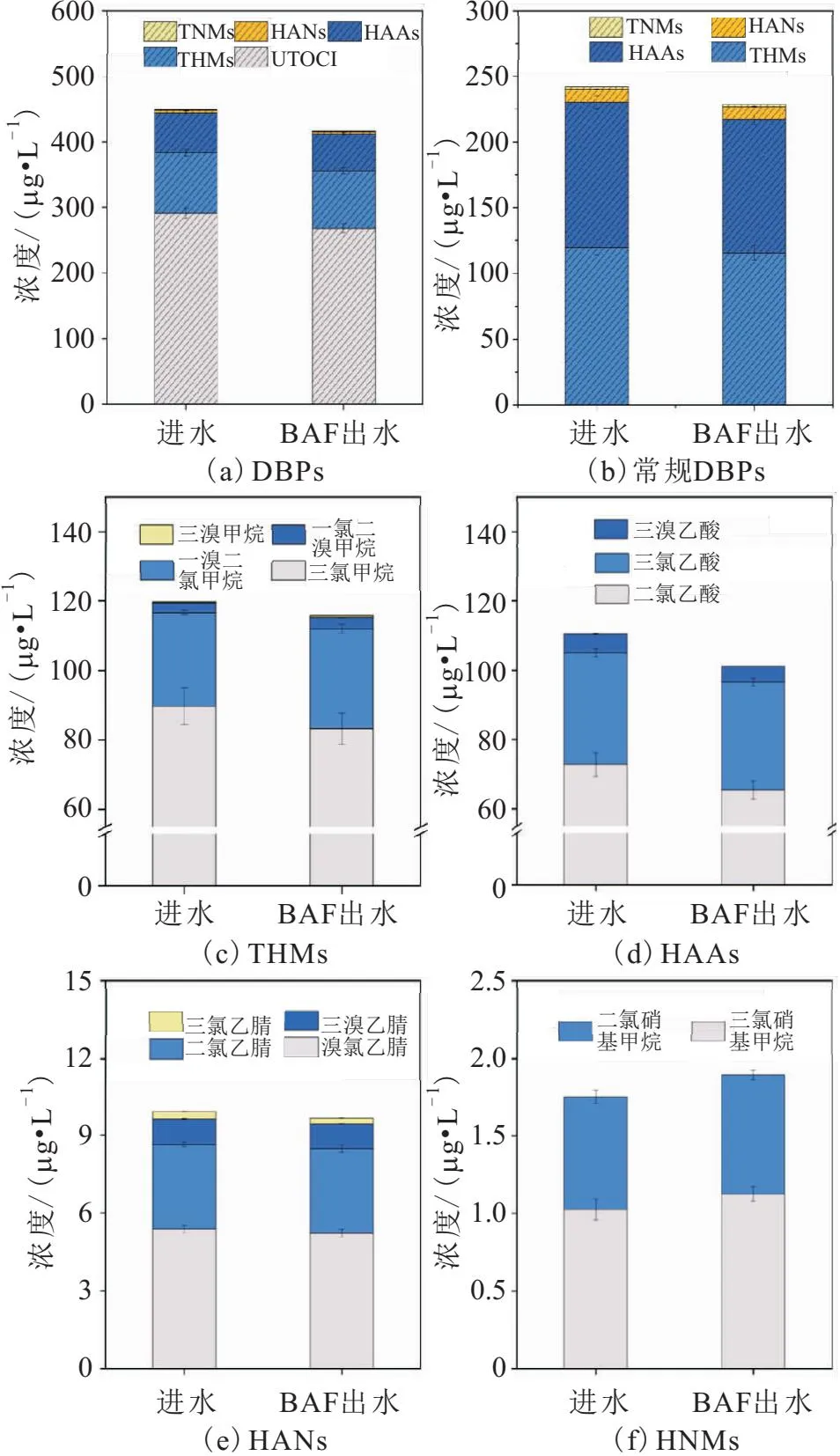
图2 BAF处理前后水样中常规DBPs浓度的变化Fig.2 Change of conventional DBPs concentrations before and after treatment by BAF
由图2可以看出:
1) 经BAF处理后,水样中部分DBPs前体物被微生物降解,使水样氯化消毒产生的常规DBPs和未知总有机氯化物(unknown total organic chloride,UTOCl)的浓度都轻微降低。此外,进水和BAF出水经氯化消毒后,UTOCl的浓度占总有机氯化物浓度的60%以上,这说明常规的DBPs检测方法如GC-ECD和LC-MS等并不足以全面识别出水中的DBPs,需要超高分辨率质谱FT-ICR MS检测作为补充[18-19]。
2) 对于受管制的DBPs(THMs和HAAs),BAF处理后其浓度分别降低了约3%和9%,主要是三氯甲烷和二氯乙酸浓度的降低较为明显,这可能是由于BAF去除的类芳香性蛋白是主要的THMs和HAAs前体物,但消毒后水样中三氯甲烷和二氯乙酸的浓度仍高于《生活饮用水卫生标准》(GB 5749—2022) 中规定的浓度限值(分别为60和50 μg/L),由于其具有潜在的致癌性[35],需要在后续处理过程中对其加以关注。
3) BAF处理对水样中HANs和HNMs这两种含氮DBPs前体物的去除效果不显著,反而导致了HNMs浓度的轻微升高,这可能是由于生物膜产生的SMPs作为前体物参与了部分HNMs的生成[36]。但值得注意的是,HNMs的细胞毒性可达THMs的几百倍[37],需要在后续处理过程中对其进行重点关注。
2.2 BAF对DOM分子的去除与转化
BAF处理前后水样中DOM分子水平参数的强度加权平均值如表2所示;BAF处理和氯化消毒后水样中DOM分子量(molecular weight,MW)、元素组成和物质组成的变化,如图3所示。

图3 BAF处理和氯化消毒后水样中DOM分子量、元素组成和物质组成的变化Fig.3 Changes in molecular weight,element composition and substance composition of DOM in water samples after BAF and chlorination

表2 BAF处理前后水样中DOM分子水平参数的强度加权平均值
由表2和图3可知:
1) 经BAF处理过后进水中DOM的平均分子量从409.25 Da增加到417.66 Da,但DOM分子量分布变化不明显[图3(a)],说明只有少部分小分子有机物在此过程中被矿化或被转化成高分子量SMPs[4]。
2) 根据DOM的元素组成将其分为8类[图3(b)],进水中CHO、CHNO和CHOS类分子的数量最多,这与Wagner等[38]对江水中DOM分子组成的研究一致。BAF出水中这几类数量较多的DOM分子的数量降低,而CHNOS和CHNOCl这两类杂原子数量更多的分子数量增加了,这个现象与污水处理厂生物处理过程对DOM的转化相似[39]。
3) 根据DOM分子的氢碳比(H/C)和修正后的芳香性指数(AImod)可将DOM分为高度不饱和类及酚类物质、饱和类物质、脂肪类物质、多酚类物质、稠环多环芳烃这5类[40]。由图3(c)可见,进水中主要为脂肪类物质和高度不饱和类及酚类物质,这两者的占比达90%以上。经BAF处理后水样中脂肪类物质的比例降低,高度不饱和类及酚类物质的比例升高,可能是由于滤池中的生物膜将脂肪类物质转化为高度不饱和类及酚类物质。
分别比较BAF处理前后和氯化消毒前后水样中单个DOM分子的变化情况,将DOM分为被去除的DOM分子、生成的DOM分子和未变化的DOM分子这3类。BAF处理和BAF出水氯化消毒过程中DOM的分子转化,如图4所示。
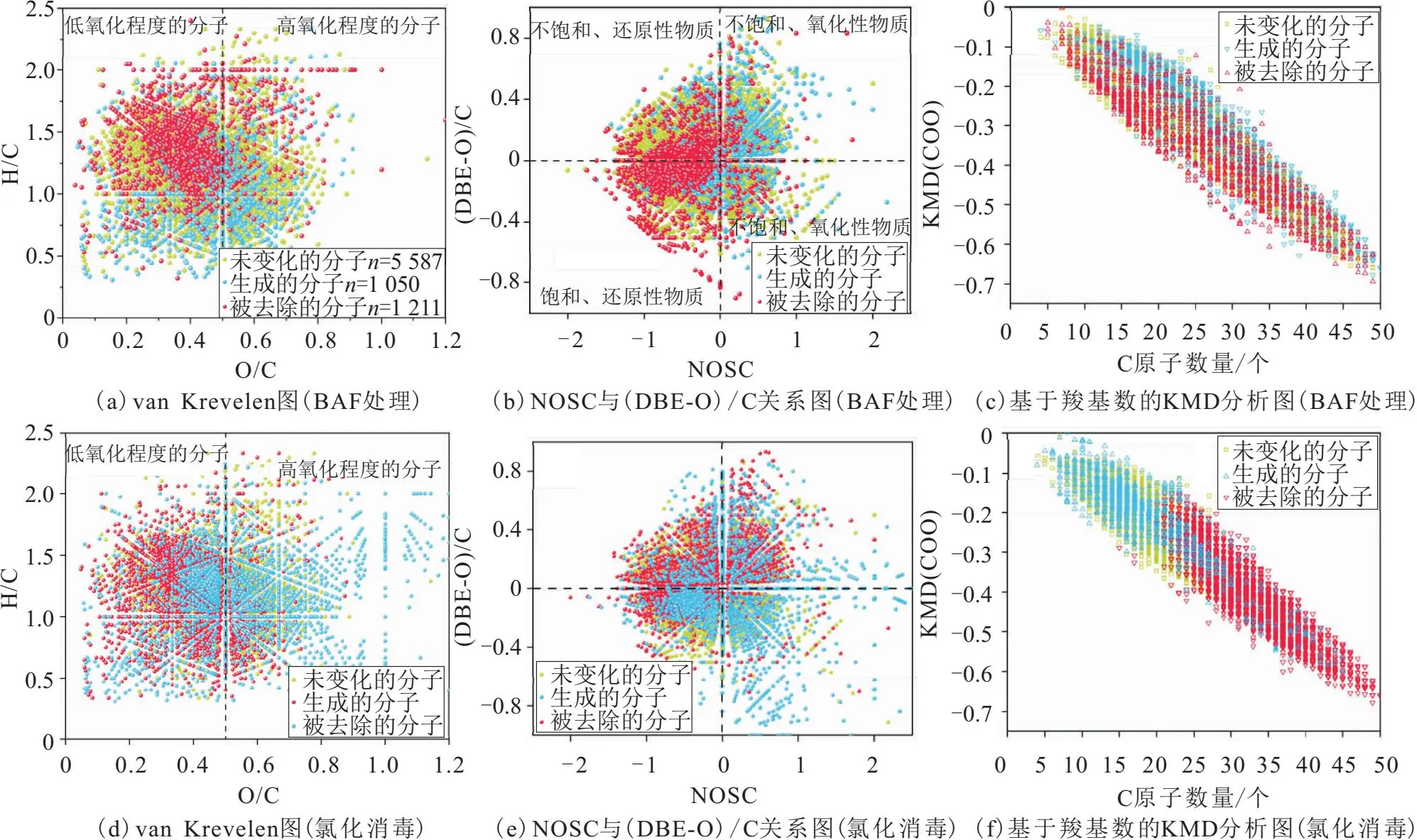
图4 BAF处理和BAF出水氯化消毒过程中DOM的分子转化Fig.4 Molecular transformation of DOM during BAF and chlorination
由图4可以看出:
1) 经BAF处理去除了1 211个DOM分子,生成了1 050个DOM分子,但仍有5 587个DOM分子难以被去除。被去除的DOM分子集中在O/C小于0.5和H/C大于1的区域,生成的DOM分子主要分布在O/C大于 0.4和H/C小于1的区域[图4(a)],说明BAF处理倾向于将低氧化程度和高饱和度的DOM分子转化成高氧化程度和高不饱和度的DOM分子,对应着BAF处理后水样中DOM的平均H/C值降低、双键当量(double bond equivalent,DBE)和芳香度(AImod)升高(表2)。笔者团队之前的研究表明高氧化程度和高不饱和度的DOM分子(O/C>0.5和H/C<1)易于被混凝沉淀去除,说明该水厂BAF后续的混凝工艺有利于去除BAF产生的DOM分子。
2) 根据碳的名义氧化程度(NOSC)和不饱和度[(DBE-O)/C]值的正负将DOM分子分为:①不饱和、还原性物质;②不饱和、氧化性物质;③饱和、还原性物质;④饱和、氧化性物质[图4(b)][41]。可见,BAF处理去除的DOM分子主要为NOSC值小于0的还原性物质,生成的DOM分子为NOSC值大于0的氧化性物质。
3) 通过基于羧基(COO)数的Kendrick质量亏损[KMD(COO)]分析来探究水样中被去除的DOM分子、生成的DOM分子和未变化的DOM分子的结构信息可知:越靠右的DOM分子含羧基数和碳原子数越多,越靠上的DOM分子不饱和度越高;被去除的DOM分子的KMD值普遍低于生成的DOM分子,而生成的DOM分子含有更多的羧基[图4(c)]。这进一步证明BAF生成的DOM分子易于被后续的混凝沉淀去除,因为羧基越多的DOM分子越容易与铝离子络合从而被混凝沉淀去除[42]。
2.3 氯化消毒对DOM分子组成的影响
由于次氯酸钠的氧化作用,进水和BAF出水中大量分子量大于500 Da的DOM分子在氯化消毒后被矿化或被分解成小分子[图4(a)][34],DOM的平均分子量随之明显降低(表2);消毒后水样中CHO和CHNO类分子的数量明显减少,CHOCl和CHNOCl类的分子大量增加,说明CHO和CHNO类分子作为主要的DBPs前体物参与了CHOCl和CHNOCl类DBPs的生成[图4(b)][7,18-19]。
van Krevelen图显示次氯酸钠主要是将水样中低氧化程度(O/C<0.5)的分子矿化或与之反应生成高氧化程度的分子[图4(d)],说明低氧化程度分子与氯反应更活跃,因为将还原性越强的化合物氧化可以获得更多的能量[18]。此外,次氯酸钠主要是将水样中DOM中的不饱和组分转化为饱和物质[图4(e)]。如图4(f)所示,水样中被次氯酸钠氧化去除的DOM分子主要分布在碳原子数量大于20个的区域,部分被去除的DOM分子被氧化或与氯反应生成了大量碳原子数量低于25个的DOM分子。
2.4 BAF处理对氯代DBPs生成的影响
为了准确地鉴定氯化消毒后生成的氯代DBPs,将进水和BAF出水中已存在的含氯有机物剔除,剩余的即为新生成的氯代DBPs。结果表明:进水消毒后产生了1 096个氯代DBPs,BAF出水消毒后产生了1 119个氯代DBPs;虽然BAF将进水中DOC浓度降低了约28%,但后续消毒过程中生成的氯代DBPs数量有些许升高,可能是由于生物膜产生的SMPs参与了氯代DBPs的生成。
一般来说,主要通过氧化反应、取代反应和加成反应来与DOM反应[7],而后两种反应会将氯原子加入到有机物分子中导致DBPs的形成。表3中汇总了可能致使DBPs生成的反应途径,除了+Cl—H以外,其他几种反应途径都会将O原子加入到DBPs分子中,这解释了为何氯化消毒过后水样中DOM的平均O/C值上升(表2)。
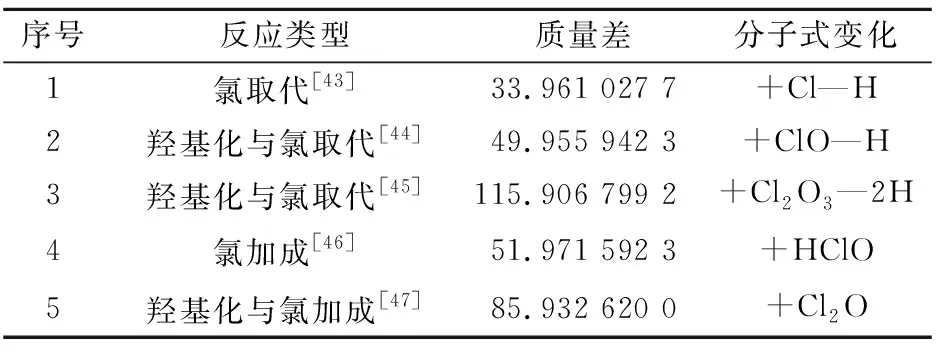
表3 导致氯代DBPs生成的可能的反应途径
由表3可知,DOM分子(前体物)与氯可能的反应途径有5种,每种类型反应后生成的DBPs与其前体物的相对分子量的差即为一个质量差。将氯化消毒后被去除的DOM分子的相对分子量与氯化消毒过后生成的DBPs的相对分子量相减,差值符合表3中质量差(包括质量差的整数倍)的即为一个前体物-DBPs反应对,该方法可以精准识别DBPs的前体物和DBPs的生成途径[25]。
将进水和BAF出水氯化消毒过后的DBPs及其前体物作反应途径网络图(图5),其中每个箭头代表一种或一类反应,节点的大小代表每个分子O/C值的大小。进水和BAF出水中出现最频繁的反应类型均为氯取代(+Cl—H)、氯加成(+HClO)和羟基化与氯取代(+ClO—H)3种;BAF处理后前体物-DBPs反应对的数量(即图5中边的数量)从3 644增加到3 695,且各种反应途径的数量也基本没有变化,说明从整体来看BAF对DBPs的生成途径的影响并不大。
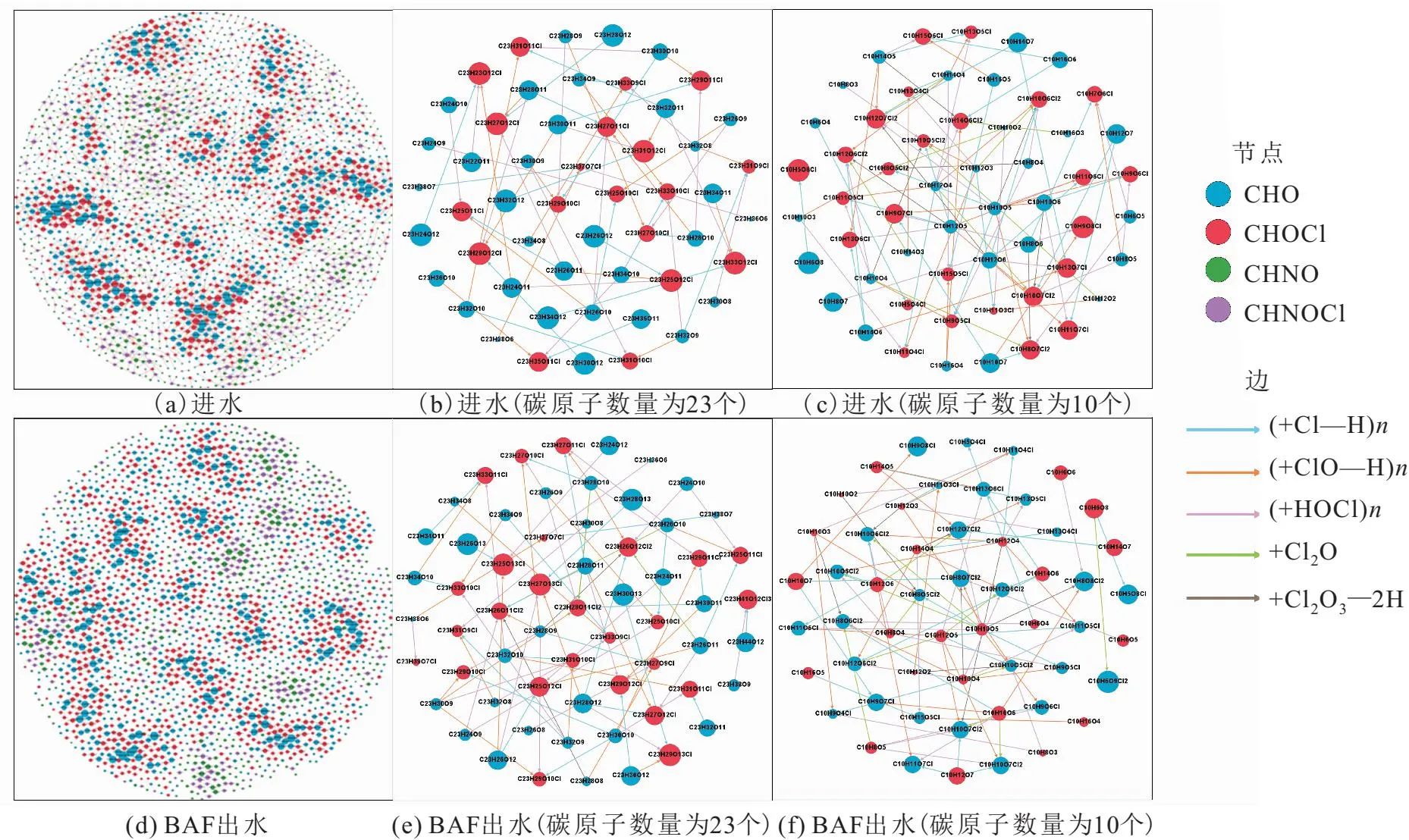
图5 BAF处理和氯化消毒前后水样中DBPs与其前体物的反应途径网络图Fig.5 Network diagrams of reaction pathways DBPs and their precursors before and after BAF and chlorination
为了更清晰地观察BAF对DBPs生成途径的影响效果,选择碳原子数量为23个和10个的DBPs及其前体物作网络图(图5),结果表明:BAF处理后碳原子数量为23个的前体物-DBPs反应对中新增了许多+Cl2O和+Cl2O3—2H两种反应类型;BAF处理对碳原子数量为10个的小分子基本无影响,且小分子参与的反应类型更多、更复杂,需要在处理过程中重点关注这些小分子物质。
为了明确BAF处理对DBPs及其前体物的影响,将进水和BAF出水氯化消毒后的DBPs及其前体物分子通过van Krevelen图作对比,其结果见图6(a)。BAF处理去除了257个DBPs前体物,但新生成了174个DBPs前体物;被去除的前体物主要分布在O/C<0.5和H/C>1的区域,新生成的前体物主要分布在H/C<1.2的区域,致使BAF出水的DBPs前体物的不饱和度和芳香度升高(表4)。此外,BAF处理过后前体物的平均分子量也明显升高,这些现象与BAF对进水DOM的去除与转化一致(即分子量、饱和度和芳香度升高)。BAF处理对DBPs的影响与对DBPs前体物的影响一致,DBPs的O/C值要明显高于其前体物[图6(b)]。根据O原子数量对DBPs及其前体物分类[图6(c)、(d)],发现BAF处理后O原子数量低的DBPs及其前体物减少而O原子数量高的DBPs和前体物增加,这说明了BAF过程中发生了低含氧量分子向高含氧量分子的转化。
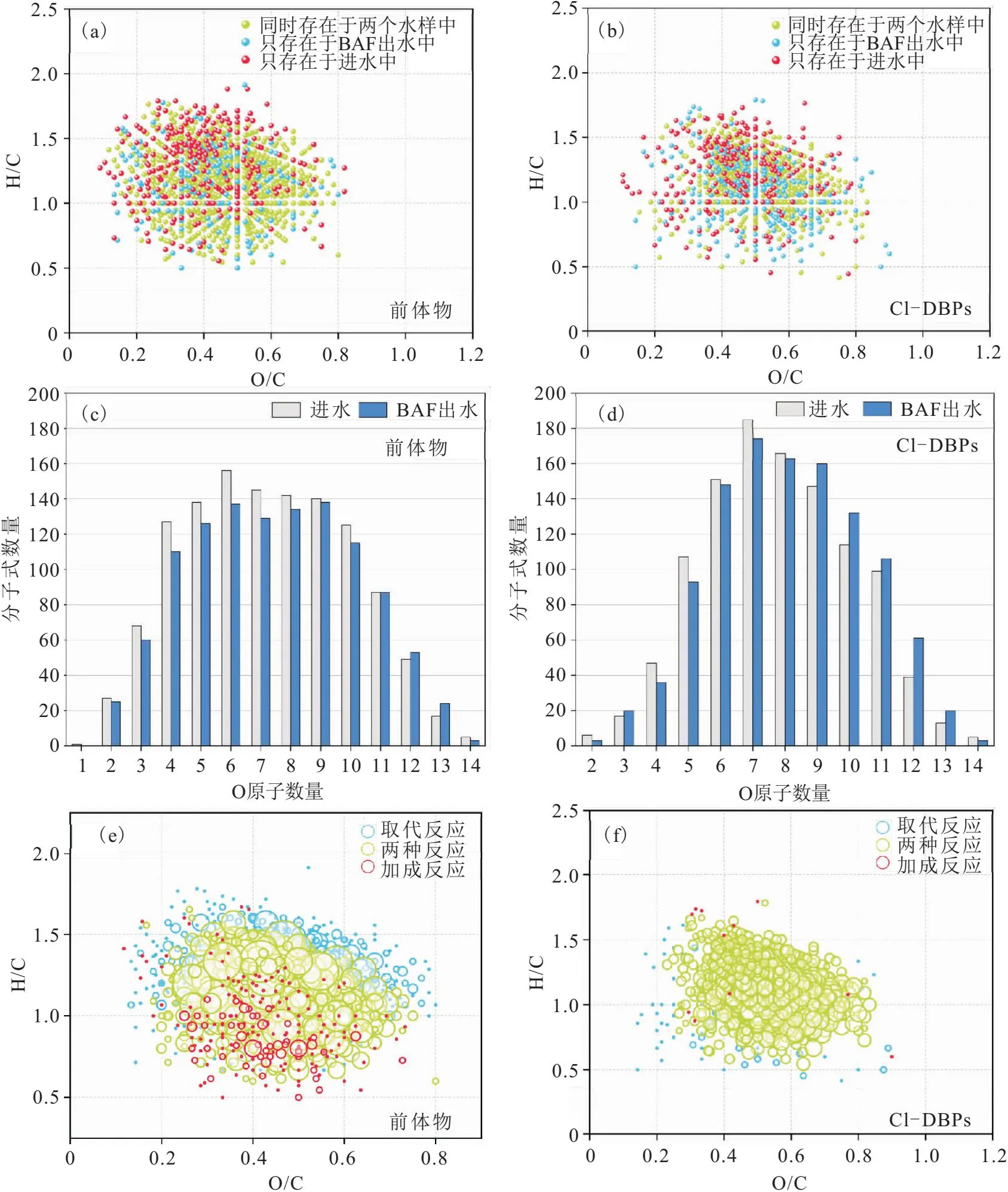
图6 进水和BAF出水中DBPs及其前体物的差异[(a)、(c)、(e)]和生成DBPs的反应类型[(b)、(d)、(f)]Fig.6 Differences between DBPs and their precursors in influent and BAF effluent [(a)、(c)、(e)] and reaction pathways of DBPs formation [(b)、(d)、(f)]

表4 BAF处理前后水样中DBPs及其前体物分子水平参数的强度加权平均值
总的来说,BAF导致了氯化消毒过后DBPs的总体分子结构从低氧化程度和低不饱和度向高氧化程度和高不饱和度的转变。这些高氧化程度和高不饱和度DBPs的含氧量和不饱和键更多,可能含有更多的羰基和芳香环,而羰基和芳香性DBPs通常被认为具有比脂肪族DBPs(如THMs和HAAs)更高的毒性和健康风险。
然而,笔者团队前期的研究发现,由于高氧化程度和高不饱和度的DOM分子含有更多的含氧官能团和不饱和键,导致其更易于被混凝去除,使得混凝前预氯化产生的高氧化程度和高不饱和度DBPs在混凝沉淀后被大量去除[48]。因此,虽然BAF处理对DBPs及其前体物的削减效果较弱,但在分子水平上,BAF处理对DOM分子的转化可能会促进水厂后续的混凝沉淀单元对DBPs及其前体物的去除效果。
根据进水和BAF出水中DBPs及其前体物的反应途径作van krevelen图[图6(e)、(f)],图中圆圈越大代表参与的反应途径越多。结果表明:参与加成反应的DBPs前体物的不饱和度要比参与取代反应的DBPs前体物高,这可能是由于前体物分子的不饱和基团越多越有利于氯原子加成到不饱和基团中[49]。此外,O/C值越低的分子参与的反应越多,进一步证明了氯倾向于跟低氧化程度的分子发生反应生成DBPs。如图6(f)所示,几乎所有的DBPs都可能通过多种反应途径产生,这说明DBPs的生成过程十分复杂。
本研究的发现可证明FT-ICR MS结合质量差网络分析在探究未知DBPs及其形成途径方面具有潜力。然而,这些未知DBPs的分子结构尚不清楚。还需要进一步的研究来识别DBPs的结构,如超高效液相色谱串联Orbitrap MS[6]和碰撞诱导裂解质谱[25],这将有助于通过定量构效关系(QSAR)或其他方法评估这些DBPs的潜在毒性。
3 结 论
1) 经BAF处理后进水中DOC和UV254值分别降低了约28%和16%,类芳香蛋白质被部分去除。常规DBPs分析结果显示:BAF处理后,THMs、HAAs和HANs的浓度轻微降低,HNMs的浓度有所升高,这些DBPs仅能解释不到浓度占比60%的总有机氯化物。
2) BAF处理倾向于将低氧化程度和高饱和度的分子转化成高氧化程度和高不饱和度的分子,致使BAF处理后水样中DOM分子的平均H/C值降低和平均DBE升高。这是因为滤池中的生物膜主要是将脂肪类物质转化为高度不饱和类及酚类物质,氯易于与低氧化程度的高分子量有机物反应生成高氧化程度的小分子有机物。
3) CHO和CHNO类物质是最主要的DBPs前体物。氯取代(+Cl—H)、氯加成(+HClO)和羟基化与氯取代(+ClO—H)3种反应类型是最主要的DBPs生成途径,参与加成反应的DBPs前体物的不饱和度要比参与取代反应的DBPs前体物高。
4) 虽然BAF处理可能会导致一些健康风险更高的含羰基或芳香性DBPs的生成,但其对DOM分子的转化可能会促进水厂后续的混凝沉淀单元对DBPs及其前体物的去除。
