新生儿肠道CRKP定植和继发感染的影响因素
2024-02-24李庆蓉和平安
翟 誉,李庆蓉,李 江,何 薇,和平安,吕 梅,杨 旭
(昆明医科大学第二附属医院检验科,云南 昆明 650032)
肺炎克雷伯菌(Klebsiellapneumoniae, KP)是社区和医院中常见的一种病原菌。近年来随着临床对碳青霉烯类抗生素的过度使用,耐碳青霉烯类细菌的检出率不断增加。据中国细菌耐药监测网数据显示,我国新生儿2019、2020、2021年耐碳青霉烯类肺炎克雷伯菌(CRKP)的检出率分别为14.5%、15%和13.4%,远高于老年组(>65岁)、成人组(14~65岁)和儿童组(<14岁)[1]。复旦大学附属儿童医院的一项研究[2]表明,新生儿CRKP感染发生率较高,是新生儿健康的一大威胁,严重危害公共卫生安全[3]。胃肠道定植是CRKP感染的潜在危险因素[4],新生儿因肠道屏障功能和免疫功能不全而易于定植CRKP,使CRKP肠道定植成为继发感染的潜在原因[5]。虽然已有新生儿CRKP定植及其分子流行病学的相关报道[6],但对新生儿CRKP肠道定植及定植后继发感染的相关因素与同源性关系的研究较少,定植与定植后继发感染的相关因素尚不明确,且无新生儿CRKP肠道定植的保护因素的探究,因此,了解新生儿肠道定植及定植后继发感染的影响因素有利于医院感染控制措施的完善与实施。
本研究旨在通过收集某院新生儿科的临床病历信息,分析新生儿CRKP肠道定植及定植后继发感染的危险及保护因素,并通过多位点序列分析(MLST)与脉冲场凝胶电泳(PFGE)的方法来探究新生儿肠道定植转为感染的CRKP菌株之间的同源性关系。研究定植及定植后继发感染的影响因素,控制危险因素,加强保护因素,降低新生儿CRKP肠道定植和定植后继发感染的发生率。
1 对象与方法
1.1 研究对象 选取2021年1月—2022年10月昆明医科大学第二附属医院入住新生儿科的新生儿为研究对象。
1.2 研究方法
1.2.1 研究分组 新生儿入院后48 h内进行一次耐碳青霉烯类肠杆菌(CRE)主动筛查,并在住院期间每周进行一次CRE肛拭子主动筛查。纳入标准:CRKP肠道定植组,粪便培养或肛周拭子CRE筛查阳性且鉴定为CRKP;非CRKP肠道定植组,48 h内两次粪便培养或肛周拭子CRE筛查阴性。CRKP肠道定植后继发感染组:已发生CRKP肠道定植,明确有临床感染症状且标本中分离出CRKP菌株。排除标准,入院后48 h内未进行粪便/肛拭子主动筛查的新生儿和入院前有证据表明存在CRKP定植或已发生临床感染症状的新生儿。
在定植相关因素分组中将发生CRKP肠道定植的新生儿作为定植组,共174例,采用随机抽样的分层抽样法对非定植新生儿抽样,保证定植组和非定植组在相同时间段入院,最终筛选出174例无CRKP肠道定植的新生儿作为非定植组。定植组与非定植组两组的病例基础状态一致。同时在分析定植继发感染的相关因素中,将研究对象分为感染组与非感染组,感染组为35例已确诊肠道CRKP定植且在住院期间发生CRKP临床感染的新生儿;非感染组为139例已确诊肠道CRKP定植但在随后住院期间未发生CRKP临床感染的新生儿。
1.2.2 诊断标准 CRKP定植定义为新生儿仅有直肠拭子分离培养阳性,但未表现出临床体征和/或症状。因CRKP菌株分离自新生儿肠道,因此定植来源为内源性。根据2001年卫生部颁发的《医院感染诊断标准(试行)》[7]。CRKP感染定义为新生儿至少有一份临床分离阳性标本,并且表现出临床感染阳性体征和/或症状和有相应的其他实验室阳性指标。本研究将整个住院时间作为CRKP发生定植到感染的随访时间。且将确定为CRKP肠道定植48 h后出现的临床感染定义为筛查标本和临床标本之间的“后续”感染。
1.2.3 资料收集及菌株来源 新生儿临床资料均从电子病历系统查阅获得。定植相关因素纳入时间为发生定植前3天,定植继发感染相关因素的纳入时间为定植后到发生继发感染症状前。相关因素内容包括:(1)新生儿因素。性别、低体重(<2 500 g)、极低体重(<1 500 g)、早产儿、试管婴儿、母乳喂养、羊水污染、Apgar评分≤7分、腹泻、低蛋白血症[清蛋白(Alb)<35 g/L]、中性粒细胞减少症(外周血中性粒细胞绝对值<1.5×109/L)、神经系统疾病、消化道出血(有相应的临床症状、符合消化道出血的实验室检查、影像学检查结果)、鼻胃管喂养、气管插管、机械通气、灌肠、口服益生菌,以及使用糖皮质激素、氟康唑、碳青霉烯类抗生素、氨基糖肽类抗生素、头孢菌素类抗生素、青霉素类抗生素。(2)母亲因素。多胎妊娠、胎膜早剥、剖宫产、高龄(>35岁)、妊娠高血压、妊娠糖尿病。(3)环境因素。入住新生儿重症监护病房(NICU)、总住院时间。同时对定植后继发感染的35例新生儿于2022年1—10月采集粪便/肛拭子和血/痰标本进行培养,从中培养、分离非重复CRKP菌株。将这些非重复CRKP菌株纯化、冷冻干燥,保存于-80℃冰箱备用。
1.3 试验方法
1.3.1 主要仪器与试剂 仪器:VITEK 2 Compact全自动微生物分析仪(法国梅里埃公司);基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)(德国布鲁克公司);Thermo SeriesⅡWater Jacket CO2温箱;法国生物梅里埃DENSICHEK电子比浊仪;郎基聚合酶链式反应(PCR)基因扩增仪A300(杭州郎基科学仪器有限公司);君意JY300C通用型电泳仪(北京君意仪器公司);凝胶成像分析系统-JY04S-3C(北京君意仪器公司);高速冷冻离心机(大龙兴创实验仪器有限公司);恒温金属浴(杭州奥盛);海尔-80℃冰箱。质控菌株:大肠埃希菌ATCC 25922。试剂:VITEK 2 GN鉴定卡和VITEK 2 AST-GN334药敏卡(法国生物梅里埃公司);麦康凯培养基、Mueller-Hinton培养基(郑州安图生物工程股份有限公司);PCR扩增试剂(1×TSE101金牌mix、ddH2O、引物)、5 000 bp DNA分子量标准(DNA Marker)、含蛋白酶K的细胞裂解液、EB染料、琼脂糖、LB琼脂平板(北京擎科生物科技公司)。
1.3.2 菌株鉴定 使用VITEK 2全自动微生物分析仪对所有分离菌株进行鉴定。同时采用MALDI-TOF MS对平板上的单个菌落进行复核,确保试验菌株为CRKP菌株。
1.3.3 DNA提取 采用煮沸法提取菌株DNA。挑取3个纯菌落置于含有500 μL含有灭菌双蒸水的EP管中,充分混匀制成菌悬液后于金属浴中加热10 min,使用高速离心机13 000 r/min离心5 min,离心后所得上清液即为DNA模板。
1.3.4 碳青霉烯酶基因检测 参照GeneBank中目标基因的标准序列并查阅相关文献[8]选取引物,采用聚合酶链式反应(PCR)扩增35例新生儿分离的CRKP菌株DNA模板中的碳青霉烯酶耐药基因(blaKPC-2、blaNDM-1、blaOXA-48、blaIMP)。将得到的扩增产物送至北京擎科生物科技公司进行测序,测序结果在NCBI BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对。引物序列见表1。
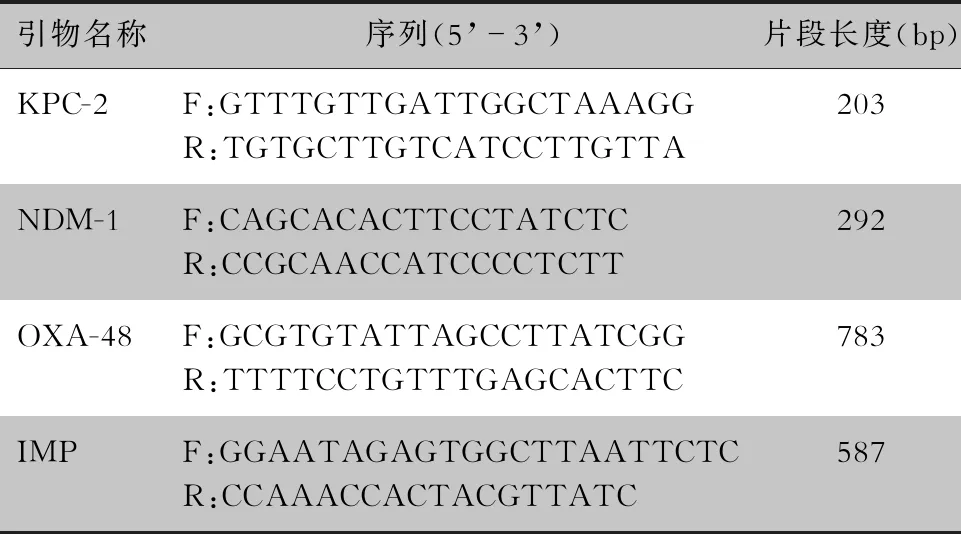
表1 CRKP菌株PCR扩增耐药基因引物序列及产物大小
1.3.5 MLST检测 参照MLST网站(https://bigsdb.pasteur.fr/klebsiella/primers_used.htmlpasteur.fr)提供的引物序列,扩增KP的7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB),将扩增产物送至北京擎科生物科技公司测序。
1.3.6 PFGE检测 为更详细地分析CRKP菌株之间的同源性,进行PFGE检测。首先将标本接种于LB琼脂平板,37℃过夜,用bioMérieux DENSIMAT比浊仪调整细菌悬液浓度,使浊度为3.8~4.2。加入1% Seakem Gold胶,混匀制备胶块。使用含蛋白酶K的细胞裂解液(CLB)消化2 h。纯水清洗胶块2次;TE(10 mmol/L Tris:1 mmol/L EDTA,pH值8.0)清洗胶块4次。使用XbaI内切酶进行酶切,在37℃孵育4 h。在CHEF-DRIII(Bio-Rad Laboratories公司)电泳仪中进行PFGE。电泳后将胶放入含1 μg/mL溴化乙啶(EB)染色25~30 min,置纯水中脱色至少90 min,每30 min换一次纯水。在读胶仪中成像。
将获得的PFGE图像录入BioNumerics(Version 8.0,Applied Maths, Belgium)软件包进行处理,经统一的分子质量标准,分子量标准用沙门菌H9812经过XbaI酶切后的片段标定条带位置,识别图像条带,必要时进行手工校正,<20.5 Kbp的条带忽略不计。每两个图像之间的相似性系数用Dice系数(Dice coefficient)表示,根据每两个图像之间的相似性系数,用非加权配对算术平均法(unweighted pair-group method using arithmetic ave-rages, UPGMA)进行聚类,构建聚类树。
1.4 统计学方法 应用SPSS 26.0统计软件进行录入与分析。对于符合正态分布的计量资料采用t检验,对于非正态分布的计量资料采用非参数检验(Mann-Whitney秩和检验),总住院时间以中位数(四分位数间距)[M(P25,P75)]表示;计数资料采用卡方检验或Fisher确切概率法,以例或百分比(%)表示。影响因素分析时,先对各种可能因素进行单因素分析,再将单因素分析中P≤0.05的因素纳入多因素分析,多因素分析采用二元logistic回归模型。P≤0.05为差异具有统计学意义。
2 结果
2.1 新生儿CRKP肠道定植的影响因素 共有174例定植组与174例非定植组新生儿进行CRKP肠道定植相关因素的分析。2021年1月—2022年10月该院新生儿肠道CRKP总定植率为12.1%(174/1 438)。单因素分析结果表明,低体重(<2 500 g)、早产儿、多胎、Apgar评分≤7分、剖宫产、母乳喂养、入住NICU、鼻胃管喂养、机械通气、气管插管、肠外营养、灌肠、低蛋白血症、消化道出血、口服益生菌、总住院时间长、使用糖皮质激素,以及使用碳青霉烯类、氨基糖肽类、头孢菌素类、青霉素类抗生素和氟康唑在定植组和非定植组间比较,差异均有统计学意义(均P<0.05)。见表2。
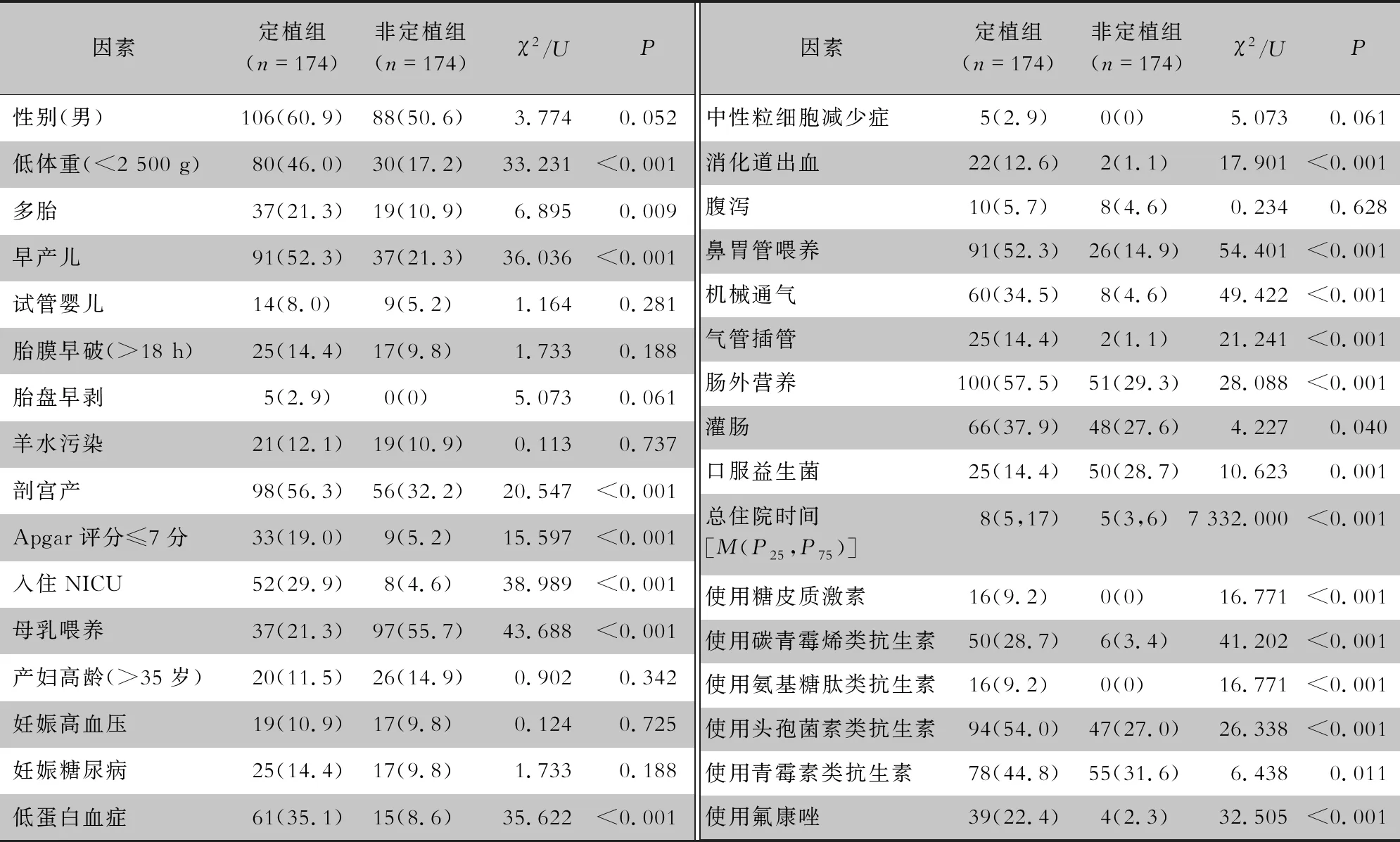
表2 新生儿CRKP定植影响因素的单因素分析[例(%)]
将单因素分析中有统计学意义的变量进行二元logistic回归分析,剖宫产、使用头孢菌素类抗生素、鼻胃管喂养是新生儿发生CRKP定植的独立危险因素(均OR>1,P<0.05)。母乳喂养、口服益生菌、灌肠是保护因素(均OR<1,P<0.05)。见表3。
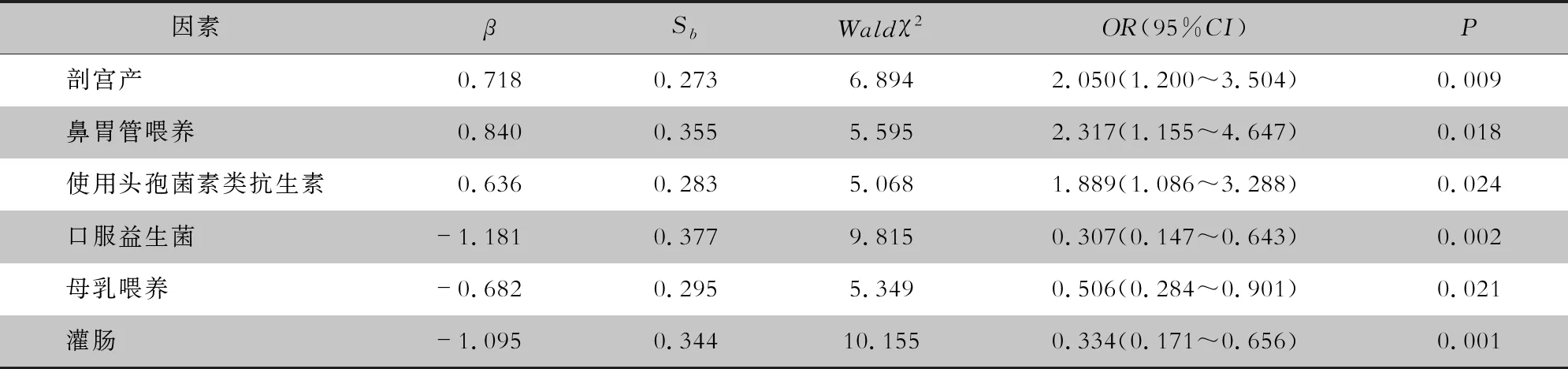
表3 新生儿CRKP定植影响因素的logistic回归分析
2.2 新生儿CRKP肠道定植后继发感染的影响因素 2021年1月—2022年10月,该院新生儿科CRKP定植后继发感染的新生儿共35例,占新生儿科所有CRKP肠道定植新生儿的20.1%(35/174)。感染组35例新生儿与非感染组139例新生儿进行CRKP肠道定植后继发感染相关因素的分析。CRKP肠道定植后继发感染危险因素的单因素分析结果显示:极低体重(<1 500 g)、早产儿、母乳喂养、入住NICU、低蛋白血症、神经系统疾病、消化道出血、鼻胃管喂养、气管插管、机械通气、灌肠、总住院时间长、使用糖皮质激素,以及使用碳青霉烯类、氨基糖肽类抗生素、氟康唑在感染组和非感染组间比较,差异均有统计学意义(均P<0.05)。见表4。
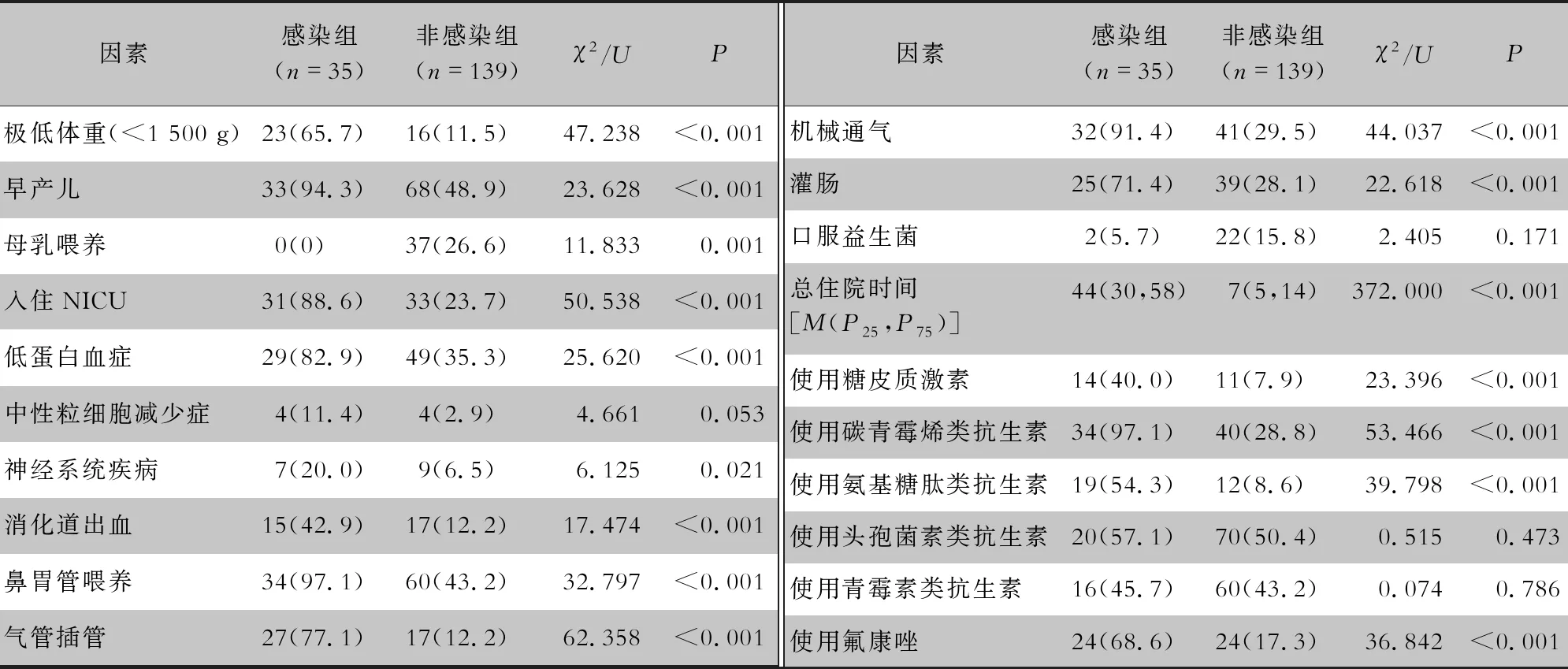
表4 CRKP继发感染影响因素单因素分析[例(%)]
将单因素分析中有统计学意义的变量进行二元logistic回归分析,使用碳青霉烯类抗生素、总住院时间长是CRKP定植后继发感染的独立危险因素(均OR>1,P<0.05)。见表5。

表5 CRKP继发感染影响因素的logistic回归分析
2.3 碳青霉烯酶耐药基因检测结果 将从感染组分离的CRKP菌株耐药基因序列与NCBI网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,结果显示感染组CRKP菌株产碳青霉烯基因均为blaKPC-2。同时未发现携带blaNDM-1、blaIMP、blaOXA-48耐药基因类型的CRKP菌株。部分CRKP菌株的KPC-2耐药基因型检测结果见图1。
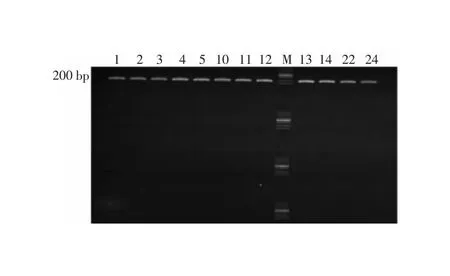
注:M为DNA Marker;1、2、3、4、5、10为部分新生儿的粪便(肛拭子)标本分离的定植菌;11、12、13、14、22、24为感染后其血或痰标本分离的感染菌。
2.4 MLST结果 将测序结果在MLST网站上进行比对,获得每个管家基因的等位基因编号。参照MLST网站比对CRKP分离菌株的等位基因编号,其编号为3-3-1-1-1-1-4,根据分析得出肠道CRKP定植菌与定植后继发感染CRKP菌株的序列分型全部为ST11型。
2.5 PFGE结果 对感染组中来自粪便(肛拭子)标本、痰或血标本中的菌株进行复苏,共成功复苏7株肛拭子标本和7株对应新生儿的痰或血标本中的CRKP菌株。将14株成功复苏的CRKP菌株进行PFGE分型,PFGE聚类分析图谱显示,此14株CRKP菌株属于同一型别,且同源性为100%。见图2。

注:13、14、15、16、17、18、19为感染组中7例新生儿粪便(肛拭子)标本中分离的菌株即定植株;20、28、29、30、31为感染组7例新生儿痰标本分离的菌株即感染株;26、27为其对应的从血标本分离的菌株即感染株。
3 讨论
新生儿CRKP的检出率随临床碳青霉烯类抗生素的大量应用日益增加[9]。研究[2]表明,新生儿CRKP感染率逐年增高。新生儿CRKP的高检出率及感染率引起了人们的关注。CRKP定植是感染的潜在危险因素[10],无论是成人还是新生儿。有关成人CRKP定植后继发感染的研究[11]显示,CRKP定植者中CRKP感染率为8.8%~42%。定植后继发感染的差异可能是因为纳入的患者群体和所在环境不同,以及对感染控制措施的实施方案不同。研究[12]采用新生儿肛拭子和咽拭子标本,CRKP定植新生儿继发临床感染的风险为19.1%,本研究采用肛拭子主动筛查,结果表明该院CRKP定植新生儿中20.1%后续出现临床感染症状。胃肠道是最常用的耐药菌筛查部位,特别是直肠或肛周拭子[13],但该院新生儿肠道定植后继发CRKP感染的概率与研究[12]中新生儿由定植继发为感染的概率相近,殷丽军等[12]研究对象为NICU中新生儿,NICU中新生儿病情危重,侵入性操作或抗菌药物应用频繁,机体免疫力差,黏膜屏障功能减弱,更易发生CRKP感染。
CRE在新生儿中的感染率不断增加[14],新生儿感染CRE后会引起各种并发症,严重的会诱发死亡,因此了解新生儿感染CRE尤其是CRKP的危险及保护因素尤为重要。
新生儿由于吮吸吞咽及胃肠蠕动功能不完善,需要鼻胃管喂养。鼻胃管喂养为侵入性操作,可造成新生儿黏膜损伤导致其防御功能减弱易于CRKP定植。抗菌药物的使用是新生儿CRKP定植的独立危险因素,与研究[15]结果相同。其中头孢菌素类抗生素的使用是CRKP定植的独立危险因素,与Qin等[13]研究结果相同。而头孢菌素类抗生素可抑制或杀灭大多数细菌,导致胃肠道菌群紊乱,易于细菌在肠道内定植。剖宫产也是新生儿CRKP定植的独立危险因素,分娩方式会影响新生儿肠道菌群定植。剖宫产出生的新生儿肠道菌群与母亲皮肤和医院环境微生物群相似[16],这些细菌对各种抗菌药物具有抗药性。因此,CRKP更容易在剖宫产出生的新生儿肠道中定植。
母乳喂养是新生儿CRKP定植的保护因素[14]。除此之外,益生菌的使用也是CRKP定植的保护因素,但目前尚未有益生菌使用的相关报道。母乳中含有一些益生菌[17],母乳喂养可刺激细菌增殖,有助于建立正常的肠道菌群,从而促进肠道成熟,增强免疫保护[18]。益生菌是一类活性微生物菌,进入人体后可通过刺激其他微生物生长,调节胃肠道黏膜及全身系统的免疫反应,防止CRKP菌株在胃肠道的定植,从而阻遏CRKP由定植进一步发展为感染。
本研究发现灌肠是CRKP定植的保护因素。新生儿胃肠道未发育完全,肠道蠕动功能差,可以通过灌肠的方式刺激肠蠕动,促进粪便排泄。灌肠是首次被报道为CRKP定植的保护因素,灌肠可能是通过改善肠道内环境,减少肠道内有害菌数量,减少细菌在新生儿肠道的定植与继发感染。
本研究结果表明,新生儿CRKP定植继发感染的独立危险因素与碳青霉烯类抗生素的使用相关,与其他研究[12]不同。碳青霉烯类抗生素在CRKP从定植发展为感染的过程中会破坏肠道的微生态平衡,从而使相互竞争的病原菌被消除,最终导致CRKP大量增殖。此外,Lin等[19]研究表明碳青霉烯类抗生素的长期使用可诱导获得性KPC酶的产生,而产KPC酶定植患者更容易发生CRKP感染。同时该院夏晴[20]研究也发现新生儿的感染病原菌为产KPC酶的CRKP菌株,进一步表明碳青霉烯类抗生素的长期使用会成为新生儿CRKP定植继发感染的独立危险因素。研究[21]表明住院时间延长是CRKP感染的危险因素,在本研究中总住院时间是肠道定植新生儿继发感染的独立危险因素。随着住院时间的延长,新生儿机体免疫力差,黏膜屏障功能受损,肠道定植细菌CRKP较易发生移位,导致CRKP感染。
国内外对于胃肠道定植与感染关系研究相对普遍,2017年国外一项探讨胃肠道定植与感染之间关系的研究[22]表明,与肠道非定植患者相比,胃肠道定植患者易感染肺炎克雷伯菌。对基于基因组学进行的两项研究的结果中也表明定植菌株与感染菌株的同源性可高达80%[23]。blaKPC-2是我国成人CRKP菌株的主要耐药基因型,而我国新生儿流行的耐药基因型主要为NDM-1型[24]。该院新生儿主要感染产KPC-2酶KP[20],与文献[23]报道不一致。研究[13]显示环境可作为人类获得KP的贮菌源,无论是定植还是感染。因此,推测此次该院新生儿流行的KPC-2的CRKP菌株可能是由成人病房传播或因医院环境污染引起,也可能是新生儿免疫力低发生的宿主菌自身性感染,需要进一步研究。
为进一步验证CRKP定植与感染菌株之间的同源性,本研究对定植和感染菌株进行了PFGE分析。虽然MLST和PFGE均可以用作细菌分型,但相比较而言,PFGE检测分辨率高、分型能力强。而MLST检测分辨率较低,难以对细菌进行准确的同源性分析。因此通过使用MLST和PFGE两种分子检测方法能更好确定其同源性,以便进一步的分析研究。PFGE结果显示,14株CRKP菌株同源性为100%,与MLST结果一致,表明肠道定植与继发感染的CRKP菌株间具有同源性。
本研究仍具有一定的局限性,首先没有将新生儿感染的CRKP菌株与医院其他科室流行的CRKP菌株进行比较,对传播流行的原因不清楚。其次,护理人员与同一病房住院新生儿之间的个人接触是最可能的传播途径,但没有对医院的环境及人员进行微生物检测,不能排除环境或者护理人员手卫生消毒不彻底这一传播因素。最后,目前为止仍然无法确定这种克隆型菌株是如何传播至新生儿病房,未来有待进一步研究。
总之,本研究通过分析CRKP定植及定植继发感染的影响因素,可为降低新生儿科CRKP感染率提供科学依据。在新生儿科定期主动筛查CRE,及时监测耐药菌及其分子流行病学特征,尽早开始母乳喂养与使用益生菌,并采取医院感染防控措施,有助于避免CRKP在新生儿病房中的暴发流行。
利益冲突:所有作者均声明不存在利益冲突。
