金属负载氧化石墨烯对CO2水合物生成的动力学特性研究
2024-02-23建伟伟张在源
叶 赛, 建伟伟, 王 帅, 张在源
(辽宁石油化工大学 石油天然气工程学院,辽宁 抚顺 113001)
随着全球能源消耗量的逐年增长,温室气体CO2的排放量急剧增加,导致温室效应不断加剧[1]。为解决这一全球化问题,碳捕获、利用和封存(CCUS)技术受到越来越多的关注[2]。其中,将CO2气体以水合物的状态封存是有效捕获CO2的一种方法[3]。然而,水合物生成过程存在速度慢、储量低等问题,从而阻碍了该技术的推广[4-5]。
在现阶段的研究中,用于加速水合物生成的方法有物理法和化学法[6]。物理法包括搅拌[7]、鼓泡[8]、雾化[9]和加入表面活性剂[10-11],其目的在于扩大气-液接触面积,增强水合物生成过程中的传质传热,从而加快水合物的生成速度。根据促进机制的不同,化学法可分为热力学促进和动力学促进。其中,热力学促进剂通常包括四氢呋喃(THF)、四丁基溴化铵(TBAB)、丙酮和气体添加剂,其主要作用是降低水合物相平衡条件和缓和反应条件;动力学促进剂主要以表面活性剂为主[12],包括十二烷基苯磺酸钠(SDBS)、十二烷基硫酸钠(SDS)等,其主要作用是降低液体的表面张力,降低气体分子进入液相的扩散阻力,增加气体分子的溶解度,进而促进水合物的生成。物理法存在设备复杂、需要额外的能量消耗、不利于连续工业生产等问题,化学法则存在回收率低、部分添加剂有毒等问题[12]。
近年来,纳米流体因其优良的表面结构、较好的热导率等优点被广泛应用于促进水合物生成的研究。S.R.FIROOZABADI 等[13]在磁场条件下研究了Fe3O4纳米颗粒对CO2水合物生成的气体消耗量、诱导时间、水合转化率和储气量的影响。结果表明,与纯水体系相比,在温度为274.15 K、压力为4.0 MPa 的磁场条件下,当Fe3O4纳米颗粒的质量分数为0.15%时,CO2水合物生成的气体消耗量、储气量和水合转化率分别提高了443.9%、443.6% 和434.6%,诱导时间缩短了96.6%。
氧化石墨烯(GO)具有良好的分散性,且表面含有丰富的官能团,可明显促进水合物的生成[14]。N.LIU 等[15]考察了GO 质量分数(25、40、50、60 μg/g)对CO2水合物生成的影响,并与纯水体系中CO2水合物生成情况进行了对比。结果表明,质量分数为25 μg/g 的GO 促进CO2水合物生成效果最好,相较于纯水体系,其诱导时间约缩短了74.0%。S.YAN等[16]研究了GO 对CO2水合物生成的影响。结果表明,与纯水体系相比,质量分数为50 μg/g 的GO 纳米流体将CO2水合物生成的诱导时间缩短了53.0%~74.3%,最大气体消耗量增加了5.1%~15.9%。综上可知,GO 可明显缩短CO2水合物生成的诱导时间,增加气体消耗量。
研究表明,金属基纳米粒子对溶液导热性的影响较大,在水合物生成过程中可强化传热传质,促进异相成核,进而加快水合物的生成。S.ARJANG等[17]在压力为4.7、5.7 MPa 的条件下研究了银纳米粒子对甲烷水合物生成的促进作用。结果表明,在银纳米粒子的作用下,在压力为4.7、5.7 MPa 时,甲烷水合物生成的诱导时间较纯水体系分别缩短了85.0%和73.9%,水合物储气量分别增加了33.7%和7.4%。
金属负载到纳米碳材料,既可以保留材料本身良好的分散性,还可以提高金属的导热性。Y.M.SONG 等[18]将不同质量分数(2、5、10、20、40 μg/g)的银/铜纳米颗粒接枝到碳纳米管(Ag@OCNTs 和Cu@OCNTs)上,并用于甲烷水合物的生成。结果表明,金属纳米颗粒接枝到碳纳米管,可缩短甲烷水合物生成的反应时间;当金属纳米颗粒质量分数为40 μg/g 时,Ag@OCNTs 的反应时间最短,为125.1 min,而Cu@OCNTs 的反应时间为141.8 min。综上可知,金属负载碳纳米材料可作为水合物生成的良好促进剂促进水合物生成。
目前,金属基与纳米碳材料的复合材料在CO2水合物生成方面的研究较少。由于GO 在溶液中具有良好的分散性,金属Cu、Al 具有良好的导热性,本文将GO 与金属Cu、Al 结合,制备双金属Cu、Al 负载的氧化石墨烯(GO-Cu-Al),并进行了CO2水合物生成动力学实验;分析了GO-Cu-Al 质量分数对CO2水合物生成的诱导时间、反应时间、气体消耗量和储气量的影响,并对双金属负载材料与单金属负载材料进行了对比分析,以期为快速、高效的CO2水合物生成技术的研发提供理论依据和实验参考。
1 实验部分
1.1 实验材料
GO,片径为0.5~5.0 μm,厚度为0.8~1.2 nm,江苏先丰纳米材料科技有限公司;硝酸铝(Al(NO3)3,分析纯)、氯化铜(CuCl2,分析纯)、盐酸肼(H4N2·HCl,分析纯),国药集团化学试剂有限公司;去离子水,实验室自制。
1.2 实验装置
ME204E 型电子天平,梅特勒-托利多仪器上海有限公司;PS-60AL 型超声波清洗机,深圳市科洁超声科技有限公司;MS-1 型磁力搅拌器,常州峥嵘仪器有限公司;DHG-9620A 型干燥箱,上海申贤恒温设备厂;YK-RO-B 型超纯水机,舒活泉厦门智能科技有限公司。
实验室自行搭建了应用于CO2水合物生成的实验装置,如图1 所示。该实验装置由气瓶、高压反应釜、恒温水浴系统、图像和数据采集装置、真空系统等组成。高压反应釜容积为1 L,设计压力为10 MPa,高压反应釜盖上有温度传感器、压力传感器、高压进气口和排气口;温度传感器精度为±0.01 K,压力传感器精度为±0.1%,恒温水浴设计温度为263.15~323.15 K(精度为±0.01 K);使用相机实时记录CO2水合物生成状态,并将采集到的图像和数据通过计算机进行分析。
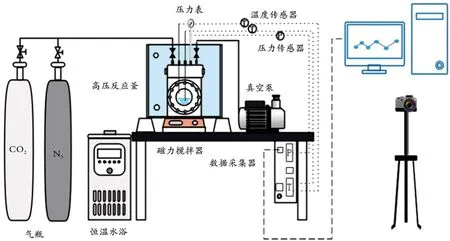
图1 CO2水合物生成的实验装置Fig.1 Experimental setup for CO2 hydrate formation
1.3 GO-Cu-Al 的制备
制备GO-Cu-Al,其负载金属Cu、Al 的物质的量均为0.001 mol,制备方法如下。
GO 溶液的制备。将0.150 g GO 加入置250 mL 纯水中,并将其混合搅拌10 min,再用超声波清洗机超声震荡30 min。
GO-Cu-Al 混合液的制备。将0.170 g 氯化铜和0.375 g 硝酸铝加入GO 体系中,在磁力搅拌器中混合搅拌30 min,随后逐滴滴入0.230 g 盐酸肼,利用磁力搅拌器搅拌6 h,得到GO-Cu-Al 混合液。
GO-Cu-Al 混合液的干燥。将GO-Cu-Al 混合液用纯水进行稀释处理至pH 为7,将滤干水分后的材料放入干燥箱内烘干48 h;将烘干后的材料研磨至粉末状,研磨后得到的产物即为GO-Cu-Al,装入密封袋密封保存。
1.4 实验流程
实验工况设置:压力为3.0 MPa,温度为274.15 K,磁力搅拌器转速为350 r/min。具体实验流程如下。
①测试反应釜的气密性。将压力为3.5 MPa 的氮气通入反应釜内,进行气密性检测,如果气密性良好则可以进行实验。
②制备GO-Cu-Al 质量分数分别为30、50、100 μg/g 的GO-Cu-Al 混合液,每一份混合液的制备量为300 mL。配制过程:将GO-Cu-Al 与相应的纯水混合,并通过磁力搅拌器搅拌60 min,然后使用超声波清洗机超声30 min,再次磁力搅拌20 min,得到分散均匀的GO-Cu-Al 混合液。
③打开反应釜盖,倒入制备好的GO-Cu-Al 混合液并放入磁力转子,打开反应釜底部的磁力搅拌器,设置转速为350 r/min,磁力搅拌直至实验结束。
④关闭反应釜盖并扣紧锁扣,连接好反应釜上的温度传感器、压力传感器、高压进气口阀和排气口阀,除排气口阀外全部关闭。对反应釜抽真空10 min,以确保反应釜内无空气残余。
⑤关闭排气口阀和抽真空装置,打开进气口阀,用CO2对反应釜和管路进行吹扫,重复3 次,进一步排出空气,随后关闭进气口阀和排气口阀。
⑥打开水浴系统,设定温度为291.15 K,以保持反应釜内温度稳定。待反应釜温度趋于稳定时,打开进气口阀,缓慢通入CO2至压力略高于实验压力,待温度、压力再次稳定,调节水浴系统温度为274.15 K,打开数据采集系统进行数据采集,并打开相机记录CO2水合物生成的全过程。
1.5 计算参数
在CO2水合物生成过程中,重点分析诱导时间、反应时间、气体消耗量和储气量的变化。诱导时间是CO2水合物开始生成之前的潜伏时间,在该时间段反应釜内的温度会突然升高,且压力下降明显。反应时间是从CO2水合物生成开始至CO2水合物完全生成所需的时间。气体消耗量是指在CO2水合物生成过程中消耗的CO2总量。储气量是指在标准条件下单位体积的CO2水合物释放的气体体积。
CO2气体消耗量计算公式见式(1)。
式中:ΔnCO2为CO2的气体消耗量,mol;p0、pt分别为反应釜内初始状态和反应结束时的压力,MPa;T0、Tt分别为初始状态和反应结束时的温度,K;Z0、Zt均为压缩因子,数值由Peng-Robinson 方程计算得出;V0、Vt分别为初始状态和反应结束时反应釜内的气体体积,m3;R为气体摩尔常数。其中,Vt由式(2)求得。
式中:Vcell、Vso、VRWt、VHt、Vm分别为反应釜容积、体系初始体积、反应水体积、水合物体积、磁力转子体积,m3。其中,VRWt和VHt可由式(3)-(4)求得。
式中:θL、θS分别为大孔穴和小孔穴的占比,可由式(6)求得:
式中:θi中的i为孔穴类型(大孔穴、小孔穴);fCO2为CO2在t时刻的逸度系数;Ci为水合物中第i个孔穴的朗缪尔常数,其值可由式(7)求得。
式中:T为温度,K;Ai、Bi均为常数。其中,在标准大气压下,小孔穴的Ai为2.474×10-4K,Bi为3 410 K;大孔穴的Ai为4.246×10-2K,Bi为2 813 K。
储气量由式(8)求出。
式中:SC为储气量,cm3/cm3;VSTP为水合物包裹气体的标准体积,m3;VH为水合物体积,m3;TSTP为标准状态下的温度,K;pSTP为标准状态下的压力,Pa。
1.6 表征方法
1.6.1 TEM 及EDS 分析
对原始GO 与GO-Cu-Al 进行TEM 分析,并对GO-Cu-Al 的形貌和晶体结构进行观察分析。利用EDS 对GO-Cu-Al 的元素种类进行分析。
1.6.2 XPS 分析
对GO-Cu-Al 进行XPS 分析,利用不同特征波长的射线照射GO-Cu-Al 表面,分析GO-Cu-Al 表面的元素状态。
1.6.3 稳定性分析
制备不同质量分数的GO-Cu-Al 混合液,在静置不同时间后观察其分散和沉淀情况,并进行稳定性分析。
2 结果与讨论
2.1 TEM 和EDS 分析
图2 为GO 和GO-Cu-Al 在不同放大倍数的TEM 图。由图2 可知,GO 表面非常光洁,GO-Cu-Al 表面出现明显的“阶梯”型纹理且颜色加深。这种结构可以进一步加大GO 的表面积,从而增大气-液接触面积,有利于CO2水合物生成。由图2(d)可看出,黑色的块状物和点状物即为所负载的金属,金属的负载比较均匀,其中有部分金属色块较大,可能是金属颗粒团聚所致。

图2 GO 和GO-Cu-Al 不同放大倍数的TEM 图Fig.2 TEM images of GO and GO-Cu-Al at different magnification
图3 为GO-Cu-Al 的EDS 图。由图3 可知,双金属Cu 和Al 颗粒已成功负载到GO 上。

图3 GO-Cu-Al 的EDS 图Fig.3 EDS diagram of GO-Cu-Al
2.2 XPS 分析
图4 为GO-Cu-Al 的XPS 图谱。从图4 可以观察到Al 2p 轨道和Cu 2p 轨道的衍射峰曲线。
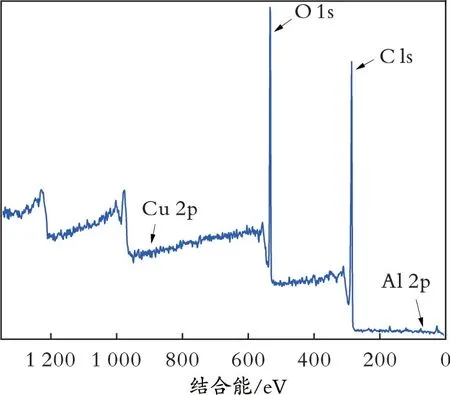
图4 GO-Cu-Al 的XPS 图谱Fig.4 XPS map of GO-Cu-Al
图5 为Al 2p 轨道和Cu 2p 轨道衍射峰曲线的放大图。由图5 可知,Al 2p 轨道放大后的衍射峰对应的结合能为75.4 eV,Cu 2p 轨道放大后的衍射峰对应的结合能为933.6 eV,Cu、Al 元素物质的量比约为1.00 ∶ 1.05,与实际金属负载物质的量相对偏差为0.047%。上述结果均表明,金属Al 和Cu 颗粒均成功地负载到了GO 表面。

图5 Al 2p 和Cu 2p 轨道衍射峰峰曲线的放大图Fig.5 Amplified diffraction peaks of Al 2p and Cu 2p
2.3 稳定性分析
将制备好的GO-Cu-Al 分别按照30、50、100 μg/g 的质量分数放入在去离子水中并进行超声溶解,而后静置,观察悬浮液的分散稳定性,结果如图6 所示。由图6 可知,3 种不同质量分数的GO-Cu-Al 悬浮液在静置60 min 后仍能稳定分散,在300 min 后不同质量分数的GO-Cu-Al 悬浮液均出现较明显的沉淀。因此,在CO2水合物生成实验过程中,增加磁力搅拌可以更好地保证纳米颗粒的均匀分散。

图6 不同质量分数的GO-Cu-Al 在超声溶解后静置不同时间的分散状态Fig.6 Dispersion state of GO-Cu-Al with different mass fraction after ultrasonic dissolution and standing for different time
2.4 GO-Cu-Al 体系中CO2水合物生成过程分析
采用GO-Cu-Al 体系,在初始温度为274.15 K、初始压力为3.0 MPa、质量分数为50 μg/g 的条件下,考察了CO2水合物生成过程中温度和压力随时间的变化情况及CO2水合物在不同时间生成的动态图,结果分别如图7、8 所示。

图7 CO2水合物生成过程中温度和压力随时间的变化曲线Fig.7 Curve of temperature and pressure with time during the formation of CO2 Hydrate
由图7 可知,GO-Cu-Al 体系在时间为0~<75 min 时,温度和压力迅速下降,该阶段是CO2水合物生成的准备阶段(见图8(a)),此时水合物尚未生成,压降是由CO2在水中溶解所致;在时间为75 min 时,温度突然上升,压力下降,表明此时水合物开始生成,诱导期结束,且由于水合物生成会放出大量的热,出现温度升高和压力降低的现象,此时可以观察到,在反应釜内的体系中有絮状结晶生成(见图8(b));在时间为>75~150 min 时,CO2水合物生成量逐渐增多,CO2水合物膜逐渐变厚,随着CO2水合物的生成,体系与气体交界处逐渐生成一层薄膜(见8(c));在时间为>150~200 min 时,反应釜内的压降幅度逐渐降低,说明CO2水合物生成速率逐渐减缓,直至系统温度和压力趋于稳定,CO2水合物生成结束(见图8(d))。

图8 CO2水合物的生成动态图Fig.8 The formation dynamic diagram of CO2 hydrate
2.5 GO-Cu-Al 质量分数对CO2水合物生成的影响
2.5.1 诱导时间和反应时间的影响
分析了GO-Cu-Al 不同质量分数对CO2水合物生成动力学的影响,并与纯水体系进行了对比,结果如图9 所示。
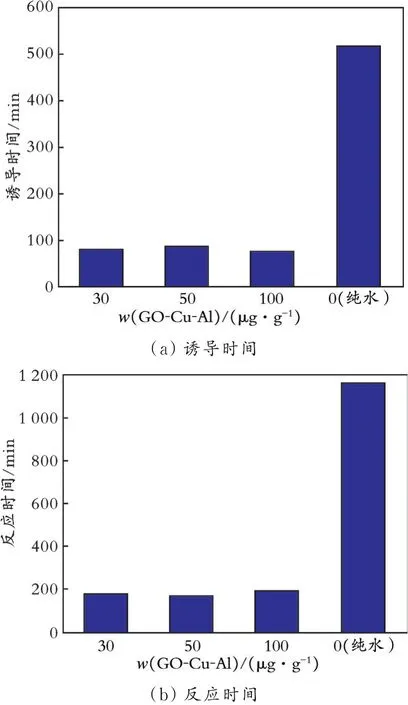
图9 GO-Cu-Al 质量分数对CO2水合物诱导时间和反应时间的影响Fig.9 Effect of GO-Cu-Al mass fraction on induction time and reaction time of CO2 hydrate
由图9(a)可知,在GO-Cu-Al 体系中,随着GOCu-Al 质量分数的增加,CO2水合物生成的诱导时间先增大后减少,但总体变化幅度不大,其中GO-Cu-Al 质量分数为50、100 μg/g 时诱导时间为85、75 min,而纯水体系诱导时间仅为515 min,GO-Cu-Al体系诱导时间约为纯水体系的1/4、1/6,加快了CO2水合物的生成。分析原因:加入到水相中的GO-Cu-Al 进行无规则的布朗运动,在微观状态下加快液体的扰动,使气体与水接触更加充分;GO 分子表面含有丰富的含氧官能团,其亲水性能优异,增大气体溶解到液相中的速率,可以有效减少CO2水合物生成的诱导时间。
由图9(b)可知,质量分数不同的GO-Cu-Al 体系所需的反应时间均在200 min 以内,随着GO-Cu-Al 质量分数的增加,GO-Cu-Al 体系所需的反应时间先减少后增加,其中质量分数为50 μg/g 的GOCu-Al 体系所需的反应时间最短(170 min),质量分数为100 μg/g 的GO-Cu-Al 体系所需的反应时间最长(195 min)。相比于纯水体系反应时间(1 170 min),GO-Cu-Al 体系的反应时间约为纯水体系的1/7。这是因为:GO-Cu-Al 体系有巨大的比表面积和优良的传热传质特性,可以及时排出CO2水合物生成过程中产生的热量,平衡体系的温度,因此极大地缩短CO2水合物生成所需的反应时间。
2.5.2 气体消耗量和储气量的影响
分析了GO-Cu-Al 质量分数对CO2水合物生成的气体消耗量、水合转化率、储气量的影响,结果如图10 所示。

图10 GO-Cu-Al 质量分数对CO2水合物生成的气体消耗量、水合转化率、储气量的影响Fig.10 The effect of GO-Cu-Al mass fraction on the gas consumption, hydration conversion and gas storage of CO2 hydrate
由图10(a)可知,在质量分数不同的GO-Cu-Al体系中,随着GO-Cu-Al 质量分数的增加,气体消耗量和水合转化率均是先降低后升高,且气体消耗量和水合转化率均在质量分数为100 μg/g 时最大,在质量分数为50 μg/g 时最小;相较于纯水体系,GOCu-Al 体系的气体消耗量均较低。这是因为:在纯水体系中CO2水合物生成所需的反应时间长,导致反应过程中CO2参与生成水合物的时间变长,因此纯水体系的气体消耗量大于GO-Cu-Al 体系。由图10(b)可知,相较于纯水体系,GO-Cu-Al 体系的储气量均高于纯水体系,GO-Cu-Al 质量分数对储气量没有明显的影响,但是由于反应时间不同,GOCu-Al 体系的气体消耗量小于纯水体系,而储气量大于纯水体系,说明GO-Cu-Al 体系的CO2分离储存效率优于纯水体系。
2.6 双金属负载和单金属负载体系对CO2 水合物生成的影响
在添加剂质量分数(50 μg/g)相同的条件下,对单金属负载GO-Cu、GO-Al 体系与双金属负载GOCu-Al 体系对CO2水合物生成过程的影响进行了对比分析,所有体系中总金属物质的量均为0.002 mol。
2.6.1 诱导时间和反应时间的影响
图11 为金属负载体系对CO2水合物生成的诱导时间和反应时间的影响。由图11(a)可知,GOCu-Al 体系所需的诱导时间最短(80 min);GO-Al和GO-Cu 体系所需的诱导时间分别为150、100 min,说明在GO-Cu-Al 体系中CO2水合物生成的诱导时间明显缩短,较GO-Al、GO-Cu 体系分别缩短了约47%和20%。由图11(b)可知,GO-Cu-Al 体系所需的反应时间为170 min,相较于GO-Cu 体系(所需的反应时间为1 025 min)和GO-Al 体系(所需的反应时间为575 min)分别缩短了约83.4% 和70.4%,双金属GO-Cu-Al 体系极大地缩短了所需的反应时间。

图11 金属负载体系在CO2水合物生成过程中的诱导时间和反应时间Fig.11 Induction time and reaction time of different metal-loaded solutions during the formation of CO2 Hydrate
2.6.2 气体消耗量和储气量的影响
图12 为不同金属负载体系的气体消耗量和CO2储气量。由图12(a)可知,GO-Cu 体系的气体消耗量(0.339 mol)最大;GO-Al 体系的气体消耗量略低于GO-Cu 体系,为0.329 mol;GO-Cu-Al 体系的气体消耗量最小,为0.248 mol。由于GO-Cu 体系和GO-Al 体系所需的反应时间相较于GO-Cu-Al体系较长,反应过程中水合物不断生成,从而持续消耗CO2,而GO-Cu-Al 体系所需的反应时间极短,导致CO2气体消耗量较少。由图12(b)可知,GOCu-Al 体系的储气量为123.81 cm3/cm3,大于GO-Cu和GO-Al 体系的储气量。CO2的存在形式:部分CO2与水以水合物的形式存在;部分CO2仅是溶解在水中,并未生成水合物;还有少量CO2位于体系之上,未参与CO2水合物的生成过程。分析原因:在CO2水合物生成的过程中,储气量是以CO2水合物的形式储存的CO2的量,相较于GO-Cu、GO-Al 体系,GO-Cu-Al 体系的CO2气体消耗量较低,因此其CO2储气量大,优于单金属负载体系,充分说明GOCu-Al 体系的CO2分离储存效率更高。

图12 不同金属负载体系的气体消耗量和CO2储气量Fig.12 Gas consumption of different material solution
3 结 论
1)GO-Cu-Al 的表征结果表明,Cu 与Al 纳米颗粒均可以均匀地负载在GO 表面,且具有良好的稳定性,有利于CO2水合物的生成。
2)CO2水合物生成实验表明,GO-Cu-Al 体系对CO2水合物生成的促进作用主要体现在诱导时间和反应时间;纯水体系的诱导时间为515 min,GO-Cu-Al 体系的诱导时间为75 min;质量分数不同的GOCu-Al 体系的储气量无明显差别,但均高于纯水体系。
3)GO-Cu-Al 体系与GO-Cu、GO-Al 体系的对比结果表明,GO-Cu-Al 体系所需的诱导时间最短,较GO-Al、GO-Cu 体系分别缩短了约47%和20%;GO-Cu-Al 体系所需的反应时间较GO-Cu 和GO-Al体系分别缩短了约83.4%和70.4%;GO-Cu、GO-Al体系的气体消耗量大于GO-Cu-Al 体系,但储气量则相反,相较于GO-Cu、GO-Al 体系,GO-Cu-Al 体系的CO2气体消耗量较低,其CO2储气量大于单金属负载体系,说明GO-Cu-Al 体系的CO2分离储存效率更高。
