乌拉尔甘草不同组织可培养内生菌分离筛选及产β-葡萄糖苷酶菌株初筛
2024-02-23孔晓双董应宏买尔哈巴艾合买提侯新强杨文琦崔卫东
孔晓双,魏 然,董应宏,侯 敏,买尔哈巴·艾合买提,侯新强,杨文琦,崔卫东
(1.新疆大学生命科学与技术学院,乌鲁木齐 830052;2.新疆农业大学农学院,乌鲁木齐 830052;3.新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091)
0 引 言
【研究意义】乌拉尔甘草(GlycrrhizauralensisFisch)属于药食同源植物。甘草药理功效广泛,具有抗菌、抗炎、抑菌等生物活性。甘草中活性成分的生成与其内生菌有很大的关联[1]。植物内生菌是指生活的一定或全部阶段生存于健康植物组织及器官内部的真菌、细菌、放线菌[2]。内生菌与植株存在着共生关系,参与宿主植物的生理或代谢过程,直接或间接转化植物代谢物[3-4]。药用植物内生菌拥有完整且庞大的产酶体系,代谢产物可转化植物体内黄酮糖苷、皂苷等化合物,进而提高活性物质的含量,影响药用植物的药效[5-6]。β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21),也称为纤维二糖酶,属于水解酶类,主要水解化合物末端的非还原性β-D-葡萄糖苷键,从而释放出β-D-葡萄糖和配基,是纤维素酶系中的三种组成成分之一,可协同降解纤维素为葡萄糖单元[7],其酶活力高低直接影响到纤维素酶的总体酶活力,且主要应用在木质纤维素材料水解及转化黄酮糖苷增加其生物活性等方面[8-9]。【前人研究进展】目前,利用微生物,尤其是植物内生菌对黄酮以及皂苷类化合物进行转化已成为研究的热点,β-葡萄糖苷酶通过水解化合物末端的非还原性β-D-葡萄糖苷键来产生苷元形式的活性成分。上官修蕾等[10]利用从茯茶样品中分离的“金花”菌所产的β-葡萄糖苷酶发酵豆粕转化大豆异黄酮苷元;于洁[11]从中药虎杖中分离的内生真菌AspergillusaculeatusHZ001产生的β-葡萄糖苷酶将虎杖苷转化为白藜芦醇,有较高的转化率;Jxa等[12]以淫羊藿苷底物,利用菌株Ignitsphaeraaggregans的β-葡萄糖苷酶转化制备生物活性更高的宝藿苷I;从人参中分离的252株内生细菌中,发现98株(38.88%)有β-葡萄糖苷酶活性,可以将人参皂苷转化为稀有人参皂苷[13]。【本研究切入点】β-葡萄糖苷酶来源广泛,在自然界中普遍存在于动物、植物、微生物中。其中β-葡萄糖苷酶主要来自霉菌、酵母菌和细菌等[14]。由于大多菌株存在产酶量少,活性低、特异性不强,限制了其在食品、化工以及生物医药方面的应用[15]。植物内生菌多样性丰富,是β-葡萄糖苷酶的良好来源。目前关于甘草内生菌产β-葡萄糖苷酶研究报道较少,需研究在分离与甘草生物相容性好的内生菌的基础上,筛选高产β-葡萄糖苷酶菌株,以期挖掘高效转化甘草活性成分的菌种资源。【拟解决的关键问题】分析乌拉尔甘草不同部位可培养内生菌的组成和数量及对产β-葡萄糖苷酶的内生菌进行初筛,研究甘草可培养内生菌在甘草不同部位分布规律以及产β-葡萄糖苷酶的菌株在甘草组织部位中的分布,为甘草内生菌的资源开发及在内生菌中筛选高产β-葡萄糖苷酶菌株提供参考。
1 材料与方法
1.1 材 料
1.1.1 样品采集
新鲜健康的乌拉尔红皮甘草于2021年秋季采自新疆阿勒泰地区,放置采样袋中带回实验室,4℃条件下保存。
1.1.2 培养基
营养肉汤培养基NB(g/L):蛋白胨10.0、牛肉浸出粉3.0、氯化钠5.0;
营养琼脂培养基NA(g/L):蛋白胨10.0、牛肉浸出粉3.0、氯化钠5.0、琼脂20.0;
胰蛋白胨大豆肉汤TSB(g/L):胰蛋白胨17.0、大豆蛋白胨3.0、磷酸氢二钾3.0、氯化钠5.0、葡萄糖2.5;
胰蛋白胨大豆琼脂TSA(g/L):胰蛋白胨17.0、大豆蛋白胨3.0、磷酸氢二钾3.0、氯化钠5.0、葡萄糖2.5、琼脂20.0;
马铃薯葡萄糖水培养基PDB(g/L):马铃薯浸粉6.0、葡萄糖20.0、pH(5.6±0.2);
马铃薯葡萄糖琼脂培养基PDA(g/L):马铃薯浸粉6.0、葡萄糖20.0、琼脂20.0、pH(5.6±0.2);
七叶苷固体培养基(g/L):蛋白胨10.0、酵母粉3.0、Nacl 3.0、七叶苷1.0、柠檬酸铁0.5、琼脂粉20.0。
1.1.3 试剂与仪器
七叶苷、柠檬酸铁:上海源叶生物科技有限公司;细菌DNA提取试剂盒、真菌DNA提取试剂盒:新疆科递源生物科技有限公司;β-葡萄糖苷酶试剂盒(微量法):苏州科铭生物技术有限公司;96孔培养板:Corning Incorporated公司;恒温培养箱(ZWY型):上海福玛实验设备有限公司;摇床(BSD-YX3200型):上海博迅医疗生物仪器公司;离心机(Presoo17型):上海博迅医疗生物仪器公司;酶标仪、PCR扩增仪(TC-XP型):杭州博日科技有限公司;电泳仪:美国伯乐BIO-RAD公司;凝胶成像系统(GELDOC Go型):上海艾研生物科技有限公司。
1.2 方 法
1.2.1 甘草内生菌的筛选
1.2.1.1 甘草表面消毒
取乌拉尔红皮甘草植株用自来水冲洗干净,切成适中的小段,在无菌操作台中进行表面消毒:无菌水冲洗3次,75%乙醇中浸泡3 min,无菌水冲洗1 min;5%次氯酸钠溶液中浸泡5 min,无菌水冲洗1 min;用75%乙醇漂洗30 s,无菌水冲洗1 min,备用[16]。取最后1次无菌水洗涤上清液100 μL,涂布于NA、TSA和PDA培养基,做3个空白对照,分别放入35和28℃培养1~5 d,若观察不到菌落生长则甘草表面消毒彻底。
1.2.1.2 甘草内生菌分离纯化
取消毒完毕的甘草主根、须根、茎、叶,分别用无菌破碎机匀浆,取组织匀浆液移入含10% NB、10%TSB、10% PDB培养基中,稀释2 000×、6 000×、18 000×后加入96孔培养板中,细菌35℃,真菌28℃培养[17],挑取长出的菌连续转接在NA、TSA、PDA培养基上直至得到纯化菌株。
1.2.1.3 甘草内生菌的鉴定
挑取纯化后的单菌落接种于营养肉汤液体培养基中,35℃、150 r/min摇床培养18 h。4℃、5 000 r/min离心5 min后取沉淀菌体,按照细菌DNA提取试剂盒操作步骤提取甘草内生细菌的DNA。采用16S rRNA通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTACGACTT-3′)分别作为正向和反向引物进行扩增。内生真菌接种在马铃薯葡萄糖水培养基中 28℃、150 r/min 摇床培养 5 d。4℃、8 000 r/min 离心5 min 后收集菌体,加入液氮迅速研磨成粉,按照真菌DNA提取试剂盒操作步骤提取甘草内生真菌的DNA。真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) 和 ITS4(5′-TCCTCCGCTTATTGAATGC-3′)进行扩增。PCR产物采用1.0%的琼脂糖凝胶电泳检验,将有条带的PCR产物送上海生工进行测序。将细菌和真菌的测序结果分别在EzBioCloud数据库(https://eztaxon-e.ezbiocloud.net)和NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)与已知模式菌株序列比对,选择相似度较高的菌株序列,利用MEGA7.0软件邻接法(neighbor-joining method)构建系统发育树,校验值bootstrap设置为1 000,将构建好的进化树文件上传iTol网站(https://itol.embl.de)上完善进化树。
1.2.2 产β-葡萄糖苷酶内生菌的筛选
1.2.2.1 产β-葡萄糖苷酶内生菌的初筛
β-葡萄糖苷酶内生菌的筛选利用七叶苷显色原理,即七叶苷被β-葡萄糖苷酶水解后生成的6,7-二羟香豆素(也称七叶苷元),可以与铁离子反应,培养基上的菌落周围会生成黑褐色物质。将纯化后的甘草内生菌重新划线至七叶苷固体培养基上培养一段时间后观察颜色变化,菌株划线附近的培养基变黑,即该菌株能产β-葡萄糖苷酶[18]。
1.2.2.2 产β-葡萄糖苷酶内生菌的复筛
将在七叶苷培养基上出现颜色反应的细菌接种到营养肉汤培养基中35℃、180 r/min培养24 h,真菌接种到马铃薯葡萄糖水培养基中28℃、150 r/min培养5 d。将培养好的菌株发酵液于4℃、8 000 g离心10 min,取上清液即为粗酶液。按照β-葡萄糖苷酶活性检测试剂盒提供的方法测定菌株产酶活性。
β-葡萄糖苷酶的酶活定义:样本在37℃条件下每分钟产生1 nmol对硝基苯酚定义为一个酶活性单位U。
1.3 数据处理
采用Excel 2019对试验数据进行整理、分析与作图,采用SPSS 24.0进行统计软件进行单因素方差分析,多重比较采用最小显著差异法(LSD)。数据进行3 次重复试验,结果以“平均值±标准差(X±SD)”表示。
2 结果与分析
2.1 甘草不同组织部位可培养内生菌的分布
研究表明,从乌拉尔甘草主根、须根、茎、叶中分离到内生菌共48株,其中内生细菌33株,内生真菌15株。从甘草主根、茎两个部位中分离的内生细菌一样多,占比27.3%;定殖在须根和叶的比例分别为24.2%、21.2%。内生真菌在主根、须根、茎、叶中定殖的比例分别为53.3%、6.7%、26.7%、13.3%。内生细菌在主根和茎部密度最大,数量最多,其次是须根,叶中的内生细菌次之。内生真菌在主根中定殖的数量最多,与其他部位分离到的真菌菌株相比有显著差异,其次是茎部和叶部,须根中真菌数量最少。表1

表1 甘草不同部位内生菌分离结果
2.2 甘草可培养内生细菌的分离鉴定
研究表明,甘草内生细菌在主根部分离得到4个属,分别是芽孢杆菌属(Bacillus)、虚拟芽孢杆菌属(Fictibacillus)、不动杆菌属(Acinetobacter)、詹森杆菌属(Janthinobacterium);须根分离获得3个属,分别是芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、农杆菌属(Agrobacterium);茎部分离到3个属,分别是芽孢杆菌属(Bacillus)、虚构芽胞杆菌属(Fictibacillus)、Metabacillus属;叶部分离到3个属,分别是芽孢杆菌属(Bacillus)、詹森杆菌属(Janthinobacterium)、Niallia属。甘草内生细菌在不同组织中多样性表现为主根>须根=茎=叶。表2

表2 甘草内生细菌的基因序列
研究表明,33株甘草内生细菌隶属于8个属。Bacillus属菌株数量最多,共有23株,占比总数的69.7%,在各组织中都有分布;Fictibacillus属3株,占比9.1%、Janthinobacterium属2株,占比6.1%;Acinetobacter属1株,占比3.0%;Pseudomonas属1株,占比3.0%;Agrobacterium属1株,占比3.0%;Metabacillus属1株,占比3.0%;Niallia属1株,占比3.0%。芽孢杆菌属是甘草内生细菌的优势菌群,且甘草主根部位的内生细菌多样性最高。图1

图1 甘草内生细菌的 16S rDNA 的 系统进化
2.3 甘草可培养内生真菌的分离鉴定
研究表明,甘草主根部分离获得5个属真菌,分别是青霉属(Penicillium)、曲霉属(Aspergillus)、枝孢属(Cladosporium)、链格孢属(Alternaria)、聚端孢霉属(Trichothecium);茎部分离到4个属,分别是小脆柄菇属(Candolleomyces)、青霉属(Penicillium)、枝孢属(Cladosporium)、曲霉属(Aspergillus);叶部分离到2个属,分别是青霉属(Penicillium)、枝孢属(Cladosporium);须根分离得到1个属,为镰刀菌属(Fusarium)。甘草内生真菌在不同组织中多样性表现为主根>茎>叶>须根。表3

表3 甘草内生真菌的基因序列
15株甘草内生真菌隶属于7个属。Cladosporium属4株,占比26.7%;Penicillium属3株,占比20.0%;Aspergillus属3株,占比20.0%;Alternaria属2株,占比13.3%;Trichothecium属1株,占比6.7%;Candolleomyces属1株,占比6.7%;Fusarium属1株,占比6.7%。枝孢属是甘草内生真菌的优势菌群,且甘草主根部位的内生真菌多样性最高。图2

注:不同小写字母表示内生细菌或内生真菌的酶活有差异性显著(P<0.05)

图2 甘草内生真菌的ITS- rDNA 的 系统进化
2.4 产β-葡萄糖苷酶内生菌的筛选
研究表明,有3株细菌和3株内生真菌的产酶黑色沉淀圈较为明显。8株内生细菌经过营养肉汤培养基发酵24 h、4株内生真菌经马铃薯葡萄糖水培养基发酵5 d后,取上清液对其进行酶活力测定。12株菌株经发酵后,A12、A15、A17、A29、A30、A31、A65、A78、P9、P11、P16、P17的酶活力平均值分别为0.53、3.51、0.48、1.29、0.85、1.51、3.69、5.64、4.01、1.23、2.84、2.69 U/mL。产黑色沉淀圈较大的6株内生菌的酶活力也较高,与另外6株菌株相比酶活力有显著差异。6株菌株酶活力较高的菌株经鉴定后3株内生细菌均为芽孢杆菌属,分别为A15(Bacillusamyloliquefaciens)、A65(Bacillussubtilis)、A78(Bacillusrugosus)。3株内生真菌分别为P9(Candolleomycescandolleanus)、P16(Aspergillusfumigatus)、P17(Cladosporiumperangustum)。12株产β-葡萄糖苷酶菌株中分离自根部位的有5株,占比41.7%。分离自茎、叶、须的比例分别为33.3%、16.7%、8.3%,产酶的菌在根部位分布最多。图3,图4
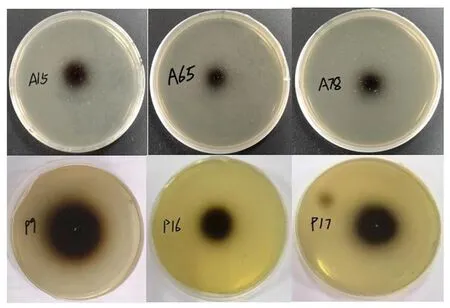
图3 七叶苷平板初筛产β-葡萄糖苷酶菌株
3 讨 论
3.1近年来围绕甘草内生菌的相关研究逐步增多,甘草内生菌的研究来源主要是乌拉尔甘草、胀果甘草[19]。不同的品种、产地、生态环境、组织部位(根、茎、叶)等因素对甘草内生菌组成有很大的影响[20]。陈静等[21]从5个地区的129株乌拉尔甘草样品中共分离到 438 株内生真菌,结果显示不同产地甘草内生真菌群落组成也各不相同。甘肃、新疆和内蒙古都以镰孢属和曲霉属为优势菌属,而宁夏和北京是以镰孢属为优势菌属。张燃等[22]对宁夏野生和种植甘草的内生菌进行分离,结果表明野生甘草内生菌数量与多样性都明显高于种植甘草。Li等[23]从新疆3个不同地区的乌拉尔甘草中共分离116株内生细菌,隶属于20个属,根组织中14个属,高于茎12个属和叶组织6个属。内生菌的分布规律与宿主本身的特性及内生菌的种类相关,在植物的不同组织部位具有不同分布和结构[24],因为不同植物组织中的结构和营养不同,不同内生菌的营养需求也不相同,这影响了内生菌定植、生长和分布[25]。
Liu等[26]研究发现青蒿根内生真菌的数量、定植率和分离率显著高于茎和叶,从根中分离的内生真菌的酶活性显著高于从茎和叶中分离的真菌,内生真菌的代谢功能在组织间存在显著差异。试验共分离12株产β-葡萄糖苷酶甘草内生菌,在甘草组织的分布比例大小顺序依次为主根41.7%,茎33.3%、叶16.7%、须8.3%。产酶的菌在根部位分布的最多,甘草的主根为其药效部位,β-葡萄糖苷酶作为一种水解酶可参与活性物质的转化和修饰,进而提高植物体内活性物质含量和药用价值[27]。
3.2张琴等[28]以新疆胀果甘草为材料,从甘草内生菌中分离的两株高产β-葡萄糖苷酶的菌株均来源根部位,经鉴定两株菌分别是泡盛曲霉和构巢曲霉,酶活力分别为18.63、18.04 U/mL,两株菌对甘草黄酮转化后的抗氧化活性均有显著增加;Huang等[29]从喜树种子中分离到一株产β-葡萄糖苷酶的新菌株花色曲霉,经响应面法优化发酵后的β-葡萄糖苷酶活性为812.86 U/mL,可高效降解纤维素;刘姜华[30]从槐角粉中分离纯化一株产β-葡萄糖苷酶的菌株为米根霉,经发酵后酶活力达到1.16 U/mL,该酶将槐角苷转化为染料木素的转化得率为80.2%;Tam等[31]从人参属植物的根、茎和叶中分离出27株β-葡萄糖苷酶试验阳性的菌株,4株酶活性较高的菌株,其中苍白杆菌Ochrobactrumsp.酶活最高为1.83U/L,用于进一步研究人参皂苷Rb1向人参皂苷Rd和Rg3的生物转化。目前植物内生菌中产β-葡萄糖苷酶的菌株多集中在真菌曲霉属和少部分的细菌,且普遍真菌酶活较高。与其他从药用植物中分离的内生细菌的报道一致[32-33]。试验获得的一株芽孢杆菌BacillusrugosusA78,酶活优于其他真菌菌株,最高为5.64 U/mL。而且芽孢杆菌具有易培养、生长周期短的特点,后期通过优化菌株发酵条件提高产酶活性,可以进一步提升β-葡萄糖苷酶在工业上的应用潜力。
4 结 论
共获得纯化内生菌48株,其中,内生细菌33株,内生真菌15株。内生细菌在主根和茎部分布最多,芽孢杆菌属是甘草组织中的优势细菌属,内生真菌在主根中定殖的数量最多,枝孢属是甘草内生真菌的优势菌属。根部可能是甘草内生菌寄生或共生的主要组织部位。筛选获得12株产β-葡萄糖苷酶的菌株,有6株酶活较高,其中BacillusrugosusA78菌株酶活最高为5.64 U/mL。产β-葡萄糖苷酶的菌株在主根组织部位分布的最多,占比41.7%,是选育产酶菌株的优势部位。
