蒿本内酯对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的改善作用
2024-02-23马广礼夏晓培马金亮
马广礼,夏晓培,马金亮
(1.许昌职业技术学医疗卫生学院,河南许昌 461000;2.河南科技大学食品与生物工程学院,河南洛阳 471000)
溃疡性结肠炎(Ulcerative colitis,UC)是一种病因尚不十分清楚的非特异性肠道炎症疾病,其主要临床表现是腹泻、脓血便、腹痛和里急后重等症状[1]。它的发病率日益增高,是全球性消化内科常见的疑难病之一,在我国的发病率为11.6/10万[2]。UC 的发病机制目前尚不明确,主要与遗传、环境、感染、肠道菌群失调以及免疫应答等因素有关[3]。我国西药治疗UC 取得了一定的疗效,治疗药物主要包括类固醇、免疫调节剂等,但引起恶心、腹泻和腹痛等不良反应仍然存在,治疗方法也存在一定的局限性,比如部分患者后期需要手术干预[4]。因此,开发有效药物治疗UC 是一个亟待解决的重要问题。
随着我国中药现代化建设步伐的加快,传统中医药及其有效成分在新药研发领域中的研究成为当下的主要热点之一。藁本内酯(ligustilide,Lig),是从中草药川芎和当归中提取的有效成分之一,具有多种生物活性和药理作用,对心脑血管、循环系统及免疫功能均有较强的药理作用,有很强的解痉、平喘、镇静作用,能改善微循环、松弛平滑肌、抑菌、提高机体免疫调节等功能[5-6]。除被广泛应用于医学领域外,Lig 还被用作食品添加剂,常用于饮料、酒类等食品中,以提高其香味及质感。此外,也有研究表明Lig 对食品质量具有保护作用,如抑制食品的褐变、氧化等[7-8]。因此,Lig 在食品工业中有着广泛的应用前景。大量的研究显示,Lig 因抑制NF-κB 的激活与减少炎症因子的释放表现出强大的抗炎药理活性,可治疗多种炎症相关疾病,如Lig 通过介导PI3K/AKT/mTOR 信号通路对脑缺血再灌注损伤大鼠模型的神经发挥保护作用[9],Lig 通过抑制NLRP3 炎症小体的激活改善阿霉素诱导的炎症心肌损伤[10],Lig 对干扰素α诱导的人脑血管外膜成纤维细胞增殖及凋亡通过lncRNA NKILA 来发挥改善作用[11]。然而,还没有研究报道Lig 可以通过激活TLR4/NFκB 信号改善UC。
本研究拟使用葡聚糖硫酸钠(dextran sodium sulfate,DSS)构建UC 小鼠模型,探索Lig 对DSS 诱导UC 小鼠的改善作用,并阐明其可能的分子机制,为Lig 的临床开发和利用提供理论依据,为提高UC 患者的生活质量提供新的治疗策略。
1 材料与方法
1.1 材料与仪器
60 只C57 BL/6 小鼠,6~8 周龄,雄性,体重(22±2)g 购自上海市公共卫生临床中心,动物生产许可证号: SCXK(沪)2020-0002,常温环境饲养于温度(22±2)℃,湿度40%~60%,12 h 光照/黑暗循环的条件中,动物福利伦理审查批文号为SPF 2 022049;Lig纯度98%,成都曼思特生物科技有限公司;DSS MW36000-50000 美国MP Biomedicals生物有限公司;苏木素-伊红染色试剂盒 北京索莱宝科技有限公司生产;IL-6、TNF-α、IL-1β试剂盒 上海朗顿生物技术有限公司。
EVOS M5000 型智能细胞成像系统 美国Thermo Fisher Scientific 公司;ELX-800 型酶标仪美国BIO-TEK 公司;FSH-2 型可调高速电动匀浆器江苏金坛市佳美仪器有限公司;Microfugu 20R 型高速冷冻离心机 美国Beckman Coulter 公司;RE-5289 型数显恒温水浴锅 常州市国旺仪器制造有限公司;FA1004B 型电子天平 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 动物造模及给药方法 将60 只雄性 C57BL/6小鼠随机分为6 组,每组10 只,分别为空白组、DSS 组、阳性药柳氮磺吡啶(sulfasalazine,SASP)组和Lig 低、中、高剂量组(低剂量组:50 mg/kg;中剂量组:100 mg/kg;高剂量组:200 mg/kg[12])。适应性饲养1 周后,每日称量并记录小鼠体重,除空白组外,其余组小鼠连续7 d 饮用3% DSS 溶液诱导UC 模型[13],同时Lig 低、中、高剂量组小鼠给予相应剂量药物,溶于10%生理盐水中灌胃干预治疗,空白组和DSS 组小鼠以相同的方式给予等体积的生理盐水。
1.2.2 UC 小鼠取材及测量结肠长度和质量 第8 d,腹腔注射适量戊巴比妥钠麻醉后,眶窦采血,解剖小鼠,测量结肠从直肠近端到回盲部的长度和质量,远端结肠组织立即用4%多聚甲醛溶液在4 ℃冰箱固定过夜,第2 d 用于做石蜡切片。
1.2.3 观察UC 小鼠病理组织形态 取部分结肠用4%多聚甲醛固定,石蜡包埋,切片进行苏木素-伊红染色组织学评估。将石蜡切片脱蜡,按照试剂盒说明书步骤对组织进行染色,用中性树胶对切片封片,在100 倍光镜下以不同的视野在相同的设置下观察结肠组织的病理学改变。
1.2.4 UC 小鼠的相关指数评价 在整个实验过程中,每天观察并记录小鼠的体重减轻、排便情况和直肠出血情况。参照文献[14]的方法,对造模后大鼠体重下降率、大便性状及大便隐血情况进行疾病活动指数(disease activity index,DAI)评分,以评估UC 的严重程度(表1)。DAI=(体重+大便形态+大便出血)/3。小鼠麻醉取血后,取结肠组织并剖开,0.9%NaCl 冲洗干净,观察结肠黏膜。根据文献[15]操作方法进行结肠损伤指数(colon and mesentery injury,CMDI)评分。按照文献[16]方法操作,观察结肠组织病理学,并进行结肠组织学指数(histological,HS)评分。结肠切片染色的组织学评价分级如下:0 级:无炎症迹象;1 级:低白细胞浸润;2 级:中度白细胞浸润;3 级:高白细胞浸润,中度纤维化,高血管密度,结肠壁增厚,中度杯状细胞丢失,局灶性隐窝丢失;4 级:白细胞透壁浸润,杯状细胞大量丢失,广泛纤维化,弥漫性隐窝丢失。

表1 DAI 的评分标准Table 1 Scoring criteria for DAI
1.2.5 血清中炎症因子TNF-α、IL-6 和IL-1β水平的测定 在实验进行的第8 d,取小鼠静脉血放置于无菌离心管中,室温静置40 min,于4 ℃、2500 r/min条件下离心15 min,收集管中的上层血清,使用酶联免疫吸附测定试剂盒测定血清液中的TNF-α、IL-6 和IL-1β水平,多余血清置于-80 ℃冰箱保存备用。
1.2.6 UC 小鼠结肠组织中蛋白免疫印迹分析 称取100 mg 结肠组织,用含有蛋白酶和磷酸酶抑制剂的十二烷基硫酸钠样品缓冲液匀浆,收集上清,测定蛋白浓度,制备样品进行电泳、电转及5%脱脂奶粉封闭的过程后,在4 ℃下孵育一抗过夜,第2 天室温孵育二抗1 h,最后在凝胶成像仪下进行显影,使用Image J 分析软件对蛋白条带的灰度值进行分析。
1.3 数据处理
采用GraphPad Prism 8.0.2 软件进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,当数据满足正态分布和方差齐性时,两两比较用LSD 检验,当数据不满足正态分布或方差齐性时,两两比较用Dunnett’s 检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 Lig 对UC 小鼠一般情况的影响
结肠炎是一种疾病,其特征是慢性和反复发作的肠道炎症。通过使用小鼠模型模拟结肠炎,可以更好地了解该疾病的发病机制,以及治疗性药物的疗效。DSS 是一种常用的诱导结肠炎的化学品,可以损伤肠道黏膜并引发炎症反应[17]。在这项实验中,其使用可使小鼠模型表现出与结肠炎患者相似的症状。如图1 所示,与空白组比较,DSS 组小鼠饮食量明显减少,造模第3 d 个别小鼠便稀;小鼠体重在第4 d 显著降低(P<0.05),毛发失去光泽,精神萎靡;造模第5 d 出现不同程度的腹泻、便血、肛门血染等现象。与DSS 组比较,Lig 各剂量组小鼠状态均有所好转,进食量逐渐增多,大便性状逐渐开始好转,Lig 低剂量组小鼠体重显著升高(P<0.05),Lig 中和高剂量组小鼠体重极显著升高,差异具有统计学意义(P<0.01),与董晶等[3]研究结果一致,充分说明Lig 能够改善UC 小鼠的病理状况。

图1 UC 小鼠的体重变化(n=10)Fig.1 Changes of body weight in UC mice (n=10)
2.2 Lig 对UC 小鼠DAI、CMDI 和HS 的影响
DAI、CMDA 和HS 是评价结肠炎症状严重程度和疗效的常用指标,具有很高的临床应用价值。DAI 是结合患者的体重下降百分率、大便黏稠度和大便出血三种情况进行综合评分,将3 项结果的总分除以3 即得到DAI 值[18]。CMDI 是结肠长度反映慢性炎症和损伤修复的间接指标[19]。HS 主要通过结肠组织病理切片观察各组大鼠结肠病变情况评分[20]。如图2 所示,与空白组比较,DSS 组小鼠的DAI、CMDA 和HS 三个指数评分均明显增加,差异均有统计学意义(P<0.05),说明其处于较为严重的结肠炎状态。与DSS 组比较,Lig 中、高剂量实验组的DAI、CMDA 和HS 三个指数评分显著降低,差异均有统计学意义(P<0.05),提示Lig 对结肠炎具有一定的治疗效果,而Lig 低剂量组的DAI、CMDA和HS 三个指标无显著性差异,说明Lig 的作用剂量具有一定的关键性。与Wang 等[21]的研究结果一致,充分说明Lig 对UC 小鼠的结肠组织起到一定改善作用。

图2 Lig 对UC 小鼠DAI、CMDI 和HS 的影响(n=10)Fig.2 Effect of lig on DAI,CMDI and HS in ulcerative colitis mice (n=10)
2.3 Lig 对UC 小鼠结肠长度重量比的影响
结肠长度的变化可以反映肠道炎症的程度和对肠道组织的损伤程度。在结肠炎模型中,由于炎症反应的存在,结肠黏膜会出现不同程度的缩短或者变形,导致结肠总长度的减小[22]。肠道组织的重量变化可以反映结肠气肿和水肿等病理过程。在结肠炎模型中,由于炎症反应导致的组织水肿和充血会使得结肠重量显著增加,因此测量结肠重量可以反映结肠炎症的程度,并帮助评估治疗效果[23]。如图3 所示,与空白组比较,DSS 组小鼠的结肠平均长度显著缩短,结肠重量明显增加,结肠长度重量比显著增加,差异具有统计学意义(P<0.05);与DSS 组比较,Lig 中和高剂量组小鼠的结肠平均长度显著增长,结肠重量明显减少,结肠长度重量比显著降低,差异具有统计学意义(P<0.05),与董晶等[3]研究结果一致,说明显著改善了DSS 作用引起的结肠长度缩短的病症,其中Lig 各剂量组间相比,Lig 高剂量组治疗效果优于其余两组。

图3 Lig 对UC 小鼠结肠长度重量比的影响(n=10)Fig.3 Effect of lig on length to weight ratio of colon in UC mice (n=10)
2.4 Lig 对UC 小鼠的结肠病理组织损伤的影响
炎性细胞浸润是大多数结肠炎的典型特征,以白细胞的浸润为主。炎性细胞浸润可能导致肠壁变厚,肠道管腔受压迫并产生炎性假性息肉。肠壁增厚和肌肉层病理变化:在炎症的特定阶段,结肠黏膜下层间质细胞或炎性细胞的增生可能导致肠壁明显的增厚[24]。如图4 所示,与空白组比较,DSS 组小鼠的结肠组织出现明显的上皮细胞损伤,包括隐窝结构弥漫性损伤、杯状细胞丢失和大量中性粒细胞浸润至固有层;与DSS 组比较,Lig 中、高剂量组小鼠具有相对完整的隐窝结构,上皮变形较少,炎症细胞浸润较少;Lig 低剂量组小鼠则表现出较明显的组织损伤,隐窝结构部分损伤,炎症细胞浸润较多。与Nameer 等[25]的实验结果一致,表明Lig 可以对UC小鼠的结肠病理组织损伤程度发挥一定改善作用。

图4 Lig 对UC 小鼠结肠病理组织改变的影响(100×)Fig.4 Effect of lig on the pathological changes of colonic tissue in UC mice (100×)
2.5 Lig 对UC 小鼠血清中TNF-α、IL-6 和IL-1β 水平的影响
TNF-α、IL-6 和IL-1β是三种重要的炎症因子,它们在免疫系统中起到重要的作用。TNF-α能够诱导炎症反应、增强免疫细胞的活性,是重要的调节剂,可以引起全身性症状和导致组织损伤[26]。在炎症过程中,IL-6 可以增加白细胞数量和活性,促进其他免疫因子的产生,参与身体的免疫应答[27]。IL-1β可以促进炎症細胞的增殖和释放[28]。如图5 所示,与空白组比较,DSS 组小鼠结肠中促炎细胞因子TNFα、IL-6 和IL-1β的表达显著升高(P<0.05);与DSS组相比,Lig 中、高剂量组小鼠结肠中TNF-α、IL-6 和IL-1β的表达水平显著降低(P<0.05)。以上结果与董晶等[3]研究结果一致,表明Lig 可显著抑制DSS 所致UC 的炎症因子表达升高,且Lig 高剂量的治疗效果最佳。
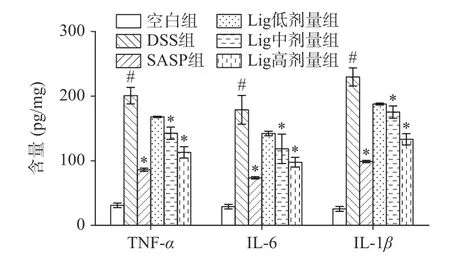
图5 Lig 对UC 小鼠血清中TNF-α、IL-6 和IL-1β 水平的影响(n=10)Fig.5 Effect of lig on the levels of TNF-α,IL-6,and IL-1β in the serum of UC mice (n=10)
2.6 Lig 对UC 小鼠结肠中TLR4/NF-κB 信号通路的影响
TLR4/NF-κB 信号通路与细胞因子的产生密切相关。各种外源源性危险信号可激活TLR4 受体并进一步诱导下游转录因子NF-κB 活化,最终促进促炎因子和趋化因子的产生。如图6 所示,与空白组比较,DSS 组小鼠结肠TLR4 蛋白的表达和NF-κB蛋白的磷酸化显著升高(P<0.05);与DSS 组比较,SASP 组和Lig 高剂量组小鼠结肠TLR4 蛋白的表达和NF-κB 蛋白的磷酸化显著降低(P<0.05),而Lig 低和中剂量对UC 小鼠结肠组织中蛋白表达无显著性区别。上述结果与Ma 等[29]研究结果一致,表明Lig 治疗UC 可能与抑制NF-κB 信号通路相关,可抑制炎症因子释放,减缓炎症反应的发生。

图6 Lig 对UC 小鼠结肠组织中的TLR4/NF-κB 信号通路的影响(n=10)Fig.6 Effect of lig on TLR4/NF-κB signaling pathway in colonic tissue of mice with DSS-induced colitis (n=10)
3 讨论与结论
UC 是一种反复发作的慢性肠道非特异性炎症反应,常常会引发免疫系统失调,在不同程度上可引起从直肠到近端结肠的连续黏膜炎症[1]。Lig 作为中药当归的主要有效成分之一,具有镇静、镇痛、解热及抗炎药理作用。本研究通过给予小鼠喂喝3%DSS 水溶液复制UC 模型,小鼠若出现便血和体重下降,结肠上皮细胞坏死、溃疡和炎症细胞浸润等情况,说明建模成功。观察小鼠一般情况、体重及其结肠长度进行DAI 等相关指数分析,通过测定血清中各种细胞因子水平,结合苏木素-伊红染色判断结肠损伤程度,发现Lig 对UC 小鼠的改善作用机制可能与抑制NF-κB 信号通路相关。
DAI 是一种用于评估疾病活性的指标,常用于评估慢性肠道炎症疾病,如UC 和克罗恩病的临床状况[14]。CMDI 是结肠长度反映慢性炎症和损伤修复的间接指标[15]。HS 主要通过结肠组织病理切片观察各组大鼠结肠病变情况评分[16]。本试验结果表明,与空白组相比,DSS 组小鼠的DAI、CMDI 和HS 指数水平显著升高(P<0.05),与DSS 组相比,Lig 中和高剂量DAI、CMDI 和HS 三个指数水平显著降低(P<0.05),其中高剂量Lig 的治疗效果最明显,与Wang 等[21]的研究结果一致,充分说明Lig 可以改善小鼠UC 的病理情况。
TNF-α是TNF 超家族的原型成员,主要由巨噬细胞和单核细胞分泌,是炎症反应和相关疾病的产生和发展中的主要促炎细胞因子[26]。IL-6 是一种具有184 个氨基酸的四螺旋多效细胞因子,该蛋白质由成纤维细胞、单核细胞、巨噬细胞、T 细胞和内皮细胞合成,其合成和分泌在炎症条件下诱导,在免疫反应、炎症和造血中起着重要作用[27]。IL-1β是抗微生物免疫以及自身免疫炎症的关键介质、有效的促炎因子,对于宿主反应和对病原体的抵抗至关重要,还会加剧慢性疾病和急性组织损伤期间的损害[28]。
本试验结果表明,与空白组相比,DSS 组小鼠血清中TNF-α、IL-6、IL-1β的表达水平显著升高(P<0.05);与DSS 组相比,Lig 中和高剂量能有效抑制UC 小鼠TNF-α、IL-6、IL-1β的表达水平,表明Lig治疗UC 可能与抑制炎症因子释放,达到炎症缓解。越来越多的证据表明TLR4/NF-κB 通路在结肠炎发病中发挥重要作用,抑制TLR4/NF-κB 通路可以改善DSS 所致的UC[30],例如MA 等[29]报道白头翁皂苷B4 可通过抑制 TLR4/NF-κB/MAPK 信号通路预防小鼠UC;JIANG 等[31]也报道了黄芩苷可通过抑制TLR4/NF-κB 信号通路对大鼠UC 发挥抗炎作用。因此,我们推测Lig 的抗炎作用可能是通过抑制TLR4 介导的NF-κB 通路的激活而实现的。本实验中,与空白组相比,DSS 组小鼠结肠组织TLR4蛋白表达量和NF-κB 磷酸化水平显著升高,Lig 干预能显著减少DSS 引起的上述效应,这些体外结果表明,抑制TLR4/NF-κB 信号通路以减轻炎症反应发生可能是Lig 发挥抗UC 的重要机制。
本实验虽然存在未设定体内细胞实验论证以及给药治疗时间太短等缺陷,但是通过查阅文献[12]复制UC 小鼠模型等系列实验充分说明Lig 能有效缓解DSS 诱导的小鼠UC,机制可能是通过抑制NF-κB 的表达及活化,进而抑制促炎因子TNF-α、IL-1β、IL-6 的释放。由此推断,Lig 缓解UC 小鼠的机制可能与NF-κB 信号通路有关,有望成为预防和治疗UC 的辅助药物。
