基于HPLC 结合化学计量学研究黄芪茎叶的最适采收期
2024-02-23李小兰高欣缘魏赫男郭丽丽
李小兰,高欣缘,孙 杰,魏赫男,郭丽丽
(山西中医药大学中药与食品工程学院,山西晋中 030619)
黄芪茎叶是豆科多年生草本植物蒙古黄芪Astragalus memeranaceus(Fisch.)Bge.Var.mongholicus(Bge.)Hsiao 或膜荚黄芪Astragalus membranaceus(Fisch.)Bge.的地上部分。每年伴随黄芪入药根部的采挖,大量的地上茎叶被废弃,如何加强对黄芪茎叶的资源挖掘和精深开发利用逐渐成为研究者关注的重要现实问题[1]。现代科学研究表明,黄芪茎叶具有与其入药根部类似的多糖类、黄酮类、皂苷类等化学成分[2],其中黄酮类具有抗炎、抗氧化等活性[3],而皂苷类具有抗心力衰竭、抗心肌缺血等作用[4]。黄芪甲苷是黄芪皂苷类成分的代表,毛蕊异黄酮葡萄糖苷是黄芪黄酮类成分的代表,这两种成分也是药典中所规定的黄芪质量控制的指标成分[5],说明黄酮类和皂苷类是植物黄芪的重要功效成分。
功效成分含量的高低会影响到黄芪茎叶资源的生理活性。分光光度法、高效液相色谱法、高效液相色谱-质谱联用法等可用于黄芪茎叶黄酮类和皂苷类功效成分的定量检测,其中高效液相色谱法仍然是多种单一成分精确定量分析的主流方法[6-7]。通过应用多波长、一测多评等方法,采用HPLC 可实现仅单次色谱分离即可高通量同步测定多成分含量的目的,在植物资源质量控制、品质评价、代谢产物研究等方面有着广泛应用[8-11]。此外,功效成分含量的高低还会受到采收期的影响。相关研究表明膜荚黄芪中毛蕊异黄酮葡萄糖苷、芒柄花苷、芒柄花素和黄芪甲苷的含量随采收期呈动态变化趋势,其中毛蕊异黄酮葡萄糖苷、芒柄花苷和黄芪甲苷含量在10 月份达到最高,而芒柄花素含量在该月达到最低[12];对蒙古黄芪的研究也表明黄酮和皂苷含量会受采收期的影响,8 月上旬采收的黄芪中黄酮和皂苷含量最高[13]。类似地,对其他食药两用植物的研究也表明采收期会影响活性成分的含量,相关研究还证实了采收期会进一步影响植物资源的功效,如秋季采收的牛藤叶提取物抗炎活性最强[14],8 月下旬采收的五味子果α-葡萄糖苷酶抑制活性最强[15]。
由此可见,采收期会影响黄芪茎叶功效成分的含量,从而影响到黄芪茎叶的活性,明确其活性成分随采收期的动态变化规律对于黄芪茎叶原料资源的质量控制具有重要意义。目前,黄芪茎叶的研究主要集中于活性成分解析和药效作用探索方面,其活性成分随采收期的动态变化规律尚不明确。基于此,本研究采用高效液相色谱法对黄芪茎叶中毛蕊异黄酮葡萄糖苷等7 种黄酮类成分和黄芪甲苷等3 种皂苷类成分进行同步含量测定,并结合化学计量学方法分析活性成分随采收期的动态变化规律,以期明确黄芪茎叶的最适采收期,为黄芪茎叶的合理采集、按需采收和最大化利用提供一定科学依据,也为黄芪茎叶的质量控制和合理利用奠定理论基础,对植物黄芪的产业化开发和产业链延伸具有重要意义。
1 材料与方法
1.1 材料与仪器
黄芪茎叶 采收于山西省浑源县黄花滩乡,经山西中医药大学中药资源与鉴定教研室刘计权教授鉴定为蒙古黄芪Astragalus membranaceusvar.mongholicus 的新鲜茎叶,样品采收后将茎、叶分离,自然阴干,干燥至恒重,粉碎,过4 号筛后储存。样品信息见表1;芦丁、毛蕊异黄酮葡萄糖苷、芒柄花苷、毛蕊异黄酮、黄芪皂苷Ⅱ HPLC≥98%,上海融合医药科技有限公司;金丝桃苷、槲皮苷、山奈酚、大豆皂苷Bb、黄芪甲苷 HPLC≥98%,上海麦克林生化科技有限公司;乙腈、甲醇 色谱纯,赛默飞世尔科技(中国)有限公司;甲醇 分析纯,天津市科密欧化学试剂有限公司;娃哈哈纯净水 杭州娃哈哈集团有限公司。

表1 样品信息Table 1 Information of samples
HH-4 数显恒温水浴锅 金坛市杰瑞尔电器有限公司;AR223CN 电子天平 奥豪斯仪器(常州)有限公司;GZX-9030MBE 电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;SB25-120 超声波清洗机 宁波新芝生物科技有限公司;RIGOL L-3000 系列高效液相色谱仪 北京普源精电科技有限公司;Agilent ZORBAX Extend C18色谱柱(4.5×250 mm,5 µm)安捷伦科技公司。
1.2 实验方法
1.2.1 供试品溶液的制备 精密称取5 g 干燥黄芪茎叶粉末,置于250 mL 圆底烧瓶中,加入100 mL甲醇,50 ℃下超声提取1 h,室温下静置冷却,过滤。滤液旋蒸至含有少量流动液体后倒出,放入60 ℃烘箱中烘干。随即用色谱级甲醇溶解并定容至5 mL,稀释适当倍数后,摇匀得到供试品溶液。
1.2.2 混合对照品溶液的制备 取各待测成分对照品适量,精密称定,加色谱级甲醇制成芦丁、毛蕊异黄酮葡萄糖苷、金丝桃苷、槲皮苷、大豆皂苷Bb、芒柄花苷、毛蕊异黄酮、黄芪甲苷、山奈酚和黄芪皂苷Ⅱ质量浓度分别为41.00、35.01、39.90、40.42、101.00、11.65、13.50、510.00、41.00、486.00 µg/mL的混合对照品溶液。
1.2.3 色谱条件 采用Agilent ZORBAX Extend-C18(4.6×250 mm,5 µm)色谱柱,流动相为乙腈(A)-水(B),梯度洗脱(0~3 min,15%→19% A;3~6 min,19% A;6~13 min,19%→21% A;13~14 min,21%→32% A;14~16 min,32%→34% A;16~21 min,34%→37% A;21~23 min,37%→35% A;23~25 min,35%A;25~27 min,35%→40% A;27~30 min,40% A;30~35 min,40%→15% A);流速0.8 mL/min;检测波长203 nm(3 种皂苷)和254 nm(7 种黄酮);柱温25 ℃;进样量10 µL。
1.2.4 HPLC 方法学考察
1.2.4.1 系统适应性考察 取“1.2.1”和“1.2.2”项下供试品溶液、混合对照品溶液适量,按“1.2.3”项下色谱条件进样测定。
(6)采用斜板组模块间歇式高频微振,能定期自动清洗斜板组模块,使斜板上的物料有序下滑,保证斜板板面上不堆积物料,板间不堵塞,从而保证设备长期稳定的工作效能。
1.2.4.2 线性关系考察 精密吸取“1.2.2”项下混合对照品溶液4、8、12、16、20、24 μL[16-17],按“1.2.3”项下的色谱条件分别进样测定,记录10 种成分吸收峰的峰面积,以各化合物的进样量(μg)为横坐标(X)、峰面积为纵坐标(Y)绘制标准曲线。
1.2.4.3 精密度考察 精密吸取混合对照品溶液10 µL,按“1.2.3”项下的色谱条件连续进样检测6 次,记录10 种成分吸收峰的峰面积。
1.2.4.4 稳定性考察 取同一批黄芪茎叶样品,按“1.2.1”项下方法制备供试品溶液,室温下于0、4、8、12、18、24 h,按照“1.2.3”项下的色谱条件分别进样检测,并记录10 种成分吸收峰的峰面积。
1.2.4.5 重复性考察 取同批次黄芪茎叶样品6 份,按“1.2.1”项下方法制备供试品溶液,按“1.2.3”项下色谱条件进样检测,并记录10 种成分吸收峰的峰面积。
1.2.4.6 加样回收率考察 精密称取已知含量的同批次黄芪茎叶样品粉末适量,按已知样品含量的50%、100%和150%分别加入混合对照品溶液[18],按“1.2.1”项下方法制备供试品溶液,然后再按照“1.2.3”项下的色谱条件进行测定,记录10 种成分吸收峰的峰面积。
1.2.5 不同采收期样品的含量测定 分别取不同采收期的黄芪茎、叶样品粉末,按“1.2.1”项下方法制备供试品溶液,每个样品平行制备三份,然后按“1.2.3”项色谱条件下进样测定,将各成分峰面积代入相应回归方程求得成分检出量a(µg),然后按下式计算该成分的含量(mg/g)。
式中,n 为样品溶液稀释倍数;V 为样品溶液体积,mL;0.01 为检测时进样体积,mL;m 为黄芪茎叶样品取样量,mg。
1.3 数据处理
各试验结果均重复3 次取平均值并计算误差值,采用SPSS 26.0 软件进行显著性差异分析和聚类分析,SIMCA 14.0 软件进行主成分分析,SPSSPRO在线数据分析平台进行熵权TOPSIS 法分析,采用Origin 2022 软件绘制图表。
2 结果与分析
2.1 HPLC 方法学考察
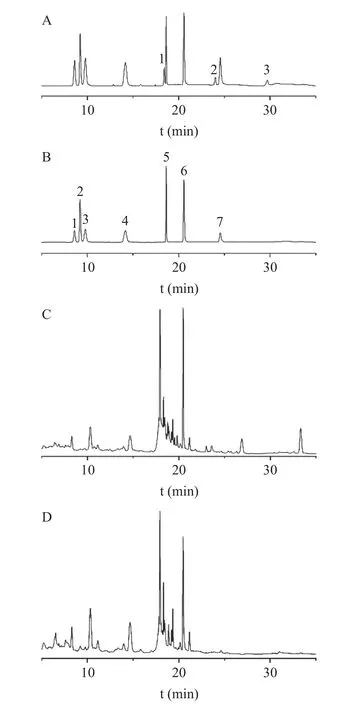
图1 混合对照品(A:203 nm;B:254 nm)及黄芪茎叶样品(C:203 nm;D:254 nm)色谱图Fig.1 HPLC chromatograms of mixed reference substances(A: 203 nm,B: 254 nm)and sample stems and leaves(C: 203 nm,D: 254 nm)of Astragalus membranaceus
2.1.2 线性关系考察结果 计算出10 种待测成分的回归方程和线性范围,结果见表2。10 种成分相关系数均大于0.9990,线性关系良好。

表2 10 种成分的线性回归方程及其线性范围Table 2 Linear regression equation and linear range of 10 components
2.1.3 精密度考察结果 分别计算各成分峰面积的RSD 值,结果显示芦丁、毛蕊异黄酮葡萄糖苷、金丝桃苷、槲皮苷、芒柄花苷、毛蕊异黄酮、山奈酚、大豆皂苷Bb、黄芪甲苷、黄芪皂苷Ⅱ的RSD 值分别为1.19%、0.40%、1.54%、0.86%、0.30%、0.20%、1.30%、1.37%、0.41%、1.64%,均小于2%,表明仪器精密度良好。
2.1.4 稳定性考察结果 分别计算各成分峰面积的RSD 值,结果显示芦丁、毛蕊异黄酮葡萄糖苷、金丝桃苷、槲皮苷、芒柄花苷、毛蕊异黄酮、山奈酚、大豆皂苷Bb、黄芪甲苷、黄芪皂苷Ⅱ的RSD 值分别为0.39%、1.28%、0.41%、0.68%、0.23%、0.40%、1.21%、1.08%、0.84%、1.33%,均小于2%,表明供试品在24 h 内稳定性良好。
2.1.5 重复性考察结果 分别计算各成分峰面积的RSD 值,结果显示芦丁、毛蕊异黄酮葡萄糖苷、金丝桃苷、槲皮苷、芒柄花苷、毛蕊异黄酮、山奈酚、大豆皂苷Bb、黄芪甲苷、黄芪皂苷Ⅱ的RSD 值分别为0.56%、1.63%、0.91%、0.82%、0.83%、1.33%、1.87%、1.95%、0.82%、1.03%,均小于2%,表明实验重复性良好。
2.1.6 加样回收率考察结果 计算其加样回收率和回收率的RSD 值,结果见表3。平均加样回收率均在98%~101%之间;RSD 值均小于2%,表明所建立的分析方法准确性良好。
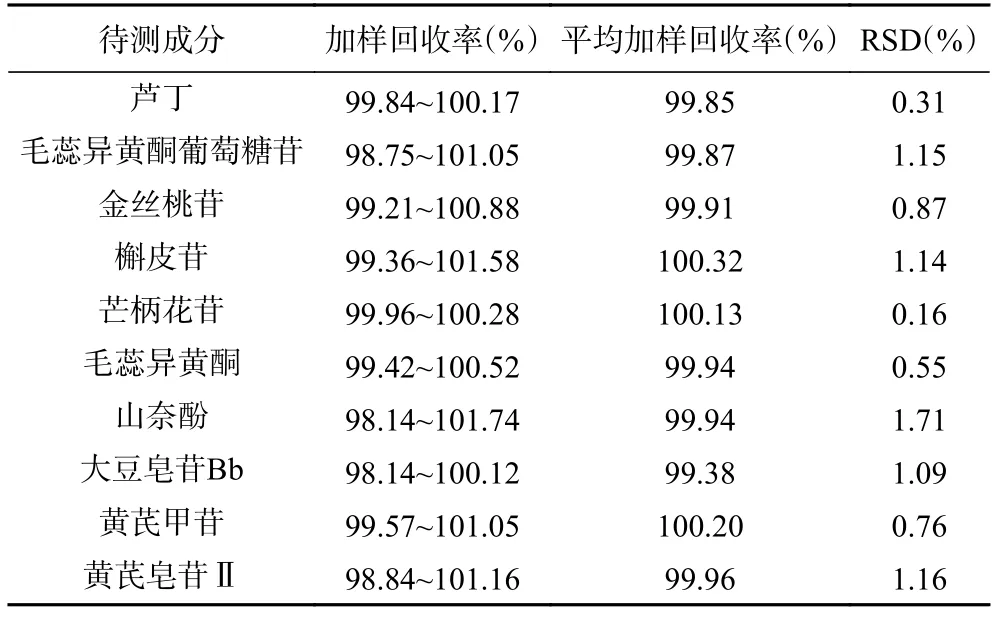
表3 加样回收率试验结果Table 3 Results of sample recovery rate test
2.2 不同采收期黄芪茎叶样品活性成分的含量测定
2.2.1 不同采收期黄芪茎样品活性成分的含量测定不同采收期黄芪茎中10 种成分的含量结果见表4。由表4 可以看出,10 种成分的含量随不同采收期均有显著变化(P<0.05),且大部分成分含量呈先上升后下降的趋势,其中,芦丁和山奈酚的含量分别在9 月25 日和8 月25 日达到峰值;毛蕊异黄酮葡萄糖苷和黄芪皂苷Ⅱ的含量在9 月10 日达到峰值;金丝桃苷、大豆皂苷Bb 和黄芪甲苷的含量在8 月10 日达到峰值。其中山奈酚、金丝桃苷和槲皮苷是黄芪茎中含量较丰富的3 种黄酮类成分,其次为芦丁和毛蕊异黄酮葡萄糖苷,黄芪甲苷是含量最丰富的皂苷类成分其峰值为11.491±0.140 mg/g。

表4 不同采收期黄芪茎中10 种成分的含量(mg/g)Table 4 Relative contents of 10 components in stems of Astragalus membranaceus at different harvest time (mg/g)
为了更直观的分析讨论上述成分的含量差异,将10 种成分含量归纳为黄酮醇类(芦丁、金丝桃苷、槲皮苷、山奈酚)、异黄酮类(毛蕊异黄酮葡萄糖苷、芒柄花苷、毛蕊异黄酮)、黄酮总量(7 种黄酮)和皂苷总量(3 种皂苷)4 大类,并分别作图,结果如图2 所示。由图2 可知,黄芪茎中皂苷总量在8 月上旬达到最高,之后开始下降;黄酮醇类和黄酮总量在8 月下旬达到最高,9 月之后含量有所下降,黄酮醇类含量变化趋势和黄酮总量基本保持一致;异黄酮类含量变化波动不明显。此外,黄芪茎中皂苷总量始终高于黄酮总量,说明茎中含有较丰富的皂苷类成分。

图2 不同采收期黄芪茎10 种成分含量差异Fig.2 Differences in the contents of 10 components in stems of Astragalus membranaceus at different harvest times
2.2.2 不同采收期黄芪叶样品活性成分的含量 不同采收期黄芪叶中10 种成分的含量结果见表5。黄芪叶中10 种成分的含量随不同采收期也均呈显著变化(P<0.05),且大部分成分含量整体也呈先上升后下降的趋势,但达峰期明显不同于黄芪茎。其中,黄芪甲苷、山奈酚和芒柄花苷的含量分别在9 月25 日、9 月10 日和6 月25 日达到峰值;芦丁和黄芪皂苷Ⅱ的含量在8 月10 日达到峰值。芦丁、芒柄花苷和山奈酚是黄芪叶中的优势黄酮类成分,含量峰值分别为14.679±0.309、4.313±0.680 和3.265±0.016 mg/g;黄芪皂苷Ⅱ是黄芪叶中的优势皂苷类成分,含量峰值分别为6.435±0.195 mg/g。

表5 不同采收期黄芪叶中10 种成分的含量(mg/g)Table 5 Relative content of 10 components in Astragalus membranaceus leaves at different harvest time (mg/g)
由图3 可知,黄芪叶中的皂苷总量在6 月下旬之后基本趋于平稳,而黄酮总量在7 月之后保持增加的趋势,8 月~9 月上旬含量较高;黄酮醇类含量变化趋势和黄酮总量基本保持一致,而7 月之后异黄酮类含量与黄酮醇类变化趋势正好相反,这说明黄芪叶中这两类黄酮类化合物的生物合成代谢过程中可能存在竞争作用。有文献表明苯丙烷代谢是黄酮类物质生物合成的主要途径,经柚皮素这一重要中间产物,再分别经黄酮醇支路和异黄酮支路合成异黄酮类和黄酮醇类化合物,其中异黄酮合酶(IFS)是合成异黄酮类的关键酶,黄酮醇合酶(FLS)是合成黄酮醇类的关键酶[19]。HU 等[20]研究表明黄芪中IFS 基因表达随着开花期的到来(6~7 月)有所下降,而FLS 的表达有所上升,这说明受关键酶活性变化的影响,开花期后黄酮醇支路的合成代谢将活跃于异黄酮支路,本研究所观察到的7 月之后黄芪茎叶异黄酮类与黄酮醇类含量的相反变化趋势与其相一致。
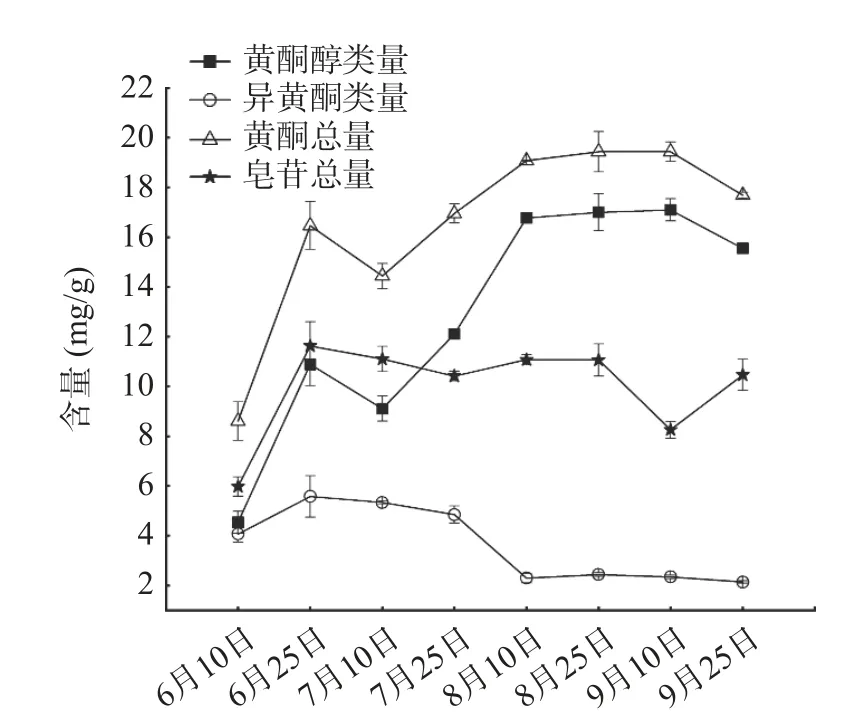
图3 不同采收期黄芪茎10 种成分含量差异Fig.3 Differences in the contents of 10 components in stems of Astragalus membranaceus at different harvest times
2.2.3 黄芪茎和叶样品活性成分的含量比较 为了进一步比较黄芪不同部位活性成分的含量差异,将黄芪茎和黄芪叶的黄酮总量和皂苷总量作对比图,如图4 所示。因10 月黄芪叶枯萎凋落,未采集到10 月的黄芪叶,故而主要对6 月~9 月的两个部位含量进行了对比。每个采收期黄芪叶中的黄酮总量均高于茎中,两个部位的黄酮总量均在8 月~9 月上旬同步达到较高水平;对于皂苷总量来说,7 月下旬之前黄芪叶中的含量高于茎中,而进入8 月之后茎中皂苷快速增加并显著高于叶中。这说明处于生长旺盛期的黄芪叶中黄酮类成分的积累更多,而黄芪茎中更利于积累皂苷类成分,提示两个部位的合用可同时兼顾这两类活性成分。
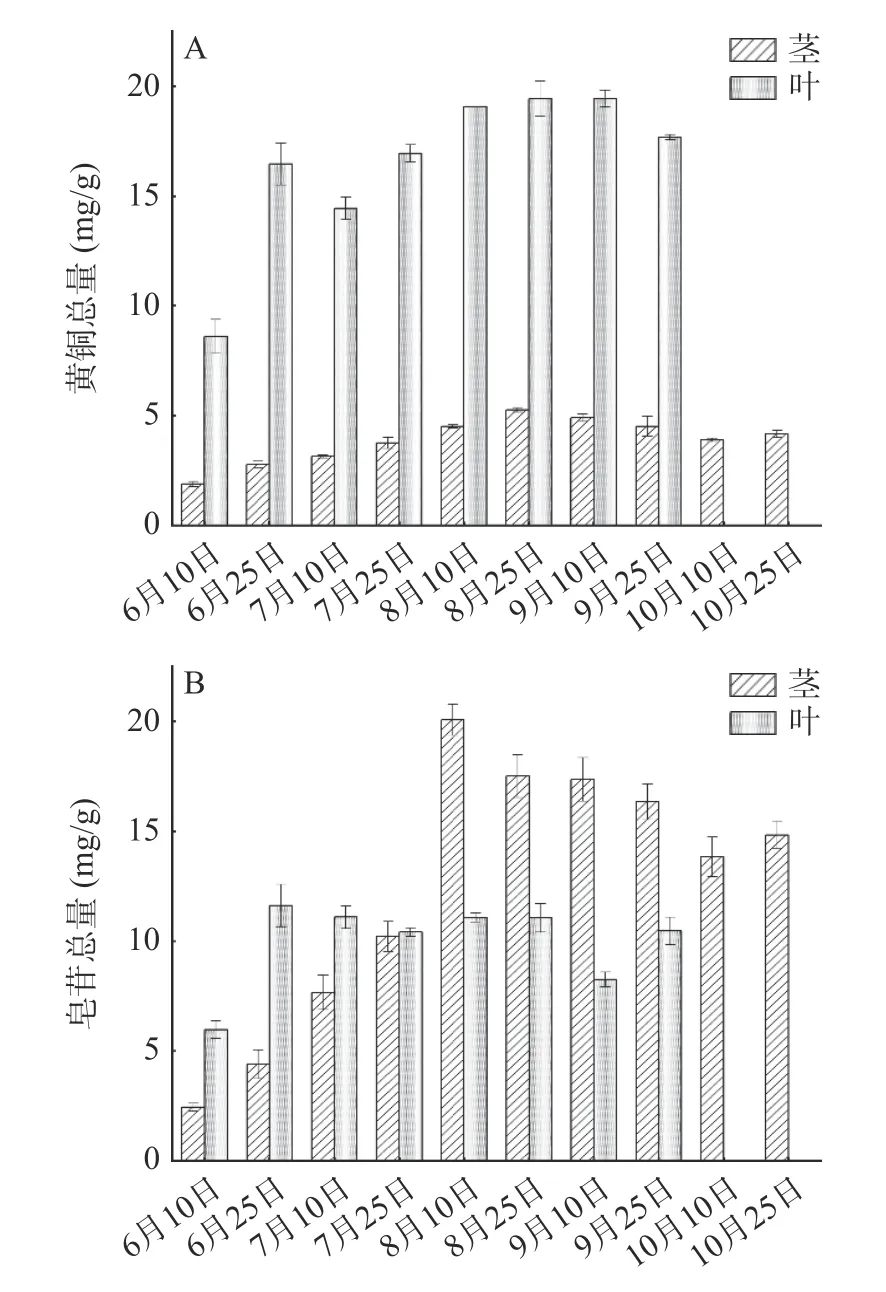
图4 黄芪茎和叶中黄酮总量(A)和皂苷总量(B)的差异Fig.4 Difference of total flavonoids (A)and saponins (B)in stems and leaves of Astragalus membranaceus
2.3 黄芪茎、叶的系统聚类分析(HCA)
为考察黄芪茎、叶中黄酮和皂苷类成分与采收期之间的相互关系,以10 批不同采收时间的黄芪茎中10 种成分含量和8 批不同采收期的黄芪叶中10 种成分含量为基准,采用系统聚类分析方法,通过组间连接法,以平方欧氏距离作为样品相似性的判定[14],分析结果见图5。以欧式距离10 为临界点时,10 个采收时间的黄芪茎聚集为2 类,其中6~7 月为一类、8~10 月为第二类,说明6~7 月黄芪茎中的成分与8 月之后的明显不同。8 个采收时间的黄芪叶聚集为3 类,6 月上旬为一类,6 月下旬和7 月为第二类,8、9 月为第三类,说明8 月前后黄芪叶中的成分有明显差异。
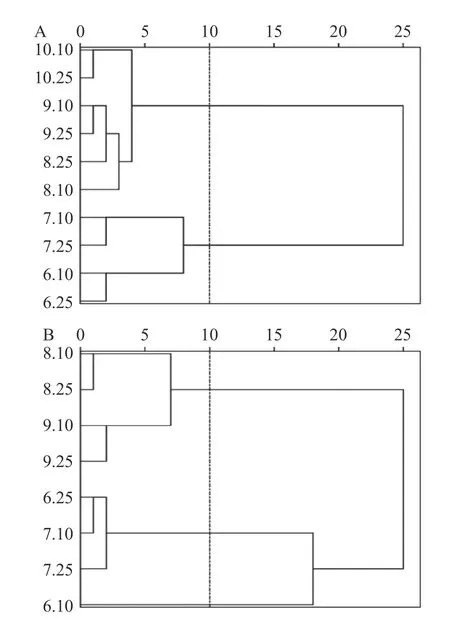
图5 黄芪茎(A)、叶(B)样品聚类分析结果Fig.5 Cluster analysis results of Astragalus stems (A)and leaves (B)samples
2.4 主成分分析(PCA)
为了更直观的比较不同采收期黄芪茎、叶成分的差异,将不同采收期黄芪茎、叶中10 种成分的三次平行测定含量数据导入SIMCA 14.0 进行主成分分析[21-23],结果表明黄芪茎前3 个主成分的累积解释能力参数值R2X 和预测能力参数值Q2分别为0.858 和0.516,即可以用3 个潜在综合指标来解释85.80%的总方差,基本能反映出不同采收期黄芪茎的主要特征;黄芪叶前3 个主成分的累积解释能力参数值R2X 和预测能力参数值Q2分别为0.843 和0.525,即可以用3 个潜在综合指标来解释84.30%的总方差,基本能反映出不同采收期黄芪叶的主要特征。从图6A 所示的PCA 得分图中可以看出,6、7 月黄芪茎分布在纵轴左侧,8、9、10 月分布在纵轴右侧,表明8 月前后黄芪茎中成分含量差异较大。同时,因8 月下旬和9 月样本组间距离较近,表明采自于此阶段的黄芪茎中的活性成分含量差异较小。从图6B 中可以看出,6、7 月黄芪叶分布在纵轴左侧,8、9 月分布在纵轴右侧,且6 月下旬和7 月样本分布较为集中,表明6 月下旬和7 月黄芪叶成分含量接近,8 月和9 月黄芪叶样本组间距离也较小,表明8~9 月黄芪叶的成分组成接近。PCA 分析结果与聚类分析基本一致。分析原因可能与7 月是浑源的最热月(平均气温~22 ℃),而8 月浑源平均气温(~20 ℃)开始下降有关,适宜的温度更利于黄芪这种喜凉植物的生长,使成分积累速度加快[24]。温度和水分是影响植物生长及其品质形成的两个重要因素,黄芪的最适生长季温度为15 ℃[25],而8 月份浑源的平均气温为20 ℃,同时8 月份也是降水高峰期,能有效促进化学成分的合成和积累。

图6 不同采收期黄芪茎(A)、叶(B)PCA 得分图Fig.6 PCA scores of stems (A)and leaves (B)of Astragalus membranaceus at different harvest times
2.5 熵权TOPSIS 法分析
为进一步考察黄芪茎叶不同采收期样品的质量高低,采用SPSSPRO 在线分析软件对不同采收期黄芪茎、叶进行TOPSIS 法分析。10 个成分指标均为极大型指标,进行正向化处理后,计算正理想解距离(D+)、负理想解距离(D-)和相对贴近度(C),其中相对贴近度值越接近1,表示综合评价越好[26],结果见表6。不同采收期黄芪茎质量的综合评价排序为J5>J6>J7>J8>J10>J4>J9>J3>J2>J1。不同采收期黄芪叶质量的综合评价排序为Y6>Y5>Y3>Y4>Y2>Y1>Y7>Y8。可见,黄芪茎在8~9 月的质量较好,黄芪叶在整个8 月的质量最高,综合考虑黄芪根的采挖时间(9~10 月左右)并结合HCA 和PCA 分析结果,同时兼顾黄芪茎叶的生长规律和产量,建议黄芪茎单独部位的采收时间为9 月,黄芪叶单独部位的采收时间为8 月;若作为地上部分的整体利用,建议8 月下旬采收黄芪茎叶较为合适,这样既可满足有效成分含量高峰期与产量高峰期一致的原则,同时也可尽量减少对黄芪根部生长的影响。

表6 不同采收期黄芪茎叶熵权TOPSIS 法分析结果Table 6 Analysis results of entropy weight TOPSIS method for stems and leaves of Astragalus membranaceus in different harvesting periods
3 结论
通过建立可用于黄芪茎叶中毛蕊异黄酮葡萄糖苷等7 种黄酮类和黄芪甲苷等3 种皂苷类化合物的HPLC 同步定量测定方法,揭示了这10 种活性成分随采收期的动态变化规律,化学计量学和统计学方法分析结果表明黄芪茎在8~9 月质量较高,叶在8 月质量较高,因此结合黄芪根部的采挖时间(9~10 月),对黄芪茎、叶单独部位以及茎叶合用部位的采收时间进行了合理建议。建议黄芪茎单独部位的采收时间为9 月,黄芪叶单独部位的采收时间为8 月;若作为地上部分的整体利用,建议8 月下旬采收黄芪茎叶较为合适。后续研究可进一步探讨采收期对黄芪茎叶功效的影响,从而为黄芪茎叶的精准利用和有效开发提供理论基础和科学依据。
