布渣叶多糖的提取工艺优化及生物活性分析
2024-02-23刘秋叶左亚杰
刘秋叶,刘 辉,陈 鑫,左亚杰,*
(1.湖南中医药大学第一附属医院,湖南长沙 410007;2.佛山科学技术学院医学院,广东佛山 528225)
布渣叶为椴树科植物破布叶(Microcos paniculataL.)的干燥叶,主要生长在我国的南方地区。其具有消食化滞,清热利湿的功效,主要用于治疗饮食积滞,感冒发热,湿热黄疸[1],是民间药食两用的常用药用植物,岭南居民常以单方或者复方的形式煮水喝以改善消化不良的症状[2]。此外,布渣叶也被用作多种凉茶的主要配方药物之一,例如“仙草爽凉茶”“广东凉茶”“王老吉”等[3-4]。布渣叶化学成分主要含有黄酮类[5]、生物碱类[6]、有机酸、挥发油等[7]。肖观林等[8]应用超高效液相色谱-四级杆-飞行时间高分辨质谱法(UPLC-Q-TOF-MS/MS)分析布渣叶中的化学成分,共鉴别出28 个黄酮类和3 个有机酸类成分;李振雨等[9]对布渣叶标准汤剂中3 种黄酮类成分的含量进行测定,结果显示布渣叶标准汤剂牡荆苷的含量范围为1.63~4.68 mg/g,异牡荆苷的含量范围为2.16~4.25 mg/g,水仙苷的含量范围为7.86~14.18 mg/g。现代药理研究证明布渣叶水提物具有解热退黄、镇痛及促消化等作用[10-12]。
植物多糖的提取方法主要有:热水浸提法[13]、微波提取法[14]、酶解法[15]、超声波辅助提取法[16]等。超声辅助热水提取法是目前使用最为广泛的提取方法,该法具有使用性广泛、提取时间短、运行简单易操作、成本低等优点[17]。张双奇等[18]采用超声辅助热水法提取天麻多糖,天麻多糖的含量可达32.83 mg/g,远高于采用回流醇沉法提取的25.04 mg/g[19]。金蓉等[20]研究发现超声辅助提取法显著提高了铁皮石斛水溶性多糖得率,并使提取时间从2 h缩短至3 min,同时超声辅助热水提取(95~100 ℃)可进一步提高多糖提取率。Chen 等[21]采用超声波辅助提取法提取山楂多糖其多糖得率7.47%±0.05%,明显高于同时采用沸水抽提法提取得到的山楂多糖得率5.88%±0.19%。
目前,布渣叶化学成分研究主要集中在黄酮类和生物碱类,关于布渣叶中多糖成分的研究还未见报道。布渣叶作为多种凉茶类保健食品的主要原料,其主要功能性质是否与其多糖成分有关需要进一步探究。因此,本文对布渣叶中多糖成分进行提取,采用超声辅助热水法优化布渣叶多糖的提取工艺,同时对布渣叶多糖的生物活性展开研究,探讨了布渣叶多糖的抗氧化、胰脂肪酶抑制活性、抗菌活性,为布渣叶多糖在食品、药品等领域进一步的开发和应用提供了理论依据。
1 材料与方法
1.1 材料与仪器
干燥布渣叶 广州南北行中药饮片有限公司;95%乙醇、浓硫酸 西陇科学股份有限公司;苯酚、葡萄糖、维生素C(VC)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、过硫酸钾、水杨酸、硫酸亚铁、过氧化氢、三羟甲基氨基甲烷、无水氯化钙、对硝基苯基丁酸酯(p-NPB)、二甲基亚砜、辛伐他汀、胰脂肪酶粉、葡萄糖标准品、5%苯酚溶液 上海麦克林生化科技有限公司;蛋白胨、牛肉膏、琼脂粉、氯化钠 杭州滨和微生物试剂有限公司;大肠杆菌(Escherichia coli)、肺炎克雷伯菌(Klebsiella pneumoniae)、金黄色葡萄球菌(Staphyloccocus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、鲍曼不动杆菌(Acinetobacter baumannii)均来源于佛山市中医院检验科。
060ST 超声波清洗机 深圳市华策科技有限公司;JJ224BC 电子天平 常熟悉市双杰测试仪器;CSH-ZY-00174 多功能酶标仪 广州步前生物科技有限公司;RE-2000A 旋转蒸发仪 郑州特尔仪器设备厂家;BBS-SDC 双人单面垂直净化工作台 广州沃霖实验室设备有限公司;BKQ-B10011 高压蒸汽灭菌锅 厦门致微仪器有限公司;PH-070A 恒温培养箱 上海博迅实业有限公司医疗设备厂;101-3AB 烘箱 常州市荣华干燥设备有限公司。
1.2 实验方法
1.2.1 布渣叶多糖的提取工艺 称取10 g 粉碎好的布渣叶,与一定体积的蒸馏水分别依次置于500 mL的锥形瓶中,在设定好的超声功率、超声温度、料液比和超声时间下提取布渣叶多糖,提取完成后立即进行减压抽滤,滤液室温冷却,在10000 r/min 条件下离心1 min,采用Sevag 法除去蛋白质,将除去蛋白质后的布渣叶提取液在4 ℃条件下用95%的乙醇进行醇沉,最后冷冻干燥得布渣叶多糖。
1.2.2 单因素实验 按照1.2.1 的方法,固定料液比为1:30(g/mL),超声时间为25 min,超声温度为65 ℃,设置不同的超声功率(135、180、225、270、和315 W),考察对多糖得率的影响;固定料液比为1:30(g/mL),超声时间为25 min,超声功率为315 W,设置不同的超声温度(35、55、65、70 和80 ℃),考察对多糖得率的影响;固定超声温度为65 ℃,超声功率为315 W,超声时间为25 min,选择不同的料液比(1:10、1:20、1:30、1:40 和1:50 g/mL),考察对多糖得率的影响;固定料液比为1:30(g/mL),超声温度为65 ℃,超声功率为315 W,设置不同的超声时间(5、15、25、35 和45 min),考察对多糖得率的影响[22-23]。
1.2.3 正交试验优化 以单因素实验结果为依据,选取具有显著影响的四个因素为自变量,布渣叶多糖得率为因变量,设计四因素三水平正交试验,如表1所示。

表1 L9(34)正交试验因素水平Table 1 L9(34)orthogonal experimental factor levels
1.2.4 布渣叶多糖的测定
1.2.4.1 多糖标准曲线的绘制 采用本实验室相同的标曲测定方法[24]。具体方法如下:称取干燥至恒重的葡萄糖标准品10 mg 定容至100 mL 的容量瓶中,配成0.1 mg/mL 的葡萄糖标准溶液。分别精密移取0、0.2、0.4、0.6、0.8、1.0 mL 上述配制好的溶液于试管中,补加蒸馏水至1 mL,依次加入5%苯酚1 mL,98%浓硫酸5 mL,摇匀,于37 ℃水浴静置30 min,在488 nm 测定吸光度,可得回归曲线方程为Y=0.0094X+0.0928,R2=0.993。式中Y 为吸光度,X 为葡萄糖溶液浓度(mg/mL)。
1.2.4.2 布渣叶多糖的含量测定 采用苯酚-硫酸法[25]进行布渣叶多糖含量测定。用移液枪吸取布渣叶多糖溶液200 µL 放置于西林瓶,加入5%苯酚溶液200 µL,摇匀后快速加入98%浓硫酸1 mL,摇匀,静置5 min,在37 ℃的水浴上加热30 min,室温冷却,在488 nm 波长下测定吸光度。根据公式(1)计算布渣叶多糖得率。
式中:c 为多糖提取液质量浓度(g/mL);V 为多糖提取液总体积(mL);n 为稀释倍数;m 为布渣叶取样量(g)。
1.2.5 布渣叶多糖体外抗氧化活性研究
1.2.5.1 DPPH 自由基清除率测定 取不同浓度(1.000000、0.500000、0.250000、0.125000、0.062500、0.031250、0.015625 mg/mL)的布渣叶多糖溶液以及0.1 mmol/L 的DPPH 溶液加入到96 孔板中,作为实验组,轻轻摇匀,室温避光反应30 min,在517 nm下测定吸光值;VC作为阳性对照[26];无水乙醇代替DPPH 溶液作为阴性对照组;空白对照组为DPPH溶液加无水乙醇;根据公式(2)可以计算布渣叶多糖和VC对DPPH 自由基的清除率。
式中:A1为样品溶液加DPPH 所测得的吸光值;A2为样品溶液加无水乙醇所测得的吸光值;A0为只加无水乙醇和DPPH 所测得的吸光度值。
1.2.5.2 ABTS+自由基清除试验 将50 µL 不同浓度(1.000000、0.500000、0.250000、0.125000、0.062500、0.031250、0.015625 mg/mL)的布渣叶多糖供试液、4.95 mmol/L K2S2O8和7 mmol/L ABTS 混合液150 μL 置于96 孔板中,作为实验组,轻轻摇匀,室温避光反应30 min,在734 nm 下测定吸光值;VC作为阳性对照[27];阴性对照组用无水乙醇代替K2S2O8和ABTS 混合液;空白对照组为K2S2O8和ABTS 混合液150 μL 与50 μL 的无水乙醇;根据公式(3)可以计算布渣叶多糖和VC对ABTS+自由基的清除率。
式中:B1为样品溶液加K2S2O8和ABTS 混合液所测得的吸光值;B2为样品溶液加无水乙醇所测得的吸光值;B0为只加无水乙醇、K2S2O8和ABTS混合液所测得的吸光度值。
1.2.5.3 OH 自由基清除试验 将不同浓度(1.000000、0.500000、0.250000、0.125000、0.062500、0.031250、0.015625 mg/mL)布渣叶多糖溶液、水杨酸醇溶液(9 mmol/L)、FeSO4溶液(9 mmol/L)、H2O2溶液(8.8 mmol/L)各50 μL 加入到96 孔板中,作为实验组,轻轻摇匀,在阴凉处避光放置反应30 min,在510 nm 下测定吸光值;VC作为阳性对照[28];阴性对照组用无水乙醇代替水杨酸醇溶液;空白对照组为FeSO4、无水乙醇、水杨酸醇溶液以及H2O2;根据公式(4)可以计算布渣叶多糖和VC对OH 自由基的清除率。
式中:C1为样品溶液加入FeSO4溶液、水杨酸醇溶液、H2O2所测得的吸光度;C2为样品溶液加入FeSO4溶液、H2O2、无水乙醇混合后测得的吸光度;C0为除不加入样品溶液,另外四种溶液均加入所测得的吸光度。
1.2.6 布渣叶脂肪酶抑制实验研究 本实验使用对硝基苯基丁酸脂作为底物溶液,参照文献[29]并稍做调整。按表2 进行反应;将20 μL 不同浓度(0.1、0.5、1.0、2.0、3.0、4.0、5.0 mg/mL)的布渣叶多糖供试液、Tris-HCl 缓冲液和胰脂肪酶储备液置于96孔板中,于37 ℃恒温箱中预热15 min,随后将0.01 mol/L底物溶液点入孔板中,再放回恒温箱中反应15 min,用酶标仪测其吸光度,波长为405 nm。根据公式(5)可以计算各样品对胰脂肪酶的抑制率。

表2 胰脂肪酶活性测定反应体系Table 2 Reaction system for determination of pancreatic lipase activity
式中:A 为对照实验组的吸光度;a 为对照空白组的吸光度;B 为样品实验组的吸光度;b 为样品空白组的吸光度。
1.2.7 布渣叶多糖抑菌活性的测定 采用微量肉汤稀释法[30]测定布渣叶多糖对供试菌的最小抑菌浓度(MIC)。将E.coli、K.pneumoniae、S.aureus、P.aeruginosa、A.baumannii在牛肉膏蛋白胨培养基接种后,于37 ℃恒温培养箱中培养24 h,制备1.5×105cfu/mL 的菌悬液和200 mg/mL 布渣叶多糖溶液,在96 孔板中进行样品接种。1~11 每孔均加入100 μL的营养肉汤,第12 孔加入200 μL 的营养肉汤;第1 孔加入200 mg/mL 布渣叶多糖溶液100 μL 倍比稀释至第10 孔;1~11 孔均加入菌悬液100 μL;37 ℃条件下孵育16 h~18 h。在酶标仪600 nm 处测吸光度,并确定MIC。
1.3 数据处理
实验结果均为三次平行实验,数据表示为Mean(平均值)±SD(标准差)。并采用Microsoft Office Excel 2019、Graph Pad Prism 8 软件进行实验数据的处理、分析及绘图。并采用SPSS 23.0 进行单因素方差分析,P<0.05 表示差异显著。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声功率对布渣叶多糖得率的影响 由图1可知,超声功率在135~270 W 范围内多糖得率随功率的升高而增大,到270 W 时达到最大值为2.29%±0.14%,之后得率逐渐降低。这与姚欣等[24]研究发现鸡蛋花多糖得率随超声功率的变化趋势相同。可能是由于超声波功率增大同时,其空化效应也会相应加强,细胞因内压加大而易于破裂,有利于多糖溶出[31]。当超声波功率超过270 W 时,多糖的溶出处于饱和状态,持续加大超声波功率会使多糖结构受损,故多糖得率降低。因此超声功率选择最佳条件中的225、270、315 W 三个参数进行正交试验。

图1 超声功率对布渣叶多糖得率的影响Fig.1 Effect of ultrasonic power on the yield of Microcos polysaccharide
2.1.2 超声温度对布渣叶多糖得率的影响 由图2所示,超声温度在35~65 ℃范围内多糖得率随温度的升高而增大,在65 ℃时达到了最大值为1.94%±0.01%,其原因可能是提高温度可以使分子运动加强,溶剂对植物组织细胞的渗透能力也不断增强,有效成分更容易析出,故布渣叶多糖得率增大[32]。当超声温度超过65 ℃时,其多糖得率逐渐降低,这可能是温度过高破坏多糖的结构引起多糖的降解。因此,选择55、65、75 ℃进行正交试验。

图2 超声温度对布渣叶多糖得率的影响Fig.2 Effect of ultrasonic temperature on the yield of Microcos polysaccharide
2.1.3 料液比对布渣叶多糖得率的影响 由图3 所示,随着料液比的增大,多糖得率也相应提高,当比例达到1:30(g/mL)时,达到最大值为1.89%±0.10%,其原因可能是,布渣叶多糖与溶液的接触面积随着提取液量的增加而扩大,有利于溶质多糖的溶出[33]。当继续增大料液比时其多糖得率下降,这可能是此时的溶液中多糖浓度与布渣叶细胞组织中的多糖浓度相当,细胞组织内外的多糖浓度差消失,此时多糖的溶出趋于平衡,多糖的提取量几乎保持不变。因此选择1:20、1:30、1:40(g/mL)进行正交试验。
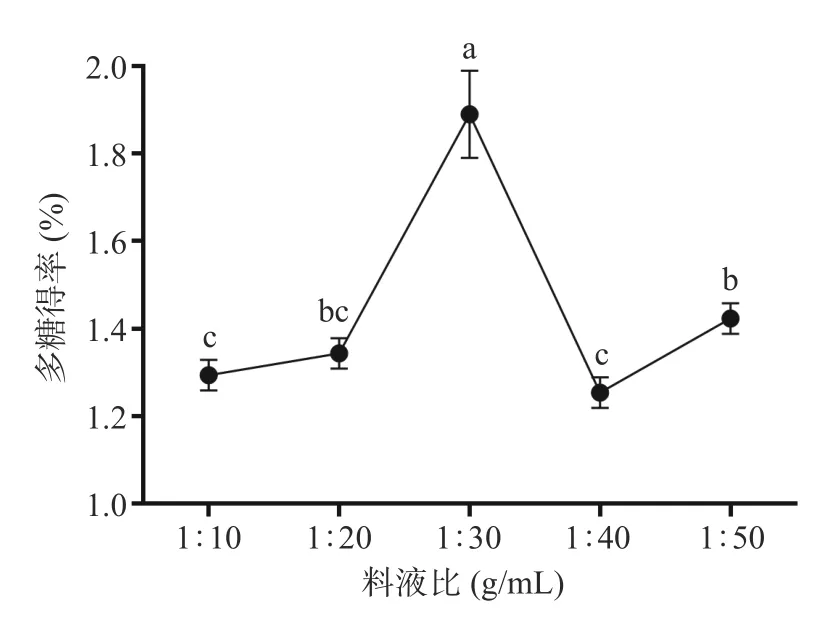
图3 料液比对布渣叶多糖得率的影响Fig.3 Effect of solid-liquid ratio on the yield of Microcos polysaccharide
2.1.4 超声时间对布渣叶多糖得率的影响 如图4所示,在5~35 min 内,多糖得率随时间的延长而增加,当超声时间增加到35 min 时,达到了最大值2.44%±0.04%。其原因可能是随着超声时间的延长,超声波的空化作用增强,细胞壁损伤增加,从而加快多糖从细胞壁中扩散[34]。继续增加超声时间,多糖得率有所下降,主要原因可能是可溶性多糖长时间暴露在高浓度的溶液中,其多糖的化学结构和生物活性会被破坏。因此,选择25、35、45 min 进行正交试验。
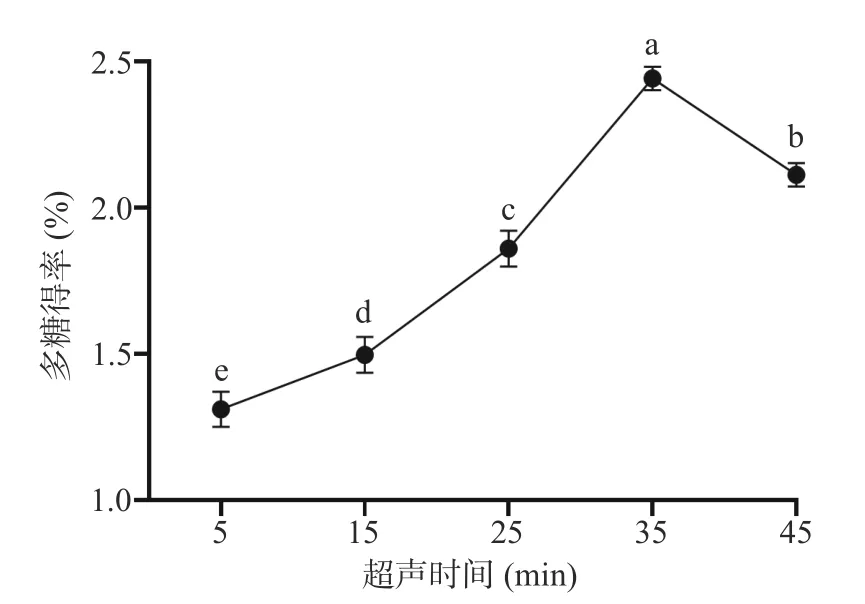
图4 超声时间对布渣叶多糖得率的影响Fig.4 Effect of ultrasonic time on the yield of Microcos polysaccharide
2.2 正交试验结果
在超声功率、超声温度、料液比、超声时间的单因素实验基础上,设计以布渣叶多糖得率为指标的正交试验,可得到最佳的提取工艺参数。
表3 中的R 值可知影响布渣叶多糖得率的因素顺序为D(超声时间)>A(超声功率)>B(超声温度)>C(料液比),又由k 值可知其最佳的提取工艺为A1B2C1D2,即超声功率为225 W,超声温度为65 ℃,料液比为1:20(g/mL),超声时间为35 min。表4 的方差分析结果表明各因素不同水平间均具有显著性差异,即超声功率,超声温度,料液比,超声时间均为影响布渣叶多糖得率的关键性因素。
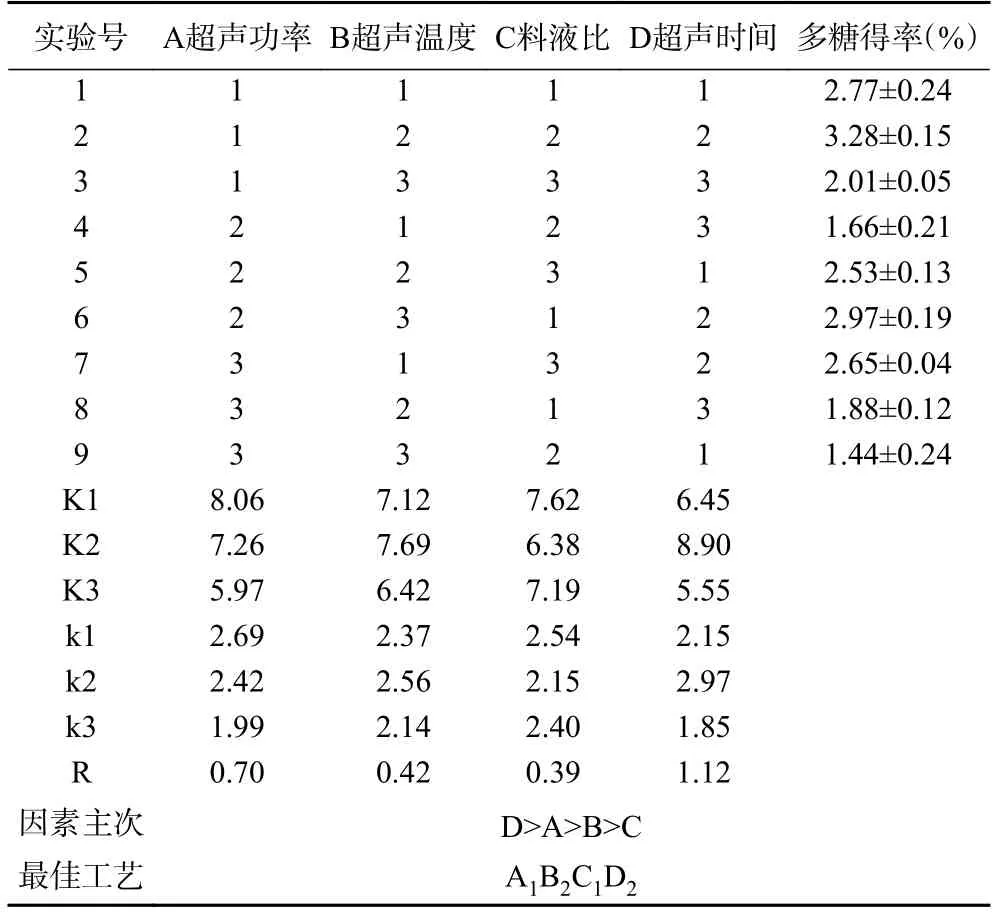
表3 正交试验结果分析Table 3 Analysis of orthogonal experiment results

表4 方差分析结果Table 4 Analysis of variance table
2.3 验证实验
由于该组合未出现在实验中,为了评价最佳提取工艺的稳定性,按照前文的提取方法重复进行三次实验,布渣叶多糖的得率分别为3.92%、3.47%、3.88%,平均得率为3.76%±0.25%,其大于表4 最佳值(3.28%±0.15%),相对偏差(RSD)值为6.6%,该提取工艺适用于布渣叶多糖的提取。王敏等[35]采用与本实验相同的方法提取蒙药漏芦花多糖并优化提取工艺参数,最佳提取工艺条件下漏芦花多糖得率为1.13%,布渣叶多糖的得率相对较高。
2.4 布渣叶多糖体外抗氧化活性测定
2.4.1 布渣叶多糖对DPPH 自由基的清除作用 根据图5 可知,布渣叶多糖对DPPH 自由基清除率和质量浓度呈一定的量效关系,在0.016~0.250 mg/mL范围内随着质量浓度的增加清除作用显著(P<0.05)增强,质量浓度大于0.250 mg/mL 后,清除作用呈现缓慢增强趋势。当质量浓度达到试验设置最大浓度1 mg/mL 时,布渣叶多糖的清除率可达94.53%±1.34%。布渣叶多糖对DPPH 自由基半数清除浓度为0.1430 mg/mL。在0.500~1.000 mg/mL 范围内布渣叶多糖对DPPH 自由基的清除率与VC接近,布渣叶多糖与文献[36]报道的猴头菇多糖对DPPH 自由基的清除效果相当。
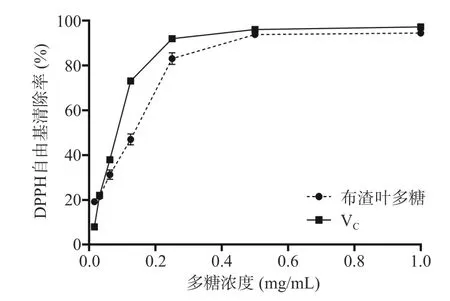
图5 布渣叶多糖对DPPH 自由基清除率的影响Fig.5 Effect of Microcos polysaccharide on DPPH free radical scavenging rated
2.4.2 布渣叶多糖对ABTS+自由基的清除作用 据图6 可知,布渣叶多糖在0.016~0.063 mg/mL 范围内随着质量浓度的增加对ABTS+自由基的清除作用呈现急剧增强趋势。当浓度高于0.031 mg/mL 时清除率均大于90%,当浓度为0.063 mg/mL 时出现最大清除率97.13%±1.70%。布渣叶多糖和VC对ABTS+自由基的半数清除浓度均为0.016 mg/mL,说明布渣叶多糖对ABTS+自由基具有较强的清除作用,与Gu 等[37]报道的欧洲慈姑多糖清除效果相近。

图6 布渣叶多糖对ABTS+自由基清除率的影响Fig.6 Effect of Microcos polysaccharide on ABTS+ free radical scavenging rate
2.4.3 布渣叶多糖对OH 自由基的清除作用 根据图7 可知,在设置的实验浓度范围内,当布渣叶多糖浓度大于0.125 mg/mL 时,布渣叶多糖对OH 自由基的清除作用呈浓度依赖型,随着浓度的升高清除率逐渐增强。在质量浓度达到1 mg/mL 时,布渣叶多糖的清除率为81.93%±2.47%,布渣叶多糖对OH自由基的半数清除浓度为0.145 mg/mL。实验结果表明布渣叶多糖具有一定的OH 自由基清除能力,但清除效果弱于Vc。上述可知,布渣叶多糖对DPPH、ABTS、OH 自由基均具有清除效果,其与文献[38]报道的甘草多糖具有相似的抗氧化能力。
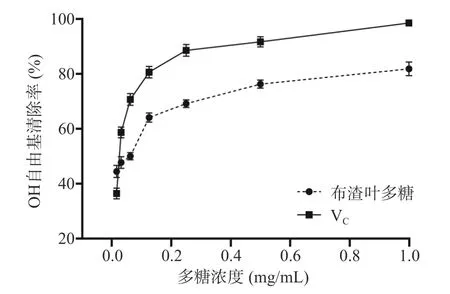
图7 布渣叶多糖对OH 自由基清除率的影响Fig.7 Effect of Microcos polysaccharide on OH free radical scavenging rated
2.5 布渣叶多糖对胰脂肪酶的抑制活性
为考察布渣叶多糖是否具有一定的体外降脂活性,本文对布渣叶多糖抑制胰脂肪酶活性进行了测试。根据图8 可知,布渣叶多糖与辛伐他汀的胰脂肪酶抑制曲线在0~1 mg/mL 时趋势大致相同。当多糖浓度为1 mg/mL 时,布渣叶多糖抑制率为33.98%±2.31%,高于文献[39]报道的裙带菜多糖[39]在同一质量浓度下的胰脂肪酶抑制率31.9%。当浓度大于1 mg/mL 后,布渣叶多糖抑制活性并没有随浓度增加而增加,而是基本保持平稳。布渣叶多糖在质量浓度达到试验设置最大浓度时5 mg/mL,抑制率为36.22%±1.76%。实验结果表明布渣叶多糖具有一定的胰脂肪酶抑制活性,但抑制能力较辛伐他汀弱。

图8 布渣叶多糖与辛伐他汀对胰脂肪酶抑制率Fig.8 Inhibition rate of polysaccharides and simvastatin on pancreatic lipase
2.6 布渣叶多糖体外抗菌活性评价
如表5 所示,布渣叶多糖对铜绿假单胞菌和鲍曼不动杆菌的MIC 分别为50 和200 mg/mL,对大肠杆菌和肺炎克雷伯菌的MIC 均为100 mg/mL,对金黄色葡萄球菌的MIC 大于200 mg/mL。结果表明布渣叶多糖对铜绿假单胞菌抑制效果最好,对金黄色葡萄球菌不敏感。陈远菲等[40]通过体外抑菌实验结果发现,甘蔗叶多糖浓度为0.14 mg/mL 时对大肠杆菌和金黄色葡萄球菌抑菌圈直径分别是9.27 和12.41 mm,甘蔗叶多糖对金黄色葡萄球菌的抑制效果优于大肠杆菌。Nguyen 等[41]采用微量肉汤稀释法测定台湾银线兰多糖提取物的抗菌能力,MIC 结果显示台湾银线兰多糖提取物对金黄色葡萄球菌(MIC=2.5 mg/mL)、大肠杆菌(MIC=2.5 mg/mL)、和铜绿假单胞菌(MIC=1.25 mg/mL)均具有抑制作用,对铜绿假单胞菌抑制效果最好。

表5 布渣叶多糖对各供试菌的MIC 比较Table 5 Comparison of MIC of polysaccharides to various strains
3 结论
本文采用超声辅助热水法提取布渣叶多糖,在单因素实验基础上结合正交试验对提取工艺参数进行优化,得出布渣叶多糖最佳提取工艺条件,该工艺提取参数可靠,重现性好,适合布渣叶多糖的提取。通过对布渣叶多糖进行3 种自由基清除实验评价布渣叶多糖的抗氧化能力,在DPPH 和ABTS+自由基清除实验中,布渣叶多糖的自由基清除率与VC相近,OH 自由基的清除率低于阳性药,但仍旧有较强的清除效果。三种抗氧化实验结果均表明,布渣叶多糖具有较强的抗氧化功效,是理想的天然抗氧化剂原料,可进一步用于食品、药品的开发。在胰脂肪酶抑制实验中,在浓度为0~1 mg/mL 范围内,布渣叶多糖与辛伐他汀的胰脂肪酶抑制率曲线趋势大致相同,说明布渣叶多糖有一定的脂肪酶抑制能力,但抑制能力稍弱。布渣叶多糖对大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌具有一定的抑菌效果,其中对铜绿假单胞菌的抑制作用最强,对金黄色葡萄球菌不敏感。
本次实验研究主要集中在布渣叶多糖提取工艺、体外活性评价方面,为布渣叶多糖在食品、药品等领域的开发和应用提供了科学依据。此后还需要对布渣叶多糖进行分离纯化和结构鉴定,同时布渣叶多糖的抗氧化、胰脂肪酶抑制及抗菌活性的作用机制还有待进一步探究。
