H2O2刻蚀MoS2纳米片增强CO2催化加氢性能
2024-02-22赵世熙谢欣雨陆诗建倪中海杨菲菲
周 维,赵世熙,谢欣雨,陆诗建,倪中海,杨菲菲
(1.中国矿业大学 化工学院,江苏 徐州 221116;2.中国核电工程有限公司 北京 100840)
0 引 言
自工业革命以来,人类社会以过度消耗化石资源为代价实现了飞速发展。然而化石资源不可再生,且其在使用过程中排放大量CO2,对全球气候和环境造成了恶劣影响。鉴于此,我国提出碳达峰、碳中和目标。将大气中廉价丰富的CO2捕集并转化为高附加值化学品,对于缓解温室效应,实现可持续发展的碳循环具有重要意义。CO2催化转化相关的研究工作受高度重视[1-2]。由于CO2具有热力学稳定性及动力学惰性,实现CO2的有效转化一直是研究者致力解决的难题,也是绿色化学与催化领域具有挑战的课题之一。通过理性设计催化剂,CO2可以转化为多种高附加值的平台分子或燃料,如CO、CH4、CH3OH、HCOOH以及高碳产物等[3-7]。在众多转化路径中,CO2通过逆水汽变换(RWGS)转化为CO,CO可进一步通过费托合成转化为烃类或醇类燃料,这使RWGS反应成为有效衔接CO2转化和C1资源化利用的中枢反应[8]。而CO2直接加氢为甲醇则是其资源化利用的直接体现,甲醇是重要的化工原料,广泛用于有机合成、农药、涂料和国防等领域,同时甲醇也是重要的能源物质,可发展替代传统化石燃料[9-12]。因此,CO2催化加氢转化为CO或甲醇被认为是实现CO2资源化利用过程中十分重要的2个反应。这2个反应有内在关联,在CO2加氢到甲醇的过程中通常伴随RWGS反应,而CO也可能是CO2加氢到甲醇的中间体。研究发现同一活性中心通过简单调控反应条件可能实现产物CO和甲醇的切换[10,13]。
目前,二维MoS2材料由于其特殊的层状结构和表面丰富可调的S缺陷位在CO2活化与转化中受到广泛关注[14-18]。HU等[14]首次报道了一种少层MoS2催化剂,在180 ℃、5 MPa、GHSV=3 000 mL/(g·h)的反应条件下,CO2转化率达12.5%,甲醇的选择性为94.3%,且运行3 000 h不失活,这是由于该材料表面具有丰富的面内S空位。SU等[15]采用理论计算研究发现,在常压条件下MoS2中的面内和边缘S空位都能以极低的能垒使CO2解离生成CO。MoS2催化剂高效的催化性能使其成为CO2催化加氢领域的新星材料,具有良好的工业应用前景。综上可知,构建高效MoS2催化剂的关键在于制造S缺陷位[16-17]。HU等[14]报道的特殊的少层MoS2催化剂制备条件较为苛刻,需要在Ar气氛下400 ℃高压釜中合成[14],大批量工业化生产还有一定难度。如何高效提升MoS2表面S空位的含量是推动MoS2催化剂工业化应用的关键技术之一。调研发现,MoS2材料在电催化析氢反应中应用较多,其中构造S空位的方法主要有O2气氛等离子体暴露法和高温氢退火法等[19-20]。这些方法通常需较高的能量输入且动力学过程不可控,可能会在一定程度上破坏MoS2的结构和形貌。最近WANG等[21]发现采用室温H2O2刻蚀法能显著提升MoS2纳米片表面S空位含量,且不破坏MoS2的结构,在电催化析氢反应中也具有优异的活性。
笔者借鉴H2O2刻蚀法处理MoS2纳米片,用于CO2催化加氢反应。分别考察了CO2在常压下转化为CO和高压下加氢为甲醇的反应性能,通过一系列表征分析H2O2刻蚀前后MoS2结构和表面S空位含量的变化,结合CO2吸附活化研究,揭示H2O2刻蚀MoS2在提升CO2催化加氢反应中的作用机制。
1 试 验
1.1 材料
制备MoS2纳米片的前驱体为四水合钼酸铵((NH4)6Mo7O24·4H2O)和硫脲(CH4N2S),购自从国药集团化学试剂有限公司。试剂均为分析纯,且使用前未进行再提纯处理。
1.2 催化剂制备
MoS2纳米片制备:采用水热合成法制备[18],具体步骤为:将0.686 g (NH4)6Mo7O24·4H2O和1.269 g CH4N2S溶解于100 mL去离子水,搅拌均匀后转移至150 mL晶化釜中,在220 ℃烘箱内晶化18 h。冷却至室温后,将所得固体过滤,并多次用蒸馏水洗涤,随后在60 ℃烘箱内干燥过夜得到MoS2纳米片催化剂,记作MoS2-0。
H2O2刻蚀MoS2:分别配置2、4、6 mol/L的H2O2溶液。取1 g MoS2纳米片,缓慢滴加3 mL 2 mol/L的H2O2溶液,静置10 min后过滤,用去离子水洗涤后在60 ℃烘箱内干燥过夜,所得催化剂记作MoS2-2。采用4、6 mol/L的H2O2刻蚀的制备方法相同,催化剂命名为MoS2-4和MoS2-6。
1.3 催化剂表征
XRD(X-ray diffraction,X射线衍射)在荷兰PANalytical X′pert-Pro型粉末X射线衍射仪中测试,扫描范围为5°~80°,扫描速率为10(°)/min。
TEM(Transmission Electron Microscope,投射电子显微镜)采用JEOL JEM-2100F电镜设备进行表征,加速电压为200 kV。
XPS(X-ray Photoelectron Spectroscopy,X射线光电子能谱)采用Thermofisher ESCALAB 250Xi型X射线光电子能谱仪测试,并采用 C 1s 为284.8校正其他元素的电荷效应。
EPR(Electron paramagnetic resonance,电子顺磁共振)采用Bruker A200光谱仪在室温条件下测试。
H2-TPR(H2-temperature programmed reduction,H2程序升温还原)表征在Micromeritics AutoChem II 2920化学吸附仪上进行测试,仪器同时配备热导池检测器和Oministar质谱检测器。试验步骤为:将0.1 g催化剂置于U型石英管内,在室温下通入30 mL/min 10% H2/Ar,待基线稳定后以5 ℃/min的速率升温至800 ℃,同时在质谱中监测m/z=34(H2S)的信号演变。
CO2-TPD(CO2-temperature programmed desorption, CO2程序升温脱附)在上述化学吸附中测试。试验步骤如下:将0.1 g催化剂置于U型石英管内,首先在400 ℃、30 mL/min H2条件下原位还原1 h,随后切换为30 mL/min He吹扫 0.5 h。待温度降低至50 ℃,将He切换为5% CO2/He(30 mL/min),保持0.5 h以吸附CO2。随后用He(30 mL/min)吹扫0.5 h除去气相CO2。待基线稳定后以5 ℃/min的速率升温至800 ℃,同时在质谱中监测m/z=44(CO2)和m/z=28(CO)的信号演变。
1.4 反应性能评价
在连续流动的高压固定床反应器内评价催化剂的反应性能。试验步骤为:将0.2 g催化剂装于不锈钢反应管内(内径10 mm),在H2氛围下(30 mL/min)以10 ℃/min的速率升温至400 ℃还原1 h,随后降温至300 ℃,将气体切换为原料气:23% CO2+69% H2+8% Ar,流量为50 mL/min进行反应。反应5 h后逐渐升温至325、350、375、400和500 ℃,并在每个恒定温度反应5 h。在常压反应结束后,降温至180 ℃进行高压反应。将反应压力升至5 MPa,反应气流量调整为30 mL/min。反应产物经加热带保温120 ℃直接进入气相色谱(Agilent7890)分析。
CO2转化率X(CO2)、甲醇选择性S(CH3OH)和甲醇时空收率(Space Time Yield,YST)的计算公式分别为
(1)
(2)
(3)
式中,F(CO2)in、F(CO2)out、F(CH3OH)out分别为反应器进口CO2、出口CO2以及出口甲醇摩尔流量;M为甲醇的摩尔质量;W为催化剂质量。
2 试验结果与讨论
2.1 催化剂的结构表征
催化剂的体相结构采用XRD进行表征,如图1所示,所有催化剂,包括初始的MoS2和采用不同H2O2浓度刻蚀的MoS2均表现出相同的衍射峰,对应于2H-MoS2结构(PDF#01-073-1508)。此外,衍射峰的峰强和峰宽也无明显变化,这表明H2O2刻蚀没有改变MoS2的体相结构。通过TEM表征观察MoS2-0和MoS2-4的形貌相同(图2),为典型的二维片层状MoS2结构。采用HRTEM分析MoS2层间距,两催化剂层间距均为0.67 nm(图2),对应于XRD检测的2H晶型MoS2的(022)衍射晶面。进一步说明H2O2刻蚀不会改变MoS2的晶相结构。

图1 不同催化剂在400 ℃还原后的XRD谱图

图2 MoS2-0和MoS2-4的TEM谱图及HETEM谱图
尽管H2O2刻蚀对MoS2的体相结构无影响,但理论上H2O2能够使MoS2表面的S氧化脱除从而构造出S空位,这一作用可通过H2-TPR表征来探测。 MoS2-0和MoS2-4的H2-TPR图如图3所示,H2与MoS2-0催化剂在230 ℃左右反应,使表面S以H2S形成脱除,从而形成S空位。然而H2O2刻蚀后的MoS2在该温度区间未检测到H2S,说明MoS2表面不稳定的S已被H2O2氧化脱除。从H2消耗峰来看,MoS2-0在230 ℃有1个明显的H2消耗峰,与H2S的脱处峰位置相同,验证了MoS2表面S与H2反应生成H2S。需要注意的是,H2的消耗不仅对应于H2S的脱除,还对应于MoS2表面O的脱除,这是因为MoS2在制备过程中暴露空气会引入少量O[14]。MoS2-4在212 ℃也观察到显著的H2消耗峰,由于没有H2S生成,则该峰也对应于H2与表面O反应生成的H2O。注意到在MoS2-0和MoS2-4两催化剂上,H2O生成峰的位置均比H2消耗峰的位置高20 ℃左右,这可能是由于H2首先需要在表面解离活化成为活化态的H,才能与O反应生成H2O。MoS2中活化氢的位点主要为边缘S空位[22],MoS2-4的H2消耗峰和水的生成峰均明显低于MoS2-0催化剂,这一现象说明H2O2刻蚀已在MoS2构造了S空位,比未刻蚀的MoS2更易活化H2。此外,未刻蚀的MoS2-0在590 ℃也出现了H2消耗和H2O的生成峰,而MoS2-4上未检测到这些信号,说明H2O2刻蚀使表面的O脱除。

图3 MoS2-0和MoS2-4的H2-TPR图
为验证H2还原后MoS2和H2O2刻蚀后的MoS2催化剂表面S空位含量是否有差异,采用EPR对表面S空位含量进行表征。如图4所示,所有催化剂均在g=2.03处检测到特征的表面Mo-S悬挂键[23](g因子是体系中未成对电子的固有属性,是顺磁共振中非常重要的一个参量,无量纲)。这一特征峰的峰强度与表面S空位的含量成正比[24]。显然H2O2刻蚀后的峰强度高于未刻蚀的MoS2,这说明H2O2刻蚀制造S空位的效果优于单纯用H2还原。此外,图4还表明不同H2O2浓度刻蚀对表面S空位含量无明显影响。

图4 不同催化剂的EPR谱图
H2O2刻蚀增强了表面S空位含量,为了进一步考察S空位的电子状态变化,采用XPS对MoS2-0和MoS2-4催化剂进行表征,如图5所示。图5(a)中在161.7和162.9 eV处的双峰对应S 2p 3/2的特征峰,表明MoS2中S的价态为-2价。图5(b)则分别在238.2和229.1 eV处检测到Mo4+3d 3/2和Mo4+3d 5/2的特征峰[13]。与MoS2-0催化剂相比,MoS2-4中S和Mo的结合能均向高结合能处偏移0.1 eV左右。这可能是由于S空位含量增多造成电子密度减少[21];但由于XPS测试步长为0.2 eV,这一微小的偏移也可能是测试误差。
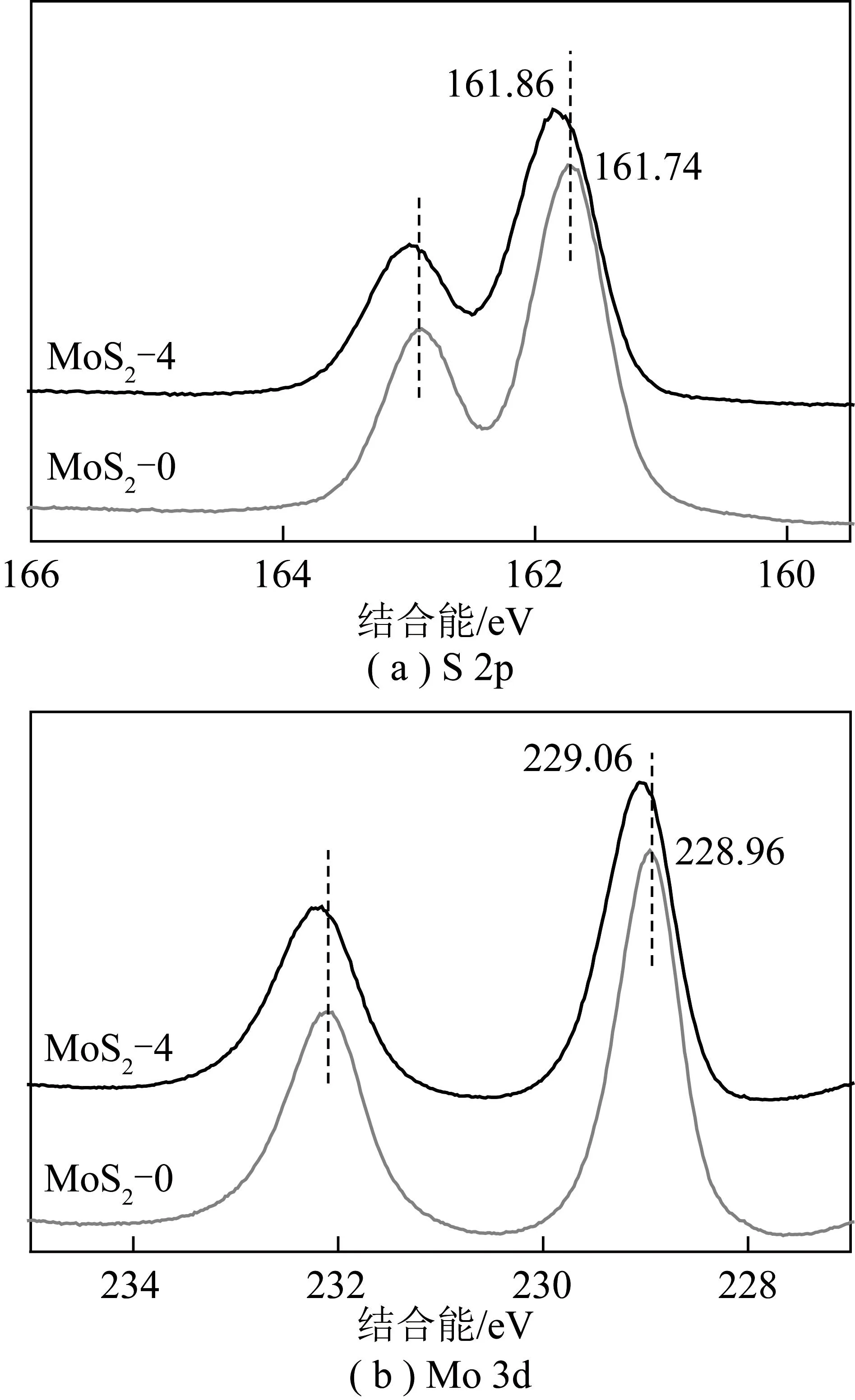
图5 MoS2-0和MoS2-4催化剂中S 2p和Mo 3d的XPS谱图
S空位与CO2的吸附活化相关,通过CO2-TPD表征了S空位对CO2吸附活化的影响。如图6所示,MoS2-0和MoS2-4催化剂均在120 ℃检测到1个小的CO2脱附峰,对应CO2在S空位的弱吸附,即物理吸附;而在高温690 ℃有显著的CO2脱附信号,为CO2在S空位上的强吸附,即化学吸附。在高温处CO2脱附的同时还检测到大量CO,表明CO2在该温度下会解离产生CO。这一现象与理论计算结果一致,HU等[14]通过DFT计算分别考察了CO2在MoS2的边缘S空位和面内S空位的解离能垒,发现直接解离为CO的能垒均小于0.3 eV,这说明CO2一旦在S空位上吸附活化,则极易解离为CO,与当前CO2-TPD观察到的结果一致。此外,MoS2-0和MoS2-4催化剂表现相似的CO2脱附曲线,说明H2O2刻蚀不改变S空位的化学特性。
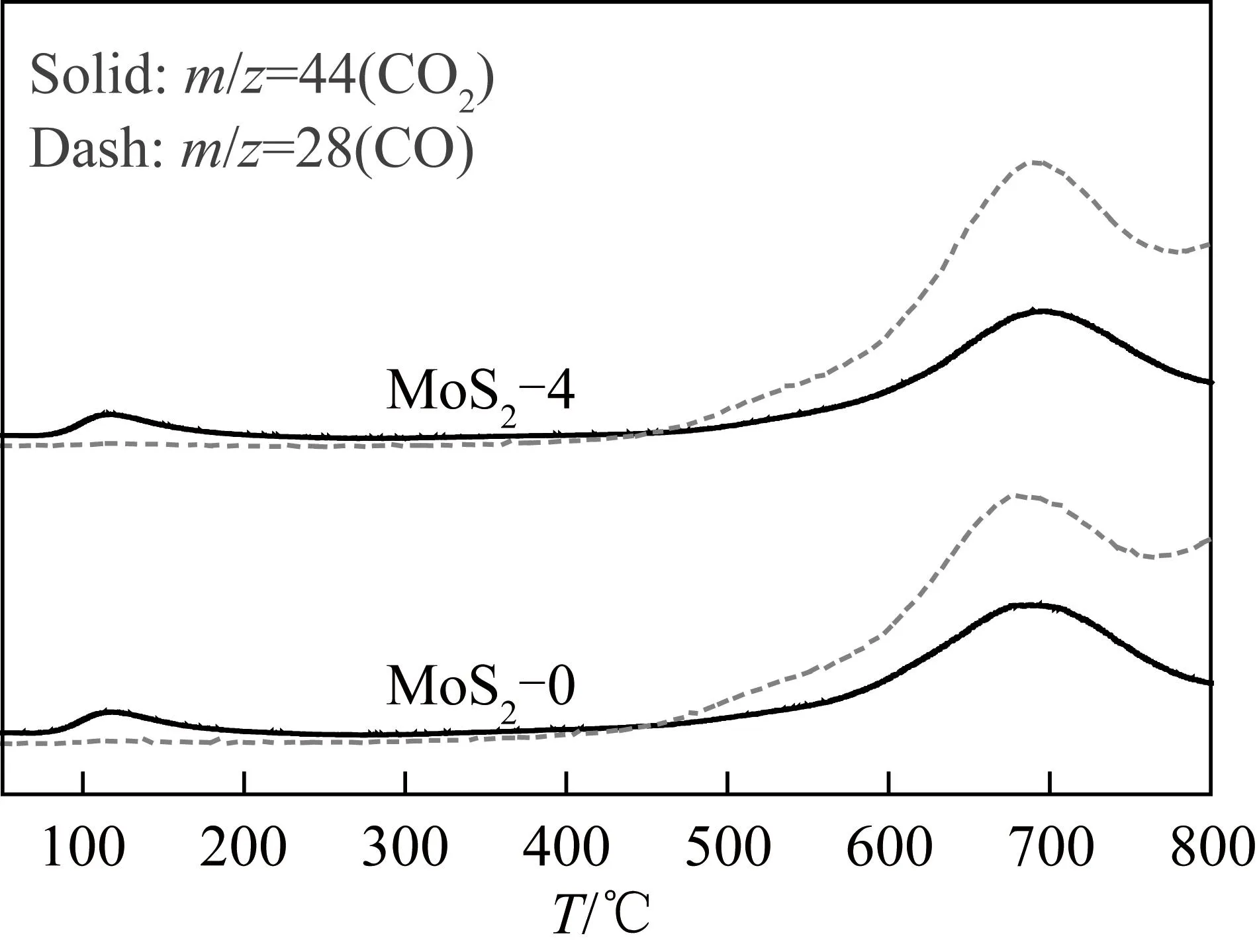
图6 MoS2-0和MoS2-4催化剂的CO2-TPD图
2.2 反应性能评价
图7(a)显示了常压500 ℃下CO2在不同浓度H2O2刻蚀后的MoS2催化剂上的转化率。需要说明的是在该条件下,加氢产物主要为CO,选择性达96%以上。CO2转化率则在刻蚀前后有明显变化:MoS2-0、MoS2-2、MoS2-4、MoS2-6催化剂中CO2的转化率分别为29.2%、35.7%、37.6%和38.5%。显然H2O2刻蚀提升了催化活性。但不同H2O2浓度刻蚀程度相差较小,致使活性差异不大,这也与EPR表征的S空位演变规律一致,说明S空位是CO2催化转化的活性中心。图7(b)分析了在常压条件下CO2在不同催化剂上的表观活化能垒,H2O2刻蚀后的表观活化能为60~62 kJ/mol,低于未用H2O2刻蚀的MoS2催化剂(73.2 kJ/mol),说明MoS2表面S空位浓度的提高更有利于CO2的转化(r为反应速率)。总得来说,CO2加氢为CO有2种可能反应机理,分别是CO2直接解离机理和先加氢为HCOO或COOH,再进一步解离的机理,也称氢助加氢机理。SU等[15]对CO2在S空位上常压加氢生成CO的反应机理进行详细的理论计算和微观反应动力学分析[15]。结果显示,在面内S空位上,直接解离的反应速率比氢助加氢反应速率高3个数量级;而边缘S空位上的反应机理则取决于反应温度,温度低于350 ℃时氢助加氢路径比直接解离路径速率快1.2~2.5倍,温度高于350 ℃时直接解离路径速率更快。结合CO2-TPD的表征,在当前反应条件下不难看出CO2更倾向于直接解离的机理。需要注意的是,无论是何种反应机理,活化氢都具有至关重要的作用,这是因为CO2解离中间体O需要加氢为H2O脱附,另一方面活化氢可能直接参与氢助加氢路径的速控步骤。S空位同时作为CO2[14-15]和H2[22]活化的位点,增加S空位含量必然有利于CO2和H2的协同活化,从而降低反应能垒。

图7 CO2在不同催化剂上的转化率和阿伦尼乌斯线性图
在高压反应条件下,H2O2刻蚀后的MoS2催化剂也表现出更优的催化性能。如图8所示,在压力5 MPa、180~240 ℃,MoS2-4催化剂上CO2转化率略高于MoS2-0。具体来说,在180 ℃时CO2在MoS2-0和MoS2-4上的转化率分别为1.2%和1.8%。反应温度升高会促进CO2转化率,到240 ℃时,CO2的转化率在两催化剂上分别升高至6.9%和8.7%。而由于H2O2刻蚀仅增加了S空位含量,对S空位的性质没有显著影响,这使得MoS2-0和MoS2-4具有相似的产物分布。在低温180 ℃时,产物主要为甲醇,选择性达到79.0%,此外,还有少量甲烷(13.2%)和二甲醚(7.8%)。随反应温度升高,甲醇选择性逐渐下降,而甲烷选择性显著增加。240 ℃时甲烷选择性达到41.5%,甲醇选择性降至33.8%。从甲醇目标产物的角度来看,MoS2-0和MoS2-4两催化剂上生成甲醇的时空收率(STY)随温度升高逐渐增大,温度升至220 ℃时甲醇的STY最优,且在任何一个温度下MoS2-4催化剂中甲醇的时空收率均高于MoS2-0。HU等[14]对CO2在S空位上加氢为甲醇的反应机理进行了理论计算分析,结果显示CO2首先以较低的能垒(< 0.3 eV)解离为CO,CO再进一步加氢为CHxO中间体,并最终加氢为甲醇。其中CHxO中间体可能会解离导致副产物CH4的生成,这与反应条件和S空位类型有关。综上分析,MoS2催化剂需要在低温下操作才能得到较高的甲醇选择性,提升S空位含量是提升其性能的关键因素。H2O2刻蚀引起的更高催化活性和相似的产物分布与上述表征结果一致。这是因为H2O2刻蚀增加了MoS2表面S空位含量,但不会改变S空位的化学性质,因此能促进CO2转化,但对CO2转化的产物分布影响较小。

图8 CO2在MoS2-0和MoS2-4催化剂上在高压、不同反应温度的转化率、产物选择性及生成甲醇的时空收率
3 结 论
1) 对MoS2纳米片进行H2O2刻蚀能显著提升表面S空位含量,且不会改变MoS2的晶相结构,对S空位的化学性质影响较小。
2) MoS2催化剂在常压下能高选择性催化CO2解离加氢为CO;而在高压低温180 ℃下能以较高的选择性(79%)催化CO2加氢为甲醇,升高反应温度会提升CO2转化率,但甲醇选择性会显著下降,同时伴随甲烷显著生成。
3) H2O2刻蚀会显著提升CO2转化的活性,而对产物选择性没有明显影响。
4) 本研究提供了一种简便高效的在MoS2表面引入S空位的制备工艺。
