疏水化多糖自聚集系统的制备方法及其形成机制分析
2024-02-22李红唐新汪小刚王勇德赵博吴振
李红,唐新,汪小刚,王勇德,赵博,吴振*
1(重庆市食品药品检验检测研究院,国家市场监管重点实验室(调味品监管技术),重庆,401121) 2(重庆市中药研究院,中药健康学重庆市重点实验室,重庆,400065)
通过将具有生物相容性的疏水性化合物及其聚合物的加工能力和适应性与生物大分子(如多糖、蛋白质和木质素等)的易改性、组装和结构功能控制能力相结合可用于构建结肠靶向递送载体材料。与其他聚合物相比,天然多糖具有安全性高、可降解、低免疫原性、可修饰性强和良好的稳定性等优势,但其缺点在于分子质量和结构的高异变性、偶联位点难以控制及封装率较低等。近年来,疏水化多糖聚合物(hydrophobized polysaccharides, HPs)因其在溶液中、薄膜中或在各种天然纳米材料中,表现出自组装能力而受到越来越多的关注[1]。HPs分子能通过自聚集形成聚合物胶束、聚合物囊泡、水凝胶、反胶束、纳米囊、纳米纤维、纳米管、纳米粒及其他聚集体等各种自聚集系统,通常其疏水链均能形成疏水微区,可用于封装、稳态化、靶向递送和控释各种疏水活性物质(如食品脂溶性活性和难溶性药物等)及提高其化学稳定性和生物利用率;其碳水化合物链均可作为亲水端,在稳定自聚集系统的空间结构及其与周围水相环境的相互作用中起着关键作用(如分散、溶解和水合效应等),也可调节肠道菌群,改善肠道微环境,此外部分亲水端也能用于水溶性活性成分的应用[2-3]。其中聚合物胶束、聚合物囊泡、水凝胶和反胶束常被推荐用于各种活性成分的高效封装、靶向递送及控释,特别是他们在结肠靶向递送食品活性成分及抗癌成分方面取得了一定成效。
考虑到制备策略对HPs自聚集系统的形成过程、微观结构及其应用特性的巨大影响,该文系统梳理了近5年HPs及其自聚集系统的发展情况,在简要梳理制备HPs的起始多糖和疏水试剂的基础上,总结了制备HPs自聚集系统(图1)方法,分析了各种制备路径的影响,提出了其前提条件及分子机制,为设计、合成和制备性能更佳的多糖基结肠靶向递送材料提供依据,为食品加工对HPs自聚集系统应用的影响提供预判和参考。
1 疏水化多糖自聚集系统的构建策略
植物多糖侧链上的羟基、氨基或羧基等活性基团可与疏水性化合物或其聚合物反应,生成各种HPs,具体见表1。根据化学结构决定性质原理,可选择食品中常见的淀粉类和非淀粉类多糖作为合成HPs的起始多糖端原料,常见的疏水试剂包括(但不限于)辛烯基琥珀酸酐、十二烯基丁二酸酐、脱氧胆酸、胆固醇、姜黄素、生育酚、脂肪酸、聚乳酸、聚ε己内酯[poly(ε-caprolactone),PCL]和聚乳酸-羟基乙酸等。郑荣等[4]详细综述了多糖疏水化改性方法,WANG等[5]详细综述了淀粉疏水化改性方法,主要包括酯化、醚化、交联、开环聚合、还原胺化、疏水药物接枝等。
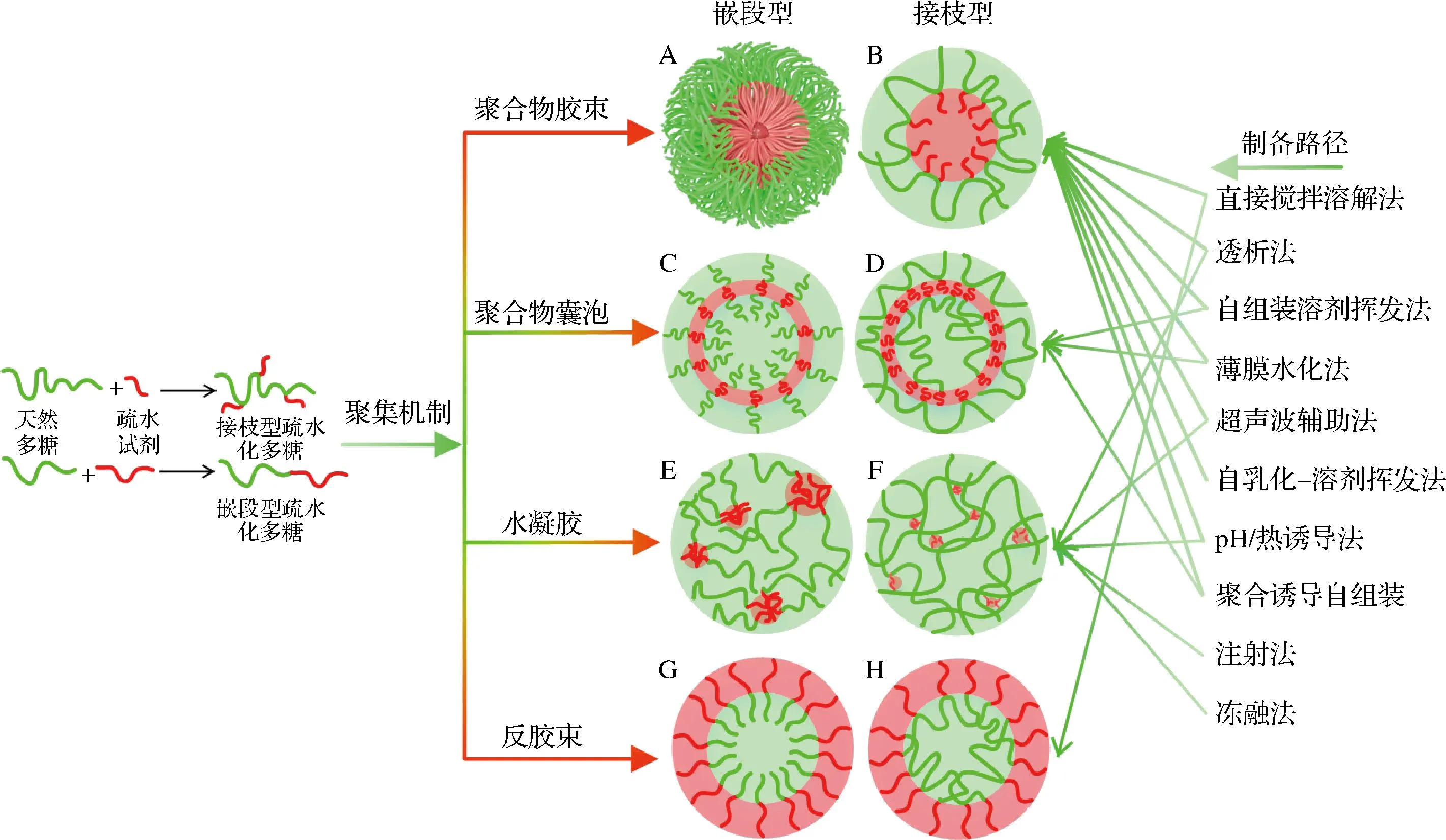
图1 疏水化多糖形成的各种自聚集系统示意图Fig.1 Schematic diagram of various systems self-assembled from hydrophobized polysaccharides
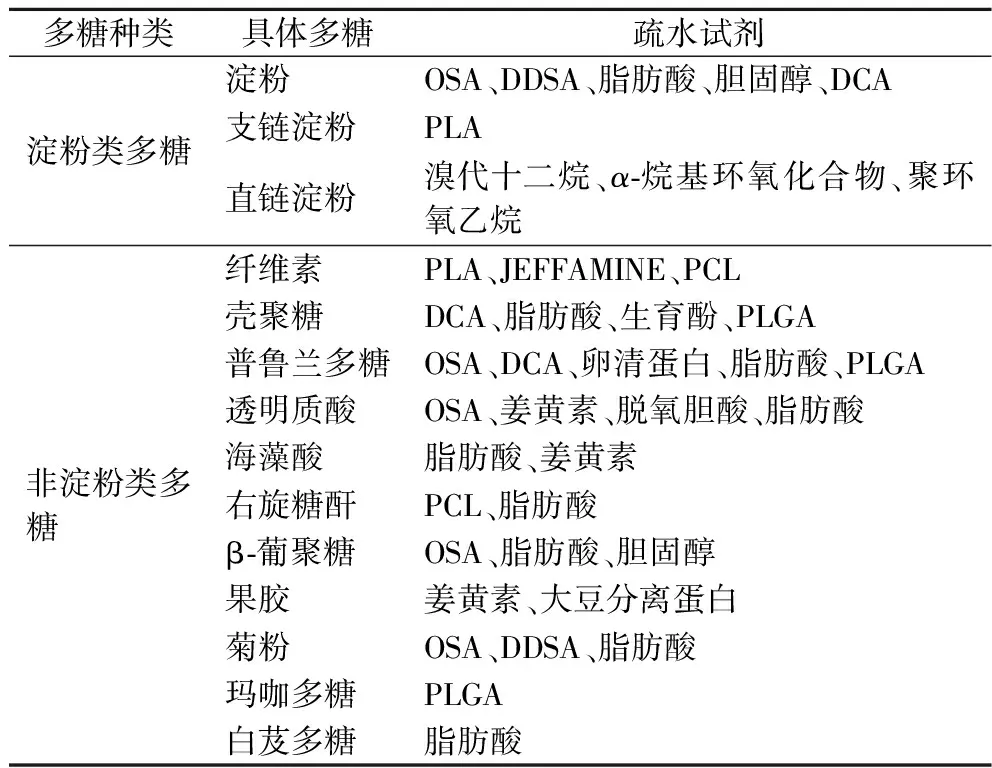
表1 常见用于合成两亲性HPs的代表性多糖和疏水试剂Table 1 Representative polysaccharides and hydrophobic reagents commonly used for the synthesis of amphiphilic HPs
对于已合成或选定的HPs材料,制备方法及后续应用环境对其自聚集体系影响很大,可通过选择合适的制备方法得到目标产物。通常HPs自聚集系统的制备可分为化学方法和物理方法,但化学方法引入了新的化学键,通常不适用于食品工业;物理方法主要是通过HPs分子在水溶液中自组装形成聚合物纳米系统,再通过疏水相互作用和/或氢键等分子作用力将疏水性功能成分装载于疏水微区中,物理方法具有简单、通用性强,并能够应用于食品体系的特点。常见的制备HPs自聚集系统的方法见图1,主要包括直接搅拌溶解法、透析法、自组装溶剂挥发法、薄膜水化法、超声波辅助法、自乳化-溶剂挥发法、热诱导法和聚合诱导自组装(polymerization-induced self-assembly,PISA)等[6]。可根据HPs分子的结构特性、溶解性、亲水亲油平衡值(hydrophile-lipophile balance,HLB)及应用对象要求选择合适的制备方法。制备方法通过影响其自聚集体系的热力学和动力学平衡过程,从而改变其结构,同时在制备过程中可通过调节HPs结构参数(如亲疏水端材料、亲疏水性、亲疏水链长及比例、多糖分子质量和HPs浓度等)及其所处的环境条件(如温度、pH值、溶剂、盐和离子强度等因素)调节其聚集形态。
1.1 HPs胶束的构建方法
1.1.1 直接搅拌溶解法
直接搅拌溶解法适用于溶解性较高的HPs,例如辛烯基琥珀酸-多糖酯[7]、JEFFAMINE-b-羟丙基甲基纤维素[8]、硬脂酸-g-燕麦β‐葡聚糖[9]和羟丙基甲基纤维素-b-PCL[10]等,当浓度大于其临界胶束浓度(critical micelle concentration, CMC)值时,溶解于水或其它水相介质(如磷酸盐缓冲液)中的HPs分子在适当温度和搅拌的帮助下能够逐渐自组装形成胶束,该法优势在于所得胶束及荷载胶束的分散性较好,其缺点是对疏水功效成分的封装效率较低。
1.1.2 透析法
透析法适用于溶解性较低的HPs,例如硬脂酸-ss-白芨多糖共聚物[11]和壳聚糖-g-PCL[12]。该方法中溶剂的选择对聚合物胶束的稳定性有较大影响,所用的有机溶剂需与水混溶,且体系中除了形成聚合物胶束还存在其他团聚集。透析法也常与其他方法结合用于制备HPs胶束,采用透析法和超声波辅助溶解法结合用于制备半纤维素-g-脂肪酸胶束[13];采用透析法(溶剂交换)和溶剂辅助溶解[二甲基亚砜(dimethyl sulfoxide,DMSO)和四氢呋喃(tetrahydrofuran,THF)]结合用于制备脱氧胆酸聚酯-b-右旋糖苷胶束[14]。
1.1.3 薄膜水化法
将HPs(如当归多糖-小檗碱聚合物胶束[15]和肝素-胆固醇共轭物胶束[16])溶解在选定的有机溶剂中,在减压下使之蒸发形成聚合物薄膜,再利用超声波和涡旋等机械手段使薄膜在水相中重新分散形成胶束。选择合适的有机溶剂至关重要,该法适用于小量和批量生产,具有无溶剂残留、实用性强和载药率高等特点,但其局限性在于仅适合具有较低HLB值的HPs;在其制备过程中,由于圆底烧瓶和旋转蒸发器容量尺寸的限制导致其可扩展性较差,难以批量生产。
1.1.4 自乳化-溶剂挥发法
先将HPs水溶液溶于有机溶液(如甲醇、氯仿等)中,在加热条件下搅拌使之乳化,继续加热使有机溶剂挥发,待溶剂挥发后,即得HPs胶束水溶液,例如右旋糖酐-g-PCL[17]和羟乙基淀粉-g-聚乳酸[18]均可通过该法制备胶束,该法具有可扩展性和较好工艺参数控制性,但难于完全去除有机溶剂及游离疏水功效成分,也难以控制所得胶束的精确尺寸和构象。
1.1.5 超声波辅助法
超声波辅助法的优势在于超声波处理有利于形成体积小、粒径均匀和Zeta绝对电位较高的纳米颗粒,例如槲皮素-g-壳聚糖胶束[19]和壳聚糖-g-聚乳酸纳米粒[20],该法就是将聚合物在室温下连续搅拌使其分散在蒸馏水中,通过超声波使其形成自组装胶束。
1.1.6 纳米沉淀法
溶解的HPs分子通过动力学控制步骤(如过饱和、成核、生长和聚集)而组装的过程,包括常规间歇、闪速和微流控纳米沉淀法,通常将HPs溶于有机溶液[如DMSO、二甲基甲酰胺(dimethylformamide,DMF)等)]中,然后将其逐渐悬滴到蒸馏水中,并不断快速搅拌,再去除有机试剂;该法适合大量制备,但耗时较长,容易形成不均匀系统。例如可用于制备右旋糖酐-聚乳酸-羟基乙酸共聚物胶束[20]和硫酸软骨素-b-聚乳酸胶束[21]。
1.1.7 pH/热诱导法
通常,pH可通过影响HPs亲疏水链的质子化或脱质子化、溶解性及两亲链分离导致其发生胶束化或解胶束化。MA等[22]研究发现,pH可诱导羟丙基纤维素-g-聚甲基丙烯酸N,N-二甲基氨基乙酯(HPC-g-PDMAEMA)胶束化;在pH值为3时,其HPC主链在加热时坍塌形成胶束内核,质子化PDMAEMA侧链起稳定作用;在pH值为8.1时,HPC主链和PDMAEMA侧链在加热时均发生坍塌,形成不稳定聚集体;在pH值为12.3时,PDMAEMA侧链发生坍塌形成胶束内核,HPC主链起稳定作用。对于某些HPs而言,低于临界胶束温度(lower critical solution temperature, LCST)时,其难以自聚集形成胶束;当温度加热至其LCST及以上时(如羟丙基纤维素-g-聚4-乙烯基吡啶[23]),其热敏性片段在水溶液中逐渐聚集形成胶束。该法具有操作简单、可扩展性好、不需要有机溶剂(或所需有机溶剂少),但该法仅限于pH或热敏型HPs。
1.1.8 聚合诱导自组装一锅法
上述传统方法制备的胶束体系其浓度较低(通常质量分数<1%),可能需要多步骤或纯化处理;而PISA一锅法(图2)是近年来在极性和非极性溶剂中制备具有不同形态的聚合物纳米结构的一种高效方法,PISA制备的胶束体系中溶质质量分数高达50%,且无需其他纯化步骤。IKKENE等[24]研究了4种制备方法(纳米沉淀、乳化-溶剂挥发法、薄膜水化法和PISA法)对右旋糖酐-g-PHPMA自聚集的影响,结果发现乳化-溶剂挥发法和薄膜水化法导致右旋糖酐-g-PHPMA在水相中发生沉淀,说明这2种方法不适于制备该种胶束;光诱导PISA(室温)导致其在室温条件下形成球状和蠕虫状混合胶束,光诱导PISA(60 ℃)和纳米沉淀法使其形成球状胶束,说明HPs自聚集过程对制备方法很敏感,可能主要与PHPMA弱疏水性及亲疏水区域体积比有关。
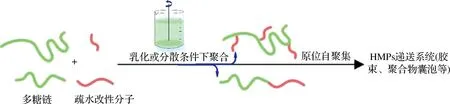
图2 利用PISA一锅法制备HPs胶束示意图Fig.2 The schematic diagram of one step polymerization-induced self-assembly for preparation HPs micelles
1.2 HPs聚合物囊泡的构建方法
制备HPs聚合物囊泡的常规方法主要有溶剂置换法和薄膜水化法,此外还有直接搅拌溶解法、纳米沉淀法、自乳化-溶剂挥发法和PISA等。
1.2.1 溶剂置换法
溶剂置换法制备聚合物囊泡需要2个阶段:首先将HPs溶解在有机溶剂中,缓慢滴入水中,使其形成聚合物囊泡;再采用透析或真空蒸发去除有机溶剂。
1.2.2 薄膜水化法
薄膜水化法制备聚合物囊泡的步骤:将HPs溶解在有机溶剂中,在减压条件下缓慢去除有机溶剂使其形成聚合物薄膜,再将其溶解即得聚合物囊泡;可采用冻融循环和超声波辅助法制备纳米级的HPs聚合物囊泡,使获得的体系更加均匀。ALIBOLANDI等[25]采用直接搅拌溶解法结合超声波辅助制备右旋糖酐-聚乳酸-羟基乙酸聚合物囊泡,其对胰岛素的包封率高达90%。ROSSELGONG等[26]研究了3种制备方法对脂肪酸-b-木聚糖在水相中自聚集构象的影响,结果发现油酸甲酯-b-低聚木糖和蓖麻油酸甲酯-b-低聚木糖在水相中直接搅拌能够形成聚合物囊泡,该法虽然制备简单,但其多分散指数较高、封装效率较低;采用薄膜水化法结合挤压可使其形成纳米级聚合物囊泡,该法具有高效封装亲水和疏水功效成分的潜力;采用微流控技术可得到具有低多分散指数和高重现性的聚合物囊泡。
1.2.3 其他方法
IKKENE等[27]通过PISA一锅法制备了右旋糖酐-g-聚2-羟基丙烷基丙烯酸酯聚合物囊泡,该囊泡中的溶质质量分数范围很广(2.5%~13.5%),并且囊泡膜厚度随聚合度增加而增加。NISHIMURA等[28]发现普鲁兰多糖-g-聚环氧丙烷通过冷却-加热循环能形成聚合物囊泡,所形成的囊泡大小与初始聚合物浓度有关。
1.3 HPs水凝胶的构建方法
通常水凝胶可分为物理、化学或杂化(半互穿与全互穿网络)水凝胶,HPs水凝胶主要是指HPs分子通过自聚集形成物理水凝胶网络结构,其制备方法主要包括注射法、热/酸诱导法和超声波辅助法,此外还有直接搅拌溶胀法、冻融法、透析法和冷冻干燥法等。
1.3.1 注射法
将HPs水溶液注入气相/油相/凝胶溶液中,依靠溶液-空气界面张力,其能形成水凝胶,即为注射法,可分为直接挤压、喷雾和微流控芯片等。其中微流控芯片技术是一种很有前途的水凝胶制备策略,其可在微流体装置中对水凝胶的制备过程进行精确操作(图3),通过调节HPs形成凝胶过程(如添加疏水功能成分及试剂、改变流速和流动相比例等),精确控制水凝胶形态及其尺寸,从而有效降低其多分散性系数,这些特性使其成为一种成本较低、可重复性和可扩展的水凝胶制备技术。KODZISKA等[29]采用该技术制备了辛烯基琥珀酸酐-透明质酸水凝胶,并将其作为抗菌生物膜材料。

图3 利用微流控芯片技术制备HPs水凝胶示意图Fig.3 The schematic diagram of microfluidic chip technology used to prepare HPs hydrogels
1.3.2 热/酸诱导法
由于HPs水凝胶能够响应内源性刺激(如pH、生物酶、生物分子识别等)和外源性刺激(如温度和光等),当其暴露于这些物理或生化信号时,其结构将发生改变,说明其能作为递送材料,且对其结构进行修饰,可作为双重或多重刺激响应材料。酸和(或)热处理能诱导HPs分子中多糖链结构的改变,促进其疏水微区及水凝胶网络结构的形成。FENG等[30]研究发现,酸化(pH 4.8)处理的大豆β-球蛋白-右旋糖酐共轭物在95 ℃加热50 min后可形成水凝胶,原因在于等电点时体系静电斥力较低,其主要靠疏水作用力构建结构稳定的纳米水凝胶网络。PILIPENKO等[31]合成了聚(N-异丙基丙烯酰胺)-g-肝素和聚(N-异丙基丙烯酰胺)-g-硫酸软骨素,其能通过聚(N-异丙基丙烯酰胺)链的非共价相互作用在适当加热条件下(>35 ℃)自组装成有序的纳米水凝胶。SETAYESH等[32]研究发现十八烷胺-g-硫酸软骨素可在弱酸性条件下(pH 5.5)自聚集形成水凝胶,可用于增溶和靶向递送姜黄素。BORAH等[33]研究发现,将叶酸功能化支链淀粉-白蛋白交联物在80 ℃搅拌加热60 min,再冷却到室温,可得到具有疏水内核和亲水外壳的纳米水凝胶,其能高效增溶和递送姜黄素。
1.3.3 超声波辅助法
采用超声波处理HPs溶液能促进其亲疏水链先分散,进一步使其依靠疏水作用力自聚集形成疏水微区,最终形成复杂的水凝胶网络结构。SAWADA等[34]采用该方法(30 W,15 min)制备了胆固醇-木葡聚糖自组装纳米水凝胶。
1.3.4 冻融法
冻融法是通过冷冻-融溶循环操作,使其内部产生物理网络交联点并交联形成三维网络结构,该法优势在于不需要使用有机溶剂。在冻结过程中,液相分离并形成微晶区,同时聚合物链聚集导致氢键和结晶的形成;而解冻过程促进了剩余聚合物之间的相互作用和结晶区域的形成,导致水凝胶网络的逐渐形成,此外冰晶在水凝胶形成过程中起到交联剂的作用,并为水凝胶留下多孔结构。
1.4 HPs反胶束的构建方法
传统表面活性剂丁二酸二异辛酯磺酸钠等在有机溶剂(如异辛烷、辛醇)中能形成稳定的反胶束,但其不适合应用于食品体系。对HPs在液体介质中的自组装现象的研究大多集中于其在水中的胶束行为,而对其在非水介质中的“反胶束”行为报道较少。ZEPON等[35]采用直接搅拌溶解法将麦芽七糖-b-聚甲基丙烯酸甲酯溶于丙酮获得了反胶束。此外,通过控制反胶束制备的加水量、离子强度及添加物等,可有效调控反胶束体系的理化特性及其应用,但需进一步研究。
2 疏水化多糖形成各种自聚集系统的前提条件及其分子机制分析
由于HPs具有两亲性,其能通过分子内/间的缔合形成大量的自聚集系统,所形成的聚集体形态结构主要取决于HPs自身因素[如糖链和疏水链分子结构及其比例、亲疏水性、疏水化程度(接枝率和嵌段率)、极性、溶解性和浓度等]和外界环境条件(如pH、温度、离子强度和共存添加物等)及其二者互作[36],这些内外因素及其互作可从各个方面影响最终形成的自聚集系统结构:(1)HPs疏水端材料性质(如疏水性、链长、聚合度、结晶度、玻璃化转变温度等)及其结构(如立体规整性和构象等)对所形成的自聚集系统最终结构起着决定性作用;(2)HPs亲水端多糖起始材料性质(如亲水性、链长、主支链比、聚合度、羧基或氨基数量及所带电荷等)及其结构(如糖链柔韧性和空间构象等)也会影响其自聚集特性;(3)多糖与疏水材料间的连接方式[嵌段(block,b)或接枝(graft,g)]和反应类型(如侧链酯化、醚化、交联、聚合、美拉德反应或化学点击反应等)决定了HPs的分子结构,进一步影响其形成的自聚集体结构;(4)外界环境条件可通过影响HPs自聚集系统的形成过程(即自聚集程序和制备路径),从而间接影响所形成的自聚集系统结构及其特性,该影响可体现在时间(形成过程)和空间(立体结构)水平上。根据Discher和Eisenberg建立的线性两亲性共聚物自聚集的经验定律,亲水体积分数(fraction,f)大于45%和小于25%的两亲性共聚物通常自组装分别形成胶束和反胶束,而亲水体积分数为25%~45%两亲性共聚物通常自组装形成聚合物囊泡[37]。尽管如此,由于多糖结构的复杂性,上述内外因素和制备策略均会影响该定律。此外,堆积参数和聚集度也常用于预测HPs自聚集构象。
2.1 疏水化多糖自聚集形成聚合物胶束分析
研究发现,拥有高比例亲水嵌段或长链疏水接枝的HPs能在水相环境中形成典型的“核-壳”或“核-壳-冠”结构胶束,其疏水链聚合形成疏水内核,亲水链包裹在外形成亲水外壳,嵌段共聚物(如脱氧胆酸聚酯-b-右旋糖苷[14]和纤维素-b-JEFFAMINE[8]等)和接枝聚合物(如壳聚糖-g-PCL[12]和脂肪酸-g-半纤维素[13]等)均能在水溶液中自发形成聚合物胶束(图1-a)。拥有高接枝率和短疏水链的HPs(如辛烯基琥珀酸-葡聚糖酯[38]和维生素E-g-壳聚糖[39])也能在水溶液中自发形成具有亲水结构域与疏水结构域相混合的“壳-核”样聚集体结构,通常也称为胶束(图1-b)。例如EENSCHOOTEN等[40]采用透射电镜测定了辛烯基琥珀酸-透明质酸胶束的微观结构,揭示了其在水溶液中能够自发形成带负电荷的球形纳米胶束结构(图4-a)。

a-辛烯基琥珀酸-透明质酸胶束[40];b-荷载胰岛素-右旋糖酐-b- 聚乳酸-羟基乙酸聚合物囊泡[25];c-卵清蛋白-普鲁兰多糖自聚集 水凝胶[41];d-麦芽七糖-b-聚甲基丙烯酸甲酯反胶束 (a~c为透射电镜图,d为原子力显微镜图)[35]图4 代表性疏水化多糖自聚集形成各种聚集 系统的构象示意图Fig.4 Conformational diagram of representative HPs self-aggregation systems
上述2类HPs形成胶束的浓度均需大于其CMC值;但当其浓度过高时,可能会形成亚稳态水凝胶体系。综合分析大量文献可知,HPs在水相自聚集形成胶束主要驱动机制如下所示:(1)疏水作用力驱动,嵌段聚合物(如右旋糖酐-b-脱氧胆酸聚酯[42])均可通过疏水作用力自聚集形成胶束;(2)疏水作用力和氢键共同驱动,接枝聚合物(如辛烯基琥珀酸-羧甲基可德胶[43])常通过疏水作用力和氢键共同维持稳定的胶束结构;(3)空间效应和范德华力驱动(如酪蛋白-右旋糖酐共轭物[44]);(4)空间立构复合作用,如右旋糖酐-b-L-/D-聚乳酸(PLA)可通过L-和D-PLA之间的空间立构复合作用形成胶束[45],与“右旋糖酐-b-全同立构PLA胶束”相比,通过空间立构复合作用形成的胶束具有更好的动力学稳定性和再分散性;(5)pH、温度、光等外界因素诱导胶束化。在食品应用中,HPs聚合物胶束可作为运载体和配料,用于脂溶性成分的封装、靶向递送和控释等,其在保健食品和膳食补充剂中具有重要的应用潜力。
2.2 疏水化多糖自聚集形成聚合物囊泡分析
两亲性HPs自组装形成的聚合物囊泡是结构类似于脂质体的多聚囊泡,通过HPs分子在一定溶剂中自组装形成,其在水相中组成由疏水双分子层包围水的迷人形态(图1C)。聚合物囊泡的这种双层膜结构与生物细胞膜非常类似,但由于HPs分子质量较高,其形成的聚合物囊泡表现出较强的理化稳定性、机械稳定性、良好的膜柔韧性和较低的渗透性,使得其能作为亲水和疏水活性成分(如胰岛素、酶、多肽、叶黄素等)靶向递送和控释载体;同时可作为微反应器封装生物酶,用于将底物转化为所需的产物。
通常,拥有适中疏水嵌段比例HPs(如右旋糖酐-b-聚丙交酯乙交酯共聚物[25])或拥有低接枝率HPs(如透明质酸-g-PCL[46])均可通过疏水作用力形成聚合物囊泡,构象分别如图1C和图1D所示。与传统脂质体相比,聚合物囊泡具有更好的化学稳定性,但其与聚合物囊泡的囊泡壁厚度和其尺寸、性质、制备方法和存储条件等有关。通常,可通过改变HPs种类、分子结构、亲疏水链比例、浓度和制备方法等控制囊泡的形成路径,进一步调控聚合物囊泡的囊泡壁厚度和尺寸,HPs聚合物囊泡的可调厚度为调控降解时间和控制被封装功效成分的释放提供了可能。ALIBOLANDI等[25]研究发现,右旋糖酐-b-聚乳酸-羟基乙酸聚合物能形成聚合物囊泡,其在模拟胃肠道条件下能够控释胰岛素(图4-b)。此外,聚合物囊泡可在特殊条件下转变为胶束结构。
2.3 疏水化多糖自聚集形成水凝胶分析
用于制备水凝胶的起始材料可以是天然或改性的聚合物,形成的水凝胶具有三维网络结构,其结构柔软、有弹性,可用于装载、靶向递送和控释亲水性活性成分和疏水性活性成分,同时还可作为食品安全风险监测工具、食品包装材料和改善食品品质载体等。高疏水嵌段比例或接枝率导致HPs水溶性降低,而过低疏水嵌段比例或接枝率导致HPs黏度降低。因此,高疏水嵌段比例或接枝率HPs、适中疏水嵌段比例或接枝率且具有高黏度和浓度HPs,在链聚集自组装过程中可通过氢键、疏水相互作用、静电相互作用、大分子缠结或主-客体相互作用等机制形成水凝胶网络(图1E和图1F),其具有可逆响应特性。例如ZENG等[41]采用美拉德反应和热处理相结合的方法制备了卵清蛋白-普鲁兰多糖聚合物,发现其能够在水溶液中自聚集形成球形纳米水凝胶结构(粒径约100 nm)(图4-c)。研究发现,HPs水凝胶基质能够吸水和膨胀的主要原因在于其含有大量的亲水基团(如COOH、NH2、SO3H、OH、CONH和CONH2等)、多糖链网络扩散和松弛机制及渗透压和毛细管作用。此外,带有羧基HPs分子在微酸性溶液中多糖链之间易形成氢键导致凝胶化,添加金属离子会导致聚电解质类HPs分子之间形成离子相互作用也能进一步使之形成凝胶网络,长链多糖(如海藻酸盐、琼脂和卡拉胶等)的HPs在低温下能发生螺旋状聚集和凝胶化。
2.4 疏水化多糖自聚集形成反胶束分析
当HPs浓度大于其CMC时,可在有机溶剂中自组装形成反胶束,反胶束结构与胶束相反,其亲水链朝内、疏水链朝外排列,形成亲水内核,称为“水池”。嵌段和接枝HPs均可用于制备反胶束(图1G和图1H),但其形成过程受其化学性质、浓度、溶剂类型和比例,甚至水添加量的影响。徐成[47]研究发现在异辛烷/正辛醇溶剂中两亲性淀粉辛酸酯和淀粉月桂酸酯均能形成反胶束。ZEPON等[35]采用原子力显微镜观察了麦芽七糖-b-聚甲基丙烯酸甲酯在丙酮中自聚集形成的反胶束结构,见图4-d。HPs反胶束可用于靶向递送活性成分和提取分离蛋白质类活性物质及作为微反应器,其在油脂制品中具有巨大的应用潜力,但目前缺乏相关研究。
需要说明的是,同一种HPs由于其自身结构或环境差异可形成不同的自聚集系统,例如辛烯基琥珀酸-淀粉酯在水溶液中可形成胶束或聚合物囊泡[48],辛烯基琥珀酸-透明质酸在水溶液中可形成胶束、聚合物囊泡或水凝胶,主要与其接枝率、浓度、环境条件和制备方法有关。通常,脂溶性成分可通过疏水作用力、氢键、范德华力和(或)静电作用与HPs自聚集系统互作,实现稳态化应用。总之,一方面,HPs通过自组装形成各种自聚集系统,以减小不溶性片段的界面面积,从而降低其界面自由能;另一方面,伴随着HPs分子参与自组装数量的增加,其疏水区域的尺寸也增加,导致相连的亲水区域更加致密以保证其热动力稳定性;同时,HPs分子组装过程明显降低了其构象熵。因此,界面自由能降低与构象熵损失之间的平衡最终决定了其形成自聚集载体的热力学稳定性。
3 结论与展望
很多天然多糖具有良好的生物相容性、低毒、低免疫原性等特征,其侧链上的羟基、氨基或羧基能够与众多的疏水试剂发生化学反应生产HPs,具有这些特性的多糖适合作为递送材料制备载体。两亲性HPs形成的自聚集系统具有良好的再修饰性、多功能性和递送能力,在食品和医药工业中具有应用前景。目前,HPs自聚集系统已广泛应用于体外活性成分封装、食物活性成分结肠靶向递送等领域。通常HPs自聚集系统的自组装主要依靠其分子间的弱作用力,如疏水作用力、氢键、静电作用力、范德华力等,避免了任何有害于食品及医药应用的有毒交联的可能性。通过揭示HPs形成各种自聚集系统的制备路径及其相应分子机制,可通过选择HPs种类及其制备方法定制其自聚集体的表面化学、大小、形状和结构,改善其理化特性,以期符合特定场所应用及实现特定的应用目标,能够为HPs自聚集系统的设计及其应用奠定基础。考虑到HPs自聚集系统在食品中的应用,后续需要重点研究改善其结构稳定性的方法,寻求适合食品应用的制备策略,探究适合工业化应用的大规模制备方法。总之,希望该文能为HPs设计及其高效应用提供依据和参考。
