杨梅素经β-catenin对厄洛替尼抗非小细胞肺癌的增敏作用与机制
2024-02-21李敏敬杨春燕
宋 鹏 李敏敬 杨春燕
1 滨州医学院医药研究中心 山东 烟台 264003;2 滨州医学院中医学院 山东 烟台 264003;3 滨州医学院口腔医学院口腔生物学教研室 山东 烟台 264003
非小细胞肺癌(non-small cell lung cancer,NSCLC)是常见的恶性肿瘤之一,占肺癌发病总数的80%以上,其患者5年生存率不到20%[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)靶向药物厄洛替尼(erlotinib)在临床上应用于晚期NSCLC的二、三线治疗[2],但肿瘤耐药成为限制厄洛替尼疗效的关键问题。因此,晚期NSCLC厄洛替尼耐药机制及耐药后的治疗策略已成为研究热点。
c-met基因扩增[3]、Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rats arcomaviral oncogene homolog,KRAS)基因突变[4]、胰岛素样生长因子1受体(insulin-like growth factor 1,IGF-1R)活化[5]及T790M突变[6]与厄洛替尼耐药相关,但仍有部分厄洛替尼耐药机制不明[7]。长期使用厄洛替尼可导致β-catenin及其相关分子Axin2、CD44、Ccnd1、Lgr-5、基质金属蛋白酶7(matrix metalloproteinase7,MMP7)上调,诱发厄洛替尼耐药[8]。体外实验证实,抑制β-catenin可降低NSCLC对吉非替尼耐药[9]。这提示,β-catenin通路可能在厄洛替尼耐药过程中发挥重要作用。杨梅素(myricetin)是从杨梅树树皮、树叶中提取的一种黄酮醇类化合物,具有镇痛、抗过敏和抗炎症的作用[10]。杨梅素可下调结直肠癌细胞中β-catenin的表达,抑制下游cyclin D1/PCNA/survivin信号传导,从而诱导肿瘤细胞凋亡[11]。杨梅素可抑制人乳腺癌细胞β-catenin的表达,进而影响乳腺癌病程[12]。杨梅素调节β-catenin信号通路的分子机制至今不明,尚待进一步研究。杨梅素被美国FDA批准可应用于医药、食品等行业,这为杨梅素作为临床抗癌药物使用提供了有利条件[13]。
在NSCLC细胞中,杨梅素可以抑制β-catenin表达。本研究拟探讨杨梅素调控Wnt-β-catenin通路的分子机制,并研究抑制β-catenin在提高NSCLC对厄洛替尼敏感性中的机制,有助于挖掘杨梅素的抗癌机理及厄洛替尼的耐药机制,并开发改善厄洛替尼等靶向药物疗效。杨梅素与厄洛替尼联合使用的治疗方案有可能成为晚期NSCLC治疗的新策略,具有潜在的应用价值。
1 材料与方法
1.1 材料 NSCLC细胞株A549购自普诺赛生命科技有限公司。siβ-catenin由广州锐博生物科技有限公司合成人β-catenin的siRNA、LipofecTAMINE 2000购自invitrogen公司。杨梅素生化试剂、Hoechst 33258 (IH0060)购自北京索莱宝公司(货号为#SM8390)。胎牛血清购自Hyclone公司(货号为SV30087.02)。DMEM(货号为11965092)、RPMI1640(货号为11875119)购自Gibco公司。β-catenin(货号为#8480)、Cleaved Caspase-3(货号为#9661)、Cleaved Caspase-7(货号为#8438)、Anti-rabbit IgG(货号为#7074)购自CST公司。β-actin购自ZSGB-Bio公司(货号为#TA-09)。
1.2 实验方法
1.2.1 细胞培养 A549细胞使用含 5%胎牛血清,100 U/mL青霉素和链霉素的RPMI1640培养基作为细胞培养液,培养条件为37℃,5% CO2细胞培养箱中培养,每2~3 d更换一次培养基。A549细胞经不同浓度杨梅素(0、50、100、200 μM)处理72 h,杨梅素处理24、48、72 h后分别收集部分细胞提取蛋白。
1.2.2 β-catenin siRNA的化学合成及转染 由广州锐博生物科技有限公司合成针对人β-catenin以及阴性对照序列。其中β-catenin的siRNA序列为 5′-UGGUUGCCUUGCUCAACAAdTdT-3′;阴性对照siRNA 序列为5′-TTCTCCGAACGTGTCACGTTT-3′。转染前细胞密度控制在50%左右,采用脂质体转染试剂Lipofec TAMINE 2 000转染siRNA,siRNA最终浓度为50 nM。
1.2.3 Western blot检测蛋白表达水平 根据收集细胞的数量进行RIPA裂解液的裂解,提取细胞总蛋白,并用BCA法定量。将裂解物在SDS聚丙烯酰胺凝胶电泳上样缓冲液中煮沸5~10 min,取20 μg左右蛋白进行SDS-聚丙烯酰胺凝胶电泳,转移到PVDF膜,用封闭液封闭,然后与一抗孵育,洗膜,继之与二抗孵育,洗膜,采用ELC化学发光试剂检测蛋白的表达量。
1.2.4 集落形成实验 胰酶消化细胞,制备细胞悬液,每孔500个细胞接种于6孔板中,使细胞分散均匀。培养24 h后分别对A549细胞加入1、5、10 nM厄洛替尼进行处理,然后将细胞继续培养2~3周,厄洛替尼处理24、48、72 h后分别收集部分细胞提取蛋白。当培养皿中出现肉眼可见的克隆时,终止培养。甲醇固定15 min,加适量姬姆萨应用液染色10~30 min。光学显微镜下采集图像,应用NIS-Elements F3.0成像系统(Bio-Rad,Hercules,CA,USA)统计集落的数量及大小。
1.2.5 Hoechst 33258实验 将0.5×103~1×103细胞接种于24孔板中,并进行相应的处理。Hoechest 33258与PBS按照1∶100的比例配置成工作液浓度,将1 mL工作液加入24孔板中37℃孵育30 min,然后弃去工作液,并用PBS清洗3次,用荧光显微镜观察,亮蓝色的即为凋亡细胞。
2 结果
2.1 厄洛替尼诱导β-catenin的表达 分别以时间梯度和浓度梯度的厄洛替尼处理A549细胞,Western blot检测厄洛替尼对β-catenin表达的影响,结果发现,厄洛替尼上调A549细胞中β-catenin的表达,并呈时间和剂量依赖性(图1)。
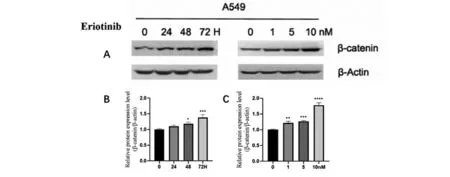
A.5 nM厄洛替尼处理A549细胞0~72 h或0~10 nM厄洛替尼处理A549细胞48 h,检测β-catenin表达,β-Actin作为内参;B、C. 蛋白表达量的定量统计。与作用时间为0 h,厄洛替尼不添加组比较,*P<0.05,**P<0.01,***P<0.001。
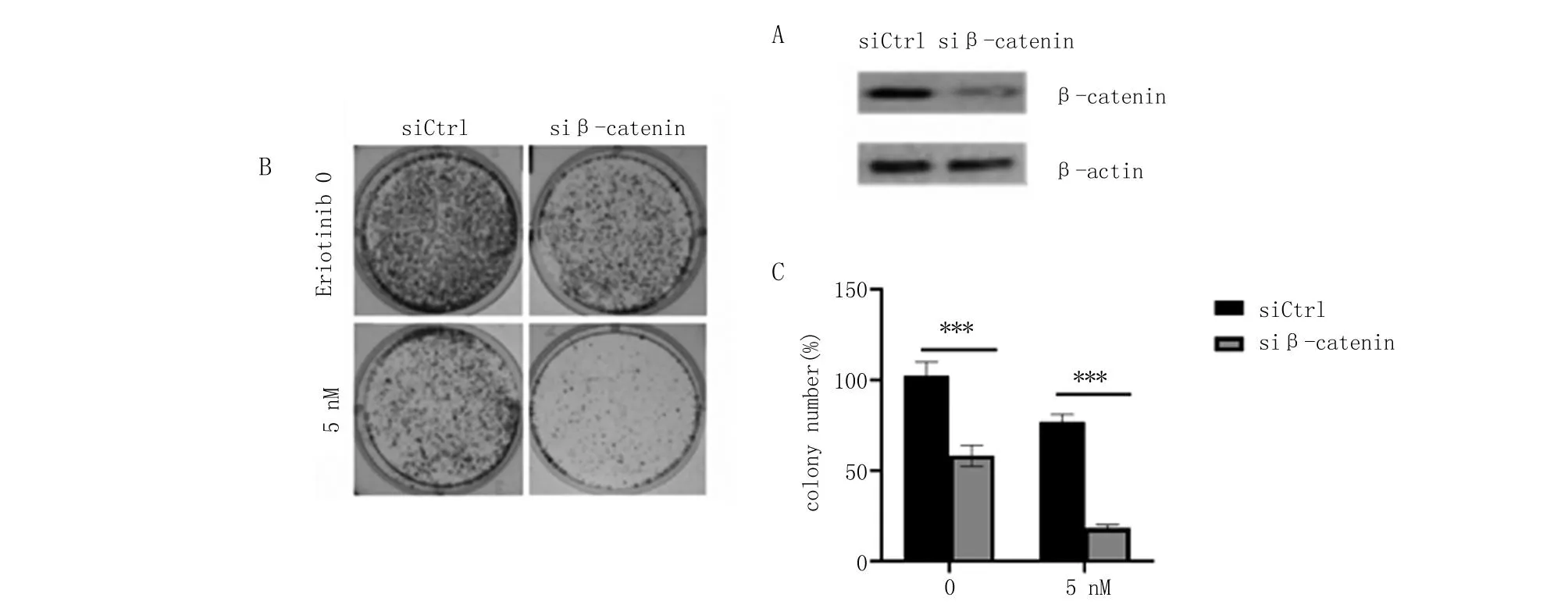
A.免疫印迹检测siCtrl、siβ-catenin转染构建的β-catenin敲降细胞系;B.上述细胞用厄洛替尼处理后的集落形成率检测。C. 柱状图显示集落形成3个复孔的数量统计值。与siCtrl组比较,***P<0.001。
2.2 敲降β-catenin后A549细胞对厄洛替尼敏感性的影响 β-catenin不但与肿瘤的发生发展密切相关,还介导肿瘤的耐药。厄洛替尼处理细胞后,β-catenin表达升高,这可能是细胞的代偿性反应,与细胞对厄洛替尼的敏感性有关。本研究采用小干扰RNA敲降β-catenin表达,Western blot显示,siβ-catenin成功敲降A549细胞中β-catenin的表达。集落形成结果表明,敲降β-catenin表达显著降低A549细胞集落形成能力,与对照细胞比较,β-catenin表达受抑制的细胞在用厄洛替尼处理后集落形成率显著降低(图2)。
2.3 杨梅素对β-catenin表达作用的影响 本研究进一步检测杨梅素对A549细胞株中β-catenin表达的影响,结果发现,A549细胞经杨梅素100 μM处理0~72 h范围内的β-catenin表达量降低,并于48 h后显著降低,呈现时间依赖性。A549细胞经不同浓度杨梅素(0、50、100、200 μM)处理24 h后,β-catenin的表达显著降低,并呈剂量依赖性(图3)。
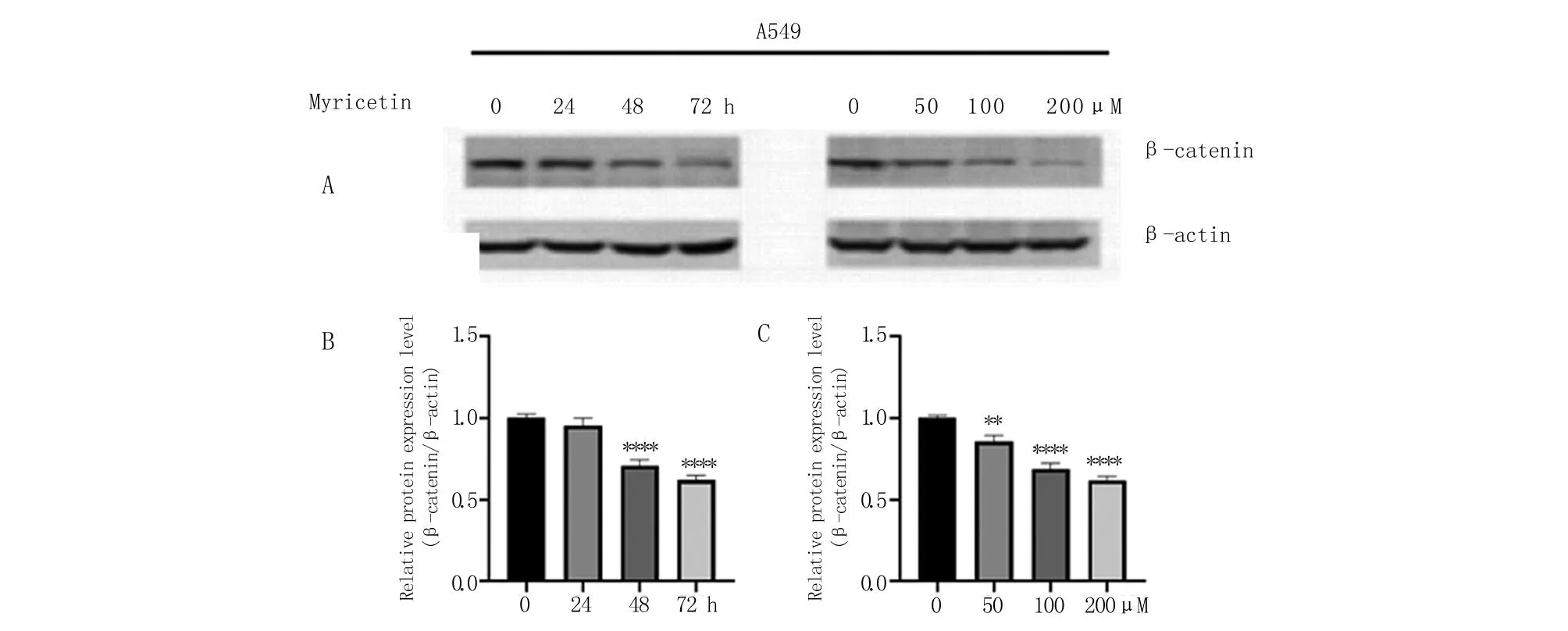
A.100 μM杨梅素处理A549细胞0~72 h或0~200 μM杨梅素处理A549细胞48 h,β-catenin表达检测,β-Actin作为内参;B、C. 对蛋白表达量的定量统计。与作用时间为0或杨梅素添加量为0的对照组比较,**P<0.01,****P<0.0001。
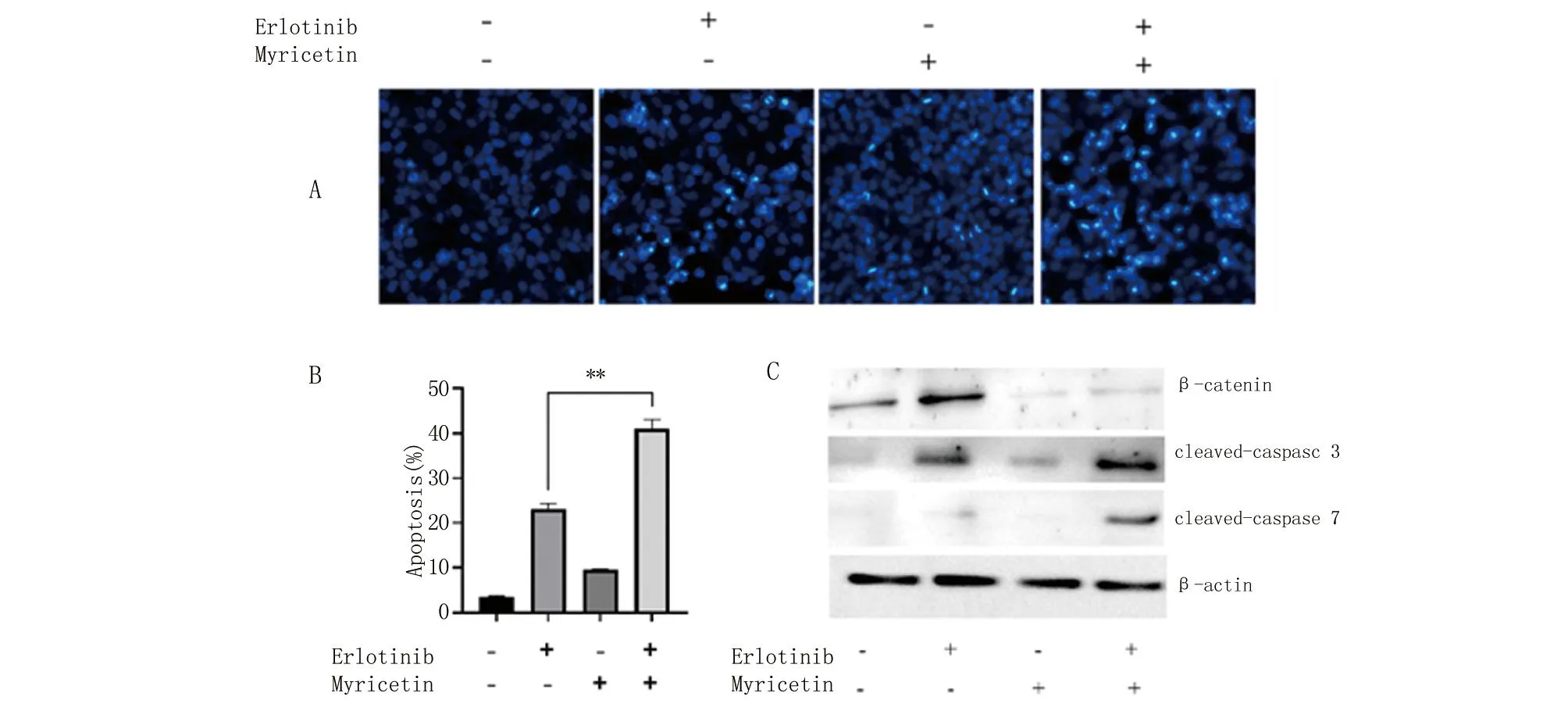
A.A549细胞经过厄洛替尼(5 nM)、杨梅素(100 μM)或两者叠加处理24 h,Hoechst 33258染色检测,蓝色高亮代表凋亡细胞;B.对A中凋亡细胞占总细胞数的比例进行柱状图分析; C.Western blot检测以上分组中cleaved caspase 3和cleaved caspase 9的表达。与厄洛替尼单独用药组比较,**P<0.01。
2.4 杨梅素对厄洛替尼促进A549细胞凋亡的增敏作用 A549细胞经过杨梅素、厄洛替尼或两者联合处理,用Hoechst 33258染色方法来检测细胞的凋亡率,用Western blot检测与凋亡相关蛋白表达水平。研究发现,与杨梅素或厄洛替尼单独处理组比较,杨梅素、厄洛替尼联合处理组中A549细胞的凋亡比率升高,P<0.01。与杨梅素或厄洛替尼单独处理组比较,杨梅素、厄洛替尼联合处理组中凋亡相关蛋白(cleaved caspase 3、cleaved caspase 7)表达量升高,P<0.01。见图4。这提示,杨梅素可能通过抑制β-catenin的表达增强厄洛替尼对非NSCLC的敏感性。
3 讨论
表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)对NSCLC患者有显著的疗效,但是其耐药性限制了EGFR-TKI的长期疗效。本研究发现,厄洛替尼能诱导NSCLC细胞系A549中β-catenin表达升高,β-catenin是增强厄洛替尼药物敏感性的关键分子。本研究首次证明,在NSCLC患者中,杨梅素能够抑制β-catenin的表达,通过促进细胞凋亡的方式增敏厄洛替尼。本研究有助于深入了解厄洛替尼耐药机制和天然提取物杨梅素的抗癌机理。本研究还未应用于NSCLC动物模型,有待从体内验证杨梅素增敏厄洛替尼的效果及作用机制。
β-catenin在NSCLC晚期治疗厄洛替尼耐药中起重要作用。β-catenin是Wnt-β-catenin信号通路的关键蛋白,该通路在多种肿瘤中都有异常表达,通过调控其下游靶基因cyclin-D1和c-myc促进细胞的增殖和肿瘤的发展[14-15]。在EGFR-TKI耐药的NSCLC细胞系中,β-catenin水平升高,抑制β-catenin信号传导可增强对EGFR- TKI治疗的敏感性[16]。β-catenin在EGFR突变的细胞中上调和激活。突变的EGFR优先结合和酪氨酸磷酸化β-catenin,导致β-catenin介导的反式激活的增加。β-catenin对于EGFR突变的肺癌的发展是必不可少的[17]。这表明,β-catenin在厄洛替尼耐药细胞系中升高,这种变化导致细胞增殖和耐药性维持。靶向β-catenin途径可能为预防肺癌发展或克服对EGFR-TKIs的耐药性提供新的策略。
β-catenin作为肿瘤治疗靶点缺乏有效药物。β-catenin与肿瘤的发生、生长、转移、免疫等密切相关[18]。使用iCRT14阻断β-catenin可以减缓肝癌的进展[19]。使用人参皂苷Rb1抑制β-catenin的蛋白表达和核易位,干扰β-catenin/TCF4的相互作用,可以抑制胃癌前病变的发生和发展[20]。小分子化合物白屈菜赤碱Chelerythrine靶向作用于NSCLC干细胞中β-catenin,减缓肿瘤进展[21]。但到目前为止,基于该靶点的抑制剂、拮抗剂等的研究大多处于临床前研究阶段,尚缺乏有效的靶向药物。并且Wnt-β-catenin通路生物学功能多样,在肿瘤性疾病、非肿瘤性疾病和干细胞功能维持方面均有重要作用。因此,靶向药物的设计要充分考虑其拖把效应及毒性效应,采用FDA已获批药物进行新功能疗效的探索成为重要的研发路径。
本研究首次发现,杨梅素可抑制NSCLC中β-catenin的表达,并呈现剂量和时间的依赖效应。杨梅素可通过调控β-catenin在肿瘤中发挥作用,例如杨梅素可通过诱导人乳腺癌中GSK3β和Bax蛋白表达,抑制β-catenin/cyclin D1/PCNA等,促进caspase-3活性,通过诱导凋亡的方式抑制MCF-7细胞活力[22]。本研究发现,在NSCLC厄洛替尼治疗中,杨梅素抑制β-catenin表达,显著促进A549细胞凋亡,增敏厄洛替尼药效。本研究将有助于开发克服厄洛替尼耐药的新策略。杨梅素联合厄洛替尼的治疗方案有可能在一定程度上克服厄洛替尼的耐药问题,为临床上治疗NSCLC肿瘤患者提供新选择,为临床研发提供了有力的实验证据。
