富含萝卜硫素的西兰花提取物对小鼠外周血CD8+T淋巴细胞活化及肠道菌群的影响
2024-02-20申春一黄建敏刘金燕李洁瑶毅1
王 政,申春一,黄建敏,刘金燕,李洁瑶,张 毅1,
1)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2)郑州大学第一附属医院肿瘤科 郑州 450052
萝卜硫素(sulforaphane,SFN)是广泛存在于西兰花、卷心菜和花椰菜等植物性食物中的一种抗氧化剂。体内外研究[1]发现,SFN可以调节免疫系统,调动体内的CD8+T淋巴细胞等效应细胞,增强抗肿瘤的免疫反应。此外,SFN还具有抗氧化、保护胃肠道、预防高血压和动脉粥样硬化等作用,在疾病预防及治疗领域具有重要潜力[2-3]。肠道作为食物消化吸收的主要场所,其中含有众多微生物。肠道微生物是连接宿主及外界环境的桥梁,除了维持肠道正常消化功能以外,还通过各类代谢物参与宿主生理病理过程[4]。肠道微生物与宿主相互依存,共同进化,形成抵抗外来病原体的屏障,并且可以调节免疫应答以及增强代谢健康[5-7]。CD8+T淋巴细胞是机体主要的免疫效应细胞,肠道中有益菌比例的增加可以刺激体内CD8+T淋巴细胞分泌效应因子,提高肿瘤免疫的治疗效果[8]。本研究使用一种富含SFN的西兰花提取物作为膳食补充剂,探究长期摄入该提取物对健康小鼠肠道菌群及外周血CD8+T淋巴细胞活性的影响。
1 材料与方法
1.1 主要试剂与仪器蒸馏水、不含SFN的西兰花提取物、含0.3 g/L SFN的西兰花提取物,由普洱祺云生物科技有限公司提供。FITC标记的CD45单抗、BV510标记的CD3单抗、AF700标记的CD8单抗、PE-Cy7标记的CD69单抗、BV421标记的IL-2单抗、BV785标记的TNF-α单抗和Zombie NIR Fixable Viability试剂盒购自北京Biolegend公司。DxFLEX 流式细胞仪为美国Beckman Coulter公司产品。
1.2 实验动物和分组雌性4周龄C57BL/6N小鼠购自浙江维通利华实验动物技术有限公司,合格证编号:20210714Abzz0619000778。将15只小鼠随机分为空白对照组(control group,CON)、阴性对照组(negative control,NC)、SFN组,每组5只。SFN组给予含0.3 g/L SFN的西兰花提取物125 μL灌胃。NC组和CON组分别给予不含SFN的西兰花提取物及蒸馏水125 μL灌胃。每天灌胃1次,连续4周。所有动物实验均经郑州大学伦理委员会批准。
1.3 体重测量实验开始后每2 d测量1次小鼠体重,均在灌胃前进行。
1.4 外周血采集与指标检测实验最后1天,将小鼠尾尖部剪去约 0.5 mm,从尾根向尾尖挤压按摩取血。
1.4.1CD8+T淋巴细胞活化情况 向小鼠尾静脉血中加入红细胞裂解液,室温孵育10 min,离心后弃上清,得到外周血单个核细胞,加入FITC标记的CD45单抗、BV510标记的CD3单抗、AF700标记的CD8单抗和PE-Cy7标记的CD69单抗并混匀,室温孵育15 min后上流式细胞仪检测,以CD45+CD3+CD8+CD69+T淋巴细胞为活化的CD8+T淋巴细胞细胞,计算活化的CD8+T淋巴细胞百分比。
1.4.2CD8+T淋巴细胞中IL-2和TNF-α含量 取适量外周血单个核细胞经表面抗原染色筛选出CD8+T淋巴细胞后,加入细胞固定液,避光放置20 min;洗涤2次,用100 μL的细胞破膜剂重悬、孵育30 min,加入BV421标记的IL-2单抗、BV785标记的TNF-α单抗,避光孵育30 min;洗涤后上流式细胞仪检测。使用平均荧光强度表示CD8+T淋巴细胞中IL-2及TNF-α的含量。
1.5 肠道菌群分析实验结束前采集3只小鼠的新鲜粪便,于-80 ℃冰箱保存。 基因扩增及后续生物信息学分析均由上海百趣生物医学科技有限公司提供。通过OmicShare Tools进行主成分分析(principal component analysis,PCA)、主坐标分析(principal co-ordinates analysis,PCoA)以及非度量多维尺度(non-metric multidimensional scaling,NMDS)分析。PCoA中使用Bray-Curtis距离矩阵反映两个群落之间的差异性。
1.6 统计学处理采用GraphPad Prism 9.1.1分析数据。各组小鼠不同时间点体重的比较采用重复测量数据的方差分析,活化的CD8+T淋巴细胞百分比、IL-2和TNF-α含量及肠道菌群相对丰度的比较采用单因素方差分析和SNK-q检验。采用Pearson相关分析衡量IL-2和TNF-α含量与肠道菌群相对丰度的相关性。检验水准α=0.05。
2 结果
2.1 3组小鼠体重变化3组小鼠体重均逐渐增加,各时间点组间差异无统计学意义(图1)。
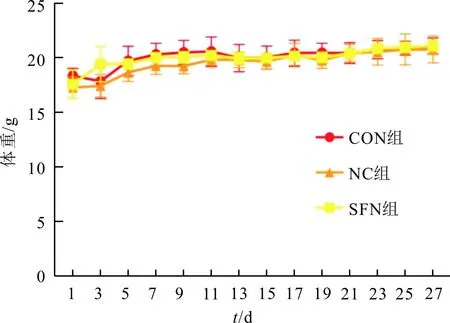
F组间=2.640,P=0.177;F时间=21.070,P<0.001;F交互=1.261,P=0.330。
2.2 3组小鼠CD8+T淋巴细胞活化情况SFN组小鼠外周血活化的CD8+T淋巴细胞百分比,IL-2、TNF-α含量高于CON组及NC组(表1)。

表1 3组活化的CD8+T淋巴细胞百分比和IL-2、TNF-α含量比较
2.3 3组小鼠肠道菌群组成分析3组小鼠肠道菌群组成有明显区别(图2)。
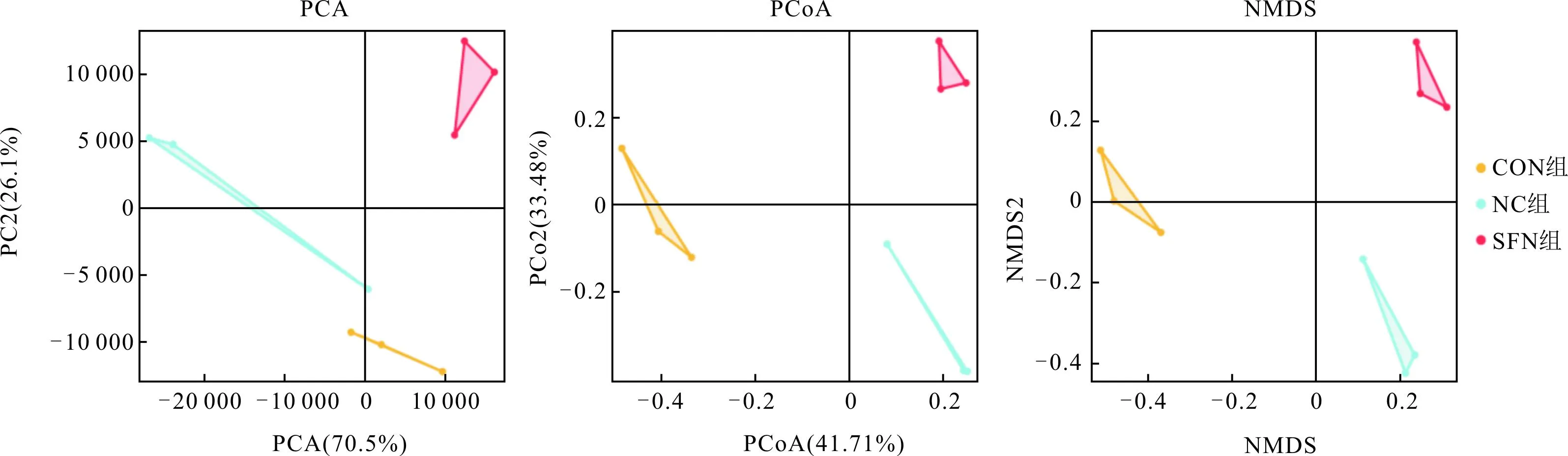
图2 3组小鼠肠道菌群组成的PCA、PCoA、NMDS分析结果
2.4 3组小鼠肠道菌群组成分析
2.4.1基于门水平的肠道菌群组成 见图3。门水平上,CON组小鼠优势菌群为拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes),NC组及SFN组小鼠优势菌群为拟杆菌门、厚壁菌门、疣微菌门(Verrucomicrobiota)及放线菌门(Actinobacteriota)。SFN组疣微菌门相对丰度高于CON组及NC组,见表2。

表2 3组小鼠疣微菌门及阿克曼菌属相对丰度的比较 %
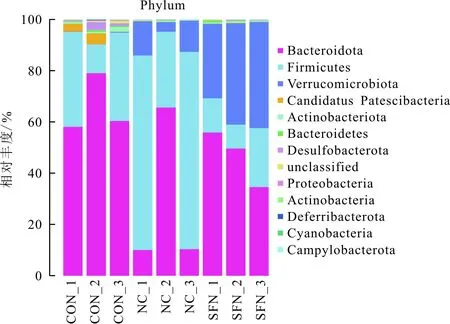
图3 3组小鼠基于门水平的肠道菌群组成分析
2.4.2基于属水平的肠道菌群组成 见图4。属水平上,CON组小鼠优势菌群有未分类的Muribaculaceae属(Muribaculaceae_unclassified)、乳杆菌属(Ligilactobacillus)、另枝菌属(Alistipes)和萨科瑞莫纳斯属(Candidatus_Saccharimonas)等。NC组小鼠优势菌群有未分类的Muribaculaceae属、乳杆菌属、阿克曼菌属(Akkermansia)和肠杆菌属(Enterorhabdus)等。SFN组小鼠肠道优势菌群有未分类的Muribaculaceae属、乳杆菌属、阿克曼菌属、未分类的梭菌属_UCG-014(Clostridia_UCG-014_unclassified)等。SFN组小鼠肠道中阿克曼菌属相对丰度大于NC和CON组,见表2。
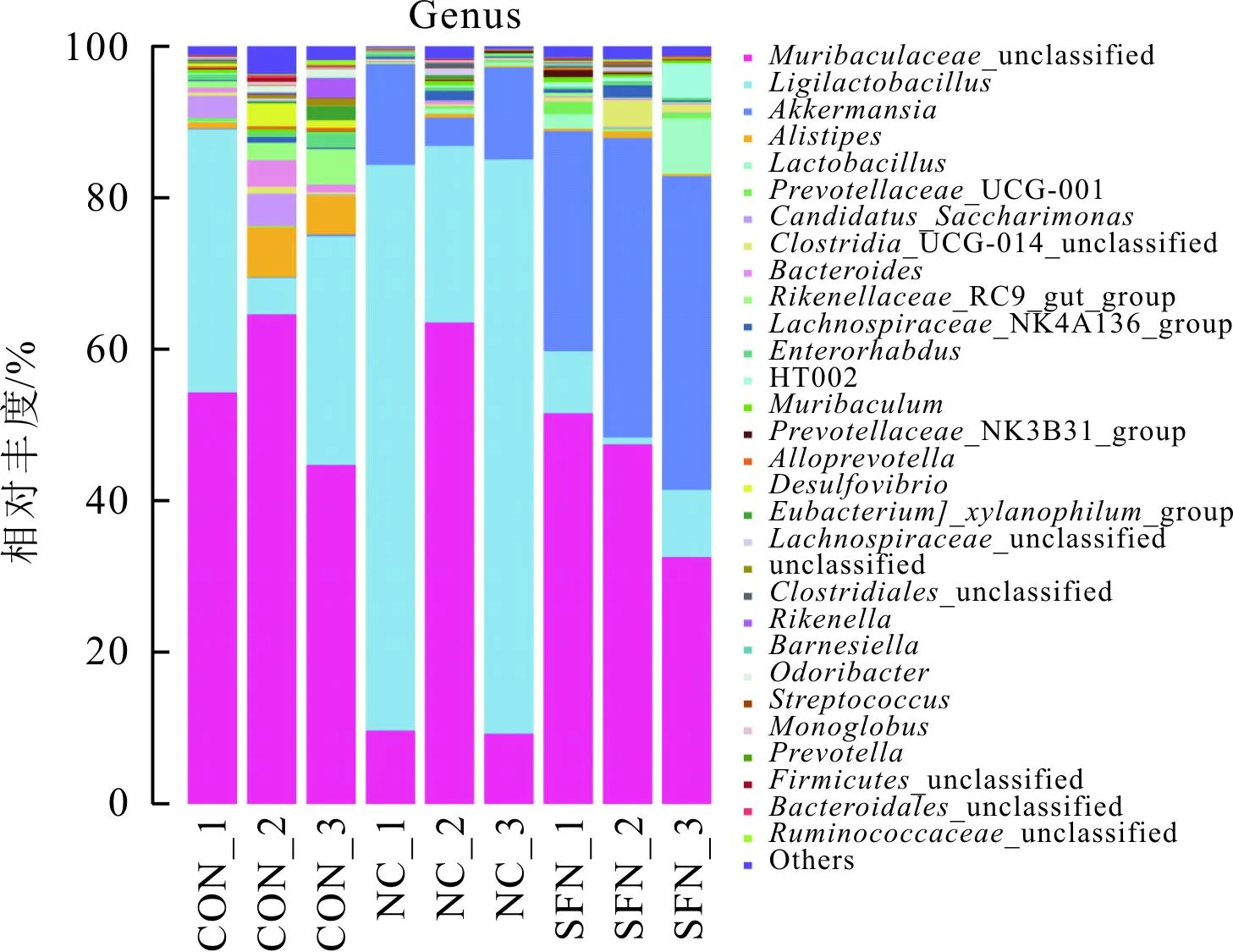
图4 3组小鼠基于属水平的肠道菌群组成
2.5 外周血CD8+T淋巴细胞IL-2及TNF-α的含量与肠道阿克曼菌属相对丰度的相关性肠道阿克曼菌属的相对丰度与外周血CD8+T淋巴细胞中IL-2及TNF-α的含量呈正相关(r=0.934和0.664,P<0.05),见图5。
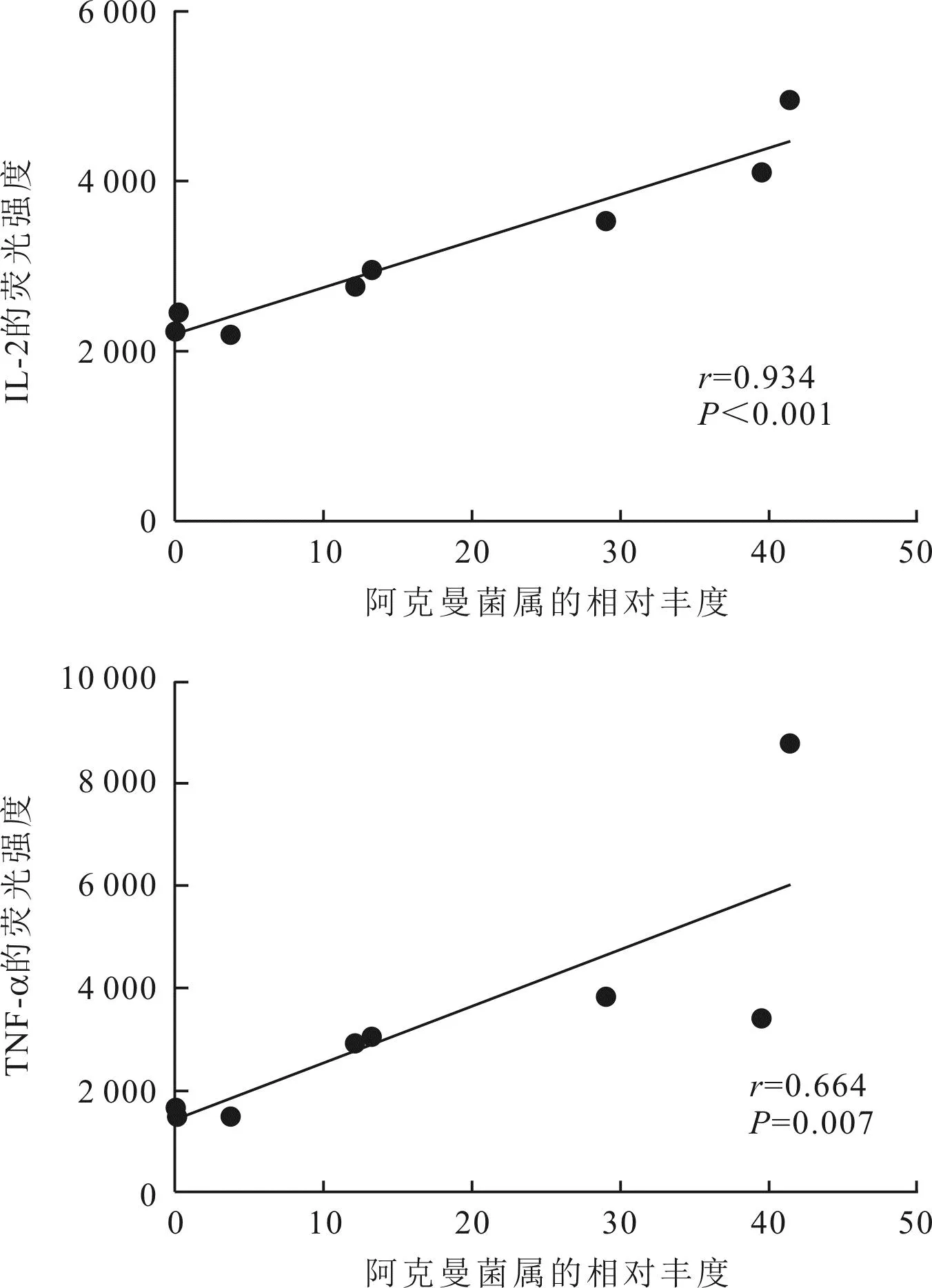
图5 外周血CD8+T淋巴细胞中IL-2和TNF-α含量与肠道阿克曼菌属相对丰度的相关性
3 讨论
SFN是来源于植物的一种营养素,对免疫系统有多种作用。它一方面可以减轻肠炎小鼠的肠道炎症反应[9],抑制辅助性T细胞介导的自身免疫性疾病[10];另一方面可以通过增强效应T细胞的功能,抑制髓源抑制性细胞,进而增强抗肿瘤作用[1]。
肠道菌群作为机体“第二基因组”,参与机体的各种生理活动。研究[11]发现,肠道菌群是调节宿主免疫反应的关键因素之一,一些有益菌能够调节树突状细胞、巨噬细胞、淋巴细胞的功能,增强其对病原体的清除能力。结直肠癌、乳腺癌患者肠道内乳杆菌、梭菌等可通过其代谢物促进CD8+T淋巴细胞的抗肿瘤作用[8,12]。
本研究结果显示,连续摄入富含SFN的西兰花提取物对小鼠体重增长无影响,说明长期连续摄入富含SFN的西兰花提取物对小鼠生长无损害;肠道菌群分析结果显示,连续摄入富含SFN的西兰花提取物后小鼠肠道中疣微菌门和阿克曼菌属的相对丰度明显增加;SFN组CD8+T淋巴细胞中IL-2和TNF-α含量增高,且阿克曼属菌相对丰度与CD8+T淋巴细胞中IL-2和TNF-α含量呈正相关。
阿克曼菌属包含许多肠道有益菌,如嗜黏蛋白阿克曼菌。该菌以肠道表面黏蛋白作为氮源、碳源和能量来源,可以保护肠道屏障的完整性[13],缺乏会引起一系列疾病[14]。在肿瘤治疗过程中,肠道中的阿克曼菌可以增强肿瘤对免疫检查点抑制剂的应答[15],它分泌的胞外囊泡也可以提高CD8+T淋巴细胞的比例,抑制前列腺癌的增殖[16]。结合本研究结果推测,通过摄入SFN增加肠道阿克曼菌属的相对丰度,进一步活化外周血CD8+T淋巴细胞,或许可以辅助抗肿瘤。
综上所述,长期摄入富含SFN的西兰花可以调节宿主肠道菌群,通过提高肠道中阿克曼菌属的相对丰度,促进CD8+T淋巴细胞活化,增强清除病原体的能力。本研究有助于SFN相关益生菌产品的开发,为后续药物研发提供理论基础。