焚烧飞灰水热合成托贝莫来石过程中重金属的固化特性
2024-02-16李潇鼎田书磊吴宗儒吴骞王嵯周睫雅周秀艳吴昊
李潇鼎,田书磊,吴宗儒,吴骞,王嵯,周睫雅,周秀艳,吴昊*
1.东北大学资源与土木工程学院
2.环境基准与风险评估国家重点实验室,中国环境科学研究院
3.东北大学秦皇岛分校资源与材料学院
随着经济的发展和城市化进程的加快,城市生活垃圾的数量大幅增加。2021 年我国城市生活垃圾清运量达到2.35 亿t,相较于2011 年的1.64 亿t 增长约43%[1]。据估计,2030 年我国城市生活垃圾清运量将超过3 亿t[2]。焚烧技术因具有减容减量、节省土地资源、消除大部分有机物和病原微生物以及回收热能等优点成为处理城市生活垃圾的首选方式[3-4]。2021 年,我国城市生活垃圾焚烧处理量达1.80 亿t,约占无害化处理量的72%[1]。然而,随着垃圾清运量的逐年增加以及垃圾焚烧技术在国内的大力推广,产生了大量高氯、高重金属的城市生活垃圾焚烧飞灰(FA)[5],严重威胁了生态环境和人体健康。因此,如何安全有效地处置FA 已经成为当前亟须解决的环境问题。
目前,我国FA 多采用进入生活垃圾填埋场进行处置,但随着北京、上海、广东、江苏、浙江等省(市)的生活垃圾填埋场已封场或即将封场,新建填埋场选址困难,新产生的FA 面临着无处填埋的窘境[6]。对此,诸多学者对FA 的处理处置开展了研究,包括固化/稳定化(水泥固化[7])、热处理(玻璃化[8]、熔融[9]和烧结[10])和分离萃取(生物浸提[11]、化学浸提[12])等。水泥固化因其成本低廉、工业设备简单而被广泛应用,但重金属长期稳定性和水泥耐久性是主要问题[13]。分离萃取技术通过有机溶剂、无机溶剂或生物浸提剂可以有效分离FA 中的重金属和可溶性氯盐[14],但大量化学试剂的消耗和产生的废液难处置的问题限制了其工业应用[15]。传统的热处理方法对于FA 中非挥发性重金属具有良好的固化效果,尤其是玻璃化[16],但因其设备复杂和能耗高极大增加了处理成本[17]。因此,找到一种集经济、节能和高效于一体的处置方法成为学者研究的重点。
近年来,水热技术因能耗低、设备简单、无害化效果好等优点,引起了国内外学者的关注。水热条件下分子运动加快、离子积常数增加、化学反应速率显著提高,可将FA 中的Ca、Si 和Al 等元素转化为更稳定的硅铝酸盐矿物(如沸石类、硅酸钙类和水滑石类),实现对FA 中重金属的固化/稳定化,达到“解毒”的目的[18]。Bayuseno 等[19]采用碱法水热处理FA,发现水热过程中可形成多种硅铝酸盐矿物,包括方沸石、羟基钙霞石和托贝莫来石〔tobermorite,Ca5Si6O16(OH)2·4H2O〕等,使Zn 和Pb的浸出毒性分别降低93.2%和94.1%。阮熠[20]将炉排炉FA 与流化床FA 协同水热处置,形成大量水钙铝榴石和托贝莫来石等硅铝酸盐矿物,重金属(Cd、Cr、Cu、Pb、Zn)浸出浓度显著降低,远低于填埋标准。
托贝莫来石是一类重要的硅酸钙矿物,对重金属的稳定具有重要作用[18-19,21],同时其优良的离子交换性能可作为去除废水中Pb2+、Cu2+、Cd2+和Ni2+等重金属离子的有效吸附剂[22],尤其是部分Si4+被Al3+取代的托贝莫来石。研究表明,Al 的掺入不仅可以加速托贝莫来石的形成,还会产生电荷不平衡,使其具有更加优异的离子交换性能[23-24]。此外,托贝莫来石因其轻质、抗压强度高、导热系数低的特点也被广泛应用于隔热和耐火建筑材料[25-26]。托贝莫来石的形成受多种因素的影响,包括Ca 与(Si+Al)的摩尔比〔以Ca/(Si+Al)表示〕、时间、温度等。研究表明,Ca/(Si+Al)是影响合成的关键因素,其最佳范围为0.6~1.2[27]。然而,由于垃圾焚烧过程中会向洗涤器中注入大量Ca(OH)2以去除酸性气体[28],因此FA 中Ca/(Si+Al)较高,若要合成托贝莫来石需添加额外硅铝源来调节比例。此外,相关研究表明FA 中大量的氯会阻碍托贝莫来石前驱体〔C—(A)—S—H凝胶〕的形成[29],进而影响托贝莫来石的结晶,因此合成前需将FA 进行脱氯预处理。
目前关于FA 合成托贝莫来石稳定重金属的研究仅限于产物的浸出毒性,对合成过程中重金属的液相迁移规律、分布形态和环境风险评估关注较少[30-32]。因此本研究以经过水洗脱氯的FA(WFA)为原料水热合成托贝莫来石,探究Ca/(Si+Al)对水热产物晶相组成、微观形貌和表面官能团的影响,同时分析水热过程中重金属在固相产物和水热液中的分布规律以及表征产物中重金属的浸出行为、形态演变和环境风险,以期为FA 基托贝莫来石的后续应用提供试验与理论基础。
1 材料与方法
1.1 原料
WFA 样品取自北京市某水泥厂,该厂采用飞灰水洗脱盐(FWD)技术对FA 进行水洗预处理,工艺流程如图1 所示。首先将FA 以密闭方式送入飞灰料仓中,将计量好的FA 与水混合制成浆料,经过三级逆流漂洗工艺后利用气流烘干机低温烘干形成WFA。试验样品经混匀后放入烘箱,在105 ℃条件下烘干24 h。

图1 FWD 工艺流程示意Fig.1 FWD process flow diagram
WFA 的主要化学成分如表1 所示。WFA 主要由Ca(78.9%)、Si(2.80%)、Fe(2.40%)、S(4.19%)和Al(1.29%)组成,Ca 主要来源于烟气脱酸过程中大量加入的石灰石等物质。WFA 中的Ca/(Si+Al)和Al/(Si+Al)约为19.29 和0.68,远超出合成托贝莫来石的比例范围[21],因此需额外添加Si 源和Al 源调节比例。WFA 的微观形貌呈球形或椭球形颗粒,颗粒之间紧密连接,孔隙率较低(图2)。

表1 WFA 的化学组成Table 1 Chemical composition of WFA

图2 WFA 的微观形貌Fig.2 Micromorphology of WFA
1.2 水热合成试验
采用带有搅拌驱动器的MC 500 型固定头多功能反应器进行水热试验,流程如图3 所示。取15 g WFA,加入SiO2和Al2O3调节原料中Al/(Si+Al)为0.15,Ca/(Si+Al)依次为0.60、0.83、1.10,调整比例后按照液固比为10 mL∶1 g 加入浓度为2 mol/L 的NaOH 溶液,将所得浆液在恒温磁力搅拌器中50 ℃搅拌混合5 h。将搅拌后的浆液放入带有聚四氟乙烯材质内衬的反应釜中,密封反应釜,将温度升至200 ℃持续8 h。反应结束后采用冷却水盘管将釜体内温度降至室温,用布氏漏斗对浆体进行液固分离,水热产物用超纯水洗涤至中性后在80 ℃下干燥12 h。Ca/(Si+Al)为0.60、0.83、1.10 条件下的水热产物分别标记为WHT-1、WHT-2 和WHT-3。

图3 水热合成托贝莫来石的流程Fig.3 Flow chart of hydrothermal synthesis of tobermorite
1.3 重金属浸出毒性
WFA 及其水热产物的重金属毒性浸出试验参照HJ/T 299—2007《固体废物 浸出毒性浸出方法 硫酸硝酸法》进行,采用电感耦合等离子体原子发射光谱仪(ICP-OES,5100 SVDV,Agilent,美国)测定重金属浓度,浸出毒性标准参照GB 5085.3—2007《危险废物鉴别标准 浸出毒性鉴别》。
重金属浸出率的计算公式如下:
式中:n为浸出率,%;t为目标金属的浸出毒性,mg/kg;H为目标金属在样品中的浓度,mg/kg。
水热过程中重金属向液相迁移率[18]的计算公式如下:
式中:w为水热过程中重金属向液相中的迁移率,%;Ci为水热液中重金属i(Cr、Cd、Zn、Pb、Hg)的浓度,mg/L;V为对应水热液的体积,L;Wi为WFA 中重金属i的浓度,mg/kg;m为WFA 的质量,g。
1.4 重金属含量
WFA 及其水热产物中Pb、Cr、Zn、Ni 浓度参照HJ 766—2015《固体废物 金属元素的测定 电感耦合等离子体质谱法》采用耦合等离子体质谱仪(ICPMS,HR-TCP-MS,Finigan-MAT,德国)测定,WFA 及其水热产物中Hg 浓度参照GB/T 22105.1—2008《土壤质量 总汞、总砷、总铅的测定 原子荧光法 第1 部分:土壤中总汞的测定》采用原子荧光光度计(AFS-2202E,北京海光)测定。
1.5 重金属形态提取
采用改进BCR(Community Bureau of Reference)四步连续提取法[33]对WFA 和水热产物进行重金属化学形态分析,提取液经0.45 µm 滤膜过滤后采用ICP-MS 测定提取液中的重金属浓度。
目标重金属的风险评价指数(risk assessment code,RAC)定义为弱酸可提取态所占比例[34],计算方法如下:
式中:CF1为弱酸可提取态浓度,mg/kg;CF2为可还原态浓度,mg/kg;CF3为可氧化态浓度,mg/kg;CF4为残渣态浓度,mg/kg。
1.6 分析测试方法
采用X 射线衍射仪(XRD,D8 Advance,BRUKER OPTICS,德国)测定WFA 和水热产物的晶相组成;采用扫描电子显微镜-能谱仪(SEM-EDS,ZWISSigma 300,德国)观察WFA 和水热产物的微观形貌;采用傅里叶变换红外光谱仪(FTIR-650,天津港东科技)分析测定WFA 及其水热产物的表面官能团;使用ICP-OES 测定水热液中Zn、Pb、Cr、Cd 的浓度;采用原子荧光光度计测定水热液中Hg 的浓度。
2 结果与讨论
2.1 水热合成托贝莫来石
2.1.1 矿物相分析
WFA 和水热产物的XRD 图谱如图4 所示。WFA 的晶相组成主要包括石膏(CaSO4·2H2O)、方解石(CaCO3)、石英(SiO2)和硬石膏(CaSO4)。经水热处理后,石膏、硬石膏和石英的特征峰消失,所有产物在2θ为7.76°、16.3°、28.9°和29.9°处均发现托贝莫来石晶体峰位,说明在碱性水热条件下石膏和石英发生溶解,为后续硅铝酸盐矿物的形成提供Ca 和Si 元素。WHT-1 水热产物中发现大量方沸石(NaAlSi2O6·H2O)和青金石(Na6Ca2Al6Si6O24SO4)与托贝莫来石共存。这可能是由于在低Ca/(Si+Al)时,随着SiO2和Al2O3的溶解,溶液中较低的Ca2+浓度更有利于形成硅铝酸盐凝胶,进而结晶形成沸石类(方沸石、青金石)硅铝酸盐矿物;随着反应的进行,方沸石和青金石的形成消耗了溶液中大量Si 和Al,此时体系中Ca/(Si+Al)得到提升,更有利于富含Ca 的C—S—H 凝胶形成,因此出现托贝莫来石特征峰[20]。Ca/(Si+Al)的增加更有利于形成Ca 含量较高的水化硅(铝)酸钙〔C—(A)—S—H〕凝胶,因此方沸石和青金石等矿物相消失,托贝莫来石特征峰强度逐渐增强。结果表明,Ca/(Si+Al)对产物类型有重要影响,较高的Ca/(Si+Al)更有利于托贝莫来石的形成。

图4 WFA 和水热产物的XRD 分析Fig.4 XRD analysis of WFA and hydrothermal products
2.1.2 微观形貌分析
水热产物的SEM、EDS 分析结果见图5、图6。经水热处理后微观形貌发生较大改变,WHT-1 表面出现大量大小不一、不规则的片状晶体,但大部分仍以聚集体的形态存在,孔隙率较低。随着Ca/(Si+Al)的增加,WHT-2 表面片状物质的结晶更加明显,同时聚集体逐渐解聚,形成更多的片状结构。当Ca/(Si+Al)为1.10 时,WHT-3 中出现大量板条状晶体,彼此相互交错形成高孔隙率结构,这是托贝莫来石的典型结构[35-36],这种结构可以大大增加其表面积,更有利于重金属的吸附。同时,EDS 分析结果检测到水热产物由Ca、Si、Al、C 和O 等元素组成,WHT-1、WHT-2和WHT-3 水热产物中Ca/(Si+Al)分别为0.36、0.48和0.87,可见WHT-3 更接近理想托贝莫来石晶体的Ca/(Si+Al)(0.85),进一步证明Ca/(Si+Al)的增加更有利于合成托贝莫来石晶体。

图5 水热产物的SEM 分析Fig.5 SEM analysis of hydrothermal products

图6 水热产物的EDS 分析Fig.6 EDS analysis of hydrothermal products
2.1.3 FTIR 分析
FTIR 已被用于描述原子堆积模式下晶体和非晶材料的复杂化学结构,WFA 和水热产物主要特征峰位置和强度如图7 所示。WFA 中3 417 cm−1附近的宽吸收峰为O—H 的伸缩振动[37],1 425 和873 cm−1附近的吸收峰归因于CO32−的振动[38],713 cm−1处的吸收峰归因于Si—O(石英)的振动[39],以上结果表明WFA 中存在CaCO3和SiO2。水热处理后,水热产物WHT-1、WHT-2 和WHT-3 在451 和664 cm−1附近均出现1 个新的吸收峰,这是由于O—Si—O 的弯曲振动和Si—O—Si 的伸缩振动[37]引起的,表明水热产物中硅酸盐结构的形成。WHT-1样品在1 000 cm−1附近出现的吸收峰对应沸石中TO4(T 为Si 或Al)的不对称伸缩振动[40],表明WHT-1 样品中存在沸石结构,这与XRD 分析相一致。960 cm−1处的吸收峰归因于托贝莫来石Q2位点Si—O 的拉伸振动[41],随着Ca/(Si+Al)从0.60 增至1.10,此处的吸收峰强度逐渐增强,表明托贝莫来石的结晶度逐渐增加;同时波数从967 cm−1位移至956 cm−1附近,这归因于Al 元素掺入托贝莫来石形成了Al—O—Si 结构,因此加剧了Si—O 的不对称伸缩振动[42]。Ca/(Si+Al)的增加抑制了沸石类结构的形成,减少了Al 的消耗,因此更有利于Al 掺入托贝莫来石结构,图6 也证明了这一点。WHT-3 水热产物在1 176 cm−1附近出现1 个新的吸收峰,是由托贝莫来石Q3位点的Si—O 拉伸振动引起的,这是托贝莫来石的特征带[43],表明形成了聚合度更高的托贝莫来石结构。这是由于Ca/(Si+Al)的增加更有利于形成富含钙的C—(A)—S—H 凝胶,此时凝胶中的硅氧四面体大多以短链或二聚体的形式存在,更有利于重排形成托贝莫来石晶体[44]。此外,Al 元素的掺入也可以增加托贝莫来石的聚合度[45]。1 639 cm−1附近的吸收峰是层间水分子的O—H 弯曲振动产生的,3 475 cm−1附近的宽峰归因于O—H 的伸缩振动[41]。1 434 cm−1处的吸收峰对应CO32−的不对称拉伸振动[44],这归因于水热产物制备过程中的碳化[46]。以上结果表明,WHT-3 中形成的托贝莫来石具有更好的结晶度和聚合度,可能更有利于稳定重金属。

图7 WFA 和水热产物的FTIR 分析Fig.7 FTIR analysis of WFA and hydrothermal products
2.2 重金属的稳定性
2.2.1 重金属的浸出浓度
WFA 和水热产物中存在大量重金属(表2),其浓度表现为Zn>Pb>Cr>Ni>Hg。WFA 中大量Pb、Zn 的存在除了与垃圾本身相关以外,还与Pb 和Zn 的存在形态相关,在垃圾焚烧过程中Pb、Zn 容易与Cl 元素结合形成沸点较低的ZnCl2和PbCl2[47],因此易挥发并最终吸附在飞灰表面。然而重金属总量不足以反映其稳定性,因此采用硫酸硝酸法测定了WFA 及其水热产物的浸出浓度(表3)。WFA 中Hg 的浸出浓度为0.210 mg/L,为GB 5085.3—2007中规定限值的2.1 倍,因此WFA 被归于危险固体废物。经水热处理后,产物中Hg、Ni、Pb、Zn 和Cr 的浸出浓度分别降低了87.1%~99.5%、89.3%~99.0%、88.3%~99.4%、63.1%~88.9%和48.5%~63.7%,远低于GB 5085.3—2007 所规定的浓度限值。
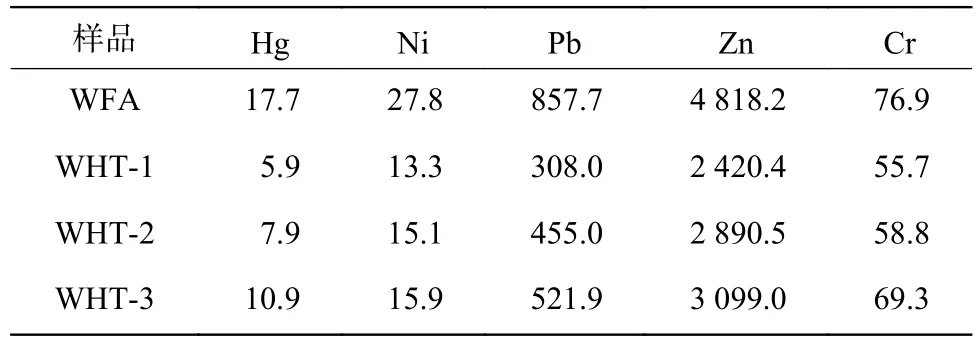
表2 WFA 和水热产物中的重金属浓度Table 2 Heavy metal contents of WFA and hydrothermal products mg/kg

表3 WFA 和水热产物中的重金属浸出浓度和浸出率Table 3 Heavy metal leaching concentrations and leaching rates of WFA and hydrothermal products
重金属浸出率是指重金属总量中可浸出部分的数量,是揭示重金属可浸出比例的重要指标[48],可以更加直观地反映出水热前后固相产物中重金属浸出毒性的变化。WFA 中5 种重金属的浸出率分别为11.86%、3.71%、0.38%、0.04%和7.09%(表3)。随着Ca/(Si+Al)的增加,水热产物中5 种重金属的浸出率呈下降趋势。相较于WFA,WHT-3 样品中5 种重金属的浸出率分别降低了97.89%、97.84%、97.37%、75.00%和61.49%,表明重金属迁移性大大降低。这可能是由于水热过程中的碱性条件促进了溶解的重金属与OH−在液相中的沉淀[18],同时托贝莫来石的形成也对重金属的稳定有重要作用[40]。相较于Hg、Ni、Pb 和Zn,Cr 的浸出浓度和浸出率下降幅度较小,这可能是由于托贝莫来石主要通过层间Ca2+与重金属的离子交换作用将重金属吸附固定在晶格中[12],而飞灰中部分Cr 以Cr3+和Cr6+的形式存在,由于价态效应,托贝莫来石结构中的Ca2+更容易与Ni2+、Pb2+和Zn2+等二价重金属交换[49]。
2.2.2 重金属的液相迁移
在水热过程中,较高的碱度会导致部分重金属转移至液相中。尤其是当碱激发剂浓度超过1 mol/L时,Pb 和Zn 的氧化物和氢氧化物会在强碱性条件下发生溶解,形成等配位阴离子,具体反应过程如下[50-51]:
这些配合物会导致水热液中重金属浓度上升,通常合成的硅酸钙矿物对带负电荷的两性金属络合物吸附作用较弱。水热过程中重金属向液相的迁移率如图8 所示。从图8 可以看出,Ca/(Si+Al)较低时,WHT-1 中Pb 的液相迁移率(18.96%)较高,这是因为水热液的碱度较高(pH 约为13.7)。随着Ca/(Si+Al)的增加,重金属向液相中的迁移率逐渐降低,在WHT-3 样品中4 种重金属(Cr、Pb、Zn 和Hg)的液相迁移率分别降至1.41%、4.28%、0.29%和0.05%(由于Ni 在水热液中的浓度低于检出限,故不做讨论),表明大部分重金属均稳定在水热产物之中,这可能与水热产物中托贝莫来石晶体逐渐增加有关[52]。研究发现,托贝莫来石合成的各阶段具有稳定重金属的效果。在合成初期,托贝莫来石的前驱体C—S—H 凝胶具有较大的比表面积和吸附能力[53],可以吸附大量重金属。同时,重金属离子还可以与Ca、Si 形成化合物,吸附沉淀在非晶态的C—S—H 表面[54]。在晶体成核生长的过程中,吸附在表面的重金属可以逐渐迁移至晶体内部,与层间的Ca2+进行交换,从而进入晶格内部,实现重金属的固化[50]。

图8 水热过程中重金属向液相的迁移率Fig.8 Mobility of heavy metals to liquid phase during hydrothermal processes
2.2.3 重金属的形态分布
水热产物中重金属的生物有效性和流动性与重金属的形态分布息息相关[55]。水热处理对5 种重金属形态分布的影响如图9 所示。重金属的流动性和生物有效性顺序依次为弱酸可提取态(F1)>可还原态(F2)>可氧化态(F3)>残渣态(F4)。由图9 可见,WFA 中Hg 含有大量F1 形态,占比为44.68%;Zn 主要以F2 的形式存在(占比为68%),具有较高的迁移性和生物有效性;Pb、Cr 和Ni 主要以F4 形态存在(占比分别为62.1%、69.3%和56.9%),生物有效性和迁移性较低。经水热处理后,5 种重金属的F1 形态和F2 形态占比降低,F4 形态占比显著上升。尤其是Zn 和Hg,WHT-3 样品中Zn 和Hg 的F4 形态占比相较于WFA 分别上升72.3 和44.3 个百分点。对于Cr 而言,水热处理对其形态分布影响不大,随着Ca/(Si+Al)的增加,Cr 的F1 形态占比仅降低4.2 个百分点,F4 形态占比提升约18 个百分点。表明托贝莫来石对Cr 的固化效果有限,这也与水热产物中Cr 的浸出率明显高于其他重金属的结果相一致。以上结果表明,托贝莫来石的形成可以将重金属转化为残渣态,大大降低重金属的迁移性与生物利用度。这归因于托贝莫来石形成过程中对重金属的物理/化学吸附[52]、离子交换和物理包封[29,49,56]作用,使重金属转化为不易浸出的组分,达到固化重金属的效果。
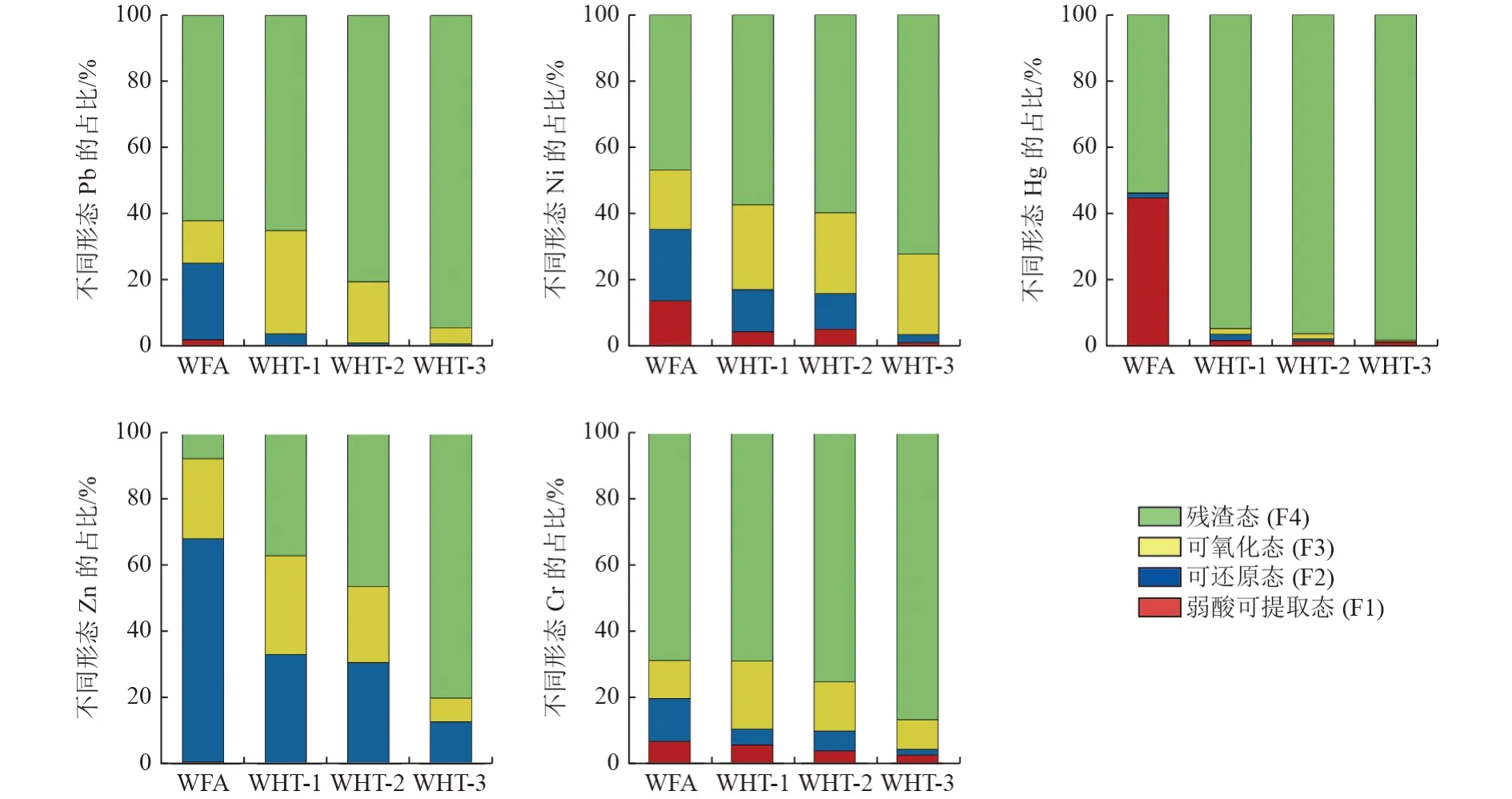
图9 WFA 和水热产物的BCR 形态分析Fig.9 BCR morphological analysis of WFA and hydrothermal products
2.2.4 环境风险评估
RAC 也是评价水热处理前后WFA 中重金属环境风险的重要指标,根据RAC 可以将重金属环境风险分为5 类:无风险水平(<1%),低风险水平(1%~10%),中等风险水平(11%~30%),高风险水平(31%~50%),极高风险水平(>50%)。WFA 和水热产物的RAC 评价结果显示(表4),WFA 中只有Zn 的RAC 小于1%,表明其无环境风险;Cr 和Pb 的RAC 分别为6.52%和2.03%,具有低环境风险;Ni 的RAC 为13.56%,具有中等环境风险;Hg 的RAC 高达44.68%,具有高环境风险。在水热过程中,随着Ca/(Si+Al)的增加,5 种重金属的RAC 逐渐降低。WHT-3 样品中Hg、Ni、Pb、Zn 和Cr 的RAC分别降至1.04%、0.95%、0.04%、0.04%和2.40%,其中Hg 和Cr 降至低风险水平,而Ni、Zn 和Pb 均达到无风险水平(<1%)。

表4 WFA 和水热产物的RAC 评价结果Table 4 Results of RAC evaluation of WFA and hydrothermal products %
3 结论
(1)Ca/(Si+Al)对产物类型具有重要影响,Ca/(Si+Al)较低时,水热产物中出现大量方沸石和青金石等沸石类矿物相。随着Ca/(Si+Al)的逐渐升高,水热产物中托贝莫来石特征衍射峰和特征官能团吸收峰的强度逐渐增加,微观形貌也由紧密连接的球形或椭球形颗粒转变为典型的板条状结构。因此,较高的Ca/(Si+Al)更有利于托贝莫来石的合成。
(2)水热过程中WFA 中的大部分重金属均稳定在固相产物中,而不是迁移至液相中。水热处理显著降低了WFA 中重金属的毒性浸出浓度和浸出率,这归因于托贝莫来石的形成降低了弱酸可提取态重金属的占比,显著增加了残渣态重金属的占比。在Ca/(Si+Al)为1.10 条件下水热产物中5 种重金属的RAC 均低于10%,达到环境低风险水平。表明水热合成托贝莫来石对FA 中重金属具有良好的稳定效果。
