基于天枢与上巨虚穴经皮神经电刺激观察对溃疡性结肠炎模型大鼠结肠组织TLR9/MyD88/NF-κB蛋白表达的影响
2024-02-10张冠林向晶焦子远卓越易细芹张泓
张冠林 向晶 焦子远 卓越 易细芹 张泓

〔摘要〕 目的 基于“合募配穴”原則观察经皮神经电刺激(transcutaneous electrical nerve stimulation, TENS)对溃疡性结肠炎(ulcerative colitis, UC)模型大鼠结肠组织Toll样受体9(toll-like receptor 9, TLR9)/髓样分化因子88(myeloid differentiation factor 88, MyD88)/核因子-κB(nuclear factor-κB, NF-κB)信号通路相关蛋白表达的影响,探讨TENS治疗UC的相关机制。方法 从48只SPF级成年SD大鼠中随机抽取12只作为空白组。其余36只通过2-4-6三硝基苯磺酸(2-4-6 trinitrobenzene sulfonic acid,TNBS)/乙醇法制备UC大鼠模型,成模后再次随机分为模型组、TENS组、阳性药物组,每组12 只。成模后第1 天开始干预:模型组仅行捆绑固定;TENS组捆绑固定后刺激天枢、上巨虚两穴;阳性药物组用225 mg/kg剂量的柳氮磺胺吡啶混悬液灌胃。以上各组干预均每天1 次,共10次。观察记录各组大鼠每天食量和体质量。干预结束后,HE染色观察各组大鼠结肠组织病理学变化;ELISA法检测结肠组织白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)炎性因子的含量;Western blot法检测结肠组织TLR9、MyD88、NF-κB蛋白的表达量变化。结果 (1)与空白组相比:模型组大鼠结肠组织出现明显溃疡面,上皮细胞大面积萎缩,炎性因子大量浸润,IL-6、TNF-α炎性因子含量升高(P<0.05);TLR9、MyD88、NF-κB蛋白表达量上调(P<0.05)。(2)与模型组相比:TENS组和阳性药物组结肠组织损坏情况较轻,上皮细胞黏液较充分,腺体分支较少,炎性细胞浸润面积小;IL-6、TNF-α含量减少(P<0.05);TLR9、NF-κB蛋白表达量降低(P<0.05)。(3)与阳性药物组相比:TENS组TNF-α、IL-1β的含量及TLR9、MyD88、NF-κB蛋白表达量相对较高(P<0.05)。结论 TENS能够保护肠道上皮细胞,减轻肠道炎症,其机制可能与降低结肠细胞促炎因子水平,抑制TLR9/MyD88/NF-κB信号通路蛋白的过表达有关。
〔关键词〕 溃疡性结肠炎;经皮神经电刺激;Toll样受体9;髓样分化因子88;核因子-κB;炎性因子
〔中图分类号〕R245.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.01.019
Effects of transcutaneous electrical nerve stimulation at "Tianshu"
(ST25) and "Shangjuxu" (ST37) acupoints on the protein
expressions of TLR9/MyD88/NF-κB signaling pathway in
colonic tissue of model rats with ulcerative colitis
ZHANG Guanlin, XIANG Jing, JIAO Ziyuan, ZHUO Yue, YI Xiqin, ZHANG Hong*
School of Acupuncture-moxibustion, Tuina and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of transcutaneous electrical nerve stimulation (TENS) on toll-like receptor 9 (TLR9)/myeloid differentiation factor 88 (MyD88)/nuclear factor-κB (NF-κB) signaling pathway-related protein expressions in colonic tissue of ulcerative colitis (UC) model rats based on the principle of "He-sea and front-Mu point combination", and to explore the related mechanisms of TENS in treating UC. Methods Twelve of 48 SPF adult SD rats were randomly selected as blank group. The remaining 36 UC rat models were prepared by 2-4-6 trinitrobenzene sulfonic acid (TNBS)/ethanol method, and then randomly divided into model, TENS, and positive drug groups after modeling, with 12 rats in each group. Intervention began on the first day after modeling. Model group was only bound and fixed; TENS group was stimulated at "Tianshu" (ST25) and "Shangjuxu" (ST37) acupoints after being bound and fixed; positive drug group was intragastrically administered with 225 mg/kg of sulfasalazine suspension. All groups were intervened once a day for a total of 10 times. The daily food intake and body weight of rats in each group were observed and recorded. After the intervention, HE staining was used to observe the pathological changes of colonic tissue in each group, ELISA to check the content of inflammatory factors of interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), and interleukin-1β (IL-1β), and Western blot to examine the changes in the expression levels of TLR9, MyD88, and NF-κB proteins. Results (1) Compared with blank group, the colonic tissue of rats in model group showed obvious ulceration, large-area atrophy of epithelial cells, extensive infiltration of inflammatory factors, and increased content of IL-6 and TNF-α (P<0.05); the expression levels of TLR9, MyD88, and NF-κB proteins were up-regulated (P<0.05). (2) Compared with model group, TENS and positive drug groups showed milder colonic tissue damage, more sufficient epithelial cell mucus, fewer glandular branches, and smaller area of inflammatory cell infiltration; the content of IL-6 and TNF-α decreased (P<0.05); the expression levels of TLR9 and NF-κB proteins were reduced (P<0.05). (3) Compared with positive drug group, the content of TNF-α and IL-1β and the expression levels of TLR9, MyD88, and NF-κB proteins in TENS group were relatively higher (P<0.05). Conclusion TENS can protect intestinal epithelial cells and alleviate intestinal inflammation, and its mechanism may be related to reducing the level of pro-inflammatory factors in colonic cells and inhibiting the overexpression of TLR9/MyD88/NF-κB signaling pathway proteins.
〔Keywords〕 ulcerative colitis; transcutaneous electrical nerve stimulation; toll-like receptor 9; myeloid differentiation factor 88; nuclear factor-κB; inflammatory factors
潰疡性结肠炎(ulcerative colitis, UC)是临床上常见的一种慢性炎症性肠病,其临床症状主要包括腹痛、腹泻、便血等,同时出现肠道黏膜不同程度的溃疡和破损[1-2]。近年来,UC发病率逐年上升,已然成为一种全球性疾病,且患病人群逐渐年轻化[3]。目前,临床针对于UC的治疗手段主要有5-氨基水杨酸盐、皮质类固醇、口服抗生素以及各类中药等[4-5],但此类治疗在具有一定疗效的同时也存在着较明显的药物毒副作用和因治疗周期长而产生的机体耐药性等问题。随着我国康复医学的发展,经皮神经电刺激(transcutaneous electrical nerve stimulation, TENS)已被广泛应用于临床治疗各种疾病,其具有无痛、无创、方便实用的特点,能够实现患者进行自我居家治疗,极大地节省患者的时间和精力。研究显示,TENS能够通过提升迷走神经的活性,有效降低炎症因子的释放,从而对炎症性肠病起到一定的治疗作用[6-7],但对本病疗效尚不清楚。目前有研究表明,合募配穴原则是临床针灸治疗大肠腑病的重要配穴方法,以电针、温针灸等方式刺激天枢、上巨虚等穴位能够有效改善UC症状,延缓UC的进程[8-9]。但存在部分患者因晕针、畏针或治疗周期长而无法坚持等因素导致临床针灸难以大范围应用的问题。故本实验利用TENS于UC模型大鼠之天枢、上巨虚二穴处进行干预,观察其对UC大鼠Toll样受体9(toll-like receptor 9,TLR9)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子-κB(nuclear factor-κB,NF-κB)信号通路相关蛋白以及部分炎性因子表达的影响,并对其治疗效果进行分析,以期将TENS方便快捷、安全性高的优势与UC迁延难愈、治疗周期长的疾病特点相结合,为临床治疗UC提供一种新的治疗思路与方法。
1 材料与方法
1.1 实验动物及分组
本实验动物为健康成年SD大鼠(SPF级),共48只,雌雄各半,体质量(180±10) g,由湖南中医药大学实验动物中心提供,动物实验伦理编号:LL2022022305,动物许可证号:SCXK(湘)2019-0004。大鼠适应性分笼饲养于恒温24~26 ℃、相对湿度50%~70%、24 h明暗交替的环境中7 d。7 d后随机抽取12只大鼠作为空白组,其余36只大鼠作为造模组。造模结束后,将36只大鼠再次随机分为模型组、TENS组、阳性药物组,每组12 只。
1.2 实验试剂与仪器
2-4-6三硝基苯磺酸(2-4-6 trinitrobenzene sulfonic acid,TNBS)(美国Sigma公司,批号:2297);柳氮磺胺吡啶片(上海信谊天平药业有限公司,批号:国药准字H31020840);大鼠Anti-TLR9兔源多克隆抗体(南京川博生物技术有限公司,批号:53889-1);MyD88鼠源单克隆抗体(武汉三鹰生物技术有限公司,批号:67969-1-Ig);NF-κB p65兔源单克隆抗体(武汉爱博泰克生物科技有限公司,批号:A19653);羊抗鼠二抗(伊莱瑞特生物科技有限公司,批号:E-AB-1001);大鼠白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(厦门仑昌硕生物科技有限公司,批号:YD-30219、YD-31063、YD-30206)。
华佗牌经皮电刺激治疗仪(苏州医疗用品厂有限公司,型号:SDZ-V);脱毛膏(法国Veet公司,规格:100 mL);NC膜(美国Millipoer公司,型号:ISEQ00010);电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI);脱色摇床(海门其林贝尔仪器制造公司,型号:TS-100);显影仪(美国Bio-Rad公司,型号:170-8280);低温冷冻离心机(德国Sigma公司,型号:3-30K);酶标仪(美国Thermo公司,型号:RT-6100)。
1.3 造模方法
本实验采用TNBS/乙醇法建立UC大鼠模型[10-13]。大鼠常规饲养7 d后,禁食不禁水24 h,称重,以异氟烷吸入的方式麻醉大鼠,麻醉后固定倒悬位,取10 cm长聚丙烯管(直径2 mm),剪侧孔数处,并由肛门插入8 cm到达结肠部位,快速注入药液(100 mg TNBS/kg+50%乙醇0.25 mL)后,再注入约0.4 mL的空气,以使聚丙烯管中的药液全部注入肠腔,继续使大鼠保持1 min倒悬位,以防注入液倒流,并使药液与结肠充分接触,待麻醉清醒后正常喂养。造模后第1天,若模型大鼠出现腹泻、血便、活动减少等典型症状且粪便隐血试验阳性说明造模成功[14]。空白组给予等量生理盐水灌肠。
1.4 干预方法
TENS组参照《实验针灸学》大鼠标准穴位图谱[15]、《实验动物常用穴位名称与定位第2部分:大鼠》定位[16]。上巨虚:双侧后肢上后三里穴下约5 mm处。天枢:脐中旁开5 mm。将大鼠仰卧位固定于特制鼠板上,皮肤取穴点进行脱毛处理后,将自制直径为5 mm的硅胶电极贴片分别贴敷于UC大鼠上巨虚、天枢两穴的位置,调节电刺激治疗仪频率为100 Hz[17],强度定于该治疗仪“6”档,以触及大鼠肌肉轻微抖动为宜,每次20 min,模型组仅行固定处理。于成模后第1天开始刺激,每天1次,共10 次。阳性药物组根据成人药物剂量公式等比换算得出大鼠灌胃等效剂量为225 mg/kg,将柳氮磺胺吡啶片利用研钵研磨成粉末状,加入生理盐水(10 mL/kg)中充分混合制成灌胃药液,每天灌胃1次,共10次。
1.5 观察指标与检测方法
每天记录大鼠食量和体质量,观察大鼠精神状况、毛发光泽、二便性状、活动情况。治疗10 d后进行取材,以异氟烷吸入的方式麻醉大鼠,将麻醉后的大鼠固定于鼠板上,沿腹正中线切开皮肤暴露腹腔,于乙状结肠部分取3份长度为1 cm的结肠组织,沿肠壁纵向剖开,用生理盐水将肠道内容物冲洗干净以备后续检测。其中1 份多聚甲醛固定保存用于HE染色;其余2 份暂放入冻存管并置于液氮中,待取材结束后存储于-80 ℃冰箱用于ELISA检测和Western blot检测。
1.5.1 HE染色 将多聚甲醛固定的组织进行石蜡包埋、切片,依次进行二甲苯脱蜡、无水乙醇、95%乙醇、85%乙醇、75%乙醇、蒸馏水处理后进行苏木素染色,染色后用自来水冲洗,最后进行脱水、透明、中性树胶封片观察。
1.5.2 ELISA检测 将各组大鼠取材得到的结肠组织在适量生理盐水中充分研磨,放入离心机以3 000 r/min半径8 cm离心10 min后取上清液。按照检测试剂盒说明书要求进行打板、孵育,放入酶标仪中检测样本OD值,最终计算出各样本中IL-6、TNF-α、IL-1β的浓度。
1.5.3 Western blot检测 首先提取结肠组织蛋白,将组织放入裂解液中并加入钢珠,充分研磨后放入组织破碎仪(8 r,15 min)破碎2~3 次,冰上裂解15 min,取出钢珠4 ℃、12 000 r半径8 cm离心20 min,离心后取上清打板测定蛋白浓度(BCA法),最后计算蛋白浓度,配上样液煮沸(100 ℃,20 min),保存于-20 ℃冰箱。制胶结束后将胶板放入电泳盒,倒入电泳液。在胶板孔道中上样(5 ?滋L Marker,10 ?滋L上样液)后进行80 V电泳,待蛋白条带跑至胶板底部结束电泳进行转膜(200 V,90 min),转模结束将PVDF膜放入5%脱脂奶粉中摇床封闭90 min,孵育一抗过夜。次日回收一抗后用TBST于摇床上洗膜3 次,每次6 min。摇床孵育二抗90 min,结束后回收二抗加入TBST洗膜3 次,每次6 min,显影观察蛋白条带。
1.6 统计学分析
采用SPSS 25.0软件进行处理。计量资料采用“x±s”表示,若符合正态性和方差齐性,采用单因素方差分析;不符合正态性或方差齐性采用秩和检验。设定检验水准为0.05,P<0.05认为差异存在统计学意义。
2 结果
2.1 造模后大鼠一般情况
空白组大鼠情况稳定,无不良事件发生,12例均完成周期观察。模型组造模后第1天出现2例死亡,解剖观察发现结肠出现明显溃疡面;在干预第5 天出现2例死亡,观察发现均严重腹胀,解剖发现大鼠肠道出现大面积坏死,粪便堆积在肠道无法排出;其余大鼠均成模且存活,最终8例完成周期观察。TENS组造模后第1天出现1例死亡,解剖观察发现肠道出现穿孔;在干预第7、9天分别出现1例死亡,均为结肠坏死大便难以排出所致;其余大鼠均成模且存活,最终9例完成周期观察。阳性药物组造模后第2天出现2只未成模大鼠;在干预第3天出现1例死亡,观察发现体质量过轻,体温低;在干预第9天因灌胃操作不当致气管破裂出现1例意外死亡;其余大鼠均存活,最终8例完成周期观察。
2.2 大鼠日常情况变化
空白组大鼠日常精神状况良好,二便正常,饮食量尚可。模型组大鼠出现不同程度血便,体质量降低,饮食量下降,毛发暗淡粗糙,性情暴躁;TENS组和阳性药物组均存在上述模型组的情况,但相较有所改善。
2.3 大鼠体质量及食量变化
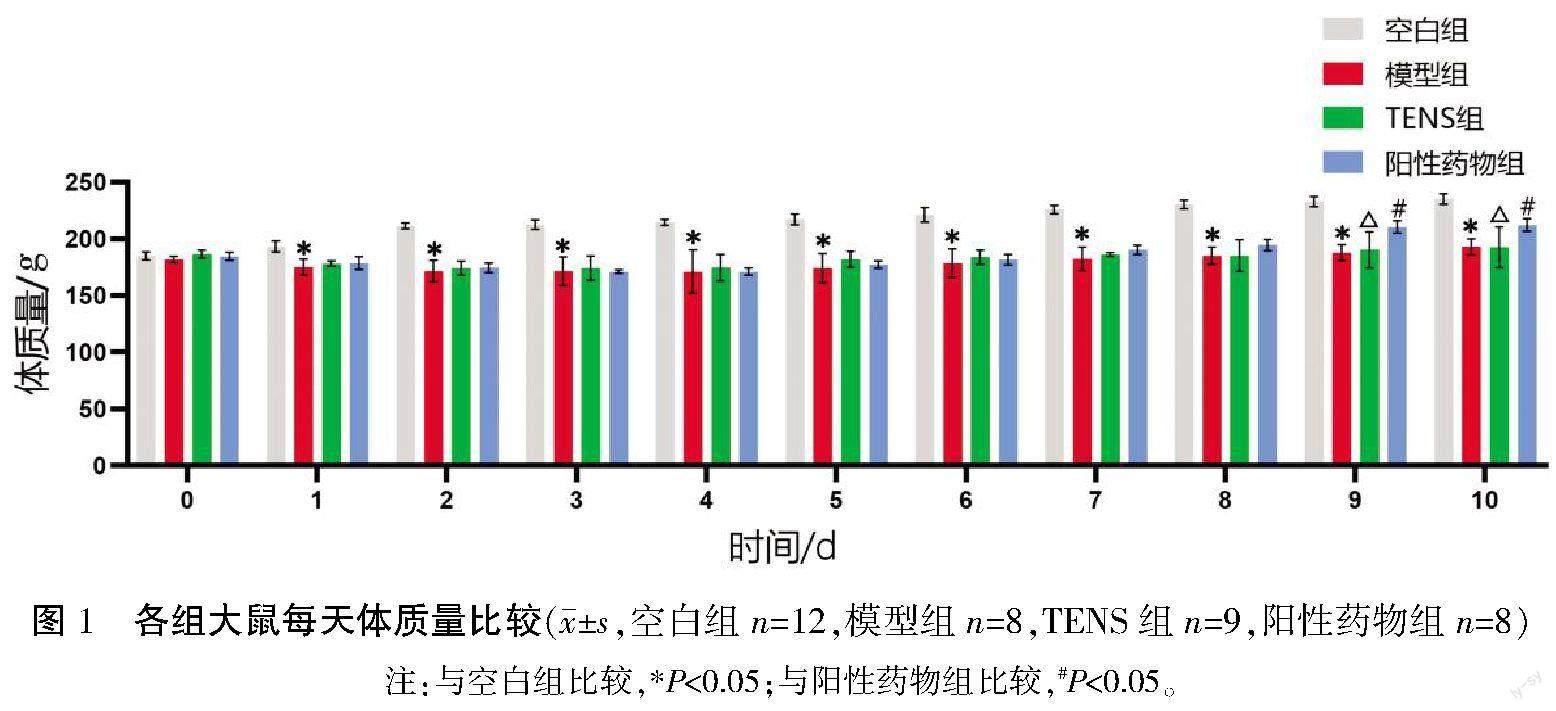
空白组大鼠体质量呈现平稳上升的趋势,其余各组大鼠于造模后第1天体质量明显降低,持续降低至第4天开始逐渐增高,于第9—10天体质量趋于稳定。与空白组比较,模型组大鼠体质量在成模后第1天起出现不同程度的降低(P<0.05);与模型组比较,TENS组大鼠体质量降低幅度较小,差异无统计学意义(P>0.05);与阳性药物组比较,TENS组大鼠体质量降低幅度较小,但在第9—10天體质量偏低(P<0.05)。详见图1。
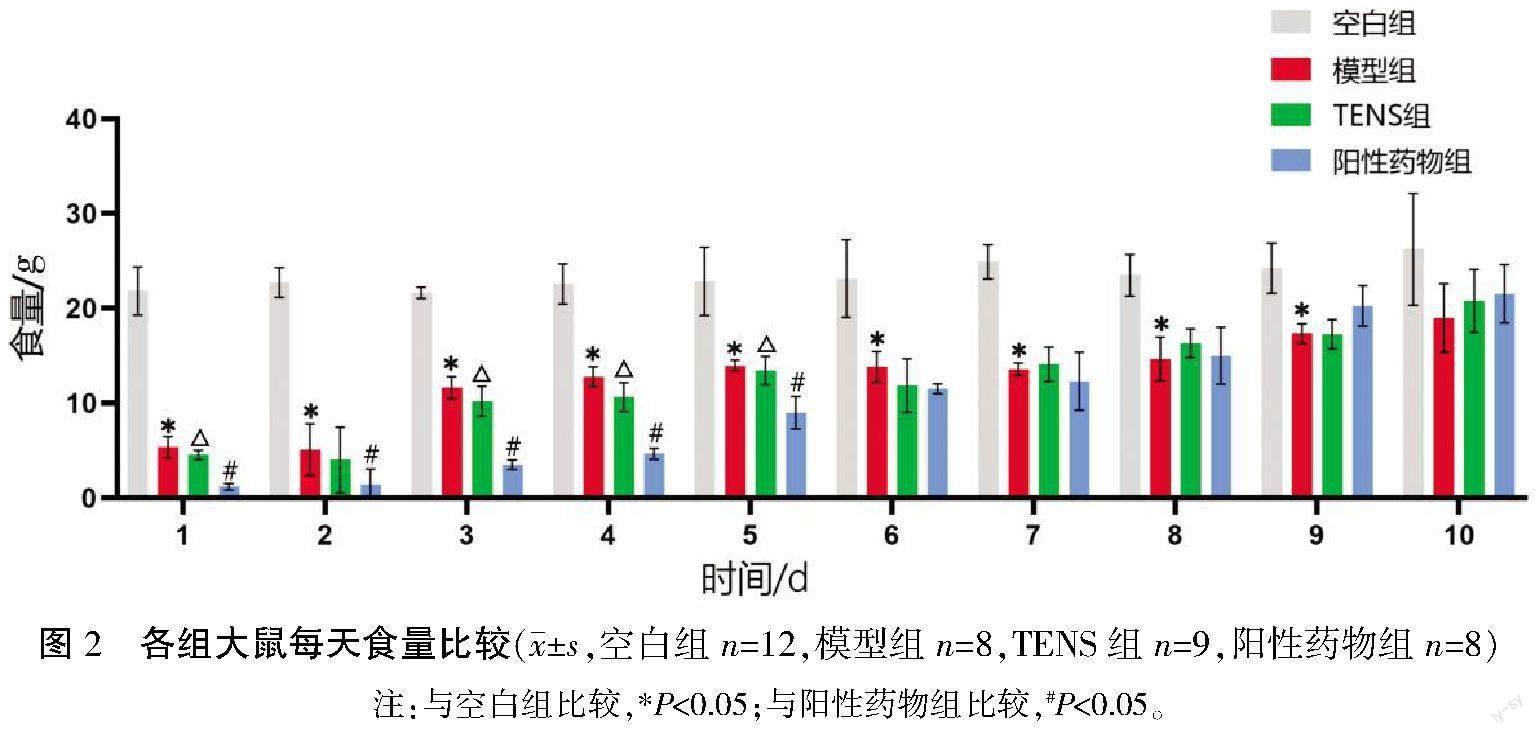
造模成功后各组大鼠均以大鼠普通饲料重量(g)为单位记录每日食量,观察发现空白组大鼠食量无明显变化,其余各组大鼠于造模后第1—2天食量明显减少,至第3 天食量开始逐渐增加。与空白组比较,模型组大鼠食量较小(P<0.05);与模型组相比,TENS组大鼠食量较小,差异无统计学意义(P>0.05);与阳性药物组相比,TENS组大鼠食量较大,第1天和第3—5天的差异有统计学意义(P<0.05)。详见图2。
2.4 大鼠结肠组织变化
空白组结肠上皮结构规则且完整,杯状细胞形态正常,无炎性细胞浸润。与空白组比较,模型组杯状细胞明显萎缩,细胞内黏液减少,淋巴细胞增多,基底部浆细胞大量浸润;与模型组比较,TENS组上皮细胞形态较完整,炎性浸润程度较轻,出现部分杯状细胞脓肿,腺体分支情况较轻;与阳性药物组比较,TENS组杯状细胞萎缩明显,炎性浸润程度更高。详见图3。
2.5 各组大鼠结肠组织中IL-6、TNF-α、IL-1β含量比较
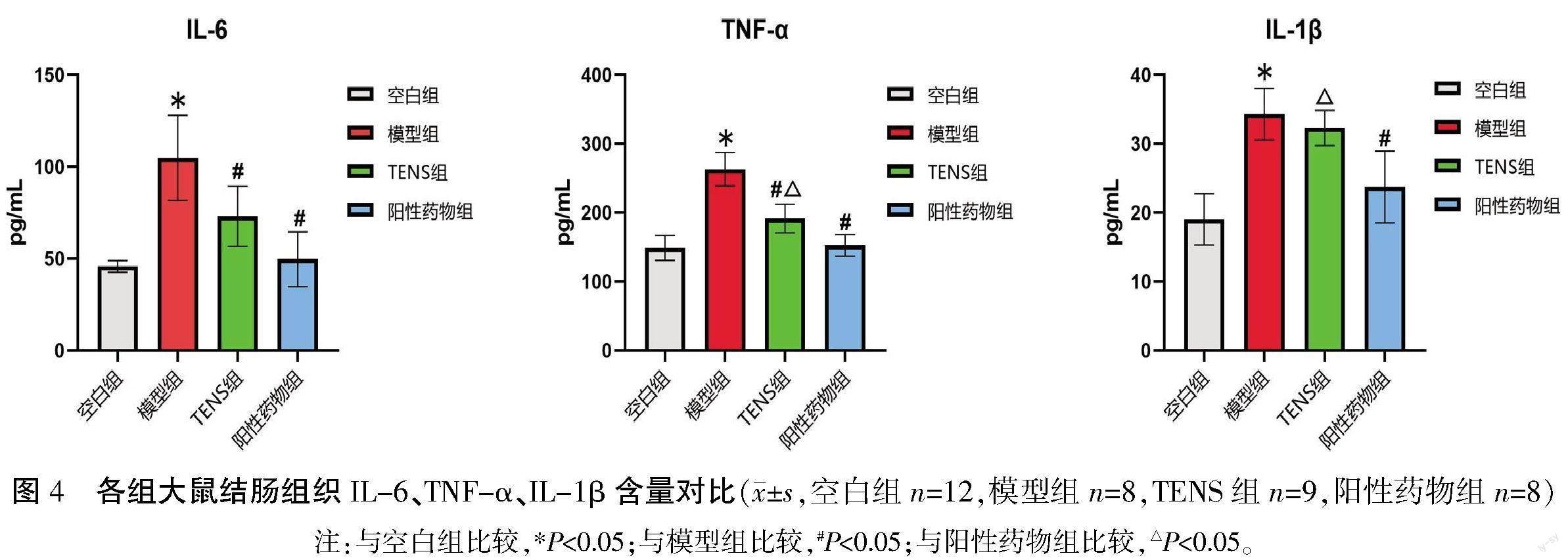
在控制标准品回归曲线R2值不小于0.990 0的基础上计算各样品炎性因子浓度。与空白组相比,模型组结肠组织中IL-6、TNF-α、IL-1β的含量更高(P<0.05);与模型组相比,TENS组IL-6、TNF-α的含量更低(P<0.05),IL-1β的含量较低,但差异无统计学意义(P>0.05);与阳性药物组相比,TENS组结肠组织TNF-α、IL-1β的含量更高(P<0.05),IL-6的含量较高,但差异无统计学意义(P>0.05)。详见图4。
2.6 各组大鼠结肠组织中TLR9、MyD88、NF-κB表达量比较
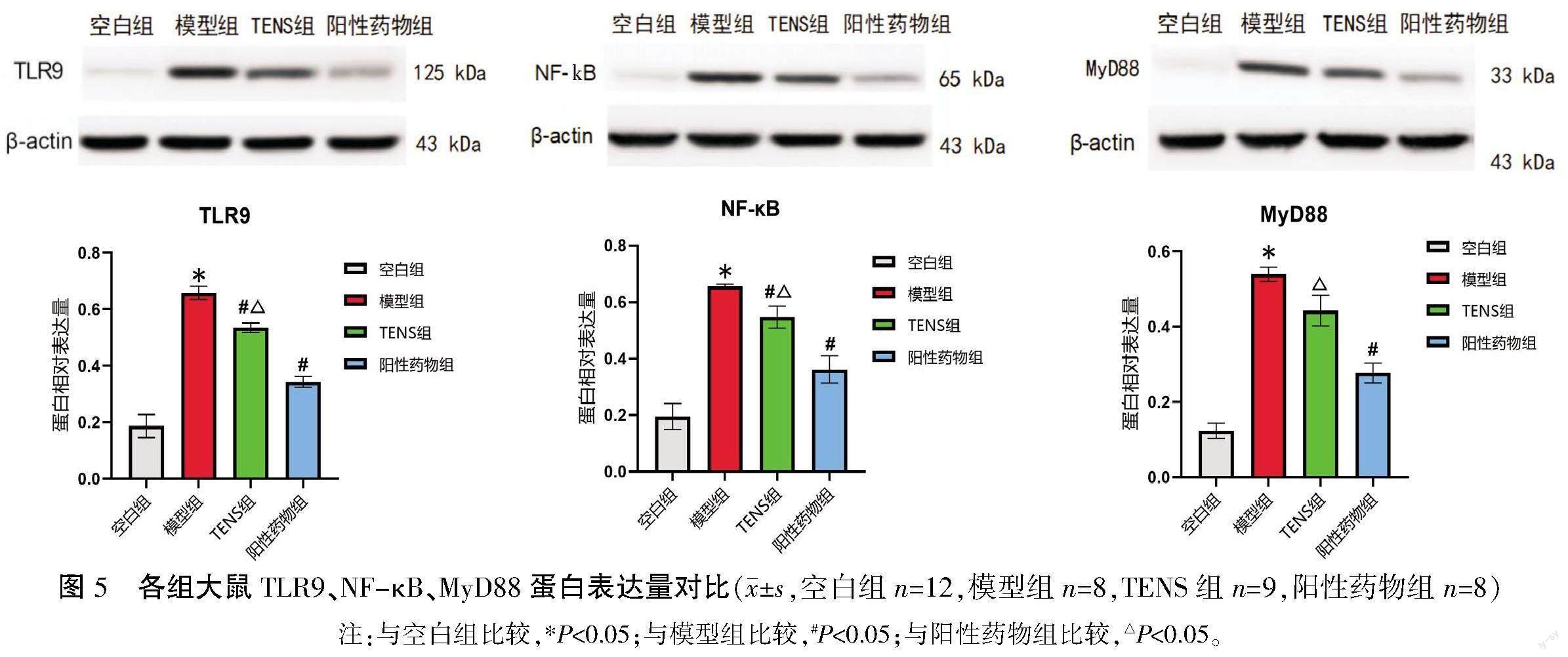
与空白组比较,模型组TLR9、MyD88、NF-κB蛋白表达量更高,差异有统计学意义(P<0.05);与模型组比较,TENS组TLR9、NF-κB p65蛋白表达量更低(P<0.05),MyD88蛋白表达量较低,但差异无统计学意义(P>0.05);与阳性药物组比较,TENS组TLR9、MyD88、NF-κB蛋白表达量更高(P<0.05)。详见图5。
3 讨论
UC是一种病因复杂的慢性炎症性肠病,多是由于长期饮食不规律、吸烟、遗传等多种因素导致肠道内微生态发生变化,从而引发的一系列炎症[18-20]。目前,5-氨基水杨酸盐类药物的应用是临床上治疗UC最常用的方法[21-22]。但其拥有较好药效的同时也具有一定的毒副作用,例如恶心呕吐、大便干结、肠道菌群失调和耐药性出现等,且药物对患者的肝肾功能也会造成一定的负担,以上情况均会影响UC的长期治疗效果[23-26]。而针对UC病程长、反复发作的疾病特点,针灸、理疗等补充治疗手段疗效稳定、风险性低的特征使其成为临床愈加常见的辅助治疗方式[27]。TENS是近年逐渐兴起的一种康复理疗方式,在临床上广泛用于减轻各类炎症。研究证明,TENS可以显著降低大鼠体内促炎因子的水平,其中TENS频率为100 Hz时疗效更加明显[28]。高晓林等[29]研究发现,TENS能够促进大鼠免疫功能的恢复,显著降低患者术后炎性因子的水平;王艺霏等[30]研究发现,通过经皮耳穴-迷走神经刺激能够有效抑制小鼠神经炎性反应,下调MyD88蛋白的表达;金海峰等[31]研究发现,骶神经电刺激能够有效改善UC大鼠的每天进食量和体质量,降低UC大鼠肠道炎性因子的水平,发挥抑制肠道炎症的作用。虽然目前关于TENS治疗UC的报道尚少,但TENS同样是通过作用于迷走神经,下调大鼠体内相关蛋白表达和炎症因子水平,减轻炎症。同时其具有安全性高、操作简便的特点,能够达到患者自主治疗的目标,因此,TENS相較于其他电刺激手段具备更加优良的治疗优势,容易被更多患者所接受。故探讨TENS对于UC的治疗效果具有一定的临床意义。
TLR9作为细胞内天然的识别受体,能够精确地识别细菌和病毒的CpG DNA[32]。MyD88是TLR9的下游接头蛋白,能够接受上游信号并激活下游NF-κB分泌大量炎性因子,从而引起炎症的发生[33-34]。IL-6、TNF-α和IL-1β是由体内巨噬细胞、T淋巴细胞等免疫细胞所分泌的炎性因子,其主要功能是参与免疫的激活和介导过程,促进炎症的发生[35-36]。TLR9/MyD88/NF-κB信号通路是存在于肠道上皮细胞中的经典通路,此通路表达上调后调节体内免疫细胞分泌IL-6、TNF-α、IL-1β等促炎因子的含量显著升高,在UC的致病过程中发挥了重要作用[37]。
中医学认为UC属于“泄泻”“肠澼”等范畴,该疾病发病于脾,迁延难愈,反复发作[38]。天枢与上巨虚两穴均属足阳明胃经,其中天枢属于大肠募穴,上巨虚属于大肠下合穴,此两穴均有疏经活络、通腑理肠的功效,故选取此穴组治疗UC能够取得良好的效果。其次,针对治疗UC选用此穴组属于合募配穴的配伍方式。本课题组前期研究证明,电针合募配穴对于治疗UC改善肠道炎症具有明显的效果,并且广泛应用于临床[39-40]。相较于电针,TENS在操作上更加简便、更加安全,所以探讨TENS通过刺激天枢、上巨虚对于UC的治疗效果,具有一定的临床意义。最终通过本实验证明,TENS组大鼠的结肠组织形态变化明显优于模型组,且TLR9、NF-κB、MyD88的蛋白表达量及IL-6、TNF-α、IL-1β的含量均低于模型组。由此说明,TENS可能是通过抑制TLR9/MyD88/NF-κB信号通路相关蛋白的表达,下调了IL-6、TNF-α、IL-1β等促炎因子的含量,减轻了肠道炎症;但与阳性药物组相比,TENS组蛋白表达量及炎性因子的含量更高。总之,于天枢、上巨虚二穴施加TENS对于UC具有一定的治疗作用,其作用机制可能是抑制了TLR9/MyD88/NF-κB信号通路上相关蛋白的表达,降低了体内IL-6、TNF-α、IL-1β炎性因子的含量,从而达到减轻肠道炎症的效果。本实验先尝试证明TENS治疗本病的有效性,在此基础上将有必要再进一步探讨TENS作为一种辅助治疗方法治疗UC是否有望达到降低西药使用剂量、缩短治疗时间、增加临床疗效等目标等。
参考文献
[1] PORTER R J, KALLA R, HO G T. Ulcerative colitis: Recent advances in the understanding of disease pathogenesis[J]. F1000Research, 2020, 9: F1000FacultyRev-F1000Faculty294.
[2] FEUERSTEIN J D, MOSS A C, FARRAYE F A. Ulcerative colitis[J]. Mayo Clinic Proceedings, 2019, 94(7): 1357-1373.
[3] DU L, HA C. Epidemiology and pathogenesis of ulcerative colitis[J]. Gastroenterology Clinics of North America, 2020, 49(4): 643-654.
[4] BURRI E, MAILLARD M H, SCHOEPFER A M, et al. Treatment algorithm for mild and moderate-to-severe ulcerative colitis: An update[J]. Digestion, 2020, 101(Suppl 1): 2-15.
[5] 徐静雯, 奚 燕. 中医辩(辨)证治疗溃疡性结肠炎的疗效观察[J]. 中国全科医学, 2023, 26(S1): 41-43.
[6] 马晶晶. 迷走神经功能异常在炎症性肠病发病中的作用研究[D]. 南京: 南京医科大学, 2018.
[7] 郭志远. 经皮穴位电刺激对脓毒症患者肠屏障的影响[D]. 芜湖:皖南医学院, 2021.
[8] 刘 朝, 杨金生, 吴 远, 等. 基于数据挖掘的针灸治疗溃疡性结肠炎的诊疗现状与特点[J]. 中华中医药杂志, 2015, 30(11): 3893-3897.
[9] CAO Q R, LING C, LIU M J, et al. Electroacupuncture of “Shangjuxu” (ST37) and “Tianshu” (ST25) reduces colonic injury by suppressing NF-κB/NLRP3 signaling in rats with ulcerative colitis[J]. Acupuncture Research, 2022, 47(4): 314-320.
[10] 马秀兰, 王秀萍, 王佳林, 等. 大鼠溃疡性结肠炎模型的建立[J]. 中医药临床杂志, 2021, 33(9): 1754-1759.
[11] 王文豪, 张 欣, 孙振民, 等. 溃疡性结肠炎大鼠模型不同建立方式比较[J]. 中国老年学杂志, 2023, 43(16): 4008-4011.
[12] 张冰冰, 齐 越, 贾 冬, 等. 2,4,6-三硝基苯磺酸诱导溃疡性结肠炎大鼠模型的建立及评价[J]. 中华中医药学刊, 2015, 33(8): 1834-1836, 2050.
[13] 贺海辉, 沈 洪, 朱宣宣, 等. 2,4,6-三硝基苯磺酸/乙醇法誘导建立溃疡性结肠炎大鼠模型[J]. 中国老年学杂志, 2015, 35(15): 4138-4140.
[14] SILVA I, PINTO R, MATEUS V. Preclinical study in vivo for new pharmacological approaches in inflammatory bowel disease: A systematic review of chronic model of TNBS-induced colitis[J]. Journal of Clinical Medicine, 2019, 8(10): 1574.
[15] 唐 勇. 实验针灸学[M]. 3版. 上海: 上海科学技术出版社, 2021: 146.
[16] 中国针灸学会. 实验动物常用穴位名称与定位第2部分:大鼠[J]. 针刺研究, 2021, 46(4): 351-352.
[17] 蒋袁絮, 王 韵, 刘红香, 等. 2 Hz和100 Hz经皮神经电刺激对大鼠慢性炎症痛治疗作用的比较[J]. 中国中西医结合杂志, 2001, 21(12): 923-925.
[18] 王铭慧, 李玉华, 曹晓焕, 等. 溃疡性结肠炎的研究进展[J]. 中国中医药现代远程教育, 2011, 9(24): 170-175.
[19] KOBAYASHI T, SIEGMUND B, LE BERRE C, et al. Ulcerative colitis[J]. Nature Reviews Disease Primers, 2020, 6(1): 74.
[20] KESHTELI A H, MADSEN K L, DIELEMAN L A. Diet in the pathogenesis and management of ulcerative colitis: A review of randomized controlled dietary interventions[J]. Nutrients, 2019, 11(7): 1498.
[21] MURRAY A, NGUYEN T M, PARKER C E, et al. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis[J]. The Cochrane Database of Systematic Reviews, 2020, 8(8): CD000544.
[22] SEGAL J P, LEBLANC J F, HART A L. Ulcerative colitis: An update[J]. Clinical Medicine, 2021, 21(2): 135-139.
[23] GUILLO L, D'AMICO F, ACHIT H, et al. Kidney function monitoring to prevent 5-aminosalicylic acid nephrotoxicity: What the gastroenterologist should know[J]. Digestive and Liver Disease, 2021, 53(6): 691-696.
[24] V?魱LCHEZ A, ORTS J A, FRéDéRIQUE SCHEIRS S, et al. Mesalazine renal lithiasis[J]. Archivos Espanoles De Urologia, 2020, 73(6): 561-564.
[25] SEHGAL P, COLOMBEL J F, ABOUBAKR A, et al. Systematic review: Safety of mesalazine in ulcerative colitis[J]. Alimentary Pharmacology & Therapeutics, 2018, 47(12): 1597-1609.
[26] 宋先梅. 美沙拉嗪联合双歧三联活菌治疗重度溃疡性结肠炎药物副作用分析[J]. 中国冶金工业医学杂志, 2018, 35(1): 62-63.
[27] 沈翠翠. 近5年针灸治疗溃疡性结肠炎的研究进展[J]. 江西中医药, 2022, 53(9): 74-77, 80.
[28] DO CARMO ALMEIDA T C, DOS SANTOS FIGUEIREDO F W, BARBOSA FILHO V C, et al. Effects of transcutaneous electrical nerve stimulation on proinflammatory cytokines: Systematic review and meta-analysis[J]. Mediators of Inflammation, 2018, 2018: 1094352.
[29] 高晓林, 谢 晨, 杨文佳, 等. 经皮穴位电刺激对神经内分泌免疫相关因子的影响[J]. 上海针灸杂志, 2018, 37(9): 1088-1095.
[30] 王艺霏, 王 瑜, 张 悦, 等. 经皮耳穴-迷走神经刺激对抑郁症模型大鼠前额叶皮质Toll样受体4/髓样分化因子88信号通路相关蛋白表达的影响[J]. 针刺研究, 2021, 46(7): 580-585.
[31] 金海峰, 叶 挺, 刘杰民, 等. 骶神经电刺激对大鼠肠道炎症的抑制作用及机制[J]. 中华中医药杂志, 2019, 34(8): 3705-3710.
[32] 谭 琰, 邹开芳, 钱 伟, 等. 溃疡性结肠炎患者TLR9表达变化的研究[J]. 华中科技大学学报(医学版), 2014, 43(5): 520-527.
[33] BAYER A L, ALCAIDE P. MyD88: At the heart of inflammatory signaling and cardiovascular disease[J]. Journal of Molecular and Cellular Cardiology, 2021, 161: 75-85.
[34] WU J, NIU J K, LI M J, et al. Keratin 1 maintains the intestinal barrier in ulcerative colitis[J]. Genes & Genomics, 2021, 43(12): 1389-1402.
[35] TATIYA-APHIRADEE N, CHATUPHONPRASERT W, JARUKA?鄄MJORN K. Immune response and inflammatory pathway of ulcerative colitis[J]. Journal of Basic and Clinical Physiology and Pharmacology, 2018, 30(1): 1-10.
[36] KAMINSKY L W, AL-SADI R, MA T Y. IL-1β and the intestinal epithelial tight junction barrier[J]. Frontiers in Immunology, 2021, 12: 767456.
[37] 劉梦莹, 王启之. TLR9/NF-κBp65信号通路与溃疡性结肠炎[J]. 胃肠病学和肝病学杂志, 2015, 24(9): 1149-1151.
[38] 刘俊红, 杨会举, 雷丽亚. 槐榆炭方保留灌肠治疗溃疡性结肠炎临床观察[J]. 河南中医, 2020, 40(3): 427-430.
[39] 曹倩茹, 凌 晨, 刘梦君, 等. 电针“上巨虚”和“天枢”对溃疡性结肠炎大鼠核转录因子-κB/NOD样受体热蛋白结构域3信号通路相关蛋白表达的影响[J]. 针刺研究, 2022, 47(4): 314-320.
[40] 易细芹, 张 泓, 凌 希, 等. 电针对溃疡性结肠炎大鼠结肠IL-1β及nAchRα7mRNA的影响[J]. 上海针灸杂志, 2016, 35(10): 1251-1255.
