黄芪甲苷与三七总皂苷配伍冰片改善大鼠脑缺血再灌注后肾脏损伤的研究
2024-02-10欧典李艳玲刘晓丹黄小平张伟王颂周峰李佳婷邓常清丁煌
欧典 李艳玲 刘晓丹 黄小平 张伟 王颂 周峰 李佳婷 邓常清 丁煌






〔摘要〕 目的 觀察黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)与三七总皂苷(Panax notoginseng saponins,PNS)配伍冰片改善大鼠脑缺血再灌注后肾脏损伤的作用。方法 采用大脑中动脉线栓法建立局灶性脑缺血模型,实验随机分为假手术组、模型组、单用冰片组、AST Ⅳ配伍PNS(AP)组、AST Ⅳ与PNS配伍冰片(APB)组,缺血2 h后再灌注48 h,神经功能评分、HE染色和尼氏染色检测脑组织功能和神经细胞损伤,HE染色检测肾脏损伤,通过肾脏质量指数和血肌酐以及血清中尿素氮含量评价肾脏功能,ELISA法检测血清IL-1β和IL-10含量,免疫组织化学检测肾组织NF-κB蛋白的表达,Western blot检测肾组织TLR4和MyD88蛋白的表达。结果 与假手术组比较,模型组神经功能评分和神经细胞损伤率显著升高(P<0.01),尼氏体数量显著减少(P<0.01),同时肾小管水肿、核固缩,肾脏质量指数降低(P<0.01),血清肌酐和尿素氮含量升高(P<0.01),提示脑缺血再灌注可诱发肾脏继发性损伤。与模型组比较,各药物组均能不同程度地降低神经功能评分(P<0.01),减少神经细胞损伤率(P<0.01或P<0.05),增加尼氏体数量(P<0.01),改善肾脏结构损伤,增加肾脏质量指数(P<0.01或P<0.05),降低血清肌酐和尿素氮含量(P<0.01或P<0.05),以AST Ⅳ与PNS配伍冰片效果最佳。与假手术组比较,模型组血清IL-1β含量升高(P<0.01),肾组织NF-κB、TLR4和MyD88蛋白表达增高(P<0.01)。与模型组比较,各药物组血清IL-1β含量降低(P<0.01或P<0.05),血清IL-10含量升高(P<0.01或P<0.05),肾脏组织中NF-κB、TLR4和MyD88的蛋白表达降低(P<0.01或P<0.05)。结论 脑缺血后可诱发肾脏继发性损伤,AST Ⅳ和PNS配伍冰片除可减轻脑缺血再灌注后脑组织损伤外,还可减轻脑缺血后继发性肾脏损伤,其作用与调控TLR4/MyD88/NF-κB信号通路、抑制肾脏炎症有关。
〔关键词〕 黄芪甲苷;三七总皂苷;冰片;脑缺血再灌注损伤;肾脏损伤;炎症反应;NF-κB
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.01.001
Astragaloside IV and Panax notoginseng saponins combined with Bingpian (Borneolum Syntheticum) in improving renal injury after cerebral ischemia-reperfusion in rats
OU Dian1,2, LI Yanling1,2, LIU Xiaodan1,2, HUANG Xiaoping1,2, ZHANG Wei1,2, WANG Song1,2,
ZHOU Feng1,2, LI Jiating1,2, DENG Changqing1,2*, DING Huang1,2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Key Laboratory of Hunan Province for Integrated Chinese and Western Medicine on Prevention and Treatment of Cardio-cerebral Diseases, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of astragaloside Ⅳ (AST Ⅳ) and Panax notoginseng saponins (PNS) combined with Bingpian (Borneolum Syntheticum) in improving renal injury after cerebral ischemia-reperfusion in rats. Methods A focal cerebral ischemia model was established by middle cerebral artery occlusion method. The rats were randomized into sham-operated group, model group, Bingpian (Borneolum Syntheticum) group, AST Ⅳ combined with PNS (AP) group, and AST Ⅳ and PNS combined with Bingpian (Borneolum Syntheticum) (APB) group. After two hours of ischemia, reperfusion was performed for 48 hours. Neurological function was graded. HE staining and Nissl staining were used to determine brain tissue function and nerve cell damage. In addition, HE staining was used to measure renal injury. Renal function was evaluated by renal mass index and the content of creatinine and urea nitrogen in serum. Moreover, the content of IL-1β and IL-10 was checked by ELISA, NF-κB protein expression in the renal tissue was examined by immunohistochemistry method, and TLR4 and MyD88 protein expressions in the renal tissue were determined by Western blot. Results Compared with sham-operated group, the neurological function score and nerve cell injury rate in model group significantly increased (P<0.01), and the number of Nissl bodies significantly decreased (P<0.01). Additionally, renal tubular edema and nuclear pyknosis were observed, and renal mass index decreased (P<0.01). The content of serum creatinine and urea nitrogen increased (P<0.01). It is suggested that cerebral ischemia-reperfusion can induce secondary renal injury. Compared with model group, all drug groups showed reduced neurological function scores (P<0.01), decreased nerve cell injury rate (P<0.01 or P<0.05), increased number of Nissl bodies (P<0.01), improved renal structural damage, elevated renal mass index (P<0.01 or P<0.05), and lower content of serum creatinine and urea nitrogen (P<0.01 or P<0.05) to varying degrees. APB group had the best effects in these above changes. Compared with sham-operated group, the content of IL-1β in serum and the protein expression levels of NF-κB, TLR4, and MyD88 in the renal tissue of model group increased (P<0.01). Compared with model group, all drug groups showed a decrease in the serum IL-1β content (P<0.01 or P<0.05) and protein expression levels of NF-κB, TLR4, and MyD88 in the renal tissue (P<0.01 or P<0.05), and an increase in the serum IL-10 content (P<0.01 or P<0.05). Conclusion Cerebral ischemia-reperfusion can induce secondary renal injury, and APB can not only alleviate brain tissue damage after cerebral ischemia-reperfusion, but also reduce secondary renal injury after it. Its effects are related to the regulation of the TLR4/MyD88/NF-κB signaling pathways and the inhibition of renal inflammation.
〔Keywords〕 astragaloside Ⅳ; Panax notoginseng saponins; Bingpian (Borneolum Syntheticum); cerebral ischemia-reperfusion injury; renal injury; inflammatory response; NF-κB
脑缺血后,神经细胞受损,神经功能障碍,同时可并发多器官功能障碍,其中继发性肾脏功能障碍是常见的并发症,具有较高的发病率和致死率[1]。中医学认为,“肾者,精之处也”,又谓“肾藏精,精生髓通于脑”,故《管子·水池》以“肾生脑”概之[2]。目前,临床上主要针对脑缺血原发部位的损伤进行治疗,如溶栓治疗、修复神经损伤和促神经再生等,而对缺血再灌注过程中其他并发器官的损伤和功能障碍没有进行保护,影响疾病的治疗效果和预后效果[3]。
脑缺血再灌注损伤后,缺血缺氧刺激引起交感神经兴奋,肾脏血管收缩加剧,出现肾脏缺血缺氧,结构受损,同时大量的白细胞活化,引起炎性介质的大量释放,产生炎症因子风暴,进一步加重肾损伤[4]。课题组前期研究发现,黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)与三七总皂苷(Panax notoginseng saponins,PNS)配伍冰片可有效改善脑缺血再灌注后的炎性损伤,减轻脑水肿,促进神经细胞的增殖,保护血脑屏障(blood brain barrier,BBB)和神经血管单元结构及功能的完整性[5]。因此,本研究从改善肾脏损伤、减轻肾脏炎症反应等角度探讨AST Ⅳ与PNS配伍冰片对脑缺血再灌注后肾脏的保护作用及可能的作用机制。
1 材料
1.1 主要药物
戊巴比妥钠(批号:86-01-22)购自上海化学试剂采购供应站分装厂;冰片(左旋龙脑,主要成分为 1,7-三甲基-二环庚-2-醇,含量86%,批号:20170815)购自湖北俊辉有限公司;AST Ⅳ(质量分数为98%,批号:AF9102805)、PNS(质量分数为90%,批号:AF20033002)购自成都埃法生物科技有限公司;依達拉奉注射液(3-甲基-1-苯基-2吡唑啉-5酮,批号:1910142)购自福建天泉药业股份有限公司。
1.2 主要试剂
MCAO栓线(北京西浓科技有限公司,批号2634-A4);RIPA裂解液(中国cwBio,批号:01408/30450);BCA蛋白定量试剂盒(杭州联科生物技术股份有限公司,批号:A00445);ECL化学发光液(美国genview,批号:GE2301);兔抗大鼠TLR4单克隆抗体(批号:BS91353)、兔抗大鼠MyD88单克隆抗体(批号:BS3521)、兔抗大鼠NF-κB多克隆抗体(批号:BS9879M)购自美国Bioworld公司;兔抗大鼠β-actin单克隆抗体(美国Thermo Fisher Scientific,批号:20536-1-AP);兔抗大鼠二抗(批号:K195909F)和DAB显色液(批号:2120D0326)购自中杉金桥;HRP标记山羊抗兔IgG二抗(批号:E-AB-1003)、IL-1β(批号:E-EL-R0012c)、IL-10(批号:E-EL-R0016c)酶联免疫吸附测定法(Elisa)试剂盒购自武汉伊莱瑞特生物科技股份有限公司;肌酐(批号:E-BC-K188-M)和尿素氮(批号:E-BC-K183-M)购自中国Elabscience公司。
1.3 动物
SPF级Sprague-Dawley(SD)雄性大鼠,体质量220~250 g,湖南斯莱克景达实验动物有限公司提供(动物合格证号:430727211101681162)。由湖南中医药大学动物实验中心饲养[场地许可证号:SYXK(湘)2019-0009]。实验前适应性喂养7 d,造模前禁食12 h,自由饮水。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定,批准号LLBH-202004290001。
2 方法
2.1 动物模型的制备
大鼠腹腔注射0.25%戊巴比妥钠(0.2 mL/100 g),待大鼠麻醉后,参照Longa改良法[6],依次分离右侧颈总动脉、颈外动脉、颈内动脉,栓线自右侧颈总动脉向右侧颈内动脉方向插入栓线至推至阻力时停止,固定栓线,术后消毒缝合,栓线阻断2 h后,拔出部分栓线进行再灌注。对照组大鼠仅分离血管,不进行其余操作。
2.2 动物分组与给药
根据前期实验结果[5],动物随机分为:假手术组、模型组、单用冰片组(15 mg·kg-1)、AST Ⅳ(20 mg·kg-1)+PNS(50 mg·kg-1)(AP)组、AST Ⅳ(20 mg·kg-1)+PNS(50 mg·kg-1)+冰片(15 mg·kg-1)(APB)组及依达拉奉(4 mg·kg-1)组,每组10只大鼠。各药物组于缺血2 h再灌注0 h开始灌胃,每天1次。依达拉奉组给予依达拉奉腹腔注射和0.5%羧甲基纤维素钠10 mL·kg-1灌胃,每天1次。假手术组及模型组灌胃等量0.5%羧甲基纤维素钠。再灌注后48 h检测各指标。
2.3 检测指标
2.3.1 神经功能缺损评分 参照Longa[6]神经功能评分法进行评分,评分等级分为0分到4分。大鼠造模清醒后每天评分,舍弃掉评分为4分的大鼠。选取大鼠缺血2 h再灌注48 h的评分结果进行分析,评分越低,损伤越轻,评分越高,损伤越重。
2.3.2 HE染色观察大鼠大脑右侧海马区病理形态 再灌注48 h后,腹腔注射0.25%戊巴比妥钠(0.2 mL/100 g)麻醉,生理盐水心脏灌注后断头取脑,将脑组织或肾组织置于4%多聚甲醛固定后切片,依次经二甲苯脱蜡,乙醇梯度脱水,苏木素伊红染色后再行乙醇梯度脱水,封片后于显微镜下观察并拍照,观察肾小管病理变化,采用Image J 软件分析右侧脑组织海马区的病理损伤情况,计算相同单位视野下的损伤细胞数和总细胞数。细胞损伤率=损伤细胞数/总细胞数×100%。
2.3.3 尼氏染色观察大脑海马体神经元分布 再灌注48 h后,同前取脑组织固定后切片,常规脱水后,1%甲苯胺蓝染色40 min,封片后于显微镜下观察并拍照。尼氏小体分布于神经细胞内并被碱性染料染成深蓝色。用Image J图像分析软件计算大鼠海马体神经元尼氏小体染色的个数。
2.3.4 肾脏质量指数及血清中肌酐、尿素氮检测 再灌注48 h后处死,剥离左侧肾脏称取质量,以大鼠左侧肾脏质量与处死前大鼠体重之比作为大鼠的肾脏质量指数。同时腹主动脉采血。1000 g离心15 min后分离血清,置于-80 ℃冰箱保存,按照Scr和尿素氮试剂盒说明书进行含量测定。
2.3.5 酶联免疫吸附反应检测血清中IL-1β和IL-10含量 收集大鼠血清后,用ELISA试剂盒测定大鼠血清中IL-1β和IL-10含量,操作按说明书要求。
2.3.6 免疫组化检测肾脏组织NF-κB的表达 再灌注48 h后,取肾脏组织石蜡切片,经脱蜡及抗原修复后,加入NF-κB一抗(1∶500),4 ℃孵育过夜,再加入二抗孵育,DAB显色,苏木精复染,NF-κB阳性表达为棕黄色,用Image J图像分析软件计算相同面积下NF-κB表达的累积光密度值(integral optical density,IOD)作为各组NF-κB的相对表达量,并根据各实验组IOD与假手术组IOD的比值进行统计分析。
2.3.7 Westren blot检测肾脏组织中TLR4、MyD88蛋白的表达 再灌注48 h后,取肾脏组织加裂解液研磨,离心后取上清,用BCA法测定蛋白浓度,变性后电泳再湿转,洗膜后封闭,滴加TLR4(1∶500)、MyD88(1∶500)、β-actin(1∶500)一抗,4 ℃孵育过夜,PBS洗3次后,滴加HRP标记的二抗37 ℃孵育1 h,TBST洗膜后ECL法显色。用Image J分析条带IOD,以TLR4、MyD88条带IOD值与β-actin条带IOD值的比值作为TLR4、MyD88蛋白的相对表达量。
2.4 统计学分析
采用统计软件SPSS 25.0进行统计分析,实验数据用“x±s”表示。各组计量资料比较采用单因素方差分析,检验正态性和方差齐性,满足正态性后,方差齐者采用LSD检验,方差不齐者采用Dunnett's T3检验。
3 结果
3.1 药物对神经功能损伤的影响
与假手术组比较,模型组神经功能评分显著升高(P<0.01)。与模型组比较,各药物组均能不同程度的降低神经功能评分(P<0.01);与APB组比较,单用冰片组和AP组神经功能评分增高(P<0.01或P<0.05)。详见图1。
3.2 药物对海马区神经细胞损伤的影响
镜下可见,假手术组海马区神经细胞排列规则,胞核饱满,核仁清晰可见,染色质分布均匀,可见极少数细胞核固缩、神经细胞坏死,损伤率较低。与假手术组比较,模型组海马区神经细胞核固缩或嗜酸样变性,核仁不清晰,损伤率显著升高(P<0.01)。与模型组比较,各药物组均能不同程度的降低海马区神经细胞损伤(P<0.05或P<0.01),且APB组神经细胞损伤率显著低于冰片组和AP组(P<0.05)。详见图2。
3.3 药物对海马区神经细胞形态的影响
尼氏小体分布于神经细胞胞质或树突内,由许多平行排列的粗面内质网和散在于其间的游离核糖体所组成,是神经元内合成蛋白质的主要部位,被甲苯胺蓝等碱性染料染成深蓝色。假手术组可见细胞染色均匀,排列整齐紧密。与假手术组比较,模型组海马区神经细胞出现空泡现象,细胞着色变浅,排列稀疏散乱,尼氏小体数量显著减少(P<0.01)。与模型组比较,各药物组均能不同程度的增加尼氏体数量(P<0.01),且APB组的尼氏小体数量显著高于单用冰片组和AP组(P<0.01或P<0.05)。详见图3。
3.4 药物对肾脏结构损伤的影响
模型组镜下可见管壁上皮呈扁平状,组织局部炎症浸润,管腔内可见蛋白样物沉积,以及大量嗜酸性蛋白样物质积聚,形状如“甲状腺滤泡样”结构,肾小管结构破坏,小管上皮细胞水肿,扩张的肾小管旁间质纤维组织少量增生。肾小动脉和肾小静脉扩张淤血。各药物组可不同程度的改善肾脏损伤,减轻肾小管水肿,减少炎症细胞侵润。详见图4。
3.5 药物对肾脏质量指数、血清肌酐和血清中尿素氮的影响
与假手术组比较,模型组肾脏质量指数显著降低(P<0.01)、肌酐含量显著升高(P<0.01)、尿素氮含量显著升高(P<0.01)。与模型组比较,各药物组均能不同程度增加肾脏质量指数(P<0.01或P<0.05),降低血清肌酐含量(P<0.01),降低血清尿素氮含量(P<0.01或P<0.05),且APB增加肾脏质量指数的作用显著强于单用冰片和AP组(P<0.05),APB降低肌酐的作用显著强于单用冰片和AP组(P<0.05),APB降低尿素氮的作用显著强于单用冰片和AP组(P<0.05)。详见图5。
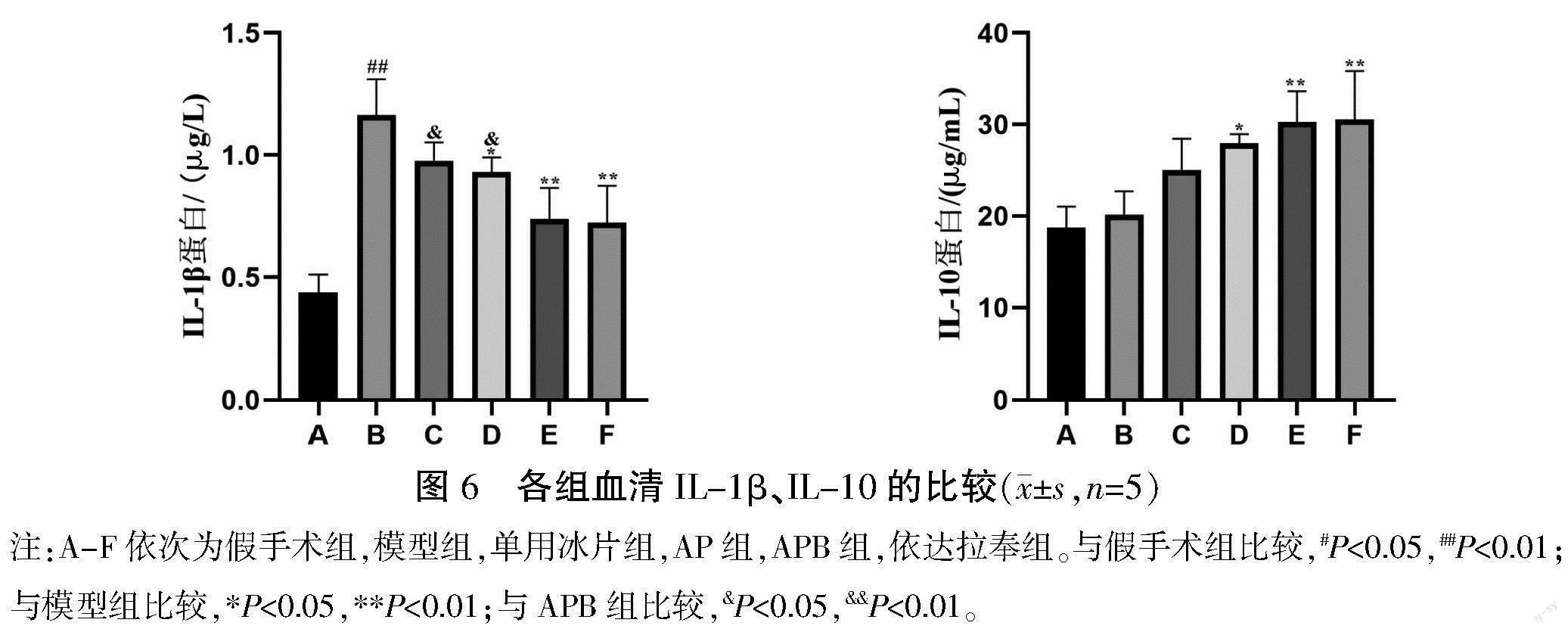
3.6 药物对血清炎症因子IL-1β和IL-10的影响
与假手术组比较,模型组血清中IL-1β含量升高(P<0.01),IL-10含量升高(P>0.05)。与模型组比较,AP组和APB组能不同程度降低血清IL-1β含量(P<0.01或P<0.05)、升高血清IL-10含量(P<0.01或P<0.05);且APB组降低血清IL-1β含量的作用强于单用冰片組和AP组(P<0.05)。详见图6。
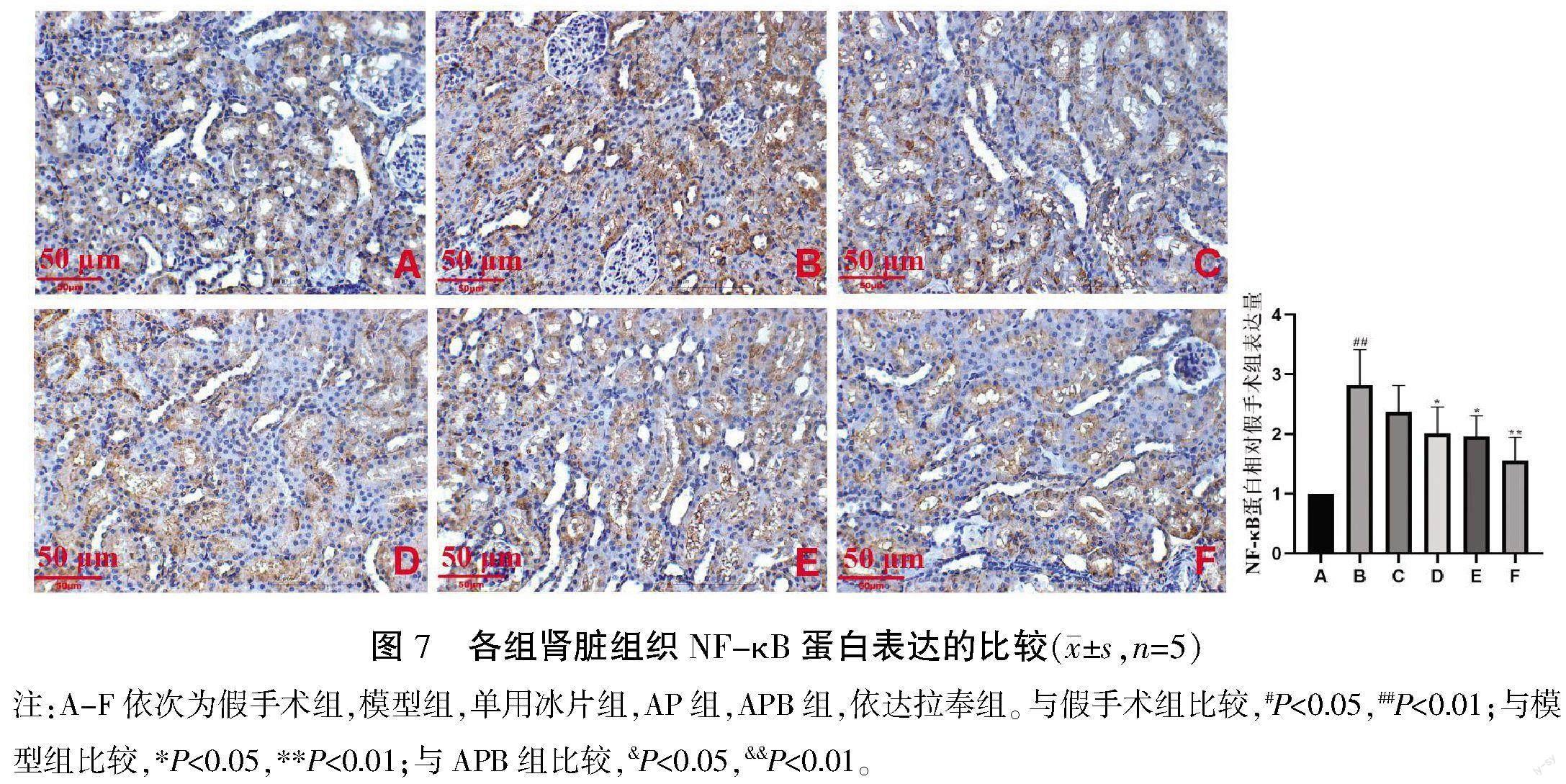
3.7 药物对肾脏NF-κB表达的影响
与假手术组比较,模型组中肾脏NF-κB表达显著升高(P<0.01)。与模型组比较,AP组和APB组能不同程度降低肾脏组织中NF-κB的表达(P<0.01或P<0.05)。且APB降低肾脏组织中NF-κB蛋白表达的作用同AP相当(P>0.05)。详见图7。
3.8 药物对肾脏组织中TLR4、MyD88蛋白表达的影响
与假手术组比较,模型组中肾脏组织TLR4、MyD88蛋白含量显著升高(P<0.01)。与模型组比较,AP和APB组能不同程度降低肾脏TLR4蛋白的表达(P<0.01或P<0.05)。详见图8。
4 讨论
脑缺血再灌注后继发性肾脏损伤是临床常见的并发症[7-9],可影响脑缺血后的住院时间和死亡率,由于肾脏和大脑是高灌注器官,存在血流动力学联系,且都处于较大的血流灌注中,在机体血压变化过程中通过自身调节维持恒定的灌注量。脑缺血后,毒性物质如氧自由基、兴奋性氨基酸和细胞内钙超载、白细胞激活后过度聚集等多种因素的堆积,并在疾病进展中,级联反应不断扩大损伤、毒性物质不断输送到肾脏等部位、神经体液调节以及炎症介质释放等造成继发性肾损伤[10-11]。缺血再灌注后体内诱发的炎症反应,可引起炎症细胞的激活和促炎细胞因子的过度分泌,引发肾脏炎症级联反应,加重肾脏损伤和脑损伤,血清中肌酐和尿素氮含量变化是肾脏功能变化的重要观察指标[12-13]。课题组前期研究发现[14-16],AST Ⅳ与PNS配伍冰片能不同程度降低脑缺血再灌注后BBB通透性,减轻脑水肿,对抗脑组织损伤,其机制可能与协同抑制脑缺血后紧密连接蛋白ZO-1、ZO-2、Occludin等蛋白表达下调,从而保护BBB有关。本研究从神经功能缺损评分、脑组织海马区神经细胞损伤率和脑组织海马区尼氏体染色等方面探讨AST Ⅳ与PNS配伍冰片抗脑缺血再灌注损伤的作用,从肾脏形态改变、肾脏质量指数、血肌酐和尿素氮含量等方面综合评价AST Ⅳ与PNS配伍冰片改善脑缺血再灌注后肾脏损伤的情况。结果提示脑缺血后可诱发肾脏继发性损伤,单用冰片组、AP组、APB组除可减轻脑缺血再灌注后脑组织损伤外,还可减轻脑缺血后继发性肾脏损伤,且APB效果最佳。
炎症侵润是肾脏受损的启动因素[17]。脑缺血再灌注损伤后,小胶质细胞激活,促炎因子IL-1β等释放增多,抗炎因子IL-10等早期增加不明显,产生的炎症介质可通过血液循环,扩散至肾脏乃至全身,引起肾损伤[18]。NF-κB是参与炎症反应、引起肾损伤和肾功能下降的重要通路,NF-κB入核增加,进入细胞核内的NF-κB与DNA结合,启动相关基因转录,释放促炎症因子IL-1β、IL-6、IL-8、TNF-α、细胞间黏附分子-1以及活性氧自由基等,启动免疫应答反应,加重肾损伤[19]。本研究从大鼠血清中IL-1β和IL-10蛋白表达、肾脏组织中NF-κB蛋白的表达评价脑缺血再灌注后肾脏的炎症反应,结果提示炎症反应是引起肾脏继发性损伤的主要原因,APB可通过抑制炎症反应发挥肾脏保护作用。
脑缺血再灌注后,肾脏损伤引起TLR4表达增高,通过募集下游髓样分化蛋白MyD88,与MyD88结合后形成TLR-MyD88复合体,激活相关信号激酶,活化下游不同的信号通路,释放出潜伏的NF-κB二聚体,启动炎症反应[20]。本研究结果提示APB可抑制肾脏炎症反应,减轻肾损伤,其机制可能是通过TLR4、MyD88和NF-κB信号通路发挥作用。
综上所述,脑缺血后可诱发肾脏继发性损伤,AST Ⅳ和PNS配伍冰片除可减轻脑缺血再灌注后脑组织损伤外,还可减轻脑缺血后继发性肾脏损伤,其作用与调控TLR4/MyD88/NF-κB信号通路、抑制肾脏炎症有关。通过本研究,可为AST Ⅳ與PNS配伍冰片的临床应用和进一步开发提供科学和实验依据。
参考文献
[1] JANG S Y, SOHN M K, LEE J, et al. Chronic kidney disease and functional outcomes 6 months after ischemic stroke: A prospective multicenter study[J]. Neuroepidemiology, 2016, 46(1): 24-30.
[2] 李 林, 魏海峰, 张 兰, 等. 中医“肾生髓, 脑为髓海”现代生物学基础探讨[J]. 中国中药杂志, 2006, 31(17): 1397-1400, 1417.
[3] ZHANG H Y, ZHENG L. Statistical analysis for efficacy of tirofiban combined with ozagrel in the treatment of progressive cerebral infarction patients out of thrombolytic therapy time window[J]. Clinics, 2021, 76: e2728.
[4] WANG N Q, WANG L Y, ZHAO H P, et al. Luoyutong treatment promotes functional recovery and neuronal plasticity after cerebral ischemia-reperfusion injury in rats[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2015, 2015: 369021.
[5] 杨筱倩, 丁 煌, 刘晓丹, 等. 冰片配伍黄芪甲苷和三七总皂苷促进脑缺血再灌注后神经修复作用的研究[J]. 中华中医药杂志, 2019, 34(12): 5854-5859.
[6] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[7] FU C, WU Y F, LIU S J, et al. Rehmannioside A improves cognitive impairment and alleviates ferroptosis via activating PI3K/AKT/Nrf2 and SLC7A11/GPX4 signaling pathway after ischemia[J]. Journal of Ethnopharmacology, 2022, 289: 115021.
[8] 王 超, 張 冉, 马梦尧, 等. 大鼠脑缺血再灌注后诱发肾脏急性损伤模型的建立与评价[J]. 皖南医学院学报, 2020, 39(2): 103-106.
[9] CAO W, LI A Q, LI J W, et al. Reno-cerebral reflex activates the renin-angiotensin system, promoting oxidative stress and renal damage after ischemia-reperfusion injury[J]. Antioxidants & Redox Signaling, 2017, 27(7): 415-432.
[10] BAI T, WANG X, QIN C, et al. Deficiency of mindin reduces renal injury after ischemia reperfusion[J]. Molecular Medicine, 2022, 28(1): 152.
[11] HUANG J, SHI L, XIA Y, et al. S100-A8/A9 activated TLR4 in renal tubular cells to promote ischemia-reperfusion injury and fibrosis[J]. International Immunopharmacology, 2023, 118: 110110.
[12] 范心雨, 臧 瑜, 产翠翠. 天麻素对大鼠脑缺血后肾损伤及NF-κb通路的影响[J]. 齐齐哈尔医学院学报, 2022, 43(12): 1122-1126.
[13] 刘 云, 方锦程, 钟文华, 等. 大鼠脑缺血再灌注通过TGF-β1/Smad7通路诱发急性肾损伤的机制探究[J]. 东南大学学报(医学版), 2022, 41(2): 163-170.
[14] 丁 煌, 唐 三, 杨筱倩, 等. 冰片配伍黄芪甲苷与三七总皂苷对脑缺血/再灌注后血脑屏障通透性的影响[J]. 中国药理学通报, 2019, 35(11): 1516-1523.
[15] 唐 三, 丁 煌, 杨筱倩, 等. 冰片配伍黄芪甲苷与三七总皂苷对脑缺血再灌注大鼠血脑屏障转运蛋白的影响[J]. 中草药, 2019, 50(18): 4389-4397.
[16] 欧阳波, 杨筱倩, 丁 煌, 等. 冰片配伍黄芪甲苷和三七总皂苷对脑缺血/再灌注损伤后神经血管单元的保护作用[J]. 中国药理学通报, 2020, 36(10): 1470-1476.
[17] 胡庆华, 缪明星, 卢 国, 等. 槲皮素对尿酸性肾病大鼠肾脏NLRP3和TLRs表达的影响[J]. 中草药, 2013, 44(24): 3496-3502.
[18] YU S H, FU J Y, WANG J, et al. The influence of mitochondrial-DNA-driven inflammation pathways on macrophage polarization: A new perspective for targeted immunometabolic therapy in cerebral ischemia-reperfusion injury[J]. International Journal of Molecular Sciences, 2021, 23(1): 135.
[19] ZHU L W, YE T, TANG Q, et al. Exercise preconditioning regulates the toll-like receptor 4/nuclear factor-κB signaling pathway and reduces cerebral ischemia/reperfusion inflammatory injury: A study in rats[J]. Journal of Stroke and Cerebrovascular Diseases, 2016, 25(11): 2770-2779.
[20] TIAN S H, YU D J, LI Z Y, et al. The inhibition of microRNA-203 on ischemic reperfusion injury after total knee arthroplasty via suppressing MYD88-mdiated toll-like receptor signaling pathway[J]. Gene, 2019, 697: 175-183.
