断根胁迫下调控胡椒根系生长促进植株修复的生理机理
2024-02-09祖超何倩郑维全李志刚王灿杨建峰








摘要:【目的】探明胡椒在不同程度断根处理和修复时间下根系自修复过程的生理机理,为胡椒及同类作物筛选适宜的机械耕作方法提供理论依据。【方法】以热引1号胡椒幼苗为研究对象,设不断根(对照,CK)、轻度断根、中度断根和重度断根4个处理,分别在断根后15、30和60 d测定分析幼苗根系内源激素含量、抗氧化酶活性、形态和活力指标、叶片光合速率和植株生长量,并对各指标间的关系进行结构方程模型分析。【结果】与CK相比,断根后30和60 d时,轻度断根和中度断根的植株鲜重增长量显著增加(Plt;0.05,下同),且断根后60 d的叶片光合速率显著提高,轻度断根60 d的株高增长量显著增加。断根促进根系形态指标生长量显著增加,其中,中度断根30 d的根系平均直径增长量及60 d的根系总长度增长量、表面积增长量和平均直径增长量均显著高于CK。断根后60 d,轻度断根和中度断根的根系活力显著高于CK,分别较CK升高92.0%和66.6%,相对于重度断根有显著修复优势。断根处理对根系内源激素含量有明显调控作用,断根后15、30和60 d,重度断根均促进赤霉素(GA)含量显著升高,断根后15和30 d重度断根也促进细胞分裂素(CTK)含量显著升高。断根后15 d,中度断根和重度断根的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性均显著高于CK;断根后30和60 d,3个断根处理的POD活性均显著高于CK。结构方程模型分析结果表明,断根通过影响根系内源激素含量、抗氧化酶活性和根系性状间接影响生物量性状,但不同修复时间下的影响指标和路径存在差异。【结论】胡椒断根后的生长修复是生长和生理指标相互作用的结果。前期根系内源激素促进根系生长,或通过正向调控抗氧化酶活性而间接促进根系生长启动修复;后期断根处理和内源激素负向调控抗氧化酶活性,促进根系生长完成修复。轻度断根和中度断根对胡椒生长修复有补偿或超补偿效应,重度断根时效性较低,60 d时才完成修复。
关键词:胡椒;断根;内源激素;抗氧化酶;根系形态
中图分类号:S573.9;Q945.78 文献标志码:A 文章编号:2095-1191(2024)11-3369-12
Physiological mechanism of regulating root growth of pepper and promoting plant restoring under root cutting stress
ZU Chao, HE Qian, ZHENG Wei-quan, LI Zhi-gang, WANG Can, YANG Jian-feng*
(Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences/The Innovation Platform for
Academician Zhang Fusuo of Hainan/Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture and Rural Affairs/Hainan Provincial Key Laboratory of Genetic Improvement and Quality Regulation for Tropical Spice and Beverage Crops, Wanning, Hainan 571533, China)
Abstract:【 Objective】To investigate the physiological mechanism of self-storing process of the roots of pepper under different root cutting degrees and restoring times, which could provide theoretical basis for selecting suitable mechanical tillage methods for pepper and similar crops.【 Method】In this study, Reyin No. 1 pepper seedlings were selected as the re‐search object, and a single factor randomized block design was adopted. Four treatments were set up: no root cutting( con‐trol, CK), mild root cutting, moderate root cutting and severe root cutting. The root endogenous hormone content, anti‐oxidant enzyme activity, morphological and vitality indexes, leaf photosynthetic rate and plant growth were determined 15, 30 and 60 d after root cutting respectively. And the relationship among indexes was analyzed.【 Result】Compared with CK, at 30 and 60 d after root cutting, the fresh weight growth of plants with mild root cutting and moderate root cutting was significantly increased( Plt;0.05, the same below), and the leaf photosynthetic rate at 60 d after root cutting was sig‐nificantly increased, and the plant height growth at 60 d after mild root cutting was significantly increased. Root cutting significantly increased the growth of root morphological indexes, among which the increase of average root diameter at 30 d and increase of total root length, increase of surface area and increase of average root diameter at 60 d of moderate root cutting were significantly higher than CK. At 60 d after root cutting, the root activity of mild root cutting and modera-te root cutting was significantly higher than that of CK, which was 92.0% and 66.6% higher than that of CK respec‐tively, and had a significant restoring advantage over severe root cutting. Root cutting treatment had obvious regulatory effect on root endogenous hormone contents. Severe root cutting significantly increased gibberellin( GA) content at 15, 30 and 60 d after root cutting, and severe root cutting also significantly increased cytoknin( CTK) content at 15 and 30 d after root cutting. At 15 d after root cutting, the activities of superoxide dismutase( SOD) and peroxidase( POD) in mod‐erate and severe root cuttings were significantly higher than those in CK. At 30 and 60 d after root cutting, the POD activi-ty of 3 root cutting treatments was significantly higher than that of CK. The results of structural equation model analysis showed that root cutting affected the biomass traits indirectly through the effects of endogenous hormone content, antioxi‐dant enzyme activity and root traits, but the influence indexes and paths were different under different restoring times. 【Conclusion】The growth restoring of pepper after root cutting is the result of interaction of growth and physiological in‐dexes. In the early stage, endogenous root hormones promote root growth, or indirectly promote root growth and start root restoring through positive regulation of antioxidant enzyme activity. In the late stage, root cutting treatment and en‐dogenous hormones negatively regulate the activity of antioxidant enzymes to promote root growth and restoring. Mild root cutting and moderate root cutting have compensation or super compensation effects on pepper growth restoring,
while time efficiency of severe root cutting is low , and the restoring is completed only after 60 d.
Key words: pepper; root cutting; endogenous hormone; antioxidant enzyme; root morphology
Foundation items: National Natural Science Foundation of China(31601820); Hainan Natural Science Foundation (322QN402); Hainan Academician Innovation Platform(YSPTZX202115)
0 引言
【研究意义】香辛料之王胡椒为多年生藤本植物,也是我国热带地区主要经济作物之一,在药用和食品工业中扮演着重要角色(邬华松等,2009;郑维全等,2017)。传统胡椒管理中耕作和施肥占全年劳动力投入总量的30%以上,是管理过程中劳动力投入最多的环节。然而,随着劳动力成本不断上升和农业从业人口老龄化(Ren et al.,2023),传统管理方式已不能适应生产实际(赵正杰等,2021)。与人工耕作和施肥相比,机械耕作和施肥提高了作业效率、均匀性和稳定性,随着现代农业科技不断发展与创新,机械化已成为发展趋势(Omulo et al.,2022)。但不合理的机械耕作是一种非生物胁迫,会抑制根系生长(Mccormack et al.,2015;Feng et al.,2022),植物在抗胁迫过程中可能会因过度损伤导致产量降低(吕丽华等,2016),而适度断根则会促进产量增加(王斯妤等,2022;毛小涛等,2023)。胡椒为多年生经济作物,如果因机械损伤降低产量而影响经济寿命,则对胡椒产业影响巨大。因此,研究不同断根程度对胡椒生长及自修复过程的影响,有助于胡椒生产中选择适宜机械耕作措施及研发配套技术,对胡椒产业的发展具有重要意义。【前人研究进展】根系不仅是作物养分吸收和支持地上部的重要器官,也是多种重要生理活性物质的合成器官,发达的根系是作物生长发育和产量形成的基础(Zhang et al.,2023)。根系在遭受到断根等损伤后,会对作物的地上部生长及根系的形态、生理产生影响(Hodge et al.,2009;Rowe et al.,2016;Xu et al.,2017),不同作物对不同断根程度的响应也存在差异(Geisler and Fer‐ree,2011)。杨喜田等(2011)研究发现,对苗木进行主根切断能加快一级侧根的延长速度;吕丽华等(2016)研究表明,适当修断根系可促进小麦有效分蘖,使地上部叶面积和干物质增加,单株粒重增加;王家研等(2019)研究发现,适当的切根强度和生根剂处理能有效促进红锥幼苗生长,增加侧根数量;Hu等(2019)研究发现,根茎修剪可提高粮食产量和收获指数。此外,适当断根在影响植物生长和生理特性的同时,通常具有补偿甚至超补偿效应(冯锴等,2014;何应会等,2016;王家妍等,2019)。潘珠静等(2022)研究发现,芽苗切根可促进南京椴苗木的生长,抑制主根生长并诱使产生大量的侧根及粗根,促使苗木根构型朝着须根化方向发展,以适应外部环境变化。根系受损后的生长修复离不开养分和水分的供应,根系活力反映根吸收养分或水分的能力(Lehmann,2003;Yan et al.,2023),植物激素控制根系生长,维持植物整体水分平衡(Yao et al.,2019)。断根可引起植物激素含量的显著变化(Dodd,2003;Rowe et al.,2016),如根系生长素和脱落酸含量的增加,这些激素通常与植物的生长和防御反应有关(Xu et al.,2017;Fanello et al.,2020;范军强等,2023)。高温、干旱、淹水、重金属等非生物胁迫会使植物体内产生大量的活性氧自由基(李彦杰等,2014;Gong et al.,2020)。断根也属于非生物胁迫,也可能引起活性氧自由基在植物体内大量积累。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内保护酶系统的主要成员,是防御活性氧自由基对细胞膜系统伤害的最重要的酶,植物通过调节SOD、POD和CAT活性升高可抵御逆境胁迫(卢克欢等,2018;Gong et al.,2020;罗忍忍等,2022)。【本研究切入点】本课题组前期预试验探究了免耕、人工耕作、粉垄耕作、挖机耕作4种耕作方式对胡椒产量的影响,发现与人工耕作相比,粉垄耕作、挖机耕作均提高了胡椒产量,说明适度断根可促进胡椒产量增加,但目前尚不清楚胡椒抗断根胁迫的修复过程。【拟解决的关键问题】以热引1号胡椒幼苗为研究对象,通过对其根系进行模拟机械损伤的断根处理,探究不同断根程度和修复时长对其生长量、根系形态、根系活力、内源激素含量和抗氧化酶活性的影响,并对胡椒断根后的生长生理、形态特性指标进行相关分析,以探索各指标间的相互关系,阐明胡椒在不同程度断根处理下修复过程的生理机理,为胡椒及同类作物筛选适宜的机械耕作方法提供理论依据。
1 材料与方法
1. 1 试验区概况及试验材料
本试验区位于海南省万宁市中国热带农业科学院香料饮料研究所人工气候室(18°44′15″N,110°11′31″E),人工气候室昼夜温度分别控制在30.5和26.5 °C,相对湿度为80.0%,光照时间为12 h/d。供试土壤为海南砖红壤,pH 4.6,土壤全氮含量4.4 g/kg,碱解氮含量125.6 mg/kg,有效磷含量54.5 mg/kg,速效钾含量67.8 mg/kg,有机质含量18.1 g/kg。
试验材料为中国热带农业科学院香料饮料研究所提供的主栽品种热引1号胡椒幼苗。
1. 2 试验方法
为模拟胡椒田间根系损伤的生长修复过程,采用重复2次的温室盆栽试验。试验开始于2022年10月,选用培养3个月,长势一致、无病虫害和机械损伤的胡椒幼苗,设4个断根程度处理,分别为不断根(对照,CK)、轻度断根(RP1)、中度断根(RP2)和重度断根(RP3),每处理重复9次。断根后,培育管理15、30和60 d,期间每隔7 d调整盆的位置,以确保光照、通风等外界条件保持一致。每隔10 d施用1次1/2浓度的霍格兰营养液[375 μmol/L K2SO4、325 μmol/L MgSO4、50 μmol/L KCl、125 μmol/L KH2PO4、1000 μmol/L Ca(NO3)2、50 μmol/L Fe-EDTA、50 μmol/L H3BO3、0.5 μmol/L MnSO4、0.5 μmol/L ZnSO4、0.05 μmol/L CuSO4、0.003 μmol/L(NH4)6Mo7O24],浇水采用称重法,浇水量为田间持水量的30%。
具体断根步骤:将胡椒幼苗从盆中整株完整取出;根据胡椒根系分布情况,将根系按其根系总数量平均分成3等份,采取保护性分隔;按照分隔好的标记进行剪切,剪1份为轻度断根,剪2份为中度断根,剪3份为重度断根,模拟大田耕作习惯,剪切位置在靠近根尖1/3处(图1)。
在胡椒断根前及断根后生长15、30和60 d时,分别测量植株生长指标、根系形态指标、根系活力及根系内源激素含量。
1. 3 测定项目及方法
1. 3. 1 植株生长指标及叶片光合速率测定 分别将各组胡椒幼苗的地上部和根系保存完整,用电子秤称量整株鲜重;用卷尺测量从胡椒幼苗基部到顶部的株高。鲜重增长量、株高增长量分别为生长修复15、30和60 d时的鲜重和株高与断根前胡椒幼苗鲜重和株高的差值。生长修复15、30和60 d时,采用LI-6400型便携式光合仪(美国LI-COR公司)在9:00—11:00测定中部完全展开叶的光合速率。
1. 3. 2 根系形态指标测定 将各组准备的根系用去离子水清洗干净,使用根系扫描仪获取根系影像图片,通过根系分析软件WinRiZO Prov.2009C进行分析,获得胡椒根系长度、表面积、平均直径、体积等数据。根系形态指标增长量分别为生长修复15、30和60 d时根系形态指标与断根前胡椒幼苗根系形态指标的差值。
1. 3. 3 根系活力、内源激素含量及抗氧化酶活性测定 以TTC染色,采用紫外分光光度法测定根系活力;使用ELISA试剂盒(上海科兴商贸有限公司)测定生长素(IAA)、细胞分裂素(CTK)、赤霉素(GA)和脱落酸(ABA)含量,使用抗氧化物酶试剂盒(苏州科铭生物技术有限公司)测定SOD、POD和CAT活性。
1. 4 统计分析
采用SPSS 25.0进行数据整理和分析,以Turkey法进行差异显著性检验,以Pearson’s检验进行相关分析,采用Graphpad Prism 8.0制图,采用R语言的plspm包进行结构方程模型分析,并使用Adobe Illustrator 2021制图。
2 结果与分析
2. 1 断根对胡椒幼苗地上部生长的影响
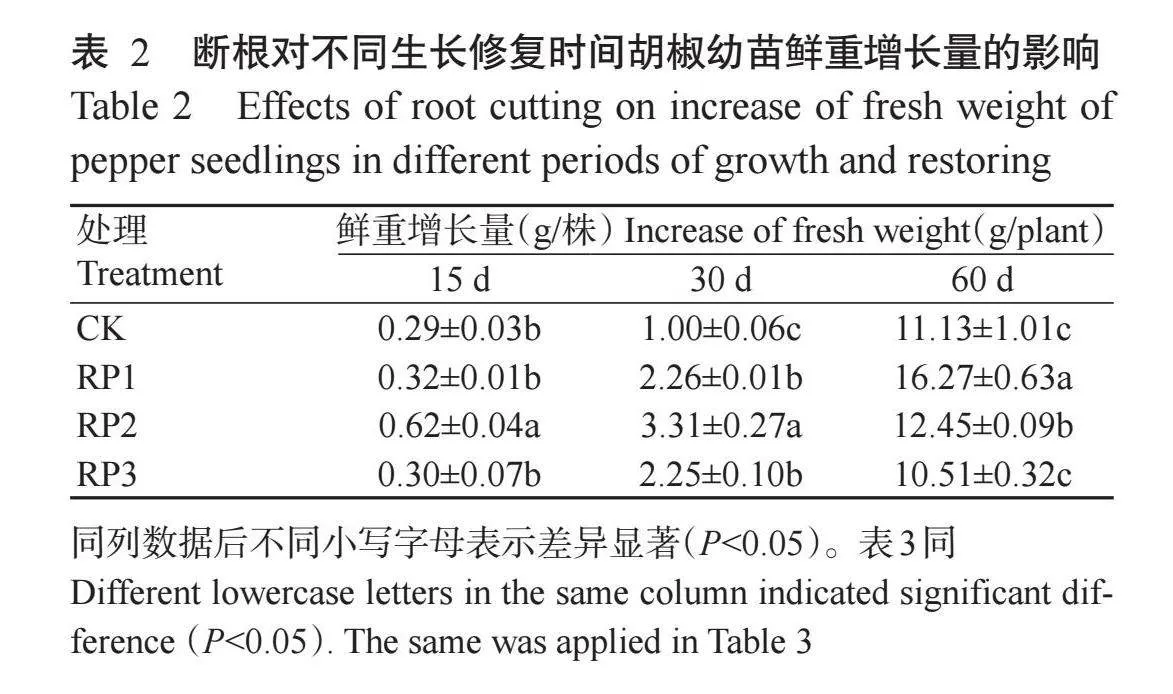
2. 1. 1 鲜重增长量 由表1可知,断根程度、修复时间及二者交互作用对胡椒幼苗鲜重增长量的影响均达极显著水平(Plt;0.01,下同)。由表2可知,与CK相比,断根后15和30 d,不同断根处理的鲜重增长量均有所增加。断根后15 d,中度断根鲜重增长量显著高于其余处理(Plt;0.05,下同),轻度断根、中度断根和重度断根分别较CK增加10.3%、113.8%和3.4%;断根后30 d,中度断根鲜重增长量显著高于轻度断根、重度断根和CK,轻度断根与重度断根无显著差异(Pgt;0.05,下同),但显著高于CK,轻度断根、中度断根和重度断根分别较CK增加126.0%、231.0%和125.0%;断根后60 d,轻度断根鲜重增长量显著高于其他处理,轻度断根和中度断根鲜重增长量分别较CK增加46.2%和11.9%,重度断根与CK无显著差异。由此可知,断根后60 d时,轻度断根和中度断根相对于重度断根均表现出显著修复优势。2. 1. 2 株高增长量 由表1可知,断根程度和修复时间对胡椒幼苗株高增长量的影响达极显著水平,二者交互作用的影响达显著水平。由表3可知,断根后15 d,中度断根和轻度断根的株高增长量显著高于重度断根,中度断根和轻度断根分别较CK增加38.8%和29.9%;断根后30 d,轻度断根的株高增长量显著高于重度断根,与中度断根和CK无显著差异;断根后60 d,轻度断根的株高增长量与重度断根无显著差异,但显著高于中度断根和CK,轻度断根、中度断根和重度断根分别较CK增加36.6%、6.9%和9.6%。由此可知,断根对胡椒株高无显著抑制作用。
2. 1. 3 叶片光合速率 由表1可知,断根程度、修复时间及二者交互作用对胡椒叶片光合速率的影响均达极显著水平。图2显示,断根后15 d,与CK相比,重度断根显著降低了胡椒叶片光合速率,轻度断根和中度断根与CK无显著差异;断根后30 d,与CK相比,中度断根和重度断根显著降低了胡椒叶片光合速率,轻度断根与CK无显著差异;断根后60 d,3个断根处理的胡椒叶片光合速率均高于CK,其中轻度断根和中度断根较CK分别显著增加62.0%和69.0%,重度断根与CK无显著差异。由此可知,在断根60 d时,轻度断根和中度断根相对于重度断根在叶片光合作用方面表现出显著修复优势。
2. 2 断根对胡椒幼苗根系生长特征的影响
2. 2. 1 断根对胡椒幼苗根系形态的影响 由表4可知,断根程度、修复时间及二者交互作用对胡椒根系总长度、根系表面积和根系平均直径的影响均达极显著水平,修复时间对根系总体积影响极显著,但断根程度及断根程度和修复时间的交互作用对根系总体积无显著影响。
由表5可知,不同断根处理的胡椒幼苗根系在不同天数下的修复程度存在明显差异。断根后15 d,根系总长度增长量表现为CK和轻度断根显著高于中度断根;根系表面积增长量表现为CK显著高于3个断根处理,轻度断根显著高于重度断根;根系平均直径增长量和根系总体积增长量表现为CK显著高于3个断根处理。断根后30 d,根系总长度增长量表现为CK显著高于3个断根处理,轻度断根显著高于重度断根;根系表面积增长量表现为CK显著高于3个断根处理,中度断根显著高于轻度断根和重度断根;根系平均直径增长量表现为中度断根显著高于其余处理,CK显著高于轻度断根;根系总体积增长量表现为CK和中度断根显著高于轻度断根和重度断根。断根后60 d,根系总长度增长量表现为中度断根显著高于其余处理,CK显著高于轻度断根和重度断根,重度断根显著高于轻度断根;根系表面积增长量表现为中度断根显著高于其余处理,CK和重度断根显著高于轻度断根;根系平均直径增长量表现为中度断根显著高于CK和轻度断根;根系总体积增长量在各处理间无显著差异。
整体来看,断根后15 d,3个断根处理的各项根系形态指标增长量均低于或显著低于CK;断根后30 d,中度断根的根系平均直径增长量和根系总体积增长量显著高于其他断根处理,表现出明显的修复优势,且直径为最先修复的有效根系形态;断根后60 d,中度断根的4个根系形态指标均高于或显著高于CK,修复优势明显,中度断根与重度断根根系直径增长量无显著差异,但显著高于CK和轻度断根,中度断根和重度断根根系直径表现出显著的修复优势。
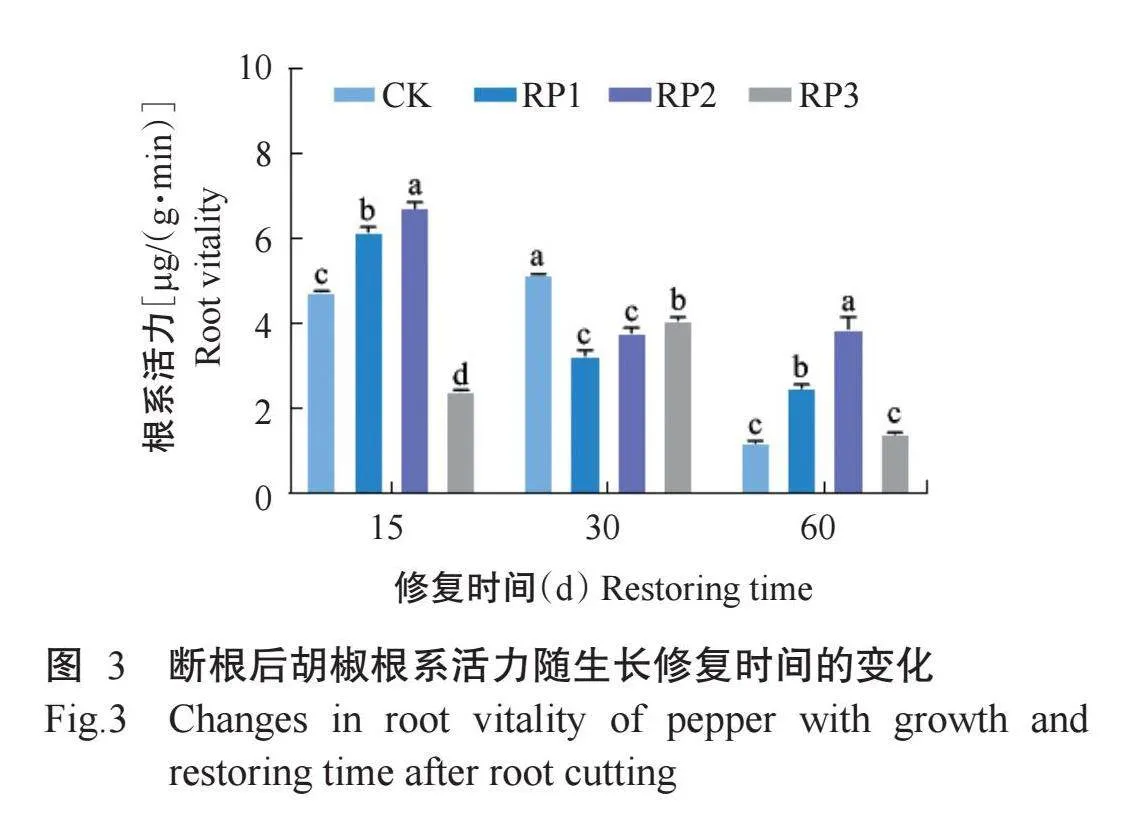
2. 2. 2 断根对胡椒幼苗根系活力的影响 由表4可知,断根程度、修复时间及二者交互作用对胡椒幼苗根系活力的影响均达极显著水平。图3显示,断根后15 d,轻度断根和中度断根的根系活力显著高于CK和重度断根,中度断根根系活力最高,其次为轻度断根,二者较CK分别显著增加41.4%和29.7%,重度断根的根系活力显著低于其余处理;断根后30 d,3个断根处理的根系活力均显著低于CK,轻度断根、中度断根和重度断根分别较CK显著降低37.1%、33.2%和14.8%;断根后60 d,轻度断根和中度断根的根系活力显著高于CK和重度断根,分别较CK显著升高92.0%和66.6%,说明断根后60 d,轻度断根和中度断根相对于重度断根有显著修复优势。
2. 3 断根对胡椒幼苗根系内源激素含量和抗氧化酶活性的影响
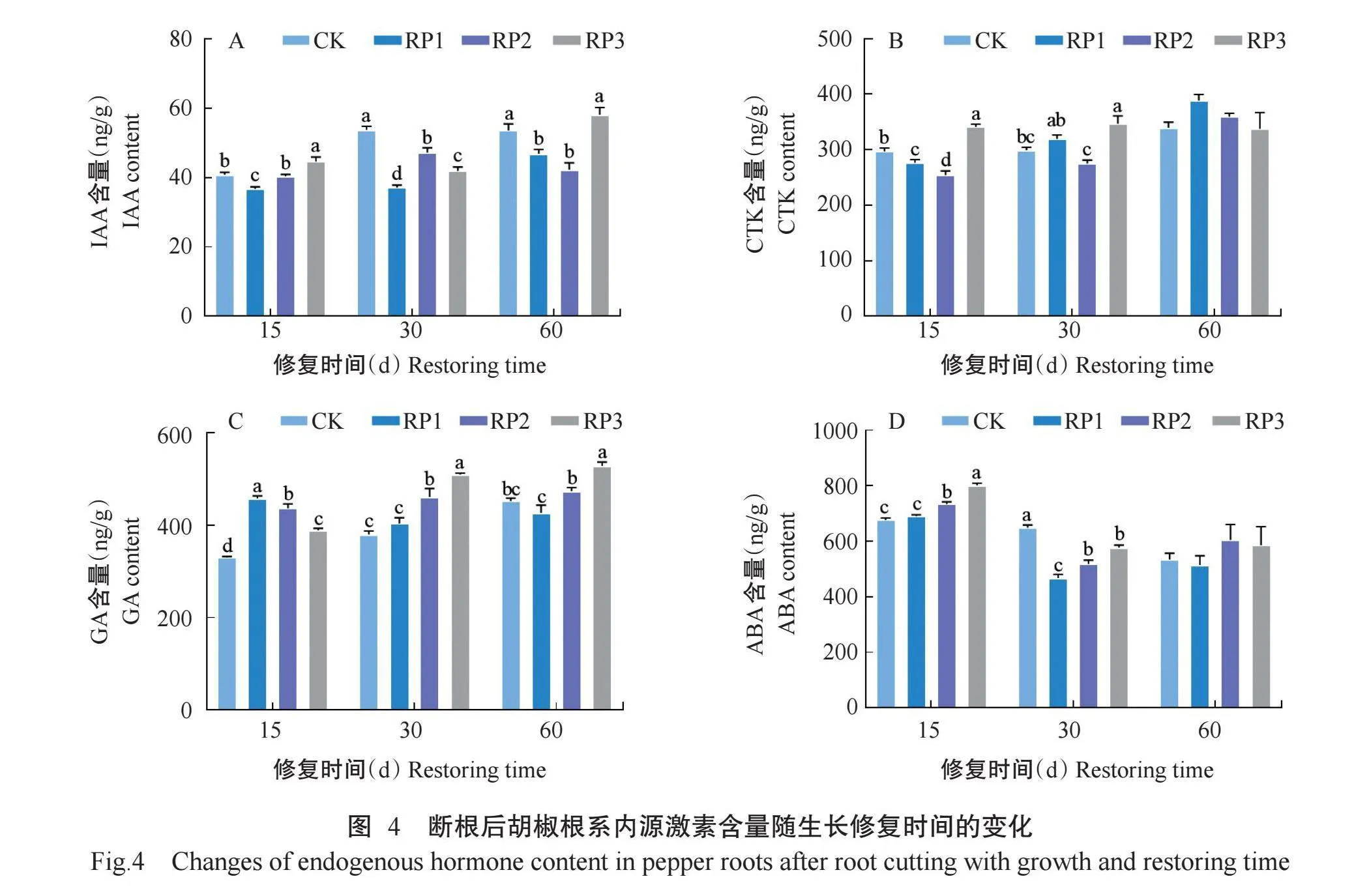
2. 3. 1 断根对胡椒根系内源激素含量的影响 方差分析结果(表6)表明,断根程度、修复时间及二者交互作用对胡椒根系内源激素含量的影响均达极显著水平。由图4可看出,断根后15 d,3个断根处理的根系IAA、ABA含量随断根程度的增加而升高,且不同断根处理间差异均达显著水平,中度断根的ABA含量、重度断根的IAA和ABA含量也显著高于CK;根系CTK含量表现为重度断根显著高于其余处理,轻度断根和中度断根显著低于CK;根系GA含量表现为3个断根处理显著高于CK,但随断根程度的增加而显著降低。断根后30 d,根系IAA含量表现为3个断根处理显著低于CK,中度断根显著高于重度断根和轻度断根,重度断根显著高于轻度断根;根系CTK含量表现为轻度断根和重度断根显著高于中度断根;根系GA含量表现为3个断根处理均高于CK,且但随断根程度的增加而升高,中度断根和重度断根显著高于CK和轻度断根;根系ABA含量表现为CK显著高于3个断根处理,轻度断根显著低于中度断根和重度断根。断根后60 d,根系IAA含量表现为重度断根与CK无显著差异,但显著高于轻度断根和中度断根;根系GA含量表现为重度断根显著高于其余处理,中度断根显著高于轻度断根;根系CTK和ABA含量在各处理间均无显著差异。由此可知,断根修复30 d内,根系IAA、CTK、GA和ABA含量在处理间差异明显,其中CTK在断根后15和30 d,GA在整个修复时期表现为胡椒抗断根胁迫的优势激素。
2. 3. 2 断根对胡椒根系抗氧化物酶活性的影响
方差分析结果(表6)表明,断根程度、修复时间及二者交互作用对胡椒根系抗氧化酶活性的影响均达极显著水平。由图5可看出,3种抗氧化酶活性在不同断根程度和修复时间下存在明显差异。对于根系CAT活性,断根后15 d,轻度断根和中度断根显著低于CK,重度断根显著高于CK;断根后30和60 d,3个断根处理均显著低于CK,中度断根显著高于轻度断根和重度断根。对于根系SOD活性,断根后15 d,中度断根显著高于其余处理,重度断根显著高于CK;断根后30 d,3个断根处理均显著低于CK,中度断根显著高于轻度断根和重度断根,轻度断根显著高于重度断根;断根后60 d,重度断根显著高于其余处理,中度断根与CK无显著差异,但显著高于轻度断根。对于根系POD活性,断根后15 d,重度断根显著高于其余处理,中度断根显著高于CK和轻度断根;断根后30和60 d,3个断根处理显著高于CK。其中,30 d时表现为重度断根gt;中度断根gt;轻度断根,60 d时表现为重度断根gt;轻度断根gt;中度断根。由此可知,中度断根主要表现为通过根系SOD活性增加进行修复,重度断根主要表现为通过CAT和POD活性增加进行修复。
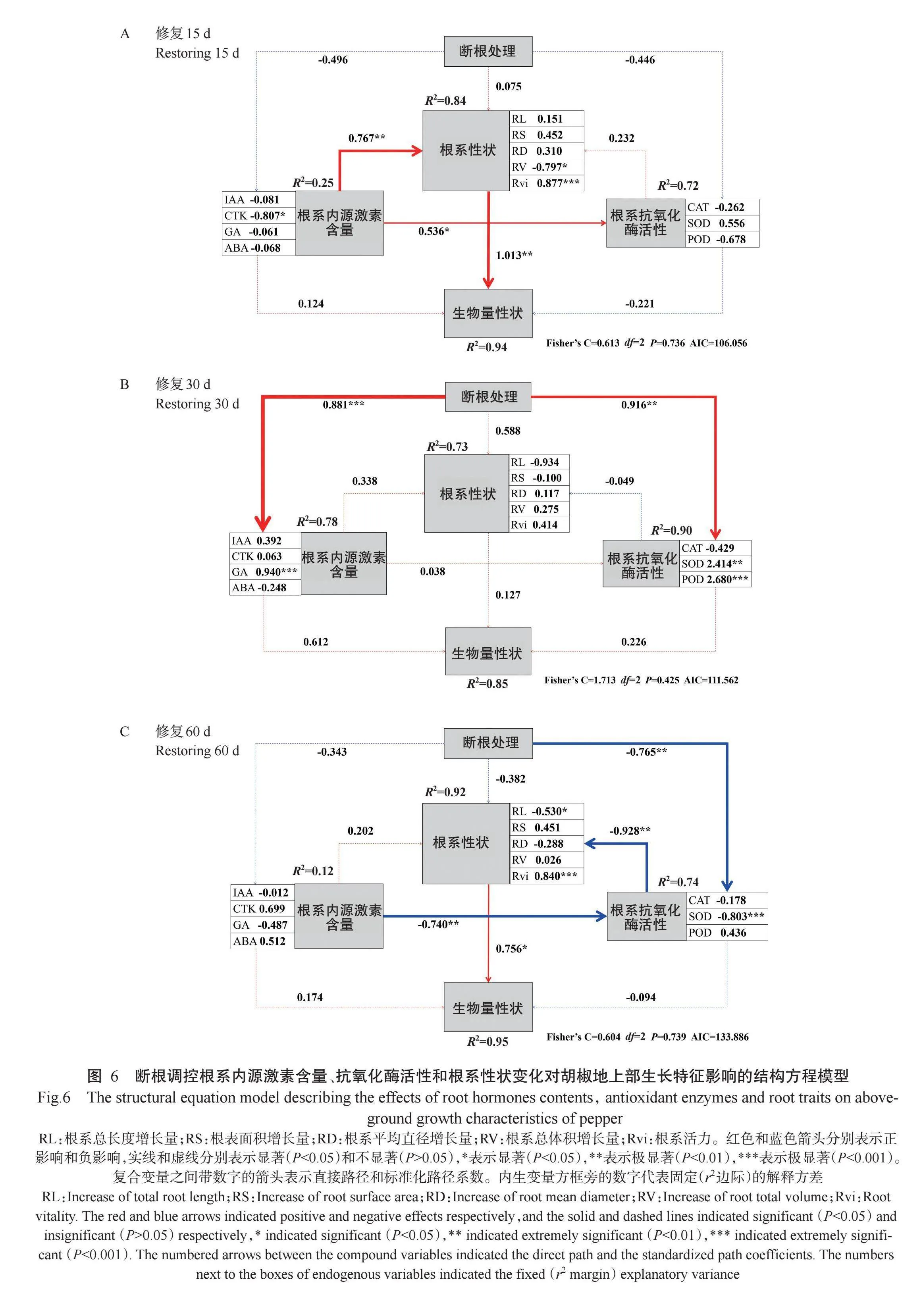
2. 4 断根后胡椒根系形态和生理指标与生长量关系的结构方程模型
利用结构方程模型(SEM)分析断根处理对植物地上部性状影响的综合影响路径,结果如图6所示。断根处理通过影响根系内源激素含量、抗氧化酶活性和根系性状间接影响生物量性状,但不同修复时间下的影响指标和路径存在差异。断根后15 d,模型(Fisher’s C=0.613,AIC=106.056)解释了地上部生物量性状94%的变异。此时,根系内源激素含量对抗氧化酶活性和根系性状有直接、显著或极显著(Plt;0.01)的正向影响,且根系性状极显著(Plt;0.01)并正向影响生物量性状。断根后30 d,模型(Fisher’s C=1.713,AIC=111.562)解释了地上部生物量性状85%的变异。断根处理对根系内源激素含量和抗氧化酶活性有直接和极显著(Plt;0.001、Plt;0.01)的正向影响,断根处理对根系性状的直接作用以及根系内源激素含量、抗物化酶活性和根系性状对地上部生物量性状的正向影响均不显著,根系抗氧化酶活性对根系性状有负向影响。断根后60 d时,模型(Fisher’s C=0.604,AIC=133.886)解释了地上部性状95%的变异。断根处理和根系内源激素含量对根系抗氧化酶活性、根系抗氧化酶活性对根系性状均有负向的极显著(Plt;0.01)影响,标志着此时修复已完成,根系性状对地上部性状有显著的正向作用。由图6还可看出,断根后15和30 d,内源激素GA和CTK对根系增长有促进作用,60 d时断根程度越高,抗氧化酶活性越低,抗氧化酶活性负向调控根系性状,根系性状正向调控生物量,促进植株完成修复。
3 讨论
本研究发现,不同断根程度均可使胡椒完成修复,但修复时间和修复程度存在差异,轻度断根、中度断根相对于重度断根可在较短时间内完成修复,甚至对胡椒生长有超补偿效应。胡椒根系应激反应优先于地上部,其中根系生理响应优先于根系形态,在根系内源激素和抗氧化酶共同调控下完成对根系形态的修复,进而对地上部产生补偿或超补偿效应。
3. 1 根系内源激素GA和CTK对根系生长修复的调控
轻度断根、中度断根和重度断根处理15 d时,植物根系GA含量显著增加,结构方程模型结果显示修复30 d时断根处理对GA有极显著正效应,因此,GA可能是胡椒根系抵御断根胁迫的关键物质,这与前人研究得出的GA影响植物根系生长发育的结果一致,但前人研究发现GA可促进根系分生区尺寸和细胞产率增加(Ubeda-Tomás et al.,2009),也可促进主根伸长(Fu and Harberd,2003;Ueguchi-Tanaka et al.,2007),还发现植物根系比茎对GA的敏感度高(Tanimoto,2012),并未得出GA促进根直径和根体积增加的结果。而本研究发现,断根修复30 d时,中度断根根系平均直径和总体积增长量高于CK,重度断根处理根系平均直径与CK无显著差异,结构方程模型分析结果也表明GA对根系直径和体积修复有间接促进作用,因此,推测胡椒根系通过上调GA含量响应断根胁迫,促进胡椒根系直径和体积的增加以实现修复。
重度断根处理15和30 d时,不仅根系GA含量显著增加,CTK含量也显著增加,结构方程模型结果显示15 d时CTK对根系性状及抗氧化酶活性均有显著或极显著正效应。IAA和CTK分别起促进细胞分裂和分化的作用,GA参与调节IAA/CTK的拮抗作用(Vanstraelen and Benková,2012),重度断根处理在修复15 d时IAA和CTK含量显著增加,但30 d时仅CTK含量显著增加,此时,可能GA调控CTK比例增加,使根系细胞向有利于促进根系修复的组织分化。结构方程模型分析结果显示内源激素含量增加有利于根系表面积的增加,因此,推测CTK可能使根细胞更多向细根分化,促进养分吸收和植株修复。
3. 2 根系抗氧化酶SOD和POD对根系生长修复的调控
本研究结果表明,断根修复15 d时,中度断根和重度断根的根系SOD和POD活性均显著高于CK,可能是根系内源激素正向调控根系抗氧化物酶启动修复,使其清除因断根胁迫增多的氧自由基。在前人关于水淹、UV-B等胁迫的研究中,发现SOD和POD防御系统启动(李彦杰等,2014;卢克欢等,2018),但调控防御系统启动的前端信号物质未进行说明。本研究中,断根修复30 d时,断根处理显著正向调控SOD和POD活性以抵御胁迫,但此时SOD活性并未显著增加,抵御胁迫的主要为POD。断根后60 d,3个断根处理的POD活性均显著高于CK,但此时断根处理负向调控根系抗氧化物酶活性,抗氧化物酶活性又负向调控根系性状,该路径标志着胡椒清除过量活性氧的自我调节过程可能已完成,通过降低抗氧化物酶活性、增加根系生长量以促进植株生长及修复。
根系作为吸收水分和养分、物质转化和合成的重要器官,也是许多内源激素与氨基酸合成的重要场所(Feng et al.,2022),发达的根系是作物生长发育和产量形成的基础(Zhang et al.,2023)。本研究发现,断根后,根系直径、长度、表面积和体积增长量在不同修复时期差异明显。断根后30 d,中度断根的根系平均直径和总体积增长量高于CK;60 d时中度断根的4个根系形态指标增长量均显著高于CK。说明最先对断根胁迫做出响应的根系形态指标为根系直径,直径增加促进了根系体积、根长和表面积的增加,通过根构型的调控,以适应外部环境变化(Mccormack et al.,2015;潘珠静等,2022),前期促进根系增长的是根系内源激素,后期断根处理负向调控根系抗氧化酶活性促进根系增长,进而促进胡椒生物量增加。
3. 3 根系生长修复对整株生物量恢复的调控
本研究发现,断根后30 d时胡椒鲜重增长量均显著高于CK,60 d时轻度断根和中度断根的鲜重增长量仍显著高于CK,这2种处理能实现修复并超越CK,而重度断根只能实现修复。对于株高,在根系修复60 d时,仅轻度断根显著增加了株高增长量。由此可见,断根修复30 d时已促进胡椒鲜重增加,此时株高并无显著增加,因此,断根后首先进行响应的为根系,可能与根系的应激反应(Geisler and Ferree,2011)、可塑性(Fanello et al.,2020)及根系为植物高效获取养分的主要组织有关(张德闪等,2017)。根系鲜重先增加,断根修复60 d时才促进地上部生物量增加,由此可见,根系自修复对于整株生物量的恢复有重要意义,自修复过程主要源于胡椒抗胁迫的生理调控和根系有效形态的增加。
4 结论
胡椒断根后的生长修复是生长和生理指标相互作用的结果。前期根系内源激素促进根系生长,或通过正向调控抗氧化酶活性而间接促进根系生长启动修复;后期断根处理和内源激素负向调控抗氧化酶活性,促进根系生长完成修复。轻度断根和中度断根对胡椒生长修复有补偿或超补偿效应,重度断根时效性较低,60 d时才完成修复。
参考文献((References)):
范军强,路晓明,王会文,武军艳,刘丽君,马骊,蒲媛媛,李学才,孙万仓. 2023. 低温胁迫下甘蓝型冬油菜抗寒性与叶片激素含量的关联性[J]. 江苏农业学报,39(1):15-21. [Fan J Q,Lu X M,Wang H W,Wu J Y,Liu L J,Ma L,Pu Y Y,Li X C,Sun W C. 2023. Association between cold resistance and leaf hormone content of Brassica napus L.under low temperature stress[J]. Jiangsu Journal of Agri‐cultural Sciences,39(1):15-21.] doi:10.3969/j.issn.1000-4440.2023.01.002.
冯锴,赵长星,王月福,陈安余,王铭伦. 2014. 断根深度对花生光合特性及干物质积累的影响[J]. 华北农学报,29(2):188-192.[ Feng K,Zhao C X,Wang Y F,Chen A Y,Wang M L. 2014. Effects of depth of root cutting on the photosynthetic characteristics and dry matter accumulation of peanut[J]. Acta Agriculturae Boreali-Sinica,29(2):188-192.]
何应会,蒋燚,刘菲,李娟,戴菱,王勇,黄荣林. 2016. 江南油杉切根移栽根系参数及其与生长的关系[J]. 中南林业科技大学学报,36(7):12-16.[ He Y H,Jiang Y,Liu F,Li J,Dai L,Wang Y,Huang R L. 2016. Root parameters and its relationship with growth of Keteleeria cyclolepis seedlings after bud-seedling root pruning transplanting[J]. Journal of Central South University of Forestry amp; Technology,36(7):12-16.] doi:10.14067/j.cnki.1673-923x.2016.07.003.
李彦杰,刘仁华,杨俊年,周大祥,秦洪文. 2014. 水淹胁迫下三峡库区野生狗牙根根系酶活性变化[J]. 水土保持研究,21(3):288-292.[ Li Y J,Liu R H,Yang J N,Zhou D X,Qin H W. 2014. Dynamics of enzyme activities of Cynodon Dactylon roots from hydro-fluctuation belt in the Three Gorges Reservoir area during flooding[J]. Research of Soil and Water Conservation,21(3):288-292.] doi:10. 13869/j.cnki.rswc.2014.03.055.
卢克欢,刘兴,杨怡,廖志华,吴能表. 2018. UV-B胁迫下Ca2+对颠茄生理特性与次生代谢产物的调控研究[J]. 作物学报,44(10):1527-1538.[ Lu K H,Liu X,Yang Y,Liao Z H,Wu N B. 2018. Effect of exogenous Ca2+ on physiologi‐cal characteristics and secondary metabolites accumulation of Atropa belladonna L. seedlings under UV-B stress[J]. Acta Agronomica Sinica,44(10):1527-1538.] doi:10. 3724/SP.J.1006.2018.01527.
罗忍忍,王瑞丹,曹磊,李丽丽,李翔,袁烨,晏家茹,侯娟,胡建斌. 2022. 植物生长调节剂对冷胁迫下甜瓜幼苗生理特性及相关基因表达的影响[J]. 河南农业大学学报,56(3):411-419.[ Luo R R,Wang R D,Cao L,Li L L,Li X,Yuan Y,Yan J R,Hou J,Hu J B. 2022. Effects of plant growth regulators on physiological characteristics and related gene expression in melon seedlings under cold stress[J]. Journal of Henan Agricultural University,56(3):411-419.] doi:10.16445/j.cnki.1000-2340.20220509.001.
吕丽华,马贞玉,梁双波,姚艳荣,贾秀领. 2016. 根修剪对小麦生长发育及水分利用的影响[J]. 华北农学报,31(S1):296-301.[ Lü L H,Ma Z R,Liang S B,Yao Y R,Jia X L. 2016. Effect of root pruning on growth development,water use efficiency for whea[t J]. Acta Agriculturae Boreali-Sinica,31(S1):296-301.] doi:10.3969/j.issn.1672-3317. 2003.02.001.
毛小涛,任立飞,白文明,张文浩. 2023. 断根对紫花苜蓿产量及根系形态的影响[J]. 草原与草坪,43(1):115-121.[ Mao X T,Ren L F,Bai W M,Zhang W H. 2023. Effect of ti-lling on yield and root morphology of alfalfa[J]. Grassland and Turf,43(1):115-121.] doi:10.13817/j.cnki.cyycp.2023.01.015.
潘珠静,郭丽丽,许涛,史锋厚,沈永宝. 2022. 芽苗切根对南京椴苗木根系生物量及根构型的影响[J]. 中南林业科技大学学报,42(9):63-70.[ Pan Z J,Guo L L,Xu T,Shi F H,Shen Y B. 2022. Effects of root pruning of bud-seedlings on Tilia miqueliana root biomass and root archi‐tecture[J]. Journal of Central South University of Forestry amp; Technology,42(9):63-70.] doi:10.14067/j.cnki.1673-923x.2022.09.008.
王家妍,魏国余,韦铄星,蒋燚. 2019. 切根和生根剂处理对红锥幼苗生长的影响[J]. 广西林业科学,48(1):100-103. [Wang J Y,Wei G Y,Wei S X,Jiang Y. 2019. Effects of root cutting and growth regulator on seedling growth of Castanopsis hystrix[J]. Guangxi Forestry Science,48(1):100-103.] doi:10.19692/j.cnki.gfs.2019.01.018.
王斯妤,王璠,涂贵庆,李帮明,陈钱,陶慧慧,陈东元,金玲莉. 2022. 断根处理对猕猴桃生长势及果实品质的影响初探[J]. 中国果树,(2):365-377.[ Wang S Y,Wang F,Tu G Q,Li B M,Chen Q,Tao H H,Chen D Y,Jin L L. 2022. Effects of root-cutting on vegetative growth and fruit quality of kiwifruit[J]. China Fruits,(2):365-377.] doi:10.16626/j.cnki.issn1000-8047.2022.12.006.
邬华松,杨建峰,林丽云. 2009. 中国胡椒研究综述[J]. 中国农业科学,42(7):2469-2480.[ Wu H S,Yang J F,Lin L Y. 2009. A summary of pepper research in China[J]. Scientia Agricultura Sinica,42(7):2469-2480.] doi:10.3864/j.issn. 0578-1752.2009.07.027.
杨喜田,陈久美,唐妍,赵勇. 2011. 侧柏幼苗切根后根系内源激素含量的变化[J]. 河南农业大学学报,45(1):66-70. [Yang X T,Chen J M,Tang Y,Zhao Y. 2011. Changes of endogenous phytohormone contents in Platycladus orienta‐lis roots after root-cutting[J]. Journal of Henan Agricul‐tural University,45(1):66-70.] doi:10.16445/j.cnki.1000-2340.2011.01.023.
张德闪,李洪波,申建波. 2017. 集约化互作体系植物根系高效获取土壤养分的策略与机制[J]. 植物营养与肥料学报,23(6):1547-1555.[ Zhang D S,Li H B,Shen J B. 2017. Strategies for root’s foraging and acquiring soil nutrient in high efficiency under intensive cropping systems[J]. Jour‐nal of Plant Nutrition and Fertilizer,23(6):1547-1555.] doi:10.11674/zwyf.17238.
赵正杰,祖超,李志刚,王灿,张大英,骆翼文,何倩,马楠,郑维全,邬华松,杨建峰. 2021. 机械施肥对胡椒光合特性及产量的影响[J]. 中国热带农业,(2):65-71.[ Zhao Z J,Zu C,Li Z G,Wang C,Zhang D Y,Luo Y W,He Q,Ma N,Zheng W Q,Wu H S,Yang J F. 2021. Effects of mechanical fertilization on photosynthetic characteristics and yield of Pepper nigrum L[. J]. China Tropical Agricul‐ture,(2):65-71.] doi:10.3969/j.issn.1673-0658.2021.02.012.
郑维全,杨建峰,鱼欢,李志刚,祖超,王灿,桑利伟,刘爱勤. 2017. 我国胡椒产业现状与创新发展探析[J]. 热带农业科学,37(12):102-108.[ Zheng W Q,Yang J F,Yu H,Li Z G,Zu C,Wang C,Sang L W,Liu A Q. 2017. Present sta‐tus and innovation development of black pepper industry in China[J]. Chinese Journal of Tropical Agriculture,37(12):102-108.] doi:10.12008/j.issn.1009-2196.2017.12.020.
Dodd I C. 2003. Hormonal interactions and stomatal responses[J]. Journal of Plant Growth Regulation,22:32-46. doi:10.1007/s00344-003-0023-x.
Fanello D D,Kelly S J,Bartoli C G,Cano M G,Alonso S M,Guiamet J J. 2020. Plasticity of root growth and respira‐tory activity:Root responses to above-ground senescence,fruit removal or partial root pruning in soybean[J]. Plant Science,290:110296. doi:10.1016/j.plantsci.2019.110296.
Feng Z P,Kong D L,Kong Y H,Zhang B H,Yang X T. 2022. Coordination of root growth with root morphology,physio-logy and defense functions in response to root pruning in Platycladus orientalis[J]. Journal of Advanced Research,36:187-199. doi:10.1016/j.jare.2021.07.005.
Fu X D,Harberd N P. 2003. Auxin promotes Arabidopsis root growth by modulating gibberellin response[J]. Nature,421:740-743. doi:10.1038/nature01387.
Geisler D,Ferree D C. 2011. Response of plants to root pruning[J]. Horticultural Reviews,6:155-188. doi:10.1002/9781 118060797.ch5.
Gong Z Z,Xiong L M,Shi H Z,Yang S H,Herrera-Estrella L R,Xu G H,Chao D Y,Li J R,Wang P Y,Qin F,Li J J,Ding Y L,Shi Y T,Wang Y,Yang Y Q,Guo Y,Zhu J K. 2020. Plant abiotic stress response and nutrient use effi‐ciency[J]. Science China Life Science,63:635-674. doi:10.1007/s11427-020-1683-x.
Hodge A,Berta G,Doussan C,Merchan F,Crespi M. 2009. Plant root growth,architecture and function[J]. Plant and Soil,321:153-187. doi:10.1007/s11104-009-9929-9.
Hu C L,Sadras V O,Lu G Y,Zhang R Z,Yang X Y,Zhang S L. 2019. Root pruning enhances wheat yield,harvest index and water-use efficiency in semiarid area[J]. Field Crops Research,230:62-71. doi:10.1016/j.fcr.2018.10.013.
Lehmann J. 2003. Subsoil root activity in tree-based cropping systems[J]. Plant amp; Soil,255:319-331.
Mccormack M L,Dickie I A,Eissenstat D M,Fahey T J,Fer‐nandez C W,Guo D L,Helmisaari H S,Hobbie E A,Iversen C M,Jackson R B,Leppälammi-Kujansuu J,Norby R J,Phillips R P,Pregitzer K S,Pritchard S G,Rewald B,Zadworny M. 2015. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes[J]. New Phytologist,207
(3):505-518. doi:10.1111/nph.13363.
Omulo G,Birner R,Köller K,Simunji S,Daum T. 2022. Com‐parison of mechanized conservation agriculture and con‐ventional tillage in Zambia:A short-term agronomic and economic analysi[s J]. Soil amp; Tillage Research,221:105414. doi:10.1016/j.still.2022.105414.
Ren C C,Zhou X Y,Wang C,Guo Y L,Diao Y,Shen S S,Reis S,Li W Y,Xu J M,Gu B J. 2023. Ageing threatens sustaina-bility of smallholder farming in Chin[a J]. Nature,616:96-103. doi:10.1038/s41586-023-05738-w.
Rowe J H,Topping J F,Liu J L,Lindsey K. 2016. Abscisic acid regulates root growth under osmotic stress conditions via an interacting hormonal network with cytokinin,ethylene and auxin[J]. New Phytologist,211(1):225-239. doi:10. 1111/nph.13882.
Tanimoto E. 2012. Tall or short?Slender or thick?A plant stra-tegy for regulating elongation growth of roots by low con‐centrations of gibberellin[J]. Annal Botany,110(2):373-381. doi:10.1093/aob/mcs049.
Ubeda-Tomás S,Federici F,Casimiro I,Beemster G T S,Bhal‐erao R,Swarup R,Doerner P,Haseloff J,Bennett M J. 2009. Gibberellin signaling in the endodermis controls Ara‐bidopsis root meristem size[J]. Current Biology,19(14):1194-1199. doi:10.1016/j.cub.2009.06.023.
Ueguchi-Tanaka M,Nakajima M,Katoh E,Ohmiya H,Asano K,Saji S,Xiang H Y,Ashikari M,Kitano H,Yamaguchi I,Matsuoka M. 2007. Molecular interactions of a soluble gib‐berellin receptor,GID1,with a rice DELLA protein,SLR1,and gibberellin[J]. Plant Cell,19(7):2140-2155. doi:10.1105/tpc.106.043729.
Vanstraelen M,Benková E. 2012. Hormonal interactions in the regulation of plant developmen[t J]. Annual Review of Cell and Developmental Biology,28:463-487. doi:10.1146/annurev-cellbio-101011-155741.
Xu D Y,Miao J H,Yumoto E,Yokota T,Asahina M,Watahiki M. 2017. YUCCA9-mediated auxin biosynthesis and polar auxin transport synergistically regulate regeneration of root systems following root cutting[J]. Plant amp; Cell Physiology,58(10):1710-1723. doi:10.1093/pcp/pcx107.
Yan M F,Zhang C,Li H B,Zhang L,Ren Y Y,Chen Y L,Cai H J,Zhang S Q. 2023. Root pruning improves maize water-use efficiency by root water absorption[J]. Frontiers in Plant Science,13:1023088. doi:10.3389/fpls.2022.1023088.
Yao C T,Zhang F W,Sun X,Shang D L,He F L,Li X D,Zhang J W,Jiang X Y. 2019. Effects of S-Abscisic Acid (S-ABA)on seed germination,seedling growth,and Asr1 gene expression under drought stress in maize[J]. Journal of Plant Growth Regulation,38(4):1300-1313. doi:10. 1007/s00344-019-09934-9.
Zhang K,Rengel Z,Zhang F S,White P J,Shen J B. 2023. Rhi‐zosphere engineering for sustainable crop production:Entropy-based insights[J]. Trends in Plant Science,28(4):390-398. doi:10.1016/j.tplants.2022.11.008.
(责任编辑 王晖)
