古樟树根腐病病原分离鉴定及室内防治药剂筛选
2024-02-09杨玉婷龙仪珂张紫嫣熊家辉黄华毅单体江







摘要:【目的】分离并鉴定粤北地区古樟树根腐病的病原菌,筛选出适宜的防治药剂,为樟树根腐病的识别和诊断以及病害防治提供理论依据。【方法】采用组织块分离法对采集自粤北地区的古樟树根部病部组织进行病原菌分离,依据柯赫氏法则确定致病菌,通过形态学和分子生物学相结合的方法鉴定病原菌种类,进一步采用菌丝生长速率法测定不同杀菌剂对病原菌的室内抑制效果。【结果】从古樟树根部病部组织中共分离出3株真菌,分别标记为SG0122-1、SG0122-2和SG0122-3,通过柯赫氏法则验证,确定菌株SG0122-1和SG0122-3是引起古樟树根腐病的病原菌;结合形态学观察和系统发育进化树分析,将菌株SG0122-1和SG0122-3分别鉴定为无量山射脉革菌(Phlebia wuliang‐shanensis)和少脉灵芝(Ganoderma subamboinense)。药剂筛选结果表明,不同供试杀菌剂对菌株SG0122-1和SG0122-3的菌丝生长抑制效果存在一定差异,其中氯氟醚·吡唑酯BAS 751 04F对菌株SG0122-1的抑制效果最强,在最低供试浓度下(3.91 μg/mL)能完全抑制其菌丝生长;其次是98%溴菌腈和96.8%苯醚甲环唑,抑制中浓度(EC50)分别为7.48和10.63 μg/mL;98%嘧菌酯和96.8%苯醚甲环唑对菌株SG0122-3菌丝生长有较好的抑制作用,其EC50分别为2.13和3.11 μg/mL,其次是97%吡唑醚菌酯和98%福美双,EC50分别为58.83和59.72 μg/mL。【结论】粤北地区古樟树根腐病病原为无量山射脉革菌和少脉灵芝。氯氟醚·吡唑酯BAS 751 04F、98%溴菌腈和96.8%苯醚甲环唑为防治无量山射脉革菌的有效药剂,98%嘧菌酯和96.8%苯醚甲环唑为防治少脉灵芝的有效药剂,其中96.8%苯醚甲环唑对2株病原菌均具有较好的抑制效果,以上药剂均可作为生产上防治樟树根腐病的候选药剂。
关键词:樟树;根腐病;病原菌;药剂筛选
中图分类号:S763.15 文献标志码:A 文章编号:2095-1191(2024)11-3311-13
Isolation and identification of root rot pathogens of ancient Cam⁃phora officinarum Nees ex Wall and fungicides indoor screening
YANG Yu-ting1, LONG Yi-ke1,2, ZHANG Zi-yan1, XIONG Jia-hui1,2 HUANG Hua-yi3*, SHAN Ti-jiang1,2*
(1College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou, Guangdong 510642, China; 2Guangdong Key Laboratory of Microbial Signals and Disease Control, Guangzhou, Guangdong 510642, China; 3Guangdong Academy of Forestry, Guangzhou, Guangdong 510620, China)
Abstract:【Objective】The pathogens that caused root rot of ancient Camphora officinarum Nees ex Wall trees in northern Guangdong were isolated and identified, and appropriate fungicides against Camphora officinarum root rot were screened. This study provided theoretical basis for the identification, diagnosis and prevention of root rot of ancient Cam‐phora officinarum.【 Method】The pathogens were isolated from the root tissues of ancient Camphora officinarum collected from northern Guangdong by tissue block separation method. The pathogen was indentified by Koch’s rule. The species of pathogens were identified by morphology and molecular biology, and the indoor inhibitory effect of different fungi‐cides on pathogen was determined by mycelium growth rate method. 【Result】Three different strains were isolated from the diseased root tissues of ancient Camphora officinarum, which were marked as SG0122-1, SG0122-2 and SG0122-3 respectively. Strains SG0122-1 and SG0122-3 were the pathogens causing the root rot of ancient Camphora officinarum af‐ter Koch’s rule verification. Combined with morphological observation and phylogentic tree analysis, stain SG0122-1 was identified as Phlebia wuliangshanensis and stain SG0122-3 was identified as Ganoderma subamboinense. The results of fungicide screening showed that there were some differences in the mycelium growth inhibition effects of different fun‐gicides on strain SG0122-1 and strain SG0122-3. Among them, chlorofluoroether · pyrazole ester BAS 751 04F had the strongest inhibitory effect on strain SG0122-1, and could completely inhibit the mycelium growth at the lowest test con‐centration( 3.91 μg/mL), followed by 98% bromothalonil and 96.8% difenoconazole, with median effect concentration (EC50) values of 7.48 and 10.63 μg/mL respectively. 98% azoxystrobin and 96.8% difenoconazole had good inhibitory ef‐fects on mycelium growth of strain SG0122-3, with EC50 values of 2.13 and 3.11 μg/mL respectively, followed by 97% pyraclostrobin and 98% thiram, with EC50 values of 58.83 and 59.72 μg/mL respectively. 【Conclusion】The pathogens causing ancient Camphora officinarum root rot in northern Guangdong are Phlebia wuliangshanensis and Ganoderma su-bamboinense. Chlorofluoroether · pyrazole ester BAS 751 04F, 98% bromothalonil and 96.8% difenoconazole are effec‐tive fungicides to control Phlebia wuliangshanensis, while 98% azoxystrobin and 96.8% difenoconazole are effective fungicides to control Ganoderma subamboinense. Among them, 96.8% difenoconazole has good inhibitory effect on the 2 pathogens, and the above agents can be used as candidate fungicides to control the root rot of ancient Camphora officina‐
rum in production.
Key words:Camphora officinarum Nees ex Wall; root rot; pathogen; fungicide screening
Foundation items:National Natural Science Foundation of China(32071766); China Agriculture Research System(CARS-21); Guangdong Forestry Science and Technology Innovation Projec(t 2020KJCX004)
0 引言
【研究意义】樟树(Camphora officinarum Nees ex Wall)又名香樟、小叶樟等,为樟科(Lauraceae)樟属(Camphora)常绿乔木,主要分布在我国长江以南地区,其树高冠大,寿命长久,四季常绿,具有独特的美学价值和文化内涵,是我国江西省和浙江省的省树以及37个地级市的市树(陈怡君,2021;邵久之等,2022;周泽敏,2022)。樟树树干挺拔、质地优良,是园林绿化和造林的主要树种(杨舒敏,2019)。此外,樟树中富含芳樟醇和天然冰片等化学成分,可用于香料、医疗、农药和化工等行业(Ma et al.,2021;胡珊等,2022;Sobhy et al.,2023)。而古樟树是樟树资源中的“活化石”,作为一种文化象征被不少地区人们所敬仰,承载着当地历史文化记忆和自然历史的发展,是重要的科学研究对象,具有较高的经济价值和文化价值(陈盼等,2023)。近年来,随着樟树种植规模的不断扩大,各种病害的发生也日趋严重,由于部分地区古树资源保护意识薄弱或对古树过度保护,造成许多古樟树死亡(单体江等,2014)。因此,探究古樟树病害及其适宜的防治药剂,对古樟树病害的防控以及古樟树资源的保护和利用具有重要意义。【前人研究进展】樟树在我国有着悠久的栽培历史,目前文献报道的樟树病害有21种,其中危害严重的有溃疡病、炭疽病、粉实病、白粉病和褐斑病等(单体江等,2014;王达,2022;王军,2022)。郭立中等(1995)、赵桂华(2009)研究发现,囊孢壳菌(Physa‐lospora sp.)和大茎点霉菌(Macrophoma aquilegiae)能引起樟树溃疡病;邓先琼和郭立中(2005)、Feng等(2023)研究发现,葡萄座腔菌(Botryosphaeria dothidea)侵染是引起湖南省和浙江省杭州市萧山区樟树树干溃疡病大暴发的病因;张晓阳等(2020)研究发现,小新壳梭孢(Neofusicoccum parvum)、可可毛色二孢(Lasiodiplodia theobromae)、假可可毛色二孢(Lasiodiplodia pseudotheobromae)和伊朗毛色二孢(Lasiodiplodia iranensis)4种真菌为福建省樟树溃疡病的致病菌;张海燕等(2023)确定了江西省樟树溃疡病的病原为葡萄座腔菌和小新壳梭孢,室内抗菌测试结果表明,98%多菌灵可湿性粉剂和95%已唑醇可湿性粉剂对2种病原菌的抑制效果最好;Gusella等(2023)从意大利樟树溃疡病组织中分离得到小新壳梭孢和新壳梭孢(Neofusicoccum luteum)。樟树褐斑病主要危害幼龄樟树枝干,病原菌为芒果球座菌(Guignardia mangiferae)(王明生等,2011)。樟树白绢病主要危害枝干,其病原为齐整小核菌(Sclerotium rolfsii),有性态为担子菌门罗耳伏革菌(Cortricium rolfsii)(赵丹阳等,2016)。樟树根腐病主要侵染幼树的根部,受害根系腐烂死亡且皮层出现大量白色菌丝体,其病原为樟疫霉(Phytophthora cinnamomi Rands)(周韦成,2019);Xiao等(2023)从安徽省出现樟树根腐病的病变组织中分离出30株真菌,通过柯赫氏法则、形态学和分子生物学技术确定其病原菌为钟器腐霉(Phytopythium vexans),精甲·噁霉灵对其抑制效果最佳。Liu等(2021)研究发现,樟树炭疽病的病原为松针刺盘孢菌(Colletotri‐chum fioriniae)和暹罗刺盘孢菌(Colletotrichum sia‐mense)。Li等(2022)首次报道在我国由Epicoccum poaceicola引起樟树叶斑病。【本研究切入点】在不同地区引起同种植物病害的病原可能不同,即使在同一地区其病原也可能不止一种。本课题组在前期调查中发现,一些樟树在生长过程中出现根腐症状,并严重危害樟树生长,同时还导致粤北地区一些古樟树死亡。目前已报道的樟树根腐病病原菌为樟疫霉和钟器腐霉,粤北地区古樟树的死亡是否由这2种病原菌引起有待确认,是否存在新的诱发樟树根腐病的病原菌值得进一步研究。【拟解决的关键问题】以粤北地区表现萎蔫症状的古樟树为研究对象,采集发病的组织材料,采用组织块分离法对病原菌进行分离,依据柯赫氏法则确定致病菌,通过形态学和分子生物学相结合的方法鉴定病原菌种类,进一步采用菌丝生长速率法测定不同杀菌剂对病原菌的室内抑制效果,以期筛选出对古樟树根腐病病原菌具有良好抑制作用的杀菌剂,为樟树根腐病的识别和诊断以及病害的防治提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 病株样品采集 古樟树患病根部组织于2021年1月22日采集自广东省韶关市,共8个样本,用无菌自封袋密封后立即送往实验室进行处理。
1. 1. 2 主要仪器 SW-CJ-2G型单人净化工作台(苏州净化设备有限公司);SN510C型高压蒸汽灭菌器(雅马拓科技有限公司);Exceed-Cd-10型艾科实验室超纯水机(成都唐氏康宁科技发展有限公司);YP5002型分析天平(上海佑科仪器仪表有限公司);LRH-250型生化培养箱(上海一恒科技有限公司);WP750型机械微波炉(顺德市格兰仕电器实业有限公司);JYC-19BE5型电磁灶(九阳股份有限公司);YJ-C-70和YJ-C-90型一次性塑料培养皿(南通百耀实验器材有限公司);HWS-12型电热恒温水浴锅(上海一恒科技有限公司);TGL-16B型离心机(上海安亭科学仪器厂);PTC-100TM型PCR扩增仪(Bio-Rad,美国);BA210型生物显微镜(麦克奥迪实业集团有限公司)。
1. 1. 3 主要试剂及药品 PreManTM Ultra Sample Preparation Reagen[t赛默飞世尔科技(中国)有限公司];2×Taq PCR MasterMix、ddH2O、引物(ITS4和ITS5、LSULROR和LSULR5)[生工生物工程(上海)股份有限公司];无水乙醇、二甲基亚砜(DMSO)、葡萄糖、琼脂、硫酸链霉素和升汞等。
供试杀菌剂原药:95%啶酰菌胺、96.8%苯醚甲环唑、97%嘧霉胺、97%吡唑醚菌酯、98%嘧菌酯、98%溴菌腈、98%福美双和98.4%多菌灵(中国农业科学院植物保护研究所廊坊农药厂);氯氟醚·吡唑酯BAS 751 04F(乳油型,100 g/L氯氟醚菌唑+ 140 g/L吡唑醚菌酯)(巴斯夫欧洲公司)。
1. 2 试验方法
1. 2. 1 病原菌分离与纯化 试验前先对采集的患病根部进行症状观察,记录相应特征。参照王喜刚等(2020)的方法分离樟树根腐病病原菌。将新鲜的病部组织用蒸馏水冲洗3~5 min,除去表面泥沙污物。洗净后将病健交界处用刀片切成2 mm厚的切片,根据木质疏松程度在超净工作台上用75%乙醇处理15~20 s,无菌水冲洗浸泡3次(1 min/次);用0.2%升汞处理1 min,无菌水冲洗3次(1 min/次);再将其剪成5 mm×5 mm的小块并放置在灭菌滤纸片上晾干,然后放置在含500 μg/mL硫酸链霉素的PDA培养基上,每皿3块呈正三角形放置,共选取72块组织块,接种24皿。用灭菌枪头吸取最后一次漂洗的无菌水200 μL滴加至空白PDA培养基中,置于25 ℃培养箱内暗培养,逐日观察是否有菌落长出,以检验表面消毒是否彻底。将接有组织块的培养皿倒置在25 ℃培养箱培养7~30 d,连续观察各组织块的变化,待菌丝长出后,用无菌牙签挑取菌落边缘生长旺盛的菌丝接种到另一个PDA培养基上,重复以上操作3次,待其菌丝生长至离培养皿(YJ-C-70型)边缘1/3~1/2时,根据菌落形态及颜色等差异判断菌种类别及纯度。第1次纯化前应先进行标注并统计每株菌的分离频率,将纯化后的菌株接种于5 mL冻存管PDA斜面培养基上,于4 ℃冰箱保存备用。每株菌的分离频率(CF)计算公式:
CF(%)=分离出真菌的组织块数/总组织块数×1001. 2. 2 病原菌致病性测定 采集健康的樟树枝条,以清水冲洗干净,用75%酒精棉球擦拭枝条表面,再用无菌水清洗3次。待其干燥后,用解剖针划伤枝条,在纯培养的菌株边缘用打孔器打取直径为6 mm的菌饼,接种在枝条的伤口处,以划伤接种PDA培养基的枝条为对照,每处理3次重复。将接种后的枝条置于提前铺好吸水纸并加入无菌水的培养皿中,用保鲜膜封口,放入生化培养箱保湿培养。每天对接种枝条进行观察,记录发病情况。从接种后发病枝条的病、健交界处进行病原菌的再分离鉴定,最终确定致病菌。
1. 2. 3 形态学鉴定 选取培养7~14 d且生长良好的待测菌株进行形态学鉴定,观察菌落形态及菌丝生长状态;用灭菌针挑取菌落边缘的新鲜菌丝制成临时玻片,用光学显微镜观察菌丝和孢子的形态特征,测量菌丝直径及孢子大小并拍照。结合菌丝和孢子形态对其进行性状描述,并参照《真菌鉴定手册》(魏景超,1979)及《植物病原真菌学》(陆家云,1997)对分离的病原菌进行形态学鉴定。
1. 2. 4 分子生物学鉴定 选取培养3~5 d的待测菌株进行分子鉴定。挑取新鲜菌丝至1.5 mL灭菌离心管(含50 μL PreManTM Ultra sample Preparation Reagent),100 ℃水浴10 min,13000 r/min离心3 min,获得真菌DNA模板。
PCR扩增与检测:采用通用引物ITS4/ITS5(ITS4:5'-TCCTCCGCTTATTGATATGC-3';ITS5:5'- GGAAGTAAAAGTCGTAACAAGG-3')扩增真菌核糖体内转录间隔区(ITS)基因片段;采用引物LSULROR/LSULR5(LSULROR:5'-ACCCGCTGAA CTTAAGC-3';LSULR5:5'-TCCTGAGGGAAACTT CG-3')扩增核糖体大亚基(LSU)基因片段(Wang et al.,2023)。PCR反应体系25.0 µL:2×Taq PCR Master‐Mix 12.0 µL,DNA模板1.0 µL,上、下游引物各0.5 µL,ddH2O 11.0 µL。扩增程序:95 ℃预变性4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,进行34个循环;72 ℃延伸10 min;12 ℃保存。PCR扩增产物由生工生物工程(上海)股份有限公司进行双向测序。得到基因序列后,采用DNAMAN软件拼接成完整序列,采用BLAST将完整序列在GenBank数据库中进行同源性检索,下载与其相似度较高的序列及其近缘属的序列,将其与参考菌株的序列按照ITS和LSU的顺序依次拼接(表1),运用MAFTT version 7进行序列处理后,使用MEGA 7.0.26,基于最大似然法(Maximum likelihood,ML)构建系统发育进化树,Bootstrap值设为1000次,模式为Genral Time Rever-sible Modle。
1. 2. 5 不同杀菌剂对樟树根腐病病原菌的室内毒力测定 采用菌丝生长速率法测定不同杀菌剂对樟树根腐病病原菌的室内毒力(欧阳锦逵,2017)。分别称取97%嘧霉胺、96.8%苯醚甲环唑、98%溴菌腈、98%嘧菌酯、97%吡唑醚菌酯、98%福美双和95%啶酰菌胺12 mg,称取98.4%多菌灵6 mg,称取氯氟醚·吡唑酯BAS 751 04F 15 mg,分别用1 mL的30% DMSO进行溶解,并倍半稀释成8个不同的浓度(98%嘧菌酯、96.8%苯醚甲环唑、97%嘧霉胺、97%吡唑醚菌酯、98%溴菌腈、98%福美双和95%啶酰菌胺初始浓度为12000 μg/mL;98.4%多菌灵初始浓度为6000 μg/mL;氯氟醚·吡唑酯BAS 751 04F初始浓度为15000 μg/mL)。将配制好的不同浓度药剂各取1 mL加入已灭菌且冷却至60 ℃的PDA培养基中,PDA培养基均为每瓶29 mL。贴壁摇晃,充分摇匀后倒入3个培养皿(YJ-C-90型)中,每皿约10 mL,制成含药培养基。其中98%嘧菌酯、96.8%苯醚甲环唑、97%嘧霉胺、97%吡唑醚菌酯、98%溴菌腈、98%福美双和95%啶酰菌胺终浓度为400、200、100、50、25、12.5、6.25和3.125 μg/mL;98.4%多菌灵终浓度为200、100、50、25、12.5、6.25、3.125和1.5625 μg/mL;氯氟醚·吡唑酯BAS 751 04F终浓度为500、250、125、62.5、31.25、15.625、7.8125和3.90625 μg/mL。
用打孔器将培养5 d且生长良好的待测菌株边缘打成若干个直径为6 mm的菌饼,将菌饼有菌丝面朝下接种于各含药PDA培养基中央,以含30% DMSO的PDA培养基为阴性对照,以含无菌水的培养基为空白对照,每处理3次重复。将其放置于28 ℃培养箱内培养,待空白对照中的菌落生长至培养皿面积的2/3左右,采用十字交叉法测量不同药剂处理的菌落直径,计算抑菌率。
抑菌率(%)=(阴性对照菌落纯生长量-处理菌
落纯生长量)/阴性对照菌落纯生长 量×100
纯生长量=菌落平均直径-菌饼直径
计算不同浓度下的抑菌率,选取其中5个浓度,以杀菌剂浓度的对数值为横坐标、抑菌率的生物统计几率值为纵坐标,在Origin 2018中进行数据处理,得到毒力回归方程和回归系数,同时计算抑制中浓度(EC50),根据各杀菌剂有效成分含量计算有效成分中的EC50,比较不同杀菌剂的相对抑制效果。利用GraphPad Prism 8.0对室内毒力测定的试验数据进行单因素方差分析及差异显著性检验(Turkey法)。
2 结果与分析
2. 1 樟树根腐病发病症状
古樟树感病后长势衰弱,叶片萎蔫似青枯状,但枝叶及树干无病征(图1-A)。将根部挖开后,可见树根颜色褐变,部分组织有明显的白色菌丝层(图1-B和图1-C)。古樟树一旦表现发病症状后很快死亡,目前尚无有效的防治措施。
2. 2 樟树根腐病病原菌的分离和致病性测定结果
采用组织块分离法从古樟树发病根部组织中分离病原菌,经过形态学观察合并相同菌株后得到3株形态各异的真菌菌株,分别标记为SG0122-1、SG0122-2和SG0122-3,其中菌株SG0122-3的分离频率最高,为56.00%,菌株SG0122-1和SG0122-2的分离频率分别为29.30%和32.00%。采用针刺法将3株菌株分别接种到离体健康的樟树枝条上,接种3 d后,发现接种菌株SG0122-1和SG0122-3的枝条接种处出现褐色病斑(图2-B和图2-D),接种菌株SG0122-1的枝条病斑颜色深且直径大于接种菌株SG0122-3的枝条,说明菌株SG0122-1的致病性强于菌株SG0122-3,并从病斑上再次分离到与接种菌株形态一致的病原菌;而对照(图2-A)和接种菌株SG0122-2(图2-C)的樟树枝条未发病。由此确定菌株SG0122-1和SG0122-3是引起古樟树根腐病的病原菌。
2. 3 病原菌形态学鉴定结果
菌株SG0122-1在PDA培养基上生长较快,培养3~5 d后菌丝布满培养皿。菌落为白色圆形,边缘规整,生长初期气生菌丝稀疏,贴壁生长,后期稠白浓密,菌丝聚集并分泌出淡黄色水滴状物质;菌丝有隔、薄壁、分支,直径为4.23~5.72 μm,分生孢子单孢,透明,近圆形,多数孢子表面略粗糙,大小为9.65~12.68 μm×9.42~11.44 μm(图3-A、图3-B和图3-C),与Huang等(2020)描述的射脉菌属(Phlebia sp.)一致,故将菌株SG0122-1初步鉴定为射脉菌属。
菌株SG0122-2的生长速度很快,培养1~3 d可布满整个培养皿。菌落为米白色不规则圆形,边缘毛绒状,背面中部可见明显的放射状条纹,边缘不规整;气生菌丝直立生长顶至皿盖,菌丝无色有隔,分支,直径3.68~11.19 μm,分生孢子梗顶端着生分生孢子头,分生孢子无色,单孢,圆形,表面有刺状突起,大小为7.37~12.94 μm×6.38~11.13 μm(图3-D、图3-E和图3-F),与赵军等(2006)、王安娇(2010)描述的小克银汉霉属(Cunninghamella sp.)一致,故将菌株SG0122-2初步鉴定为小克银汉霉属。
菌株SG0122-3的生长速度较慢,培养7 d后方可布满培养皿。菌落颜色为白色圆形,边缘规整,背面中部可见菌丝呈放射状向外延伸;气生菌丝呈绒毛状,生长后期菌落表面可见一层粉状物,略带有淡黄色至黄色斑点或斑块;菌丝有隔,分支,直径4.21~5.01 μm,厚垣孢子单孢,无色,厚壁,圆形或椭圆形至近圆形,表面粗糙,大小为10.27~16.35 μm×8.18~18.94 μm(图3-G、图3-H和图3-I),与Stéphane和Régis(2010)描述的灵芝属(Ganoderma sp.)一致,故将菌株SG0122-3初步鉴定为灵芝属。
2. 4 分子生物学鉴定结果
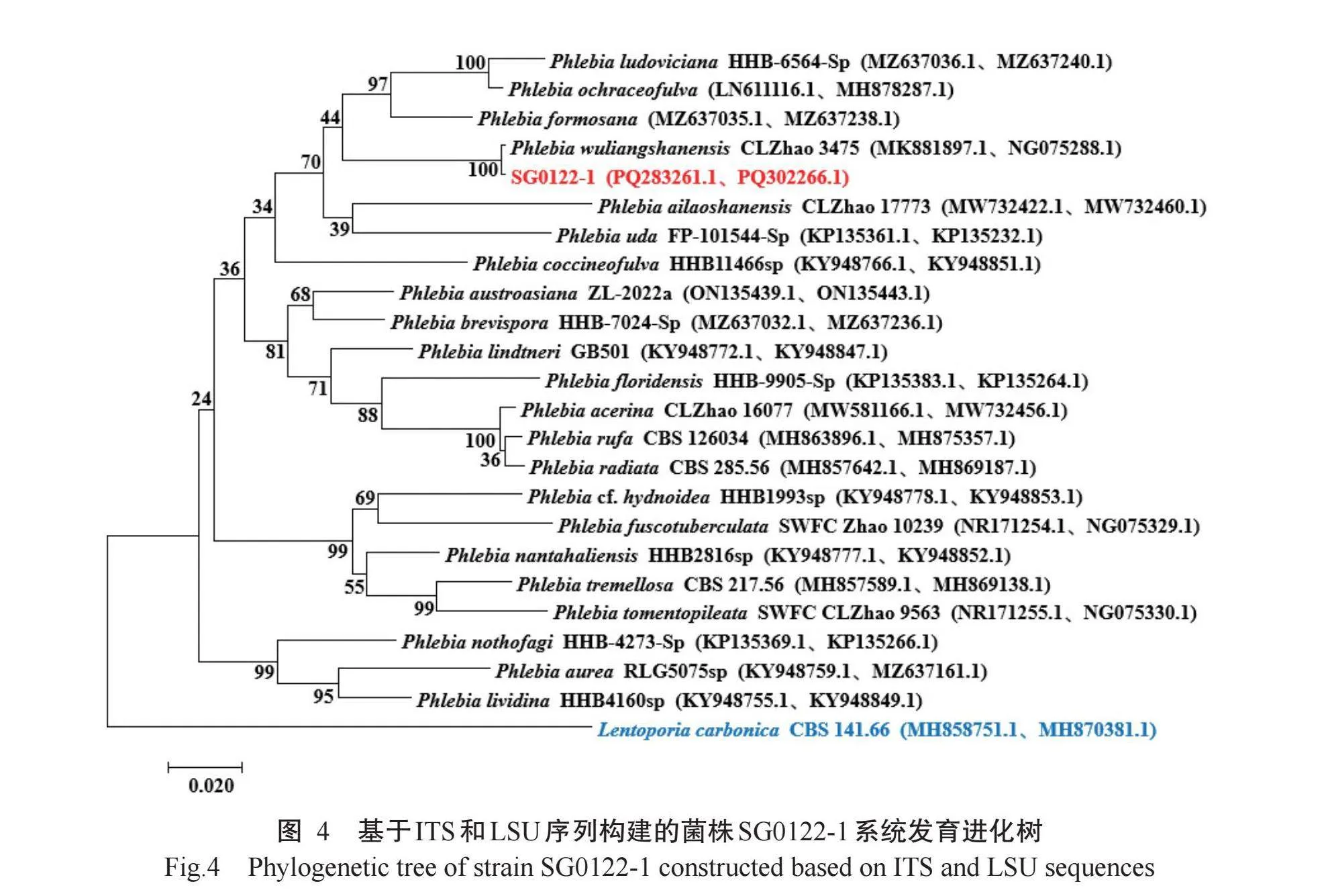
在GenBank数据库中进行同源性比对,采用最大似然法通过MEGA 7.0.26构建系统发育进化树。基于ITS和LSU序列(登录号PQ283261.1和PQ302266.1)构建的菌株SG0122-1系统发育进化树(图4)显示,菌株SG0122-1与无量山射脉革菌(Phlebia wuliang‐shanensis)(菌株登录号MK881897.1和NG075288.1)聚类在同一个分支上,序列相似性为99.56%,确定菌株SG0122-1隶属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)射脉菌属(Phlebia)真菌。基于ITS和LSU序列(登录号PQ283262.1和PQ302267.1)构建的菌株SG0122-2系统发育进化树(图5)显示,菌株SG0122-2与短刺小克银汉霉(Cunninghamella blakesleeana)(登录号NR119974.1和MH866397.1)聚类在同一个分支上,序列相似性为97.11%,确定菌株SG0122-2隶属于毛霉门(Mucoromycota)毛霉纲(Mucoromycetes)毛霉科(Mucorales)小克银汉霉属(Cunninghamella)真菌。基于ITS和LSU序列(登录号PQ283263.1和PQ302268.1)构建的菌株SG0122-3系统发育进化树(图6)显示,菌株SG0122-3与少脉灵芝(Ganoderma subamboinense)(登录号KU569546.1和KU570945.1)聚类在同一个分支上,序列相似性为99.10%,确定菌株SG0122-3隶属于担子菌门(Basidiomycete)层菌纲(Hymenomycetes)多孔菌目(Polyporales)灵芝科(Ganodermataceae)灵芝属(Ganoderma)真菌。
2. 5 不同杀菌剂对樟树根腐病病原菌的室内毒力测定结果
对菌株SG0122-1和SG0122-3进行杀菌剂室内毒力测定。从表2可看出,除95%啶酰菌胺外,其余供试杀菌剂对菌株SG0122-1或SG0122-3菌丝生长均具有一定的抑制作用,其中,98%嘧菌酯、97%吡唑醚菌酯和96.8%苯醚甲环唑对2株病原菌均具有抑制作用;97%嘧霉胺和98%溴菌腈仅对菌株SG0122-1具有抑制效果,而98%福美双和98.4%多菌灵仅对菌株SG0122-3表现出抑制作用。菌株SG0122-1对氯氟醚·吡唑酯BAS 751 04F最敏感,在最低供试浓度下(3.91 μg/mL)能完全抑制其菌丝生长;对98%溴菌腈和96.8%苯醚甲环唑也十分敏感,EC50分别为7.48和10.63 μg/mL;97%嘧霉胺、97%吡唑醚菌酯和98%嘧菌酯对菌株SG0122-1的毒力稍低,EC50分别为65.00、117.63和124.50 μg/mL。98%嘧菌酯和96.8%苯醚甲环唑对菌株SG0122-3的抑制效果最好,EC50分别为2.13和3.11 μg/mL;其次是97%吡唑醚菌酯和98%福美双,其EC50分别为58.83和59.72 μg/mL;98.4%多菌灵对菌株SG0122-3的毒力最低,EC50为167.56 μg/mL。
3 讨论
樟树是重要的园林绿化和用材树种,在我国分布广泛,但由于栽培方式单一及栽培环境恶化,其病害发生较多(石燕香等,2021)。目前文献报道的樟树病害共有21种,已知病原多达39种,如樟盘长孢(Colletorichum cinnamomi)、壳囊孢(Cytosporella cinnamomi)、葡萄座腔菌、可可毛色二孢和小蓟叶点霉(Phyllosticta cirsii)等(单体江等,2021),而本研究中报道的3株真菌均是首次从古樟树根部病部组织中分离得到。致病性测定结果表明,菌株SG0122-1和SG0122-3对樟树枝条表现出一定的致病作用,而菌株SG0122-2未表现出致病性,这与前人的报道一致。短刺小克银汉霉与其所在的属是一类极具潜力的微生物转化菌株,可对现有药物进行生物转化以增强活性、降低毒性或成为新化合物(Ye et al.,2023),同时,因其具有与哺乳动物相似的药物代谢方式而成为极佳的药物生物转化和代谢的体外模型(Song et al.,2023);目前尚无该属真菌能引起植物病害的报道,而其所属毛霉菌科的其他真菌可引发各类动植物多种疾病,如红花芍药褐斑病(钱永生等,2015)、乌榄腐烂病(郭艳峰,2016)及草莓根腐病(高旭利等,2023)等。菌株SG0122-1所属的射脉菌属真菌多存在于腐烂木材上,大多具有分解生物质的能力,如白腐菌(Phlebia brevispora)能引起黄杉木材腐烂(Erwin,2017;Zhao et al.,2023),从野生橡胶树木材上分离到的脉射菌(Phlebia radiata)可引发显著的木材细胞壁降解(Simeto et al.,2023),胶质射脉革菌(Phlebia tremellosa)降解木质纤维素的效率显著高于黄孢原毛平革菌(Phanerochaete chryso‐sporium)和云芝(Coriolus versicolor)等真菌(郭洋等,2021)。无量山射脉革菌是我国新发现的一种白腐菌,最先从云南省荆东县五梁山国家自然保护区被子植物腐烂的主干上分离得到(Huang et al.,2020)。菌株SG0122-3所属的灵芝属真菌的子实体通常具有食用或药用价值,但该属中的一些种可引起树木的茎基腐烂,如橡胶树灵芝(Ganoderma pseudoferreum)是巴西橡胶人工林的致病菌(Rachael et al.,2015),南方灵芝(Ganoderma australe)、环带灵芝(Ganoderma zonatum)、狭长孢灵芝(Ganoderma boninense)、赤灵芝(Ganoderma lucidum)分别引起海南橡胶树茎腐病(胡真臻等,2021)、棕榈茎基腐病(Braham and Seemanti,2023;Darwana et al.,2023)、油棕基底茎腐病(Khoo and Chong,2023)和椰子茎
基腐病(Surulirajan et al.,2023)等。
本研究结果表明,96.8%苯醚甲环唑在实验室条件下对菌株SG0122-1和SG0122-3均具有较好的抑制效果。苯醚甲环唑是一种广谱杀菌剂,对子囊菌、担子菌和半知菌引起的植物病害具有一定的防治效果(贤小勇等,2021;吴娥娇等,2023)。氯氟醚·吡唑酯BAS 751 04F是由巴斯夫欧洲公司开发的一种新型杀菌剂,其主要成分为氯氟醚菌唑和吡唑醚菌酯,其中氯氟醚菌唑属于内吸性异丙醇三唑类杀菌剂,通过阻止病原真菌代谢过程中麦角甾醇的生物合成、破坏细胞膜的结构和功能,从而抑制病原菌的生长达到杀菌目的(刘鹏飞等,2020);而吡唑醚菌酯是甲氧基丙烯酸酯类杀菌剂,其杀菌作用是通过抑制线粒体呼吸作用中的细胞色素间的电子传递,导致细胞死亡(罗跃等,2022)。氯氟醚·吡唑酯BAS 751 04和吡唑醚菌酯均具有保护和治疗作用,应用范围广,尤其是在复配后具有明显的增效作用(刘冰卿等,2023),本研究结果与之一致。溴菌腈作为广谱性杀菌剂,通过干扰菌体细胞的正常发育达到抑菌作用,对苎麻根褐腐病菌(陈奕坤等,2020)等具有较好的抑制作用。嘧菌酯和吡唑醚菌酯为同一类型杀菌剂,对担子菌和子囊菌等具有良好的保护和治疗作用(霍建飞等,2019),但在本研究中嘧菌酯和吡唑醚菌酯对菌株SG0122-3虽然均有抑制作用,抑制效果却相差很大,可能与测定方法以及原药纯度等有一定相关性。菌丝生长速率法测定的是杀菌剂与病原菌菌丝直接接触时产生的效果,但不同杀菌剂的作用机理不同,且作用效果还受到杀菌剂的特效性及寄主生长环境和气候等因素影响(宋慧云等,2019)。因此,在后续研究中,可进一步测定药剂对致病菌分生孢子萌发的抑制作用及其林间药效,同时测定相关药剂的残留量,从而为古樟树根腐病的科学防控提供理论依据。
4 结论
采用组织块分离法从古樟树根腐病病部组织中分离得到3株真菌,其中,无量山射脉革菌(SG0122-1)和少脉灵芝(SG0122-3)为古樟树根腐病的病原菌。室内毒力测定结果表明,氯氟醚·吡唑酯BAS 751 04F、98%溴菌腈和96.8%苯醚甲环唑为防治无量山射脉革菌的有效药剂,98%嘧菌酯和96.8%苯醚甲环唑为防治少脉灵芝的有效药剂,其中96.8%苯醚甲环唑对2株病原菌均具有较好的抑制效果,以上药剂可作为田间防治樟树根腐病的候选药剂。
参考文献((References)):
陈奕坤,王吐虹,翟杨,程毅,高春生,余永廷. 2020. 苎麻根褐腐病防治药剂的室内筛选[J]. 中国麻业科学,42(5):203-208.[ Chen Y K,Wang T H,Zhai Y,Cheng Y,Gao C S,Yu Y T. 2020. Laboratory screening of fungicides for controlling brown root rot of ramie[J]. Plant Fiber Sciences in China,42(5):203-208.] doi:10.3969/j.issn.1671-3532. 2020.05.003.
陈盼,郭盛才,陈秋菊,谭志权,张红爱,邓东旺. 2023. 广东省古樟树资源特征及影响因子研究[J]. 林业与环境科学,39(5):72-79. [Chen P,Guo S C,Chen Q J,Tan Z Q,Zhang H A,Deng D W. 2023. Study on resource characte-ristics and impact factors of ancient camphor trees (Cam‐phora officinarum) in Guangdong Province[J]. Forestry and Environmental Science,39(5):72-79.] doi:10.3969/j.issn.1006-4427.2023.05.011.
陈怡君. 2021. 樟树文化研究[D]. 南昌:江西农业大学. [Chen Y J. 2021. Study on tree culture of Cinnamomum camphora[D]. Nanchang:Jiangxi Agricultural University.] doi:10.27177/d.cnki.gjxnu. 2021.000451.
邓先琼,郭立中. 2005. 樟树溃疡病病原菌再鉴定[J]. 湖南林业科技,(1):39-40.[ Deng X Q,Guo L Z. 2005. Pathogen identification of canker of Cinnamomum caphorn (L.) Presl[J]. Hunan Forestry Science amp; Technology,(1):39-
40.] doi:10.3969/j.issn.1003-5710.2005.01.011.
高旭利,李永腾,李朝霞,兰成云,马秀明,张敏,曲丽,张卫华. 2023. 山东省草莓根腐病病原菌Mucor irregularis的鉴定[J]. 植物病理学报,54(4):701-704.[ Gao X L,Li Y T,Li Z X,Lan C Y,Ma X M,Zhang M,Qu L,Zhang W H. 2023. Identification of the pathogen Mucor irregularis causing strawberry root rot in Shandong[J]. Acta Phyto‐pathologica Sinica,54(4):701-704.] doi:10.13926/j.cnki.apps.000836.
郭立中,邓先琼,韦石泉. 1995. 樟树的一种新病害——樟树溃疡病病原菌鉴定[J]. 植物病理学报,(1):28.[ Guo L Z,Deng X Q,Wei S Q. 1995. Identification on the fungal pathogen of the canker of camphor tree[J]. Acta Phyto‐pathologica Sinica,(1):28.]
郭洋,贾晨波,张彦雄,苏建宇,徐春燕. 2021. 胶质射脉革菌(Phlebia tremellosa)单核菌株的制备与单核体筛选[J]. 基因组学与应用生物学,40(2):656-662.[ Guo Y,Jia C B,Zhang Y X,Su J Y,Xu C Y. 2021. Screening and prepa‐ration of monokaryon of the basidiomycete fungus Phlebia tremellosa[J]. Genomics and Applied Biology,40(2):656-662.] doi:10.13417/j.gab.040.000656.
郭艳峰. 2016. 乌榄主要致病菌的分离纯化鉴定[J]. 广东化工,43(8):73-74.[ Guo Y F. 2016. Separation and purifica‐tion of pathogenic fungi on Canarium pimela[J]. Guang‐dong Chemical Industry,43(8):73-74.] doi:10.3969/j.issn. 1007-1865.2016.08.034.
胡珊,梁卫驱,黄皓,侯晨,陈杰连,徐匆,罗华建,连辉明,陈仕丽,谢佩吾. 2022. 不同化学型樟树精油的化学成分和抑菌效果研究[J]. 安徽农业科学,50(22):193-197.[ Hu S,Liang W Q,Huang H,Hou C,Chen J L,Xu C,Luo H J,Lian H M,Chen S L,Xie P W. 2022. Study on chemical composition and antifungal effect of different chemical types of Cinnamomum camphora essential oils[J]. Journal of Anhui Agricultural Sciences,50(22):193-197.] doi:0. 3969/j.issn.0517-6611.2022.22.048.
胡真臻,李增平,单金雪,张宇,熊秋雨,吴如慧. 2021. 橡胶树灵芝茎腐病病原菌鉴定及其生物学特性测定[J]. 热带作物学报,42(2):488-494. [Hu Z Z,Li Z P,Shan J X,Zhang Y,Xiong Q Y,Wu R H. 2021. Identification and biological characteristics of pathogen of Ganoderma cau-sing stem rot on Hevea brasiliensis[J]. Chinese Journal of Tropical Crops,42(2):488-494.] doi:10.3969/j.issn.1000-2561.2021.02.026.
霍建飞,郝永娟,杨秀荣,姚玉荣,孙淑琴,刘春艳,王万立. 2019. 番茄漆斑病病原鉴定及防治药剂室内活性筛选[J]. 西南农业学报,32(6):1296-1301.[ Huo J F,Hao Y J,Yang X R,Yao Y R,Sun S Q,Liu C Y,Wang W L. 2019. Identification of Myrothecium roridum from tomato and screening of fungicides against it in Tianjin[J]. Southwest China Journal of Agricultural Sciences,32(6):1296-1301.] doi:10.16213/j.cnki.scjas.2019.6.015.
刘冰卿,陈霞,凌金锋,崔一平,彭埃天,宋晓兵. 2023. 氯氟醚菌唑·吡唑醚菌酯对柑橘炭疽病的田间防治效果[J]. 热带农业科学,43(7):53-56.[ Liu B Q,Chen X,Ling J F,Cui Y P,Peng A T,Song X B. 2023. Evaluation of the field control effect of mefentrifluconazole · pyraclostrobin against citrus anthracnose[J]. Chinese Journal of Tropical Agriculture,43(7):53-56.] doi:10.12008/j.issn.1009-2196. 2023.07.008.
刘鹏飞,兰杰,李志念,关爱莹. 2020. 氯氟醚菌唑(Mefentri‐fluconazole)的合成及生物活性[J]. 农药,59(4):256-257.[ Liu P F, Lan J, Li Z N, Guan A Y. 2020. Synthesis and fungicidal activity research of mefentrifluconazole[J]. Agrochemicals,59(4):256-257.] doi:10.16820/j.cnki.1006-0413.2020.04.004.
陆家云. 1997. 植物病害诊断[M]. 第2版. 北京:中国农业出版社.[ Lu J Y. 1997. Plant disease diagnosis[M]. The 2ndEdition. Beijing:China Agriculture Press.]
罗跃,吴小毛,胡贤锋,姚小龙,刘旭东,韩磊. 2022. 吡唑醚菌酯的降解代谢及毒理研究进展[J]. 农业资源与环境学报,39(4):651-663.[ Luo Y,Wu X M,Hu X F,Yao X L,Liu X D,Han L. 2022. Research progress on pyraclos‐trobin degradation, metabolism, and toxicology[J]. Jour‐nal of Agricultural Resources and Environment,39(4):651-663.] doi:10.13254/j.jare.2021.0169.
欧阳锦逵,吴春银,王小晴,王松,伍慧熊,王军,单体江. 2017. 多蕊蛇菰不同提取物及其抑菌活性[J]. 热带农业科学,37(11):61-64.[ Ouyang J K,Wu C Y,Wang X Q,Wang S,Wu H X,Wang J,Shan T J. 2017. The crude extracts of Balaophora polyandra and their antimicrobial activities[J]. Chinese Journal of Tropical Agriculture,37(11):61-64.] doi:10.12008/j.issn.1009-2196.2017.11.012.
钱永生,蔡苏,马婉琴,楼钰函,倪炎栋,吴剑丙. 2015. 4种杀菌剂对红花芍药褐斑病的室内毒力[J]. 浙江农业科学,56(9):1454-1456.[ Qian Y S,Cai S,Ma W Q,Lou Y H,Ni Y D,Wu J B. 2015. Indoor toxicity of four fungi‐cides to Paeonia lactiflora‘ Honghua’ brown spot disease[J]. Journal of Zhejiang Agricutural Sciences,56(9):1454-1456.] doi:10.16178/j.issn.0528-9017.20150937.
单体江,冯皓,艾彩霞,孙思,王军. 2014. 樟树病害及其防治研究综述[J]. 湖南林业科技,41(4):75-77.[ Shan T J,Feng H,Ai C X,Sun S,Wang J. 2014. Review on diseases of Cinnamomum camphora( L.) Presl and their contro[l J]. Hunan Forestry Science amp; Technology,41(4):75-77.] doi:10.3969/j.issn.1003-5710.2014.04.018.
单体江,叶聪,冯冲,郑滢淋,林健洛,丁平. 2021. 肉桂、樟树和阴香病害及其综合防治研究进展[J]. 江苏农业科学,49(15):40-47.[ Shan T J,Ye C,Feng C,Zheng Y L,Lin J L,Ding P. 2021. Research progress on diseases and inte‐grated control of Cinnamomum cassia,Cinnamomum cam‐phora and Cinnamomum burman[iJ]. Jiangsu Agricultural Sciences,49(15):40-47.] doi:10.15889/j.issn.1002-1302. 2021.15.007.
邵久之,刘慧娜,陈向荣,郑佳寅,吴晓霞,陶竣,周福才. 2022. 樟树不同部位的挥发物对蔬菜烟粉虱寄主选择性的影响[J]. 上海农业科技,(2):115-117.[ Shao J Z,Liu H N,Chen X R,Zheng J Y,Wu X X,Tao J,Zhou F C. 2022. The influence of volatiles from different parts of Cin‐namomum camphora on host selection of vegetable Bemisia tabaci[J]. Shanghai Agriculutural Science and Technology,(2):115-117.] doi:10.3969/j.issn.1001-0106.2022.02.045.
石燕香,赵丹阳,秦长生,徐金柱,邱华龙,杨华,田龙艳. 2021. 广东省樟树枝干有害生物为害特点及防治[J]. 林业与环境科学,37(4):96-101.[ Shi Y X,Zhao D Y,Qin C S,Xu J Z,Qiu H L,Yang H,Tian L Y. 2021. Occurrence and control strategy of diseases and pests on Cinnamomum camphora branches in Guangdong Province[J]. Forestry and Environmental Science,37(4):96-101.] doi:10.3969/j.issn.1006-4427.2021.04.013.
宋慧云,段志豪,韦嘉怡,王军,毛子翎,单体江. 2019. 多穗柯炭疽病病原鉴定及其不同杀菌剂的室内毒力测定[J]. 南方农业学报,50(3):593-599.[ Song H Y,Duan Z H,Wei J Y,Wang J,Mao Z L,Shan T J. 2019. Pathogen identifica‐tion of Lithocarpus polystachyus Rehd. anthracnose and indoor toxicity measurement of different fungicides[J]. Journal of Southern Agriculture,50(3):593-599.] doi:10. 3969/j.issn.2095-1191.2019.03.21.
王安娇. 2010. 城市园林植物废弃枝叶分解利用研究[D]. 福州:福建农林大学.[ Wang A J. 2010. Studies decomposi‐tion and exploitation of landscape pruning wastes of city[D]. Fuzhou:Fujian Agriculture and Forestry University.]
王达. 2022. 昆山地区香樟树病虫害种类及其发生规律[J]. 浙江农业科学,63(4):779-782.[ Wang D. 2022. Occur‐rence regularity of main diseases and insect pests on Cin‐namomum camphora in Kunshan[J]. Journal of Zhejiang Agricutural Sciences,63(4):779-782.] doi:10.16178/j.issn.0528-9017.20212272.
王军. 2022. 安康市香樟树主要病虫害及其防治方法[J]. 南方农业,16(12):32-34. [Wang J. 2022. Main pests and diseases of Cinnamomum camphora and their control methods in Ankang City[J]. South China Agriculture,16(12):32-34.] doi:10.19415/j.cnki.1673-890x.2022.12.011.
王明生,吴小芹,丁晓磊,王焱,马凤林,叶建仁. 2011. 樟树褐斑病病原形态及分子鉴定[J]. 林业科技开发,25(1):63-65.[ Wang M S,Wu X Q,Ding X L,Wang Y,Ma F L,Ye J R. 2011. Morphological and molecular identification of brown spot of Cinnamomum caphora[J]. Journal of Fore-stry Engineering,25(1):63-65.] doi:10.3969/j.issn.1000-8101.2011.01.016.
王喜刚,杨波,郭成瑾,张丽荣,沈瑞清. 2020. 宁夏回族自治区马铃薯镰刀菌根腐病病原菌的分离鉴定与致病性测定[J]. 植物保护学报,47(3):609-619.[ Wang X G,Yang B,Guo C J,Zhang L R,Shen R Q. 2020. Identification and pathogenicity test of pathogens causing potato Fusarium root rot in Ningxia Hui Autonomous Region[J]. Journal of Plant Protection,47(3):609-619.] doi:10.13802/j.cnki.zwbhxb.2020.2019073.
魏景超. 1979. 真菌鉴定手册[M]. 上海:上海科学技术出版社. [Wei J C. 1979. Fungal identification manua[l M]. Shang‐hai:Shanghai Science and Technology Press.]
吴娥娇,郭文龙,王志伟,关玲,乔玉山,赵密珍.2023. 不同地域草莓拟盘多毛孢根腐病菌致病力差异及对苯醚甲环唑的敏感性[J]. 江苏农业学报,39(1):44-52.[ Wu E J,Guo W L,Wang Z W,Guan L,Qiao Y S,Zhao M Z. 2023. Virulence difference and sensitivity analysis to difenoconazole of Neopestalotiopsis clavispora crown rot pathogens isolated from strawberry plants of different areas in China[J]. Jiangsu Journal of Agricultural Sciences,
39(1):44-52.] doi:10.3969/j.issn.1000-4440.2023.01.006.贤小勇,朱桂宁,林珊宇,韦小妹,黎柳锋,韦艺,韦名壮,苏方贵,黄明金,韦爱娜. 2021. 吡唑醚菌酯与苯醚甲环唑对核桃炭疽病菌的联合毒力及林间防治效果[J]. 南方农业学报,52(6):1633-1640.[ Xian X Y,Zhu G N,Lin S Y,Wei X M,Li L F,Wei Y,Wei M Z,Su F G,Huang M J,Wei A N. 2021. Synergic toxicity and field effect of pyra‐clostrobin and difenoconazole against Colletotrichum gloeosporioides on walnut[J]. Journal of Southern Agri‐culture,52(6):1633-1640.] doi:10.3969/j.issn.2095-1191.2021.06.023.
杨舒敏. 2019. 桂林全州县古树资源特征分析及景观评价[D]. 南宁:广西大学. [Yang S M. 2019. Characteristic analysis and landscape evolution of ancient tree resources in Quanzhou County of Guilin[D]. Nanning:Guangxi University.]
张海燕,李达,李冬,张杰,赵姣,张北红,栾丰刚. 2023. 江西省樟树溃疡病病原鉴定与室内药剂筛选[J]. 生物灾害科学,46(3):271-279.[ Zhang H Y,Li D,Li D,Zhang J,Zhao J,Zhang B H,Luan F G. 2023. Identification of can‐ker disease pathogens on camphor trees and laboratory screening of fungicides in Jiangxi Province[J]. Biological Disaster Science,46(3):271-279.] doi:10.3969/j.issn.2095-3704.2023.03.43.
张晓阳,吴松,王美鑫,韩森汇,宋漳,陈全助. 2020. 福建省樟树溃疡病病原菌的分离与鉴定[J]. 森林与环境学报,40(3):306-312.[ Zhang X Y,Wu S,Wang M X,Han S H,Song Z,Chen Q Z. 2020. Isolation and identification of camphor tree canker disease pathogen in Fujian Province[J]. Journal of Forest and Environment,40(3):306-312.] doi:10.13324/j.cnki.jfcf.2020.03.011.
赵丹阳,秦长生,廖仿炎,徐金柱,揭育泽. 2016. 广东省樟树有害生物调查及主要种类危害特点[J]. 中国森林病虫,35(6):21-26.[ Zhao D Y,Qin C S,Liao F Y,Xu J Z,Jie Y Z. 2016. Species and damage of pests on Cinnamomum camphora in Guangdong Province[J]. Forest Pest and Di-sease,35(6):21-26.] doi:10.3969/j.issn.1671-0886.2016.06.006.
赵桂华. 2009. 耧斗大茎点霉菌引起的樟树溃疡病病原菌特性研究[J]. 西部林业科学,38(2):1-5.[ Zhao G H. 2009. Growth characteristics of Macrophoma aquilegiae caused canker of Cinnamomum camphora[J]. Journal of West China Forestry Science,38(2):1-5.] doi:10.16473/j.cnki.xblykx1972.2009.02.010.
赵军,安家彦,李怀平. 2006. 霉菌菌落的分形研究[J]. 大连轻工业学院学报,25(2):107-110.[ Zhao J,An J Y,Li H P. 2006. Study on fractals of mold colony[J]. Journal of Dalian Institute of Light Industry,25(2):107-110.] doi:10.3969/j.issn.1674-1404.2006.02.009.
周韦成. 2019. 上海地区樟树常见病害发生特点及其防治技术[J]. 上海农业科技,(1):121-124.[ Zhou W C. 2019. Occurrence characteristics and control techniques of com‐mon diseases of camphor tree in Shanghai[J]. Shanghai Agricultural Science and Technology,(1):121-124.] doi:10.3969/j.issn.1001-0106.2019.01.056.
周泽敏. 2022. 樟树的美学内涵及在生态景观中的应用[D]. 南昌:江西农业大学.[ Zhou Z M. 2022. The aes‐thetic connotation of Cinnamomum camphora and their application in ecological landscapes[D]. Nanchang:Jiang-xi Agricultural University.] doi:10.27177/d.cnki.gjxnu.
2022.000122.Braham D,Seemanti C. 2023. Ganoderma zonatum causes butt rot of areca( Dypsis lutescens) and robellini( Phoenix roe‐belenii) palms in Florida[J]. Plant Disease,107:2844. doi:10.1094/PDIS-01-23-0083-PDN.
Darwana D,Mohamadu B J,Clament F S C,Noor K M B,Normah A B,Khairulmazmi A,Mohd R M R. 2023. Exploring the potential of Bornean polypore fungi as bio‐logical control agents against pathogenic Ganoderma boni‐nense causing basal stem rot in oil palm[J]. Scientific Re-ports,13(1):10316. doi:10.1038/S41598-023-37507-0.
Erwin E. 2017. Microscopic decay pattern of yellow meranti (Shorea gibbosa) wood caused by white-rot fungus Phle‐bia brevispora[J]. Biodiversitas,17(2):417-421. doi:10. 13057/biodiv/d170203.
Feng X X,Liu L,Jin Y,Yan X N,Zhongzhu P Q,Wang G R,Qiu C Y,Wu H M. 2023. First report of trunk canker caused by Botryosphaeria dothidea on Cinnamomum cam‐phora in China[J]. Plant Disease,107(12):4030. doi:10. 1094/PDIS-07-23-1353-PDN.
Gusella G,Di Pietro C,Leonardi G R,Aiello D,Polizzi G. 2023. Canker and dieback of camphor tree( Cinnamomum camphora) caused by Botryosphaeriaceae in Italy[J]. Jour‐nal of Plant Pathology,105(4):1675-1681. doi:0.1007/S42161-023-01517-8.
Huang R X,Luo K Y,Ma R X,Zhao C L. 2020. Morphological and molecular identification of Phlebia wuliangshanensis sp. nov. in China[J]. Mycotaxon,135(1):103-117. doi:10.5248/135.103.
Khoo Y W,Chong K P. 2023. Ganoderma boninense:General characteristics of pathogenicity and methods of contro[l J]. Frontiers in Plant Science,14:1156869. doi:10.3389/FPLS.2023.1156869.
Li D,Zhang T N,Song Q N,Liu J,Zhang H Y,Luan F G. 2022. First report of leaf spot disease on Cinnamomum camphora (camphor tree) caused by Epicoccum poacei-cola in China[J]. Plant Disease,106(3):1059. doi:10. 1094/PDIS-04-21-0683-PDN.
Liu H H,Li D,Zhang T N,Zhang H Y,Song Q N,Liu J,Yang Q P,Luan F G,Li D. 2021. First report of anthracnose on Cinnamomum camphora( camphor tree) caused by Colle‐totrichum fioriniae and Colletotrichum siamense in China[J]. Plant Disease,106(5):1519. doi:10.1094/PDIS-06-21-1307-PDN.
Ma R,Su P,Jin B L,Guo J,Tian M,Mao L Y,Tang J F,Chen T,Lai C J S,Zeng W,Cui G H,Huang L Q. 2021. Molecu‐lar cloning and functional identification of a high-efficiency( +)-borneol dehydrogenase from Cinnamomum camphora( L.) Pres[l J]. Plant Physiology and Biochemis‐try,158:363-371. doi:10.1016/J.plaphy.2020.11.023.
Rachael M,Romina G,Demetra S,Priscila C,David H. 2015. Unexpected diversity of basidiomycetous endophytes in sapwood and leaves of Hevea[J]. Mycologia,107(2):284-297. doi:10.3852/14-206.
Simeto S,Held B W,Blanchette R A. 2023. Wood decay fungi associated with galleries of the emerald ash borer[J]. Forests,14(3):576. doi:10.3390/F14030576.
Song M,Yu Q,Liu Y Q,Cai S L,Jiang X L,Xu W Z,Xu W. 2023. Microbial transformation of pimavanserin by Cun‐ninghamella blakesleeana AS 3.970[J]. Catalysts,13(8):1220. doi:10.3390/catal13081220.
Stéphane W,Régis C. 2010. The Ganodermataceae in the French West Indies( Guadeloupe and Martinique)[J]. Fun‐gal Diversity,43:103-126. doi:10.1007/s13225-010-0036-2.Surulirajan M,Karthikeyan M,Arunkumar R,Mathirajan V G,Babu R,Jerard B A,Hegde V. 2023. Ganoderma wilt—A lethal disease of coconut in Tamil Nadu research accom‐plishments and future thrust[J]. International Journal of Plant amp; Soil Science,35(15):272-281. doi:10.9734/IJPSS/ 2023/ V35I153106.
Sobhy S,Al-Askar A A,Bakhiet E K,Elsharkawy M M,Arishi A A,Behiry S I,Abdelkhalek A. 2023. Phytochemical characterization and antifungal efficacy of camphor (Cin‐namomum camphora L.) extract against phytopathogenic fung[i J]. Separations,10(3):189. doi:10.3390/separations 10030189.
Wang W,Cai T,Yang Y T,Guo H,Sahng Z,Shaid H,Zhang Y R,Qiu S R,Zeng X N,Xu X L,Liu Y,Fang P,Ding P,Mao Z L,Shan T J. 2023. Diversity of fungal communities on diseased and healthy Cinnamomum burmannii fruits and antibacterial activity of secondary metabolites[J]. Mi-crobiology Spectrum,11(3):e0008023. doi:10.1128/spec-trum.00080-23.
Xiao Y T,Li M,Chen F M. 2023. Root rot of Cinnamomum camphora( Linn) Presl caused by Phytopythium vexans in China[J]. Plants,12(5):1072. doi:10.3390/plants120 51072.
Ye Y H,Pei H R,Cao X L,Liu X Y,Li Z H,Wang B Y,Pan Y,Zheng J M. 2023. The study of a novel paeoniflorin-converting enzyme from Cunninghamella blakesleeana[J]. Molecules,28(3):1289. doi:10.3390/molecules280 31289.
Zhao C L,Qu M H,Huang R X,Karunarathna S C. 2023. Multi-gene phylogeny and taxonomy of the wood-rotting fungal genus Phlebia sensu lato( Polyporales,Basidiomy‐cota)[J]. Journal of Fungi,9(3):25. doi:10.3390/jof903 0320.
(责任编辑 麻小燕)
