不同叶片颜色的木薯MeANR基因克隆及表达分析
2024-02-09安飞飞罗秀芹陈松笔薛晶晶蔡杰








摘要:【目的】对木薯花青素还原酶基因(MeANR)进行克隆及表达分析,为解析木薯叶片花青素生物合成的分子机制、叶色改良及新品种培育提供理论依据。【方法】以3种叶片颜色的木薯华南9号(SC9,绿叶)、花叶木薯(黄绿叶)和紫叶木薯(紫叶)为材料,测定其花青素含量和原花青素含量,并对MeANR基因进行克隆及生物信息学分析,采用实时荧光定量PCR检测MeANR基因在不同组织及激素处理下的表达模式,通过转基因酵母胁迫试验验证MeANR基因在不同激素处理下的表达情况。【结果】SC9、花叶木薯和紫叶木薯叶片中的花青素含量和原花青素含量均存在显著差异(Plt;0.05),其中紫叶木薯叶片的花青素含量最高,达444.59 ng/g,分别为SC9和花叶木薯的24.48和28.32倍。从3种叶片颜色的木薯叶片中分别克隆到1个MeANR基因,其编码区(CDS)序列为1041 bp,序列完全一致,但与Phy‐
tozome数据库中公布的ANR基因序列(登录号:Manes.16G016400)存在7个碱基差异。MeANR蛋白由346个氨基酸组成,属于稳定的非分泌型亲水性蛋白,二级结构主要由无规则卷曲(42.77%)和α-螺旋(37.28%)构成,延伸链和β-转角占比较小,亚细胞定位于叶绿体。MeANR基因在芽中的相对表达量最高,其次是叶片和花,在茎中的相对表达量最低。MeANR基因在不同激素处理下呈不同的表达模式,水杨酸(SA)处理后随着处理时间的延长,MeANR基因的相对表达量呈先下降后上升再下降的变化趋势,处理后24 h MeANR基因的相对表达量比处理0 h显著下降68%,而在脱落酸(ABA)和茉莉酸甲酯(MeJA)处理后MeANR基因的相对表达量总体上呈上升趋势,但ABA处理后24 h达峰值,MeJA处理后9 h达峰值。在SA处理下转MeANR基因酵母菌的存活率低于对照(转pDR196空载体的酵母菌),而在ABA和MeJA处理下转MeANR基因酵母菌的生长情况优于对照。【结论】木薯叶片颜色深度与花青素含量存在正相关性。MeANR是木薯叶片花青素积累的负调控基因,具有明显的组织表达特异性,其表达受SA抑制,受ABA和MeJA 诱导。
关键词:木薯;叶片;花青素还原酶(ANR);基因克隆;表达模式
中图分类号:S533.035.3 文献标志码:A 文章编号:2095-1191(2024)11-3210-11
Cloning and expression analysis of MeANR gene in cassava" (Manihot esculenta Crantz)leaves with different colors
ANFei-fei1,2,LUOXiu-qin1,CHENSong-bi1,XUEJing-jing2,CAIJie1*
(1Tropical Crops Genetic Resources Institute/Key Laboratory of Ministry ofAgriculture and RuralAffairs for Germplasm Resources Conservation and Utilization of Cassava,ChineseAcademy of TropicalAgricultural Sciences,Haikou,
Hainan" 571101,China;2Sanya Research Institute,ChineseAcademy of TropicalAgricultural Sciences,Sanya,Hainan" 572025,China)
Abstract:【Objective】The purpose of the study was to clone and analyze the expression of anthocyanidin reductase gene(MeANR)in cassava,in order to provide theoretical basis for understanding the molecular mechanism of anthocya-nin biosythesis in cassava leaves,improving leave color,and cultivating new varieties.【Method】Cassava with 3 leaf co-lors:Huanan No.9(SC9,green leaves),mosaic leaf cassava(yellow and green leaves)and purple leaf cassava(purple leaves)were used as materials,the anthocyanin content and proanthocyanidin content were measured.MeANR gene was cloned and analyzed using bioinformatics. Real-time fluorescence quantitative PCR was used to detect the expression pat‐tern of MeANR gene in different tissues and hormone treatments. Transgenic yeast stress experiments were conducted to verify the expression of MeANR under different hormone treatments.【Result】There were significant difference(Plt;0.05)between anthocyanin content and proanthocyanid content in leaves of SC9,mosaic leaf cassava and purple leaf cassava.Among them,the anthocyanin content in leaves of purple leaf cassava was the highest,reaching 444.59 ng/g,which was as 24.48 and 28.32 times as that of SC9 and mosaic leaf cassava respectively. AMeANR gene was cloned from cassava leaves with 3 different leaf colors respectively,with a coding region(CDS)of 1041 bp,the sequences were consistent,with 7bp inconsistent with the published sequences in Phytozome database(accession number:Manes.16G016400). The MeANR protein consisted of 346 amino acids and was a stable non-secreted hydrophilic protein. Its secondary structure was mainly composed of random coils(42.77%)and α-helices(37.28%),with a small proportion of extended chains and β-turns.Subcellular localization was in the chloroplast. The expression level of MeANR gene was the highest in buds,followed by leaves and flowers,and lowest in stems.MeANR geneexhibited different expression patterns under different hormone treatments. After salicylic acid(SA)treatment,the relative expression level of MeANR showed a trend of first decreasing,then increasing,and then decreasing with the prolongation of treatment time. The relative expression level of MeANR gene at 24 h significantly decreased by 68% compared to 0 h. However,after abscisic acid(ABA)and methyl jasmonate (MeJA)treatments,the relative expression level of MeANR gene showed an upward trend,but reached its peak at 24 h of ABAtreatment and 9 h of MeJAtreatment. The survival rate of MeANR transgenic yeast strain under SAtreatment was
lower than that of control(yeast strain transformed with pDR196 empty vector),the growth of MeANR transgenic yeast strain treated with ABAand MeJAwas better than the control.【Conclusion】There is a positive correlation between the cassava leaf color and anthocyanin content.MeANR is a negative regulatory gene for anthocyanin accumulation in cassava
leaves,with obvious tissue expression specificity,and is inhibited by SA,induced byABAand MeJA.
Key words:cassava;leaves;anthocyanin reductase(ANR);gene cloning;expression pattern
Foundation items:National Key Research and Development Program of China(2023YFD1200204);Science and Technology Innovation Team of National Tropical Agricultural Science Center of Chinese Academy of Tropical Agricul‐tural Sciences(CATASCXTD202301);Central Public-interest Scientific Institution Basal Research Fund of Chinese Aca-demy of TropicalAgricultural Sciences(1630032022007)
0 引言
【研究意义】木薯(Manihot esculenta Crantz)是世界热带地区约10亿人赖以生存的粮食,在推进“一带一路”农业合作,维护世界粮食安全中发挥着重要作用(曹升等,2021)。在我国木薯主要种植于广西、广东、海南、云南、贵州等省(区),是生产淀粉、燃料乙醇等化工产品及动物饲料的主要原材料。木薯叶片含有丰富的抗氧化物质,如类胡萝卜素、类黄酮等(Latif and Müller,2015;王琴飞等,2018;张振文等,2018),是医药和健康食品重要原料。花青素还原酶(Anthocyanidin reductase,ANR)是花青素合成下游的一种关键酶,将有色的花青素还原合成表没食子儿茶素、表儿茶素等,进一步聚合形成无色的原花青素(Gargouri et al.,2009),对花青素含量有一定的负调控作用(Han et al.,2012;杨波等,2021),其表达对植物呈色也有重要影响。因此,探究木薯叶片颜色差异,并对MeANR基因进行克隆及表达分析,对探究木薯叶色形成的分子机制及新品种培育具有重要意义。【前人研究进展】花青素是一类广泛存在于植物中的黄酮类化合物,在植物根、茎、叶、花、皮、果实中均可检测到(Matsui et al.,2016;郭松等,2024)。花青素可分为天竺葵色素、矢车菊色素、芍药色素、飞燕草色素、牵牛色素和锦葵色素(Kong et al.,2003;Luo et al.,2023),其生物合成途径是类黄酮合成途径的一个分支,同时受多个结构基因调控,如查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮三羟化酶(F3H)、花青素合成酶(ANS)、ANR等(Jaakola,2013)。除此之外,花青素的合成还受到MYB、bHLH、bZIP和WD40四大类转录因子的影响(Zhang et al.,2024),其中MYB类转录因子形成的复合体WD40-bHLH-MYB是花青素合成的主要调控因子之一(Dela et al.,2003)。花青素的生物合成受植物营养水平、生长发育及环境因子(光、温度等)的协同调控,在植物遭受胁迫时,植物体内类黄酮尤其是花青素和原花青素在植物体内大量积累,进而减缓逆境对植物的伤害,提高植物的逆境适应性(申玉晓,2019;刘恺媛等,2021)。ANR基因作为花青素合成鲜见报道。木薯叶片通常为绿色,在绿色木薯叶片中含有极少量的花青素,而紫色木薯叶片中花青素含量是绿色木薯叶片的30倍以上,转录组数据显示MeANR基因在紫色木薯叶片中表达较低,可能是木薯叶片花青素生物合成的一个负调控基因(Luo et al.,2023),但其具体的调控作用机制尚未明晰。Rabbi等(2022)通过对国际热带农业研究所(IITA)保存的5130份木薯材料进行全基因组关联分析(GWAS),结果发现MYB6 (Manes.01G115400)既可能控制叶柄颜色,也可能控制木薯叶片绿色。【本研究切入点】目前鲜见关于木薯不同颜色形成机制及其相关基因克隆、表达分析的研究报道。【拟解决的关键问题】以3种颜色的木薯叶片为材料,对其花青素和原花青素含量进行测定,克隆MeANR基因,分析其编码蛋白结构和跨膜结构等特征,利用实时荧光定量PCR检测MeANR基因在不同组织和激素处理下的表达模式,为进一步探究其在木薯叶色改良中的功能提供理论依据。
1 材料与方法
1.1试验材料
绿叶木薯华南9号(SC9)、花叶木薯及紫叶木薯于2023年3月种植在中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃(海南儋州)19°30′33.13″N,109°30′19.34″E),种植后3个月,取健康成熟叶片置于液氮中,-80 ℃保存备用。用于亚细胞定位的本生烟由中国热带农业科学院热带作物品种资源研究所实验室保存。主要试剂:茉莉酸甲酯(MeJA)、水杨酸(SA)、脱落酸(ABA)均购自北京索莱宝科技有限公司;酿酒酵母高效感受态制备试剂盒(ZC135)购自北京庄盟国际生物基因科技有限公司;植物花青素含量检测试剂盒(G0126F)购自苏州格锐思生物科技有限公司;植物原花青素含量检测试剂盒(BC1355)购自北京索莱宝科技有限公司;Thermo Scientific RevertAid RT试剂盒(K1691)购自英潍捷基(上海)贸易有限公司;琼脂糖凝胶电泳DNA回收试剂盒(CW2302M)购自江苏康为世纪生物科技股份有限公司;Nimble Cloning试剂盒(NC001)购自海南你行生物科技有限公司。主要仪器设备:Azure C600多功能荧光成像系统(Azure Biosystems公司)、NanoPhotometer NP80超微量分光光度计(Implen公司)、qTOWER384 G荧光定量PCR系统(德国耶拿分析仪器股份公司)。
1.2 试验方法
1.2.1 样品处理及采集 将SC9茎段扦插于装满基质(沙土∶营养土∶蛭石=4∶1∶1)的花盆中培养,萌发后生长40 d的盆栽苗用于后续激素处理。选取长势良好的木薯进行3种激素(100μmol/L的MeJA、2mmol/L的SA及100μmol/L的ABA溶液)处理,各取5 mL均匀喷洒至叶片表面,并立即用塑料袋套住。在处理后0、6、9、12和24 h取木薯叶片置于液氮速冻,每个样本设3个重复,-80 ℃保存备用。
1.2.2 叶片花青素和原花青素含量测定 木薯叶片中花青素的提取参照植物花青素含量检测试剂盒分光法。原花青素含量测定参照植物原花青素含量检测试剂盒,根据样本质量计算各样品的花青素含量和原花青素含量,每个样本设3个重复。
1.2.3 总RNA提取及MtANR基因克隆 采用植物总RNA提取试剂盒(DP441)提取SC9、花叶木薯及紫叶木薯叶片总RNA,以及SC9嫩叶、成熟叶、叶柄、茎、脆性胚性愈伤组织(FEC)、花、芽、须根和块根总RNA。利用0.8%琼脂糖凝胶电泳检测总RNA 的质量和完整性,使用NanoDrop 2000超微量分光光度计测定浓度。cDNA第一链合成参照Thermo Scientific RevertAid RT试剂盒(K1691)说明进行。以3种木薯叶片cDNA为模板,利用特异扩增引物(表1)进行PCR扩增。反应体系50.0μL:2×Rapid Taq Master Mix 25.0μL,500 ng/μL cDNA模板2.0 μL,10μmol/L上、下游引物各0.5μL,ddH2O补足至
50.0μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s,进行35个循环;72 ℃延伸10 min。PCR产物用0.8%琼脂糖凝胶电泳进行检测,利用DNA回收试剂盒回收目的片段,连接至Blunt 载体上,将菌液PCR鉴定为阳性的菌落送至广州艾基生物技术有限公司测序。
1.2.4 生物信息学分析 使用ProtParam在线工具(https://web.expasy.org/protparam/)预测蛋白的基本理化性质;运用SignalP-5.0在线工具(https://services.信号肽;利用TMHMM-2.0在线工具(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测蛋白的跨膜结构;分别采用SOPMA在线工具(https://npsa.lyon.inserm.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL在线工具(https://
swissmodel.expasy.org/interactive)对蛋白的二级结构和三级结构进行预测。
1.2.5 MeANR蛋白亚细胞定位 利用Primer 5.0 设计带有接头的MeANR基因全长扩增引物(表1),以SC9叶片cDNA为模板,扩增MeANR基因片段,并采用Nimble Cloning试剂盒(NC001)构建pNC-Green-35S::GFP-MeANR表达载体,具体操作参照Yan等(2020)的方法。参照An等(2022)的方法瞬时转化烟草,3 d后使用激光共聚焦显微镜观察MeANR蛋白的定位情况。
1.2.6 MeANR基因表达模式检测 利用Primer 5.0 设计MeANR基因的定量引物(表1),通过实时荧光定量PCR检测MeANR基因在3种颜色叶片、SC9不同组织及3种激素处理后的表达情况。以MeActin 为内参基因,其引物序列见表1。每个样品设3个生物学重复。反应体系10.0μL:qPCR SYBR Green Master Mix 5.0μL,10μmol/L上、下游引物各0.5μL,200 ng/μL cDNA模板1.0μL,ddH2O补足至10.0μL。扩增程序:95 ℃预变性30 s;95 ℃ 10 s,55 ℃ 10 s,72 ℃ 20 s,进行40个循环。以SC9叶片为对照,按
2-ΔΔCt法计算MeANR基因的相对表达量。
1.2.7 转MeANR基因胁迫试验 采用同源重组方法将MeANR基因连接至酵母表达载体pDR196 中,所用引物(pDR196-MeANR)如表1所示。构建好的重组载体命名为pDR196-MeANR,参照酿酒酵母高效感受态细胞制备试剂盒说明将其转化酵母菌株W303,30 ℃ 220 r/min摇动培养过夜,调至OD600 nm为1.0,加入100μmol/L MeJA、2 mmol/L SA及100μmol/L ABA处理24 h后,依次稀释10倍、100 倍和1000倍,点接至SD/-Ura固体培养基上,30 ℃培养3d。以正常培养作为对照,比较转pDR196-MeANR重组载体和pDR196空载体的酵母菌株生长情况。
1.3 统计分析
采用Excel 2013和DPS v7.05对试验数据进行整理分析,采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 不同叶片颜色的木薯中花青素和原花青素含量比较
由图1可知,SC9的成熟叶片为绿色,花叶木薯的成熟叶片为黄绿相间,紫叶木薯的成熟叶片为紫色。由表2可知,SC9、花叶木薯和紫叶木薯叶片的花青素含量和原花青素含量均存在显著差异(Plt;0.05,下同),其中紫叶木薯叶片的花青素含量最高,达444.59 ng/g,分别为SC9和花叶木薯的24.48和28.32 倍,表明木薯叶片颜色深度与花青素含量存在正相关性。
2.2 MeANR基因克隆结果
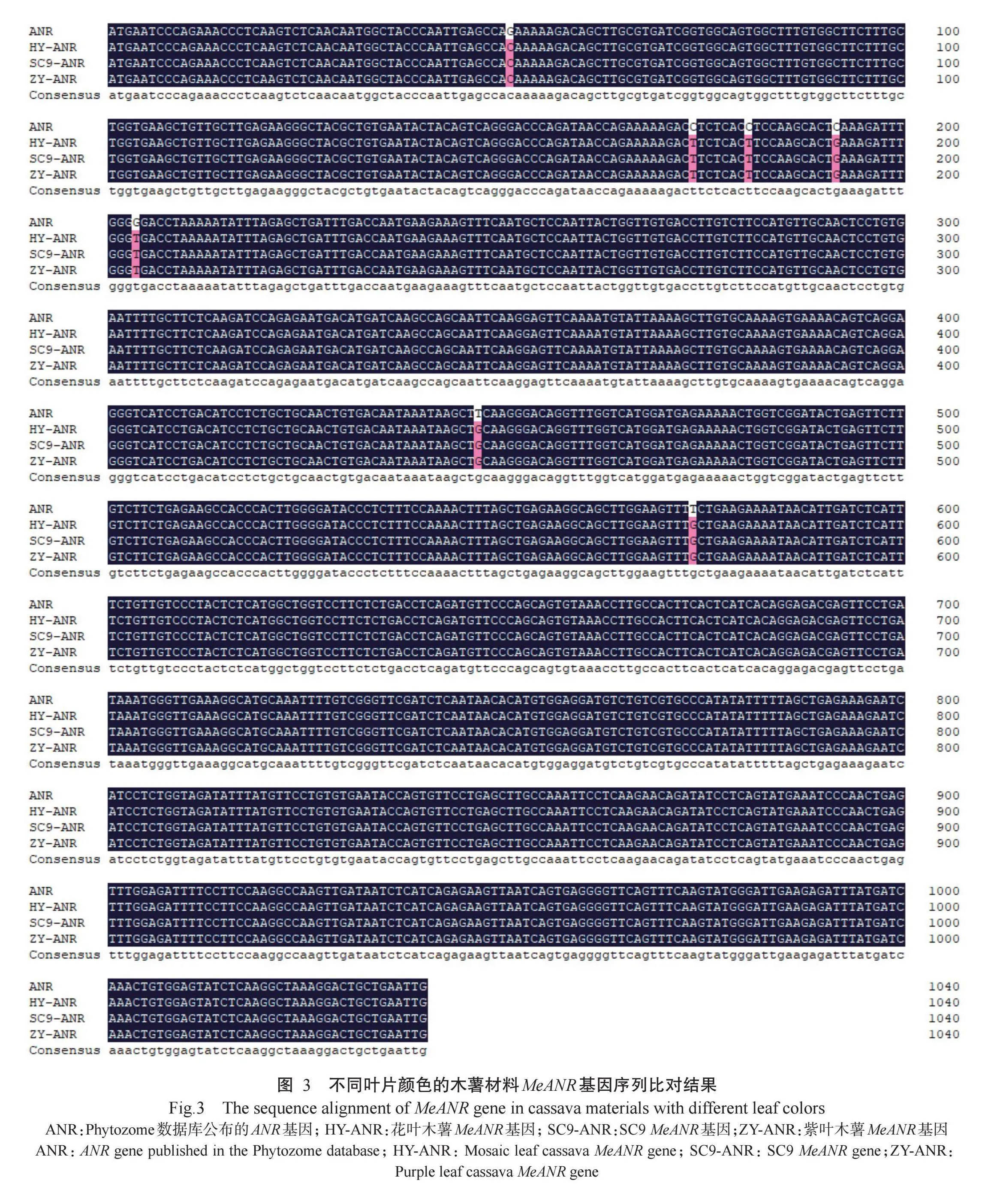
分别以SC9、花叶木薯和紫叶木薯叶片cDNA为模板,扩增获得约1000 bp片段,如图2所示。经测序比对发现,SC9、花叶木薯和紫叶木薯叶片中MeANR 基因编码区(CDS)序列一致,长度均为1041 bp,但均有7个碱基与Phytozome数据库中公布的ANR基因序列(登录号:Manes.16G016400)不一致,分别为第51位G变为C,第174位C变为T,第181位C变为T,第192位C变为G,第204位G变为T,第447位T 变为G,第574位T变为G(图3)。
2.3 MeANR蛋白生物信息学分析结果
MeANR蛋白由346个氨基酸组成,分子量为37836.38 Da,理论等电点6.16,半衰期30 h,不稳定指数34.86,属于稳定蛋白,其中异亮氨酸含量最高,达10.4%,带负电残基的总数为38个,带正电残基的总数为36个,亲/疏水性指数为-0.125,说明MeANR 为亲水性蛋白。SignalP-5.0预测结果显示,MeANR 蛋白N末端无信号肽(图4-A);TMHMM-2.0预测结果显示,MeANR蛋白无跨膜结构(图4-B),说明MeANR属于非分泌蛋白或非跨膜蛋白,可能以游离态形式存在。
由图5可知,MeANR蛋白的二级结构中,无规则卷曲和α-螺旋占比较大,分别为42.77%和37.28%,而延伸链和β-转角占14.17%和5.78%,三级结构预测结果与二级结构预测结果基本一致。
2.4 MeANR蛋白亚细胞定位结果
利用根瘤农杆菌介导瞬时转化法,将pNC-Green-35S::GFP-MeANR表达载体注射到烟草叶片中,恒温培养室培养3 d后,利用激光共聚焦显微镜进行观察,结果如图6所示。绿色荧光蛋白(GFP)集中在本氏烟叶片表皮细胞的叶绿体上,表明MeANR 蛋白主要分布于叶绿体中,推测MeANR蛋白为叶绿体蛋白。
2.5 MeANR基因的表达模式分析结果
2.5.1 不同颜色叶片中MeANR基因表达差异分析
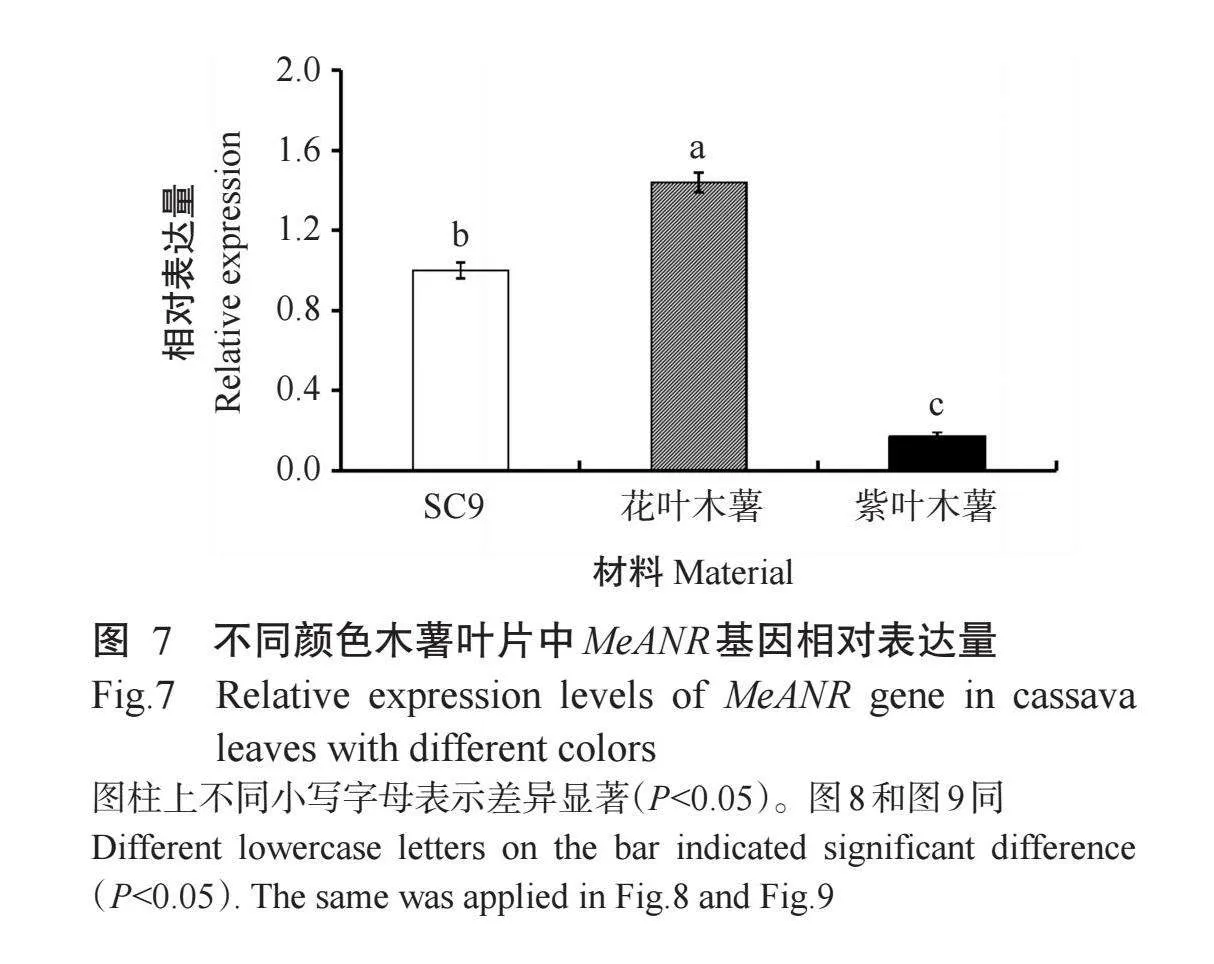
由图7可知,MeANR基因在花叶木薯叶片中的相对表达量最高,显著高于在紫叶木薯和SC9叶片中的相对表达量,在紫叶木薯叶片中的相对表达量最低。结合表2可知,木薯叶片颜色越深,原花青素含量和花青素含量越高,而MeANR基因的表达水平越低。
2.5.2 MeANR基因组织表达特性分析
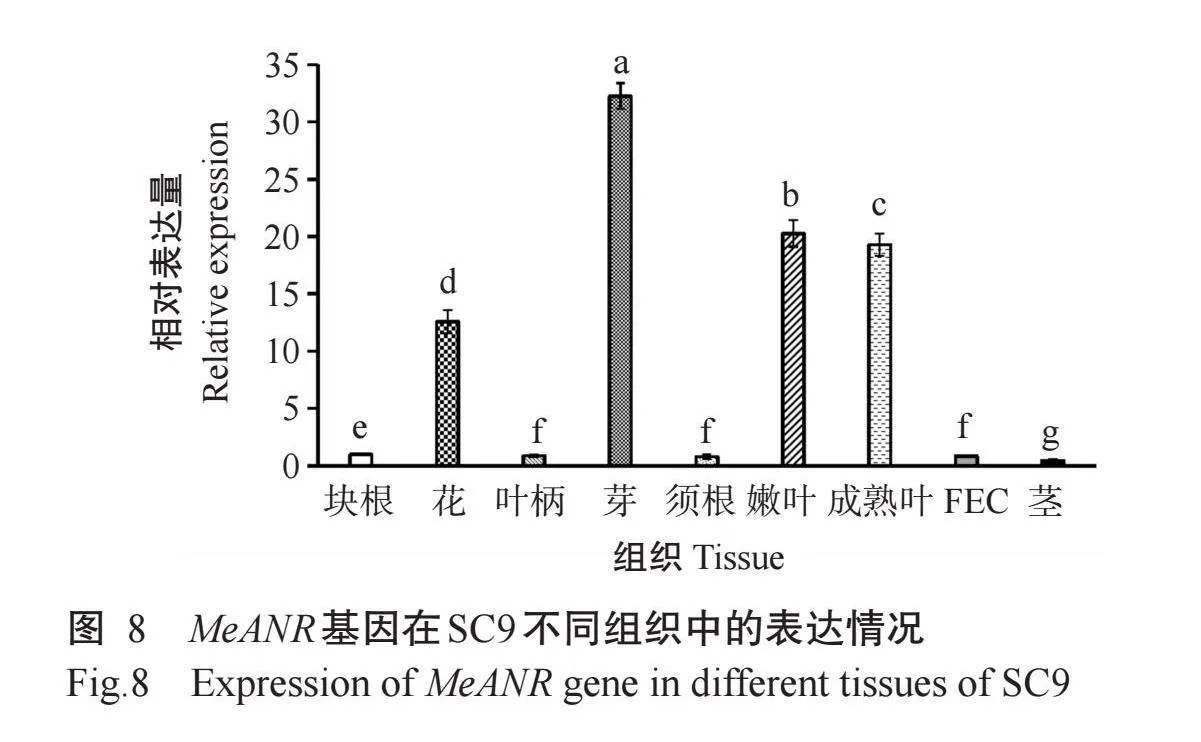
由图8可知,MeANR基因在SC9木薯9个不同组织均有表达,在芽、嫩叶、成熟叶和花中相对表达量较高,其中MeANR基因在芽、嫩叶和花中的相对表达量分别为块根的32.25、20.27和12.58倍,而在茎中的相对表达量最低。综上所述,MeANR基因的表达具有明显的组织特异性。
2.5.3 MeANR基因在不同激素处理下表达情况
不同激素处理下MeANR基因的相对表达量检测结果如图9所示。MeANR基因的表达受SA抑制,而ABA和MeJA诱导其表达。SA处理后24 h抑制效果最明显,MeANR基因的相对表达量比胁迫处理0h显著下降68%;随着处理时间的延长,MeANR 基因的相对表达量呈先下降后上升再下降的变化趋势(图9-A)。在ABA和MeJA处理下,MeANR基因的相对表达量总体上呈上升趋势,但出现峰值的时间不一致,ABA处理后24 h达峰值,MeJA处理后9 h达峰值,分别是胁迫处理0 h的131.66和90.17倍(图9-B和9-C)。
2.6 转基因酵母菌诱导试验结果
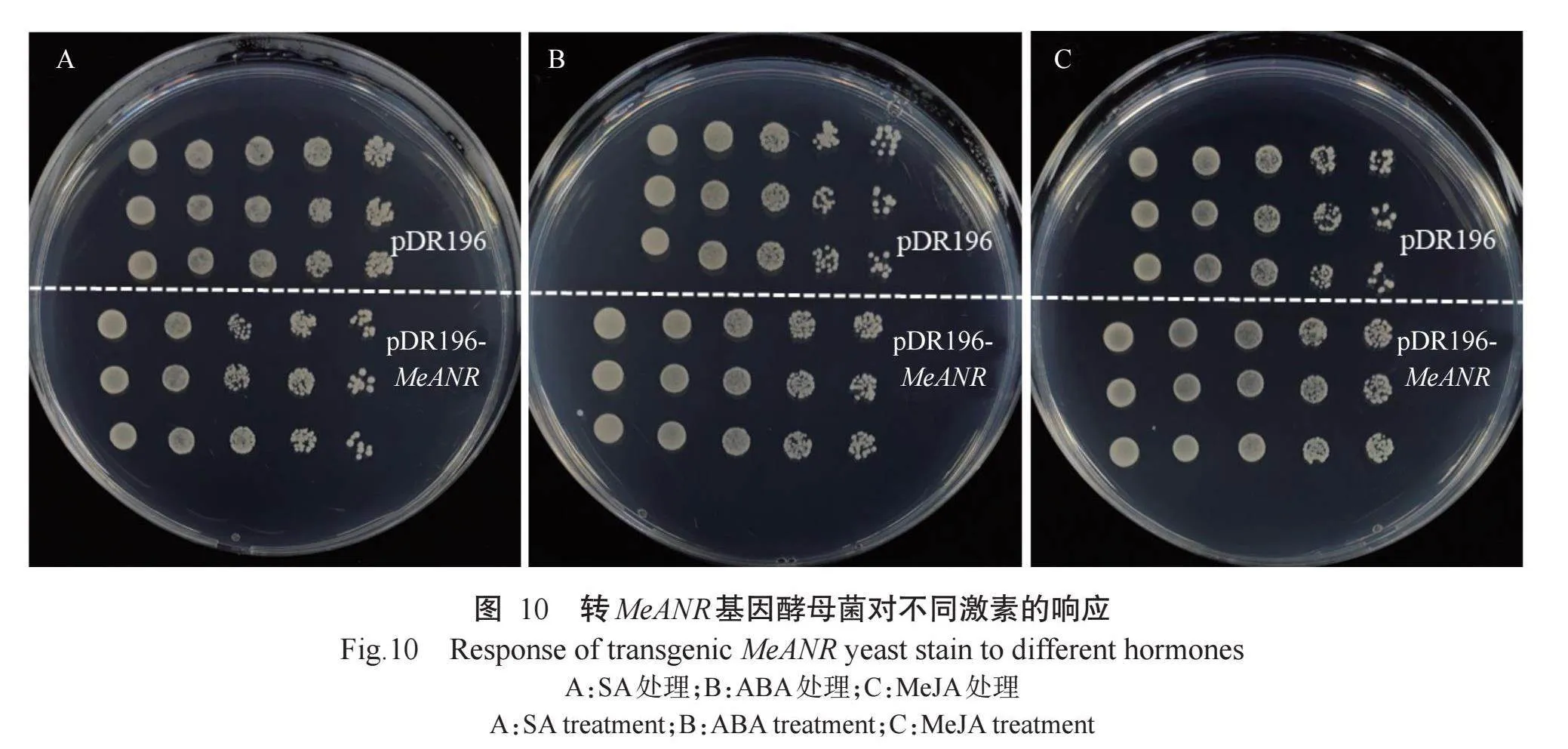
转MeANR基因酵母菌在不同激素处理下的生长情况如图10所示。转MeANR基因酵母菌在SA 处理下酵母菌存活率低于对照(转pDR196空载体的酵母菌)(图10-A),而在ABA和MeJA处理下转MeANR基因酵母菌的生长情况优于对照(图10-B和图10-C),表明MeANR基因在酵母菌中的表达受SA 抑制,受ABA和MeJA诱导。
3 讨论
木薯是我国热区重要的生物质能源和饲料,其叶片可作为动物饲料的加工原料,也可饲养木薯蚕。由于紫叶木薯叶片富含花青素,因此作为木薯蚕饲料潜力较大(曹萌萌等,2022)。ANR是花青素生物合成途径中的关键酶,对花青素含量有重要影响(余永亮等,2023)。研究木薯ANR对改善木薯叶片品质、提高木薯叶片经济价值具有重要意义。
本研究发现3种颜色的木薯叶片中MeANR基因的CDS序列一致,均与Phytozome数据库中公布的MeANR基因序列存在7个碱基差异。在SC9木薯叶片中瞬时沉默MeANR基因,新长出的叶片颜色变紫,且沉默效率越高,紫色越深(Luo et al.,2023),表明MeANR是木薯叶片花青素积累的负调控基因。由于绿叶木薯(SC9)和紫叶木薯中MeANR基因CDS并无差异,推测导致叶片颜色差异的原因是MeANR基因在紫叶木薯中的相对表达量较低,也可能是MeANR基因启动子区域存在差异,仍需进一步试验验证。后续研究可分别扩增3种颜色的木薯叶片中MeANR基因的启动子序列,筛选上游调控MeANR基因的转录因子,构建MeANR基因过表达载体及基因编辑载体,通过农杆菌介导法遗传转化SC9木薯FEC,验证MeANR基因表达变化对木薯叶片花青素含量的影响,为提高木薯叶片品质提供理论依据。本研究对MeANR基因编码的氨基酸序列进行生物信息学分析,结果发现MeANR蛋白的二级结构主要由α-螺旋和无规卷曲组成,而延伸链和β-转角占比较少,与越橘(宋杨等,2019)、红花(鲁丹丹等,2022)等物种的ANR蛋白一致;MeANR属于稳定的亲水性蛋白,不存在信号肽和跨膜结构,与红花CtANR3蛋白理化性质及蛋白高级结构(鲁丹丹等,2023)一致。
本研究实时荧光定量PCR检测结果发现,MeANR基因在花叶木薯叶片中的相对表达量最高,在紫叶木薯叶片中的相对表达量最低;MeANR基因主要在SC9木薯的芽、嫩叶、成熟叶和花中高表达,而在茎中的低表达,与芒果不同品种ANR基因表达模式(李先良等,2017)及葡萄(Bogs et al.,2005)、川桑(孟帅,2019)中ANR基因在不同组织的表达特性基本一致。上述结果表明,ANR基因在不同植物品种及不同组织的表达差异较大。研究表明,植物激素可调节花青素和原花青素等物质的合成,外源激素及环境因子共同作用于结构基因,进而影响植物花青素含量(王华等,2015)。本研究还发现,MeANR基因对SA、ABA和MeJA处理均有不同程度的响应,SA处理下随着处理时间的延长,MeANR基因的相对表达量呈先下降后上升的趋势,处理后24h抑制效果最显著,且转MeANR基因的酵母菌在SA诱导后酵母菌存活率低于对照(转pDR196空载体的酵母菌);ABA和MeJA处理下,MeANR基因的相对表达量均呈不同程度的上升,且转MeANR基因酵母菌在诱导后存活率显著高于对照。早期研究发现,外源ABA和MeJA能通过上调花青素合成相关基因的表达水平,进而诱导植物花青素的生物合成(Shen et al.,2014;An et al.,2018;陈俊洁等,2020),同时外源GA3处理也可促进花青素的积累(Weiss et al.,1995),但SA、ABA和MeJA在调节木薯花青素合成过程中的作用机制和分子机制尚未清晰,仍需进一步试验验证。此外,不同物种中植物花青素调控机制也会存在差异(王如凤等,2019),仍有待深入研究。
4 结论
木薯叶片颜色深度与花青素含量存在正相关性,MeANR是木薯叶片花青素积累的负调控基因,具有明显的组织表达特异性,受SA抑制,受ABA和MeJA诱导。
参考文献((References)):
曹萌萌,杨龙,陈松笔,安飞飞. 2022. 不同木薯叶营养成分对饲养木薯蚕的影响[J]. 南方农业学报,53(6):1759-1767. [Cao M M,Yang L,Chen S B,An F F. 2022. Effects of cassava leaves nutrient components on eri-silkworm bree-ding[J]. Journal of Southern Agriculture,53(6):1759-1767.] doi:10.3969/j.issn.2095-1191.2022.06.030.
曹升,陈江枫,黄富宇,严华兵,韦朝念,李富山,陆柳英,覃夏燕,陈会鲜,李恒锐. 2021. 广西木薯产业现状分析及其发展建议[J]. 南方农业学报,52(6):1468-1476.[ Cao S,Chen J F,Huang F Y,Yan H B,Wei C N,Li F S,Lu L Y,Qin X Y,Chen H X,Li H R. 2021. Development status and countermeasures of cassava industry in Guangxi[J]. Guangxi Agricultueal Sciences,52(6):1468-1476.] doi:10.3969/j.issn.2095-1191.2021.06.005.
陈俊洁,梅松,胡彦如. 2020. 脱落酸激素诱导拟南芥幼苗中花青素的合成[J]. 广西植物,40(8):1169-1180.[ Chen J J,Mei S,Hu Y R. 2020. Abscisic acid induces anthocyanin synthesis in Arabidopsis thaliana seedlings[J]. Guihaia,40(8):1169-1180.] doi:10.11931/guihaia.gxzw201902021.
郭松,常庆瑞,赵泽英,李莉婕,童倩倩. 2024. 基于高光谱的不同生育期玉米花青素含量估测[J]. 江苏农业学报,40(2):303-311.[ Guo S,Chang Q R,Zhao Z Y,Li L J,Tong Q Q. 2024. Estimation of anthocyanin content in maize at different growth stages based on hyperspectral technology[J]. Jiangsu Journal of Agricultural Sciences,40(2):303-311.] doi:10.3969 /j.issn.1000-4440.2024.02.012.
李先良,赵志常,高爱平,陈业渊,黄建峰,党志国,罗睿雄. 2017. 芒果ANR基因的克隆及其表达分析[J]. 江苏农业科学,45(4):22-25.[ Li X L,Zhao Z C,Gao A P,Chen Y Y,Huang J F,Dang Z G,Luo R X. 2017. Cloning and expression analysis of mango ANR gene[J]. Jiangsu Agri‐cultural Sciences,45(4):22-25.] doi:10.15889/j.issn.1002-1302.2017.04.006.
刘恺媛,王茂良,辛海波,张华,丛日晨,黄大庄. 2021. 植物花青素合成与调控研究进展[J]. 中国农学通报,37(14):41-51.[ Liu K Y,Wang M L,Xin H B,Zhang H,Cong R C,Huang D Z. 2021. Anthocyanin biosynthesis and regu‐late mechanisms in plants:A review[J]. Chinese Agricul‐tural Science Bulletin,37(14):41-51.] doi:10.11924/j.issn. 1000-6850.casb2020-0390.
鲁丹丹,谭政委,李磊,余永亮,许兰杰,杨红旗,董薇,梁慧珍. 2022. 红花花青素还原酶基因ANR的克隆及表达分析[J]. 核农学报,36(3):517-526.[ Lu D D,Tan Z W,Li L,Yu Y L,Xu L J,Yang H Q,Dong W,Liang H Z. 2022. Cloning and expression analysis of anthocyanidin reduc‐tase gene ANR in Carthamus tinctorius L[. J]. Journal of Nuclear Agricultural Sciences,36(3):517-526.] doi:10. 11869/j.issn.100-8551.2022.03.0517.
鲁丹丹,谭政委,余永亮,李磊,许兰杰,杨红旗,杨青,董薇,安素妨,梁慧珍. 2023. 红花CtANR2和CtANR3基因的克隆、结构及表达模式分析[J]. 华北农学报,38(1):84-93. [Lu D D,Tan Z W,Yu Y L,Li L,Xu L J,Yang H Q,Yang Q,Dong W,An S F,Liang H Z. 2023. Cloning,structure and expression profile analysis of CtANR2 and CtANR3 genes from Carthamus tinctorius L[. J]. Acta Agriculturae Boreali-Sinica,38(1):84-93.] doi:10.7668/hbnxb.2019 3450.
孟帅. 2019. 川桑原花青素合成关键酶基因LAR和ANR的鉴定与功能研究[D]. 重庆:西南大学 . [Meng S. 2019. Identification and functional analyses of LAR and ANR encoding key enzymes in proanthocyanidins from mulberry[D]. Chongqing:Southwest University.]
申玉晓. 2019. 玫瑰MYB转录因子调控类黄酮介导的逆境响应机制研究[D]. 武汉:华中农业大学.[ Shen Y X. 2019. MYB transcription factors regulate flavonoid-mediated stress response in Rose rugosa[D]. Wuhan:Huanzhong Agricultural University.]
宋杨,刘红弟,王海波,张红军,刘凤之. 2019. 越橘原花青素合成相关基因 VcLAR和 VcANR的克隆和功能鉴定[J]. 江苏农业学报,35(3):682-688.[ Song Y,Liu H D,Wang H B,Zhang H J,Liu F Z. 2019. Molecular cloning and functional identification of proanthocyanidin synthesis related genes VcLAR and VcANR of blueberry[J]. Jiangsu Journal of Agricultural Sciences,35(3):682-688.] doi:10. 3969/j.issn.1000-4440.2019.03.025.
王华,李茂福,杨媛,金万梅. 2015. 果实花青素生物合成分子机制研究进展[J]. 植物生理学报,51(1):29-43.[ Wang H,Li M F,Yang Y,Jin W M. 2015. Recent advances on the molecular mechanisms of anthocyanin synthesis in fruits[J]. Plant Physiology Journal,51(1):29-43.] doi:10. 13592/j.cnki.ppj.2014.0321.
王琴飞,吴秋妃,徐缓,林立铭,张振文. 2018. 木薯叶片中黄酮醇类物质的提取与检测[J].西南农业学报,31(8):1694-1699.[ Wang Q F,Wu Q F,Xu H,Lin L M,Zhang Z W. 2018. Extraction and detection of flavonols from ca-ssava leaves[J]. Southwest China Journal of Agricultural Sciences,31(8):1694-1699.] doi:10.16213/j.cnki.scjas. 2018.8.024.
王如凤,苗柯,曹方园,方荣俊,潘刚,赵卫国,张林,程嘉翎,刘利. 2019. 桑树二氢黄酮醇-4-还原酶和花青素合酶基因在桑椹中的表达谱及其与花青素含量的关系[J]. 蚕业科学,45(6):790-798.[ Wang R F,Miao K,Cao F Y,Fang R J,Pan G,Zhao W G,Zhang L,Cheng J L,Liu L. 2019. Expression pattern of mulberry dihydroflavonol 4-reductase and anthocyanidin synthase genes and their rela‐tionship with anthocyanidin content in mulberry frui[t J]. Acta Sericologica Sinica,45(6):790-798.] doi:10.13441/j.cnki.cykx.2019.06.002.
武传建,戚骁,李仁赛,封功成,苏静静,葛海军,马代夫,王爱民. 2017. 甘薯IbANR基因的多态性分析[J]. 江苏师范大学学报(自然科学版),35(1):30-33.[ Wu C J,Qi X,Li R S,Feng G C,Su J J,Ge H J,Ma D F,Wang A M. 2017. Polymorphic analyses of IbANR gene from sweetpotato[J]. Journal of Jiangsu Normal University( Natural Science Edition),35(1):30-33.] doi:10.3969/j.issn.2095-4298. 2017.01.007.
杨波,刘海霞,牛铁泉,张鹏飞,梁长梅,赵旗峰,温鹏飞 . 2021. TRV介导的葡萄叶片 VvANR基因瞬时表达分析[J]. 核农学报,35(4):826-836.[ Yang B,Liu H X,Niu T Q,Zhang P F,Liang C M,Zhao Q F,Wen P F. 2021. Tran‐sient ecpression analysis of VrANR gene in grape leaves mediated by TRV[J]. Journal of Nuclear Agricultural Sciences,35(4):826-836.] doi:10.11869/j.issn.100-8551. 2021.04.0826.
余永亮,鲁丹丹,谭政委,杨红旗,李磊,许兰杰,杨青,董薇,安素妨,郭水柱,高松,梁慧珍. 2023. 不同品种忍冬ANR基因克隆、表达模式及原核表达分析[J]. 药学学报,58(11):3449-3460.[ Yu Y L,Lu D D,Tan Z W,Yang H Q,Li L,Xu L J,Yang Q,Dong W,An S F,Guo S Z,Gao S,Liang H Z. 2023. Effects of cassava leaves nutrient compo‐nents on eri-silkworm breeding[J]. Acta Pharmaceutica Sinica,58(11):3449-3460.] doi:10.16438/j.0513-4870. 2023-0608.
张振文,徐缓,吴秋妃,林立铭,李开绵. 2018. 木薯叶花青素提取工艺研究[J]. 热带作物学报,39(3):570-574.[ Zhang Z W,Xu H,Wu Q F,Lin L M,Li K M. 2018. Extraction of anthocyanin from cassava leaves[J]. Chinese Journal of Tropical Crops,39(3):570-574.] doi:10.3969/j.issn.1000-2561.2018.03.026.
Albert S,Delseny M,Devic M. 2010. BANYULS,a novel negative regulator of flavonoid biosynthesis in the Arabi‐dopsis seed coa[t J]. The Plant Journal,11(2):289-299. doi:10.1046/j.1365-313X.1997.11020289.x.
An F F,Xiao X H,Chen T,Xue J J,Luo X Q,Ou W J,Li K M,Cai J,Chen S B. 2022. Systematic analysis of bHLH tran‐scription factors in cassava uncovers their roles in posthar‐vest physiological deterioration and cyanogenic glycosides biosynthesis[J]. Frontiers in Plant Science,13:901128. doi:10.3389/fpls.2022.901128.
An J P,Yao J F,Xu R R,You C X,Wang X F,Hao Y J. 2018. Apple bZIP transcription factor MdbZIP44 regulates abscisic acid-promoted anthocyanin accumulation[J]. Plant Cell and Environment,41(11):2678-2692. doi:10.1111/pce.13393.
Bogs J,Downey M O,Harvey J S,Ashton A R,Tanner G J,Robinson S P. 2005. Proanthocyanidin synthesis and expression of genes encoding leucoanthocyanidin reduc‐tase and anthocyanidin reductase in developing grape be-rries and grapevine leaves[J]. Plant Physiology,139(2):652-663. doi:10.1104/PP.105.064238.
Dela G,Or E,Ovadia R,Nissim-Levi A,Weiss D,Oren-Shamir M. 2003. Changes in anthocyanin concentration and com‐position in ‘Jagua’ rose flowers due to transient high-temperature condition[s J]. Plant Science,164(3):333-340. doi:10.1016/S0168-9452(02)00417-X.
Gargouri M,Gallois B,Chaudière J. 2009. Binding-equilibrium and kinetic studies of anthocyanidin reductase from Vitis vinifera[J]. Archives of Biochemistry and Biophysics,491(1-2):61-68. doi:10.1016/j.abb.2009.09.010.
Han YP,Vimolmangkang S,Soria-Guerra R E,Korban S S. 2012. Introduction of apple ANR gene into tobacco inhi-bits expression of both CHI and DFR gene in flowers,lea-ding to loss of anthocyanin[J]. Journal of Experimental Botany,63(7):2437-2447. doi:10.1093/jxb/err415.
Jaakola L. 2013. New insights into the regulation of anthocya-nin biosynthesis in fruits[J]. Trends in Plant Science,18(9):477-483. doi:10.1016/j.tplants.2013.06.003.
Kong J M,Chia L S,Goh N K,Chia T F,Brouillard R. 2003. Analysis and biological activities of anthocyanins[J]. Phy‐tochemistry,64(5):923-933. doi:10.1016/s0031-9422(03) 00438-2.
Latif S,Müller J. 2015. Potential of cassava leaves in human nutrition:A review[J]. Trends in Food Science & Techno-logy,44(2):147-158. doi:10.1016/j.tifs.2015.04.006.
Luo X Q,An F F,Xue J J,Zhu W L,Wei Z W,Ou W J,Li K M,Chen S B,Cai J. 2023. Integrative analysis of metabo‐lome and transcriptome reveals the mechanism of color for‐mation in cassava (Manihot esculenta Crantz) leaves[J]. Frontiers in Plant Science,14:1181257. doi:10.3389/fpls. 2023.1181257.
Matsui K,Hisano T,Yasui Y,Mori M,Walker A R,Morishita T,Katsu K. 2016. Isolation and characterization of genes encoding leucoanthocyanidin reductase(FeLAR) and an-thocyanidin reductase (FeANR) in buckwheat (Fagopy‐rum esculentum)[J]. Journal of Plant Physiology,205:41-47. doi:10.1016/j.jplph.2016.08.010.
Rabbi I Y,Kayondo S I,Bauchet G,Yusuf M,Aghogho C I,Ogunpaimo K,Uwugiaren R,Smith I A,Peteti P,Agbona A,Parkes E,Lydia E,Wolfe M,Jannink J L,Egesi C,Kulakow P. 2022. Genome-wide association analysis reveals new insights into the genetic architecture of defen‐sive,agro-morphological and quality-related traits in cas‐sava[J]. Plant Molecular Biology,109(3):195-213. doi:10.1007/s11103-020-01038-3.
Shen X J,Zhao K,Liu L L,Zhang K C,Yuan H Z,Liao X,Wang Q,Guo X W,Li F,Li T H. 2014. A role for Pac‐MYBA in ABA-regulated anthocyanin biosynthesis in red-colored sweet cherry cv. Hong Deng (Prunus avium L.) [J]. Plant and Cell Physiology,55(5):862-880. doi:10. 1093/pcp/pcu013.
Weiss D,van der Luit A,Knegt E,Vermeer E,Mol J N M,Kooter J M. 1995. Identification of endogenous gibberel‐lins in petunia flowers (induction of anthocyanin biosyn‐thetic gene expression and the antagonistic effect of abscisic acid)[J]. Plant Physiology,107(3):695-702. doi:10.1104/pp.107.3.695.
Yan P,Zeng Y J,She W T,Tuo D C,Li X Y,Zhou P. 2020. Nimble cloning:A simple,versatile,and efficient system for standardized molecular cloning[J]. Frontiers in Bioen‐gineering and Biotechnology,7:460. doi:10.3389/fbioe. 2019.00460.
Zhang Z,Chen C,Jiang C Y,Lin H,Zhao Y H,Guo Y S. 2024. VvWRKY5 positively regulates wounding-induced antho‐cyanin accumulation in grape by interplaying with VvMYBA1 and promoting jasmonic acid biosynthesis[J]. Horticulture Research,11(5):uhae083. doi:10.1093/hr/uhae083.
