累及甲状腺的朗格汉斯细胞组织细胞增生症的临床病理分析
2024-02-08金哲仵倩林岚唐峰△
金 哲 仵 倩 林 岚 唐 峰△
(1复旦大学附属眼耳鼻喉科医院病理科 上海 200031; 2复旦大学附属华山医院病理科 上海 200040)
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)是一种以朗格汉斯细胞单克隆增殖所致的疾病。该病好发于儿童,在15 岁以下的儿童中发病率约为5/100 万人,在15 岁以上的人群中发病率约为1/100 万人。LCH 根据病变部位分为单系统LCH 和多系统LCH。病变可发生于任何器官,最常见的是骨(约占80%),其次是皮肤(33%)、垂体(25%),也可累及肝、脾、骨髓、肺、淋巴结等[1]。发生于甲状腺的LCH 罕见[2],病因尚不明确,且无特异性临床表现和影像学诊断特征,易发生漏诊和误诊。本文收集5 例累及甲状腺的LCH 病例进行回顾性分析,并结合国内外文献,总结其临床病理特征,以提高对该病的认知和诊断水平。
资 料 和 方 法
病例资料收集复旦大学附属华山医院2017年6 月至2022 年11 月病理诊断为LCH 的患者5 例(其中1 例为外院会诊病例),并收集患者相关临床病史、影像学资料和随访资料。本研究为回顾性分析,不涉及患者隐私,豁免知情同意。
方法复旦大学附属华山医院的4 例标本全部经3.7%中性甲醛液固定,常规脱水、石蜡包埋、切片厚4 μm,HE 染色,制片,光镜下观察组织病理形态。免疫组化染色均采用EnVision 两步法。所用抗体CD1α、Langerin 及EnVision 试剂盒均购自福州迈新生物技术有限公司,S100、Ki67 购自上海长岛生物技术有限公司,VIM、CD68购自Dako公司。判读标准:Ki67 阳性定位于细胞核,CD1α 阳性定位于细胞膜,Langerin、VIM、CD68 阳性定位于细胞质,S100 阳性定位于细胞核/细胞质。BRAF V600E 突变检测试剂盒购自厦门艾德生物医药科技股份有限公司,行ARMS-PCR 法,结果按照试剂盒说明书进行判读。参考NCBI 数据库中MAP2K1 基因序列设计引物,2号外显子:正向引物序列为:5’-CCACTTTGGAACAGGACCAACTT-3‘,反向引物序列为5’-CCCCCAGCTCACTGATCTTCT-3’;3 号外显子:正向引物序列为5’-TCCCTTCCTCCCTCTTTCTTTCA-3’,反向引物序列为5’-TGCTCCATGCAGATACTGATCTCG-3’,PCR扩增后进行sanger测序。
结 果
临床特征及超声学检查5 例确诊病例中男性1 例,女性4 例;患者确诊年龄29~57 岁,平均年龄36.6 岁,中位年龄31 岁。5 例患者均以多饮多尿的症状起病,且均有垂体柄增粗的影像学表现。3 例为甲状腺双侧占位,2 例为一侧腺叶占位。病例1 触及颈部肿块,生长迅速,行颈部B 超提示甲状腺左叶下极实质性肿块,TI-RADS 4B 类,外科行“双侧甲状腺部分切除术”;病例2 为会诊病例,伴有浑身乏力、腿部胀痛无力的症状,颈部B 超提示甲状腺两叶极低回声团块,外院行甲状腺粗针穿刺;病例3 伴有月经紊乱,颈部B 超提示甲状腺双侧腺叶内数个低回声区,右叶较大44 mm×19 mm,左叶较大31 mm×16 mm,边界尚清,考虑结节性甲状腺肿,行“左侧甲状腺次全切+右侧甲状腺部分切除术”;病例4 伴有乏力、纳差、记忆力下降及体重下降,行甲状腺功能检查提示甲状腺功能减退,行颈部B 超提示甲状腺两叶见数枚低回声区,左叶中下部较大29 mm×15 mm,边界清,TI-RADS 3 类,行PETCT 检查提示鞍上区、胸椎、右侧髂骨、甲状腺多发病变,因鞍区活检手术风险高,行“左侧甲状腺部分切除术”以明确诊断;病例5 行颈部B 超提示甲状腺双叶及峡部见数枚低回声区,边界清,左叶较大32 mm×23 mm,右叶较大44 mm×23 mm,TIRADS 3 类,行PET-CT 检查提示甲状腺两叶肿大伴低密度影,FDG 代谢增高,予甲状腺粗针穿刺活检。5 例均在病理学上确诊为LCH。详见表1、图1。

图1 LCH 的超声表现Fig 1 Ultrasound findings of LCH in thyroid gland
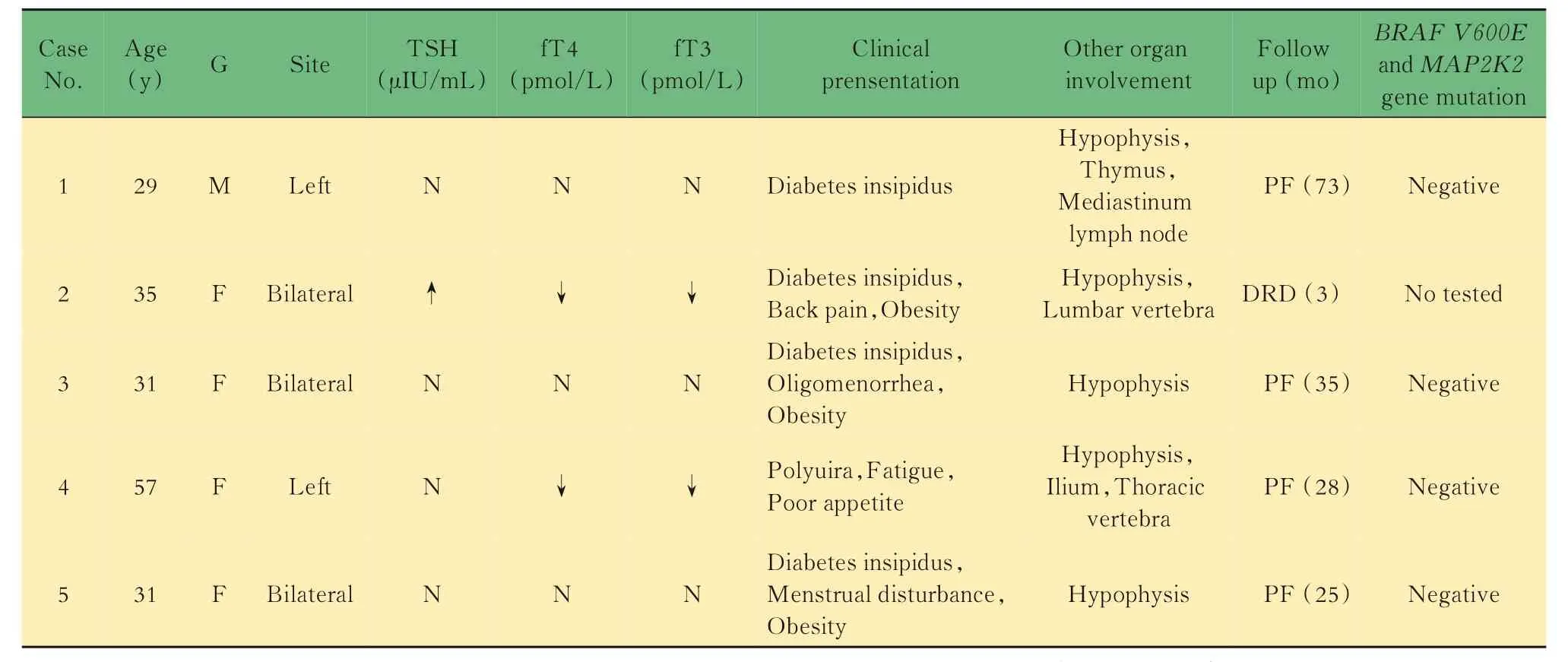
表1 5 例累及甲状腺的LCH 患者的临床病理资料Tab 1 Clinical characteristics of 5 patients with LCH involving thyroid gland
病理学特征3 例手术切除标本在巨检中均表现为灰白、灰黄肿块,质硬,界不清。其中病例1 在术中可见肿块与周围肌肉、结缔组织以及左侧喉返神经有粘连。5 例病例在镜下表现相似,见大量朗格汉斯细胞,细胞含有丰富的嗜酸性胞质,细胞核呈卵圆形,或有纵向核沟,呈咖啡豆样,核仁不明显;多数朗格汉斯细胞呈单个核,亦可见多核,其中病例3 镜下见较多的多核巨细胞,这些多核巨细胞的细胞核形态与周围肿瘤细胞一致,可见明显核沟。镜下见成片淋巴细胞、嗜酸性粒细胞及簇状中性粒细胞浸润;其中病例1 伴有大片坏死,间质胶原化明显,与周围正常甲状腺组织边界不清。另外2 例手术病例与周围甲状腺界限清楚。详见图2。

图2 LCH 的病理学形态(HE 染色)Fig 2 Pathological morphology (HE staining) of LCH
免疫组织化学及分子遗传学特征5 例CD1α、S100、Langerin 均阳性(图3),5 例Ki67 均大于15%,其中会诊病例(病例2) Ki67 高达70%。本院的4 例病例均未检出BRAF V600E和MAP2K1基因突变,会诊病例尚未行分子检测。
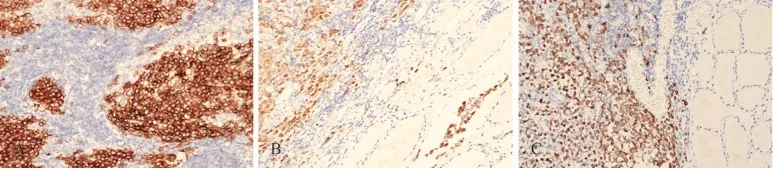
图3 LCH 的免疫组化特征Fig 3 Immunohistochemical characteristics of LCH
治疗及预后病例3 及病例5 为单系统多灶性LCH,其余3 例为多系统LCH,均在确诊后采用长春碱和类固醇联合治疗;其中病例3 在完成12 个治疗周期后,更换治疗方案,行阿糖胞苷化疗。病例2在2 次化疗后仍有背部疼痛难忍,双腿胀痛,浑身乏力、沉重的症状,非甾体类抗炎药物难以缓解,在确诊后3 个月突发死亡,原因不明,临床病例讨论推测死因可能为垂体卒中。其余4 例随访至2023 年8月,均带病生存(表1)。
讨 论
LCH 是一种抗原呈递细胞单克隆增生性疾病。该病好发于儿童,成人中罕见。LCH 可累及任何器官,常见有骨、垂体、皮肤等。而累及甲状腺的LCH少见,成人多于儿童,女性略多于男性[2]。本文5 例病例均为成人,只有病例1 为男性,其余4 例均为女性。孤立性甲状腺LCH 更为罕见,Zhang 等[3]总结了29 例甲状腺LCH,其中7 例为孤立性甲状腺LCH,4 例为单系统多灶性LCH,18 例为多系统LCH。Cai 等[4]总结了36 例累及甲状腺的LCH 病例,仅1 例为单系统LCH,其余35 例均为多系统LCH。本文的5 例病例中,病例3 和病例5 仅伴有垂体受累,为单系统多病灶LCH;其余3 例还伴有其他系统受累,为多系统LCH 累及甲状腺(表1)。
LCH 病因尚不明确,关于LCH 是炎症性疾病还是肿瘤性疾病仍有争议。其病程长,增殖的组织细胞形态温和,伴有特征性的炎症细胞浸润,表明LCH 可能是一种炎症性疾病。2010 年,Badalian-Very 等[5]报道了61 例LCH,其中57%的病例发生了BRAF V600E基因突变,故他们更倾向于LCH是一种肿瘤性病变。
临床特征LCH 的临床表现取决于甲状腺受累情况,可表现为甲状腺无痛性肿大、甲状腺功能异常等,甚至可以出现颈部压迫症状。当LCH 累及甲状腺时,通常肿块较大,本文收集的5 例病例,肿块最大径均大于2 cm,其中病例3 最大径超过5 cm。文献[3,6]报道部分患者甲状腺功能正常(41%),约20%的患者甲状腺功能减退。在本文的5 例病例中,有2 例患者表现为甲状腺功能减退,其余3 例甲状腺功能正常(表1)。
多病灶LCH 可伴有其他全身症状。成人多系统LCH 有无甲状腺受累,具有不同的临床特点。Cai 等[4]分析比较了228 例成人多系统LCH,其中35例累及甲状腺,193 例无甲状腺受累,结果显示甲状腺受累的患者垂体、淋巴结受累的频率更高,而骨受累的频率较低。本文的5 例病例均有垂体受累,与文献报道相符。且病例3 和病例5 还伴有月经紊乱的临床表现,推测其垂体-性腺轴可能受累。
然而,不论是孤立性甲状腺LCH,还是多病灶LCH 的患者,甲状腺的病理学诊断对于明确患者病情都具有重要作用。甲状腺作为浅表器官,相比于垂体、椎体、肝脏等其他器官,不论是穿刺活检,抑或是手术切除,都具有操作风险小、易获得组织病理的特点。本文的5 例病例均通过甲状腺的病理学诊断结合其他部位影像学检查结果来支持多病灶LCH 这一诊断。
超声检查甲状腺LCH 在超声下无特异性的诊断特征,可见腺叶内数枚低弱回声区,边界清,范围较大,甚至可占据整个腺叶,无明显异常血流信号。恶性特征不明显,常诊断为TI-RADS 3 类。超声下与结节性甲状腺肿难以区分。
组织病理学特点病理诊断是LCH 确诊的金标准。甲状腺LCH 在巨检中常表现为灰白、灰黄质硬肿块,与周围甲状腺组织边界不清,甚至可以与甲状腺周围肌肉及结缔组织粘连。甲状腺LCH 镜下表现与其他部位的LCH 相似,表现为结节状或弥漫成片的朗格汉斯细胞,可浸润于甲状腺滤泡之间并破坏正常滤泡结构。细胞含有丰富的嗜酸性胞质,细胞核可呈卵圆形、肾形或咖啡豆样,有纵向核沟,核仁不明显,可见核分裂象;伴有淋巴细胞、浆细胞、嗜酸性粒细胞浸润;可有大量嗜酸性粒细胞聚集,形成脓肿或肉芽肿,可伴有坏死。间质内常有丰富的胶原沉积。常伴有慢性淋巴细胞性甲状腺炎的背景。免疫组化显示肿瘤细胞表达CD1α、S100、VIM、Langerin,部分病例CD68 阳性。电镜下,细胞质内可见大量特征性的Birbeck 颗粒。朗格汉斯细胞是体内唯一含有Birbeck 颗粒的细胞,它是由C 型凝集素Langerin 组成的独特的细胞器[7],这也是LCH 中Langerin 阳性表达的原因,可与其他组织细胞疾病相区分。
分子学改变甲状腺LCH 可以和其他甲状腺疾病共存,如慢性淋巴细胞性甲状腺炎、甲状腺乳头状癌、Graves 病等。这些其他疾病的存在大大增加了诊断难度。Mohammad 等[8]总结了13 例LCH和甲状腺乳头状癌共存的病例,它们可以发生在同侧腺叶,也可以分别在两侧腺叶发生。目前推测这两种疾病在甲状腺中共存可能与BRAF V600E基因的突变有关,组织内这种微环境的改变诱导了另外一种疾病的发生。除了BRAF 突变外,LCH 还存在其他分子遗传学改变。有研究[9]显示,BRAF 并不是MAPK 通路中唯一的致病性突变基因,在BRAF V600E未发生突变的LCH 患者中,约有50%在MAP2K1基因中检测到了突变,BRAF和MAP2K1突变的互斥性提示MAPK 通路在LCH 中起了重要作用。另外,还有少部分病例发生了KRAS、NRAS或ARAF突变[1]。
本文收集的5 例病例中,有4 例进行了BRAF V600E和MAP2K1突变分子学检测,结果均为野生型(表1)。Tong 等[10]报道了18 例以皮肤和肺为主要受累器官的中国成人LCH 病例,均无BRAF V600E突变,他们猜测在LCH 中,BRAF V600E的突变与患者种族、年龄以及受累器官相关。Alayed等[11]检测了50 例LCH,结果发现成人BRAF V600E突变率低于儿童,且其中甲状腺受累的2 例病例均无BRAF V600E和MAP2K1突变。回顾Badalian-Very 等[5]所报道的病例,BRAF V600E突变主要发生在累及骨骼的LCH 患者中,且15 岁以下的儿童突变率高。Cai 等[4]检测了14 例甲状腺受累的成人LCH 病例,其中仅2 例发生了BRAF V600E突变,1 例发生了MAP2K1突变,而有8 例发生了BRAF N486_P490 片段的缺失。他们猜测成年患者的多系统LCH 与BRAF 缺失突变有关,尤其是垂体、甲状腺受累的患者。结合本文4 例病例的分子学检测结果,我们推测,甲状腺受累的成人LCH 病例可能存在BRAF V600E和MAP2K1低突变率的分子学特征,本文的病例是否也存在BRAF缺失突变,需后续进一步研究检测。
细胞学检查甲状腺LCH 的术前穿刺病理诊断相当困难,尤其是在甲状腺细针穿刺(fine-needle aspiration,FNA)中,容易发生误诊。甲状腺LCH的细胞涂片通常表现为分散或疏松成团的非典型单核细胞,细胞核淡染,核膜不规则,可见纵向核沟。背景中可见不同程度的淋巴细胞、中性粒细胞和嗜酸性粒细胞,偶可见多核巨细胞[2,12]。据文献[6,13]报道,甲状腺LCH 的细胞涂片曾被误诊为淋巴细胞性甲状腺炎、不典型滤泡上皮细胞、甲状腺乳头状癌、甲状腺髓样癌以及低分化癌伴嗜酸性粒细胞浸润等。当我们在临床病理工作中碰到此类情况,尤其是遇上非典型的大细胞伴有嗜酸性粒细胞的背景时,要注意排除甲状腺LCH,必要时用包埋块加做免疫组化进行鉴别。 此外,当临床怀疑甲状腺LCH 时,尤其对于原因不明的垂体柄病变伴有甲状腺异常超声表现时,更建议通过甲状腺粗针穿刺的组织病理学检查来帮助诊断。
鉴别诊断发生于甲状腺的LCH 需要与甲状腺炎症性病变以及其他组织细胞疾病相鉴别。(1)亚急性肉芽肿性甲状腺炎:又称亚急性甲状腺炎,好发于中青年女性,可局限于甲状腺一侧或双侧,临床上表现为甲状腺肿大及压痛。电镜下示由组织细胞、多核巨细胞形成的肉芽肿性炎,间质内有较多嗜酸性粒细胞、淋巴细胞和浆细胞浸润。其组织细胞的细胞核不具有朗格汉斯细胞的核特征,不表达CD1α、Langerin,可与LCH 鉴别。亚急性甲状腺炎是一种自限性疾病,数周或数月后可自行消退。(2)甲状腺乳头状癌(papillary thyroid carcinoma,PTC):是甲状腺最常见的恶性肿瘤,同样好发于成年女性,男女比例约为1∶3。PTC 具有多种亚型,其诊断标准主要依据细胞形态,包括毛玻璃样细胞核、核沟和相互重叠的核。PTC 可同时合并慢性淋巴细胞性甲状腺炎的背景,需要与甲状腺LCH 的炎症特征相鉴别。 45%~80% 的PTC 可发生BRAF V600E基因突变,仅依靠分子学改变难以与甲状腺LCH 鉴别。在免疫组化上,两者有较大差异,PTC表达TTF1、PAX8、CK19、Galectin3 等,可通过免疫组化鉴别。(3)甲状腺未分化癌(undifferentiated carcinoma,UTC):是恶性程度最高的肿瘤之一,多见于老年女性,表现为迅速增大的颈部肿块。UTC体积大,巨检呈灰白至灰褐色,鱼肉样,常伴出血坏死,大多数肿块与周围组织边界不清。UTC 的组织学形态取决于梭形细胞、鳞状或上皮样细胞、巨细胞3 种主要细胞成分,表现为以梭形和巨细胞为主的肉瘤样形态和以上皮样细胞为主的癌样形态。其巨细胞多形性明显,有奇异核及丰富的嗜酸性胞质,无朗格汉斯细胞典型的核特征。肿瘤内常有显著的炎症背景,但以中性粒细胞及淋巴细胞为主,而LCH 常以淋巴细胞、嗜酸性粒细胞为主。UTC 通常表达CK 和PAX8,不表达CD1α、Langerin 等LCH 的免疫组化标记[14]。(4)Erdheim-Chester 病(Erdheim-Chester disease,ECD):ECD 是一种罕见的非朗格汉斯细胞组织细胞增生性疾病,好发于四肢长骨、扁骨,可累及多系统,包括中枢神经系统、皮肤、肺、心血管系统等,也可累及甲状腺。当发生于中枢神经系统(central nervous system,CNS)时,可出现中枢性尿崩症。电镜下表现为富含脂质的泡沫样组织细胞沉积,伴有淋巴细胞、浆细胞、多核巨细胞浸润[15]。免疫组化阳性表达CD68、CD138,不表达CD1α、S100、Langerin,电镜下无特征性的Birbeck 颗粒。50%的ECD 可发生BRAF V6000E突变[1]。ECD 可与LCH 在同一器官中同时存在,也有ECD、LCH 以及甲状腺乳头状癌三者在甲状腺中共存的病例报道,推测可能与BRAF V600E突变有关[16]。(5)Rosai-Dorfman 病(Rosai-Dorfman disease,RDD):RDD 是一种不明原因的良性组织细胞增生性疾病,主要累及淋巴结,常表现为局部淋巴结无痛性肿大。约1/3的病例有结外器官受累,包括皮肤、骨、上呼吸道、中枢神经系统等,多系统RDD 也可累及甲状腺[16-17]。其特征的形态学表现为组织细胞增生伴淋巴细胞伸入。其组织细胞形态不规则,细胞核空泡状,核仁清楚;“伸入”的细胞为淋巴细胞、浆细胞和红细胞,罕见嗜酸性粒细胞。这种良性增生的组织细胞S100 强阳性,而CD1α、Langerin 阴性。也有RDD 和LCH 在同一患者中同时或先后确诊的病例报道[18]。
治疗及预后甲状腺LCH 预后差别大,与是否累及其他器官密切相关。由于其罕见性,目前对于甲状腺LCH 没有标准的治疗方案。单病灶甲状腺LCH 通常行手术切除治疗[3]。多病灶LCH 累及甲状腺者,以全身治疗为主,常选用长春碱和类固醇联合治疗。当甲状腺肿大出现颈部压迫症状时,应通过手术缓解,必要时甚至应行甲状腺全切。当甲状腺LCH 和PTC 共存时,PTC 的治疗应不受LCH的干扰,手术治疗PTC 后再结合全身症状治疗LCH[19]。存在BRAF V600E或MAP2K1突变的患者,可以选用相应抑制剂治疗。
综上所述,甲状腺LCH 罕见,多数病例为多系统LCH 累及甲状腺,常伴有垂体病变以及垂体前叶功能减退的症状。相比于其他受累器官,甲状腺更易获得活检组织,故其病理学诊断对患者后续治疗至关重要。在实际临床病理工作中,当我们面对非典型的甲状腺病变时,需考虑诊断为LCH 的可能性,并结合患者临床症状、影像学检查以及免疫组化结果来明确诊断。
作者贡献声明金哲 论文构思、撰写和修订,病例采集。仵倩 论文构思,数据收集。林岚论文审校。唐峰 论文构思、指导和修订。
利益冲突声明所有作者均声明不存在利益冲突。
