HNRNPF 促进前列腺癌的增殖、迁移和侵袭
2024-02-08王适雨谢雪锋
王适雨 谢雪锋 陈 刚△
(1复旦大学附属金山医院临床医学研究中心, 2泌尿外科 上海 201508)
前列腺癌是男性中最常见的恶性肿瘤,严重威胁男性身体健康[1]。早期局限性前列腺癌可通过根治性切除术得到较好的疗效,而进展期前列腺癌一般行雄激素剥夺治疗[2],但是多数行雄激素剥夺治疗的进展期前列腺癌患者会逐渐发展至去势抵抗阶段[3],此时患者会面临很高的死亡风险[2]。因此,有必要寻找影响前列腺癌发生发展的新的靶点。
核不均一核糖核蛋白F(heterogeneous nuclear ribonucleoproteins F,HNRNPF)是HNRNP 蛋白家族的成员之一,其可以与核不均一RNA(heterogeneous nuclear RNA,hnRNA)结合,在基因表达调控中发挥重要作用,可以影响hnRNA 的剪接和修饰、mRNA 的成熟和稳定性以及mRNA 的核浆转运等过程[4]。HNRNPF 在人体各器官组织中广泛表达,且在前列腺中的表达非常丰富[5]。已有多项研究报道HNRNPF 在多种恶性肿瘤中呈高表达[6-7],提示HNRNPF可能是一个重要的原癌基因。目前HNRNPF 在前列腺癌中的表达特征和生物学功能尚不明确。
本研究首先对HNRNPF 在前列腺癌中的表达特征及其与前列腺癌患者临床病理特征之间的相关性进行了分析,然后通过细胞生物学实验探究其对前列腺癌细胞PC-3 和DU145 的增殖、迁移和侵袭能力的影响。本研究有助于提高对于HNRNPF在前列腺癌中作用的认识,有望为探索新的前列腺癌诊疗靶点提供帮助。
材 料 和 方 法
数据库和数据集癌症基因组图谱(The Cancer Genome Atlas,TCGA)是一个收集了多种恶性肿瘤的患者临床数据及相应基因表达数据的公共数据库[8],本研究分析了HNRNPF 在TCGA数据库中的前列腺癌数据集中的表达特征、免疫浸润特征和临床相关性。基因表达数据库(Gene Expression Omnibus,GEO)是一个储存高通量芯片或测序数据集的公共数据库[9],本研究分析了HNRNPF 在GEO 数据库中的6 个前列腺癌数据集(GSE35988、GSE46602、GSE60329、GSE69223、GSE70770、GSE114740)中的表达特征。
细胞培养人前列腺癌细胞PC-3、DU145 和人胚胎肾细胞HEK293T 采购自上海富衡生物科技有限公司。PC-3 细胞使用DME/F12 培养基(美国Hyclone 公司),DU145 和HEK293T 细胞使用DMEM 高糖培养基(美国Gibco 公司)。培养基中添加10%胎牛血清(以色列Biological Industries 公司)和1%青霉素-链霉素溶液,细胞培养于37 ℃恒温、5%CO2、潮湿的环境中。
质粒的构建和转染靶向HNRNPF mRNA 的shRNA 序列如下(5’-3’):sh-HNRNPF1,AGCGACCGAGAACGACATTTACTCGAGTAAATGTCGTTCTCGGTCGCTTTTTT;sh-HNRNPF2,TGGATCAGAAGATGATGTAAACTCGAGTTTACATCATCTTCTGATCCATTTTT。以无意义shRNA 为对照:shNC,TTCTCCGAACGTGTCACGTCTCGAGACGTGACACGTTCGGAGAATTTTT。 将上述序列克隆至载体质粒pLKO.1-Puro 中,与辅助质粒pMD2.G 和pSPAX2共转染至HEK293T 细胞中,收集病毒上清液感染前列腺癌细胞PC-3 和DU145,使用2 μg/mL 的嘌呤霉素筛选获得稳定表达的细胞。
RNA 提取和实时定量PCR使用RNA 快速提取试剂盒(上海奕杉生物科技有限公司)提取细胞中的总RNA。使用PrimeScript RT Master Mix(日本Takara 公司)进行逆转录。使用BeyoFast SYBR Green qPCR Mix(2×,High ROX,上海碧云天生物技术有限公司)进行实时定量PCR。以β-actin 为内参基因,使用2-ΔΔCT法计算基因相对表达量。本研究所用引物序列如下(5’-3’):HNRNPF,ACTGCCAGGAGGTACATTGG(正向)/CTGAGGTCTCTCCCGAACAG(反向);β-actin,CATGTACGTTGCTATCCAGGC(正向)/CTCCTTAATGTCACGCACGAT(反向)。
Western blot 实验使用10%的SDS-PAGE 凝胶分离蛋白,然后将蛋白质电转移到经甲醇激活的PVDF 膜(美国Millipore 公司)上,使用5%的脱脂牛奶封闭PVDF 膜30 min,使用HNRNPF 和GAPDH(美国Proteintech 公司)一抗在 4 ℃下孵育过夜,使用偶联辣根过氧化物酶的二抗在室温下孵育1 h。使用ECL 化学发光检测系统记录实验结果。
细胞增殖实验细胞增殖曲线参考Hanniford等[10]报道的实验步骤完成。将前列腺癌细胞以5 000 个/孔的密度铺至96 孔板中,分别培养0、24、48、72 h 后,用4%多聚甲醛固定液固定细胞,然后使用1%结晶紫染液对细胞进行染色,洗涤后使用分光光度计检测595 nm 波长处的吸光度值,绘制吸光度随培养时间变化的曲线;EdU 实验使用Alexa Fluor 555 EdU 细胞增殖检测试剂盒(上海碧云天生物技术有限公司)完成,使用倒置荧光显微镜(日本Olympus 公司)进行拍摄;集落形成实验:将前列腺癌细胞以1 000 个/孔的密度铺至6 孔板中培养14天,使用4%多聚甲醛溶液固定细胞,使用1%结晶紫染液对细胞进行染色。
细胞迁移、侵袭实验Transwell 实验:在Transwell 上层小室中加入4 万个(DU145)或8 万个(PC-3)细胞,使用无血清培养基重悬,体积统一为100 μL。在下层小室中加入500 μL 含有20%胎牛血清的DMEM 或DME/F12 培养基。置于细胞培养箱中继续培养24 h(DU145)或48 h(PC-3)后,使用4%多聚甲醛固定液固定细胞,使用1%结晶紫染液对细胞进行染色,洗涤后使用棉签擦掉上层小室中的细胞,显微镜下观察细胞迁移至下层小室的情况。在每个Transwell 上层小室中加入100 μL 用无血清培养基稀释至250 μg/mL 的Matrigel 基质胶,于细胞培养箱中静置过夜。次日吸弃小室内仍然呈液态的基质胶后,可见小室底面内侧覆盖了一层凝固的基质胶。使用这种经过处理的小室进行上述实验即可检测细胞的侵袭能力。划痕愈合实验:将前列腺癌细胞铺入6 孔板中培养至100%汇合度,使用200 μL 移液器枪头在细胞中划出等宽的划痕,然后将完全培养基更换为无血清培养基,在划痕后0、24、48 h 观察划痕宽度的变化情况。
统计学分析使用R(v.3.6.3)或GraphPad Prism(v.8.0.2)进行统计分析和绘图。使用独立样本t检验(数据服从正态分布)或Wilcoxon 秩和检验(数据不服从正态分布)进行2 组样本间的比较检验,使用单因素方差分析进行3 组样本间的比较检验。P<0.05 为差异有统计学意义。
结 果
HNRNPF 在前列腺癌中高表达本研究分析了GEO 数据库中的6 个前列腺癌数据集(表1),在这些数据集中,HNRNPF 在前列腺癌标本中的表达均显著高于正常前列腺组织(图1A~F)。对TCGA 数据库中配对的前列腺癌样本数据的分析显示,HNRNPF 在前列腺癌标本中的表达显著高于正常前列腺组织(图1G)。
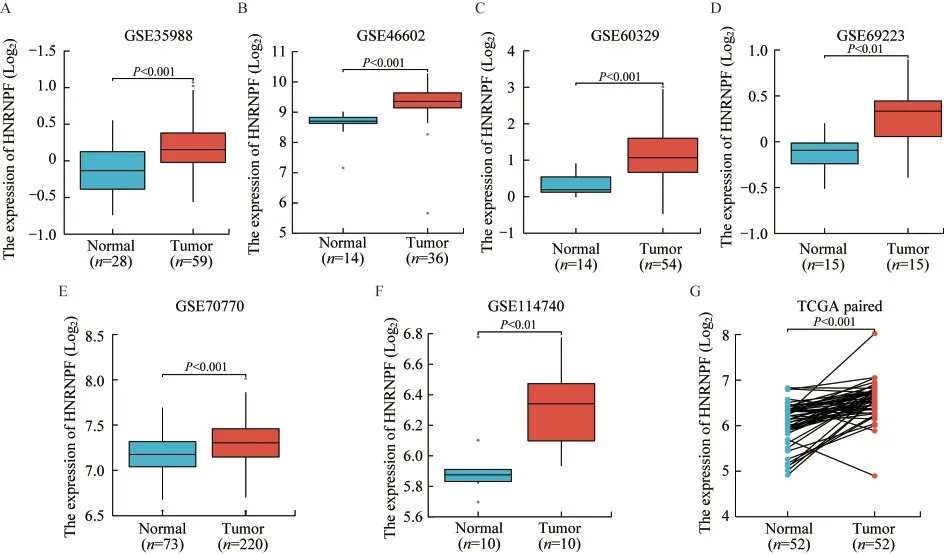
图1 HNRNPF mRNA 在GEO 和TCGA 数据集中的前列腺癌和正常前列腺癌标本中的表达Fig 1 The expression of HNRNPF mRNA in prostate cancer and normal prostate tissues in GEO and TCGA datasets

表1 本研究纳入的GEO 数据集信息Tab 1 Details of GEO datasets included in this study
HNRNPF 与前列腺癌患者临床病理特征之间的相关性临床相关性分析基于TCGA 数据库中前列腺癌患者的临床信息和基因表达数据完成。首先使用Logistic 回归法分析,结果显示HNRNPF表达量更高的患者具有更高的T 分期(P=0.006)和Gleason 评分(P=0.019),与年龄、N 分期、M 分期和前列腺特异性抗原(prostate specific antigen, PSA)水平的关联不显著(表2)。当以不同的临床病理特征对患者进行分组,比较具有不同特征患者的前列腺癌标本中HNRNPF 表达量的差异时,结果显示T分期、PSA 水平、Gleason 评分更高的患者,其前列腺癌标本中HNRNPF 的表达量显著升高(图2A~C)。,HNRNPF 表达量更高的患者,其总生存期和疾病特异性生存期均较短(图2D~E)。
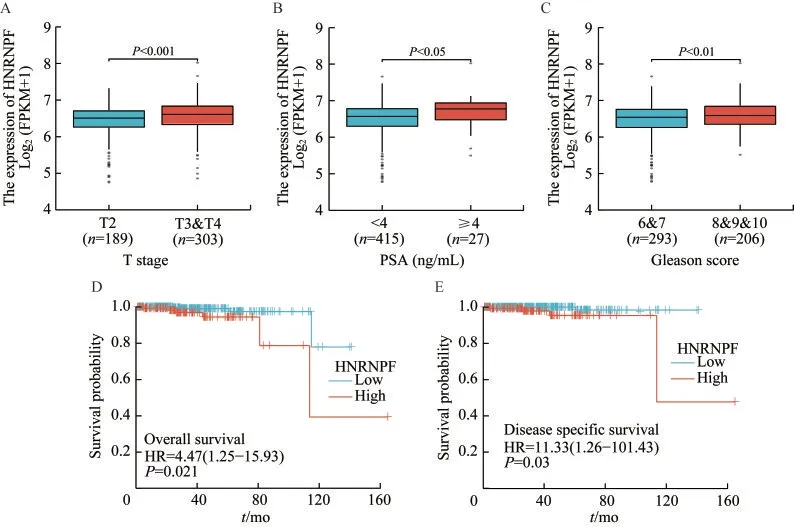
图2 HNRNPF mRNA 表达量与前列腺癌患者临床病理特征之间的相关性Fig 2 Relationship between HNRNPF mRNA expression and clinicopathologic characteristics in prostate cancer
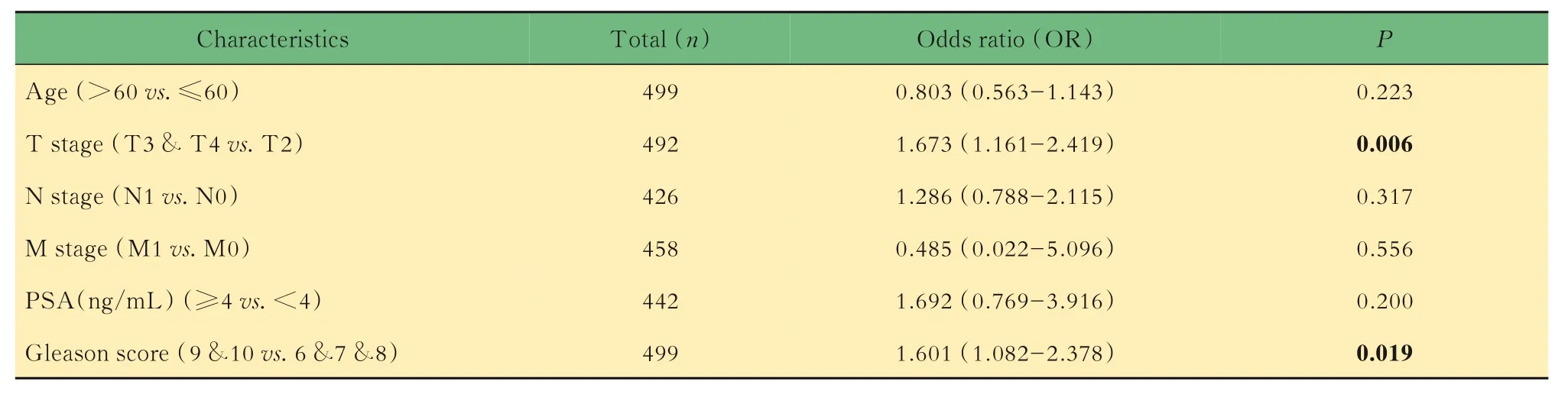
表2 HNRNPF 与前列腺癌患者临床病理特征之间的Logistic 回归分析Tab 2 Logistic regression of HNRNPF expression and clinicopathological characteristics in prostate cancer
HNRNPF 的表达量与肿瘤微环境中免疫细胞浸润相关免疫浸润分析基于TCGA 数据库中前列腺癌数据集的基因表达数据完成。分析结果显示HNRNPF 的表达量与多数类型的免疫细胞的浸润水平呈负相关(图3A),其中与浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC)(图3B、F)和自然杀伤(natural killer,NK)细胞(图3C、G)的负相关程度最为显著。另一方面,HNRNPF 的表达量与2 型辅助型T(T helper 2,Th2)细胞(图3D、H)和中央记忆型T(central memory T,Tcm)细胞(图3E、I)呈较为显著的正相关。
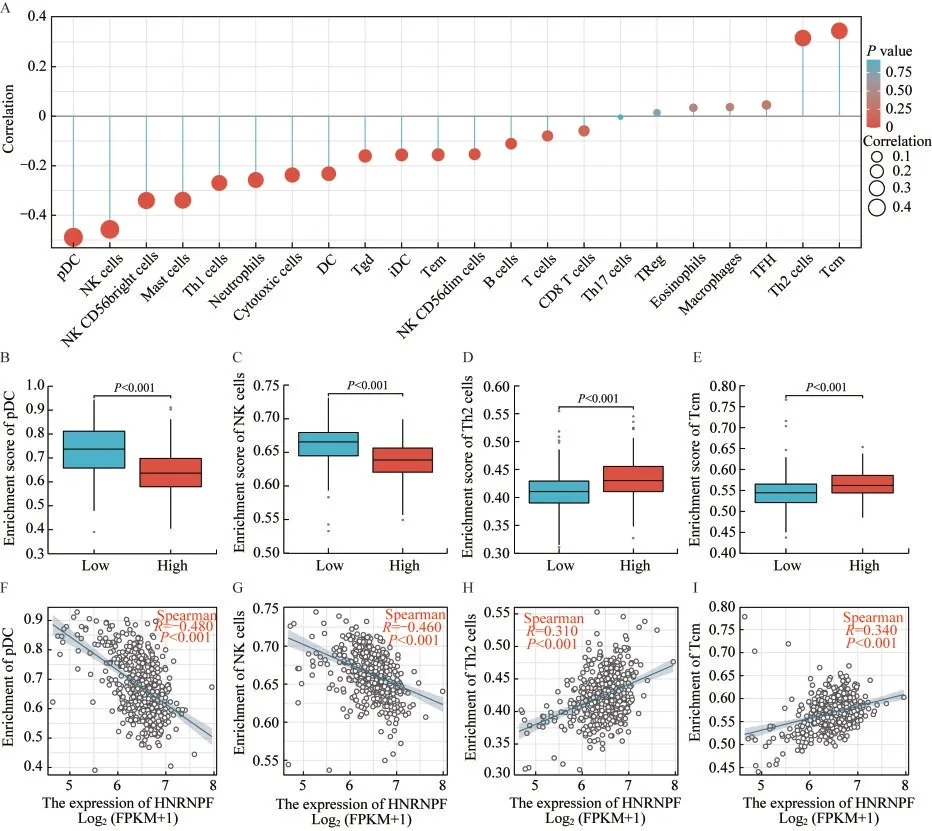
图3 HNRNPF mRNA 表达量与肿瘤微环境中免疫细胞浸润水平的关系Fig 3 Relationship between HNRNPF mRNA expression and immune infiltration in the tumor microenvironment
沉默HNRNPF 基因可抑制前列腺癌细胞增殖能力首先使用RNA 干扰法在前列腺癌细胞系PC-3 和DU145 中成功敲低HNRNPF mRNA 和蛋白质的表达量(图4A~C)。细胞增殖曲线显示沉默HNRNPF后,前列腺癌细胞的生长速度显著降低(图4D~E)。EdU 实验显示,沉默HNRNPF后,EdU 阳性细胞的比例显著下降(图4F~I),这表明固定细胞时正处于分裂增殖状态的前列腺癌细胞比例下降,证明前列腺癌细胞增殖能力受损。此外,HNRNPF被沉默后,前列腺癌细胞形成的单克隆集落的数量和大小均下降(图4J~L),这反映了细胞定植能力和定植后的增殖速度均下降。
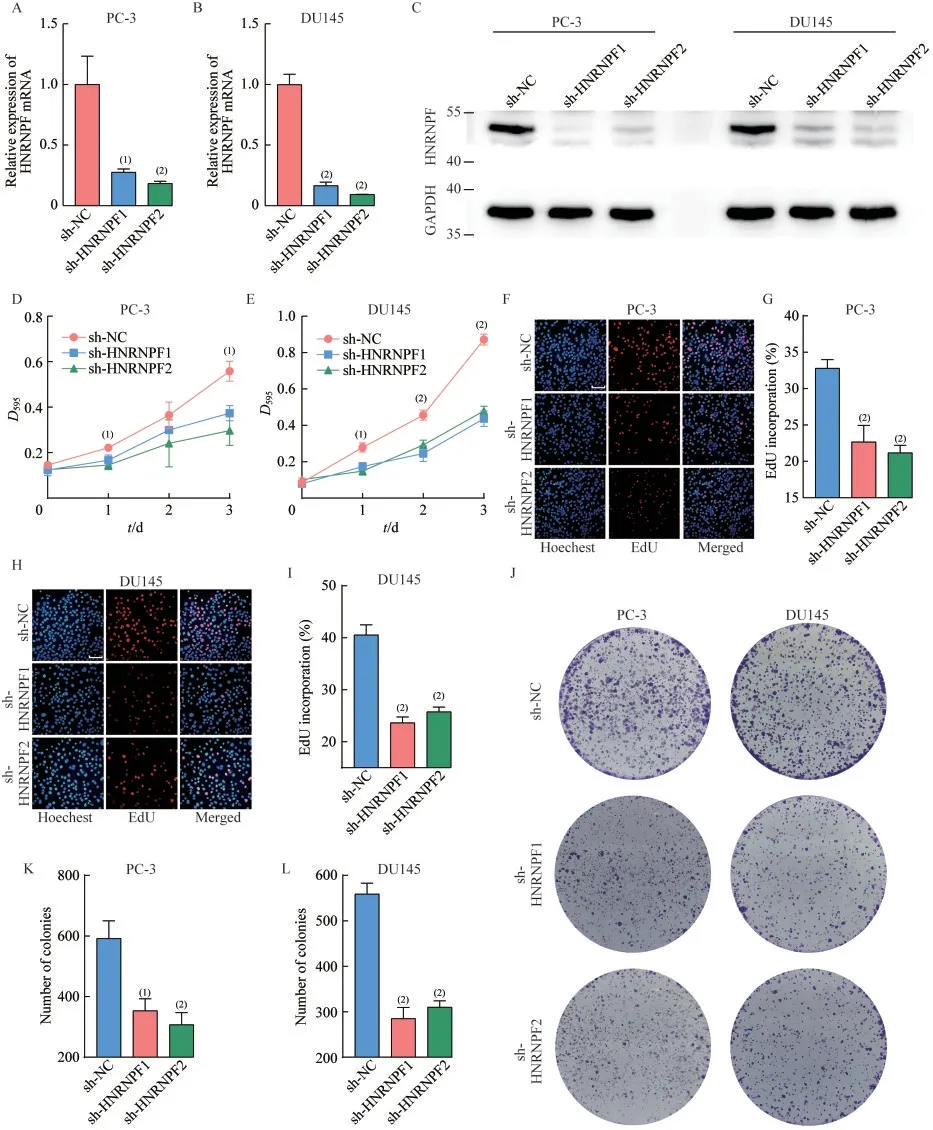
图4 沉默HNRNPF 抑制前列腺癌细胞增殖Fig 4 HNRNPF silencing inhibits prostate cancer cell proliferation
沉默HNRNPF 基因可抑制前列腺癌细胞迁移、侵袭能力Transwell 实验证实沉默HNRNPF后,前列腺癌细胞穿过小孔迁移/侵袭至下层小室的数量显著下降(图5A、B、E、F)。划痕愈合实验证实沉默HNRNPF后,前列腺癌细胞想划痕中线迁移的速度显著降低(图5C、D、G、H)
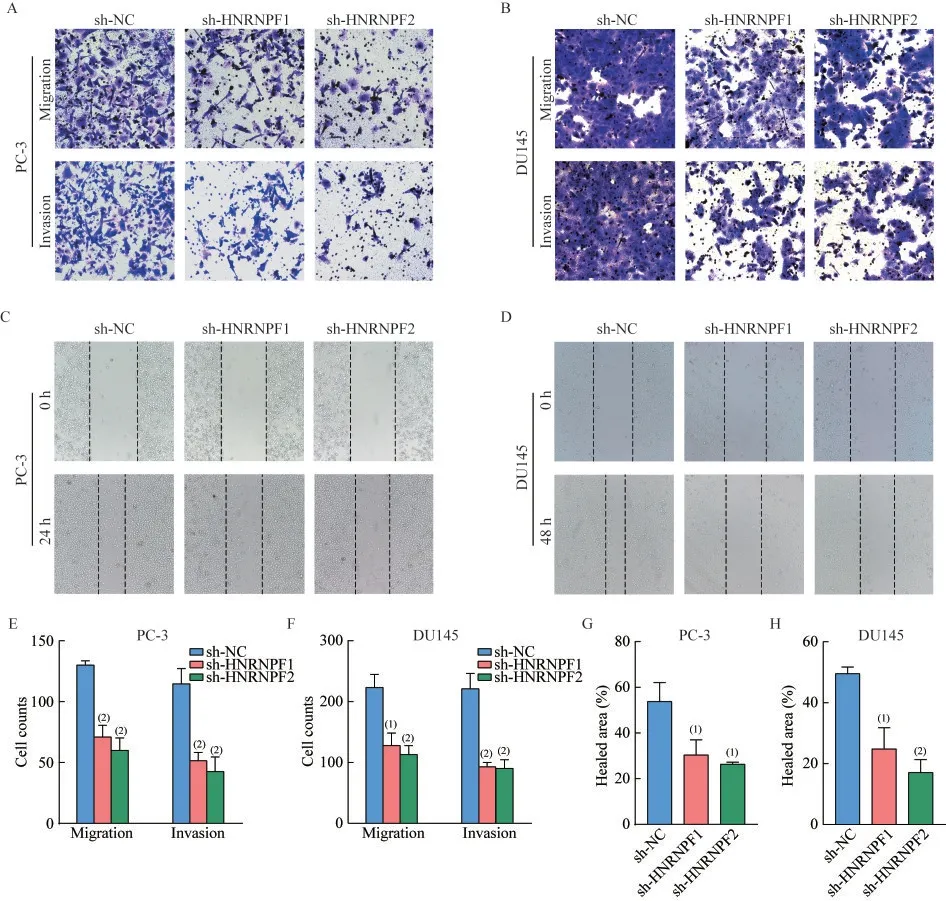
图5 沉默HNRNPF 抑制前列腺癌细胞迁移和侵袭Fig 5 HNRNPF silencing inhibits prostate cancer cell migration and invasion
讨 论
HNRNP 蛋白家族在hnRNA 的剪接、成熟、稳定、转运等过程中发挥重要作用[17]。也有文献报道HNRNP 可以影响circRNA 和lncRNA 的形成[18-19]。已有多个HNRNP 蛋白家族成员被报道具有促癌作用,例如HNRNPA1 可促进肺癌和乳腺癌的进展[20-21];HNRNPA2/B1 对多个癌症细胞系的增殖能力有影响[22];HNRNPL 可促进前列腺癌细胞增殖[19]。
HNRNPF 已被报道与直肠癌、膀胱癌、甲状腺癌等多种癌症的发生发展有关[6,23-24],但目前其在前列腺癌中扮演的角色尚无相关研究,有研究报道HNRNPF 在前列腺组织中的表达非常丰富[5],这提示我们HNRNPF 可能对保持前列腺的正常生理功能非常重要,其表达异常可能会与前列腺疾病的发生发展有关。本研究发现,在多个前列腺癌数据集中,HNRNPF 在前列腺癌组织中的表达量均显著高于癌旁,且癌组织中HNRNPF 的表达量更高的患者其癌症分期更高、预后更差。而沉默前列腺癌细胞中的HNRNPF之后,前列腺癌细胞的增殖、迁移、侵袭能力均有显著下降,但这其中的作用机制尚待研究。
RNA 选择性剪接是真核细胞中广泛存在的生物学过程[25],这一过程的异常可能会导致多种疾病[26]。HNRNPF 是一个重要的选择性剪接调节因子,有文献报道HNRNPF 可通过其3’末端修饰功能促进膀胱癌细胞的迁移和侵袭[23]。还有文献报道HNRNPF 在癌症中可以调节RNA G-四链体介导的RNA 翻译和RNA 剪接[27]。Montero-Conde等[24]通过高通量测序发现沉默HNRNPF后,细胞中出现174 项剪接异常,这些异常会影响RTK/RAS/MAPK 和PI3K/AKT/MTOR 等多个癌症相关信号通路。
免疫细胞浸润和免疫微环境对前列腺癌发生发展也具有重要影响[28]。本研究发现HNRNPF 的表达量与前列腺癌肿瘤微环境中pDC 和NK 细胞的浸润呈负相关,与Tcm 和Th2 细胞的浸润呈正相关。pDC 可以分泌大量Ⅰ型干扰素,促进抗肿瘤免疫[29];NK 细胞可以直接杀伤肿瘤细胞并增强抗体和T 细胞的抗肿瘤功能[30]。pDC 和NK 细胞的缺失已被报道与多种恶性肿瘤的发生发展相关[31-32]。Tcm 是原始T 细胞经抗原刺激后产生的记忆细胞,其本身不直接发挥功能,而是当其再次接受相同抗原刺激后转化为效应记忆T(effector memory T,Tem)细胞发挥功能[33]。Th2 细胞主要在2 型免疫途径中发挥辅助作用,提高抗体的产生以应对外源性病原体[34]。目前未见Tcm 和Th2 细胞与癌症直接相关的报道。
综上所述,本研究发现HNRNPF 在前列腺癌中呈高表达,高表达HNRNPF 的患者具有更高的癌症分期和更短的生存期,在前列腺癌细胞中沉默HNRNPF可显著抑制前列腺癌细胞的增殖、迁移、侵袭能力。本研究提示HNRNPF 能够促进前列腺癌的恶性进展,显著的临床相关性使其具有成为前列腺癌诊断或预后评估标志物的潜力。
作者贡献声明王适雨 实验设计和执行,数据整理和分析,论文撰写和修订。谢雪锋 数据整理和分析。陈刚 实验设计和指导,论文修订。
利益冲突声明所有作者均声明没有利益冲突。
