桃蚜组织蛋白酶基因CTSB 16D和CTSB 348的克隆、表达谱及对不同环境胁迫的响应
2024-02-06姜万千杨磊孟建玉杨昌利张长禹
姜万千 杨磊 孟建玉 杨昌利 张长禹
摘要
為了探索组织蛋白酶基因CTSB16D和CTSB348在桃蚜Myzus persicae(Sulzer)响应高低温和UVB胁迫中的作用,通过RTPCR技术克隆了桃蚜CTSB16D和CTSB348基因,利用生物信息学方法分析了它们的序列特征;采用实时荧光定量PCR(quantitative realtime PCR,RTqPCR)技术检测了2个基因在桃蚜不同发育阶段的相对表达量及经高温、低温和UVB胁迫不同时长的无翅成虫中的相对表达量。克隆获得了桃蚜CTSB16D(GenBank登录号:MZ962352)和CTSB348(GenBank登录号:MZ962353)基因,序列长度分别为1 096 bp和1 101 bp,开放阅读框(ORF)分别为1 017 bp和1 023 bp,分别编码338个和340个氨基酸,蛋白相对分子量为38.14 kD和37.52 kD,等电点(pI)为5.46和5.99。系统发育分析表明,桃蚜CTSB16D和CTSB348均与豌豆蚜Acyrthosiphon pisum (XP_003246386.1、NP_001119608.1) CTSB亲缘关系最近。RTqPCR分析表明,CTSB16D和CTSB348在桃蚜不同发育阶段均有表达,分别在1龄若虫和无翅成虫中的表达量最高。高、低温和UVB胁迫对CTSB16D和CTSB348基因的表达具有明显的诱导作用,且表达量均随时间的延长呈先上升后下降的趋势;4℃胁迫下,CTSB16D和CTSB348表达量均在90 min时达到峰值;36℃胁迫下,CTSB16D和CTSB348表达量均在30 min时达到峰值;UVB胁迫下,CTSB16D和CTSB348表达量分别在60 min和120 min时达峰值。桃蚜CTSB16D和CTSB348基因在不同发育阶段差异表达,且响应温度和UVB的胁迫,推测两个基因参与桃蚜的生长发育并在桃蚜响应环境胁迫中发挥了重要作用。
关键词
桃蚜; 组织蛋白酶; 基因克隆; 表达分析
中图分类号:
S 433
文献标识码: A
DOI: 10.16688/j.zwbh.2022811
Cloning and expression profiling of the cathepsin genes CTSB16D and
CTSB348 and their response to different environmental stresses in
Myzus persicae (Hemiptera: Aphididae)
JIANG Wanqian1, YANG Lei2, MENG Jianyu3, YANG Changli1, ZHANG Changyu1*
(1. Guizhou Provincial Key Laboratory for Agricultural Pest Management in the Mountainous Region, Institute of
Entomology, Guizhou University, Guiyang 550025, China; 2. China Tobacco Hunan Industrial Co., Ltd.,
Changsha 410007, China; 3. Guizhou Research Institute of Tobacco Science, Guiyang 550081, China)
Abstract
To explore the role of CTSB16D and CTSB348 of Myzus persicae (Sulzer) in response to high and low temperature and UVB stresses, they were cloned by RTPCR and their sequence characteristics were analyzed using bioinformatics approaches. The relative expression levels of the two genes in aphids at different developmental stages and in wingless adults exposed to high temperature, low temperature and UVB stresses for different durations were detected by quantitative realtime PCR (RTqPCR). The sequences of CTSB16D and CTSB348 (GenBank acc. nos. MZ962352 and MZ962353) were 1 096 bp and 1 101 bp in length, with an open reading frame of 1 017 bp and 1 023 bp, encoding 338 and 340 amino acids, respectively. The relative molecular weight of the proteins are 38.14 kD and 37.52 kD, with an isoelectric point of 5.46 and 5.99, respectively. Phylogenetic analysis showed that both CTSB16D and CTSB348 had the closest relationship with CTSB of Acyrthosiphon pisum (XP_003246386.1, NP_001119608.1). RTqPCR analysis showed that the two genes were expressed at different developmental stages, with the highest expression levels of CTSB16D and CTSB348 in the 1stinstar nymph and wingless adults, respectively. Low and high temperature and UVB stresses obviously induced the expression of CTSB16D and CTSB348 genes, and the expression increasing first and then decreased with increasing exposure time. Under 4℃, the expression levels of CTSB16D and CTSB348 reached the peak after 90 min exposure, respectively, but under 36℃, their expression reached the peak after 30 min exposure. Under UVB stress, the expression levels of CTSB16D and CTSB348 peaked after 60 min and 120 min exposure, respectively. The different expressions of CTSB16D and CTSB348 at different developmental stages and their different responses to temperature and UVB stresses suggested that the two genes were involved in the growth and development of M.persicae in response to environmental stresses.
Key words
Myzus persicae; cathepsin; gene cloning; expression analysis
组织蛋白酶(cathepsin,CTS)是一类存在于溶酶体中的胞内蛋白酶,以酶原形式在核糖体中合成,并通过高尔基体糖基化和磷酸化后转运至溶酶体内[12]。根据活性中心的氨基酸残基可将组织蛋白酶分为3大类:半胱氨酸蛋白酶(CTSB、CTSF、CTSH、CTSL、CTSK、CTSO、CTSS、CTST、CTSV、CTSX和CTSW)、天冬氨酸蛋白酶(CTSD和VE)、丝氨酸蛋白酶(CTSA和CTSG)[3]。组织蛋白酶作为一种多功能蛋白酶系,在昆虫的生长发育、细胞凋亡、免疫和生物及非生物胁迫等过程中发挥作用[4]。例如饥饿条件下,水稻二化螟Chilo suppressalis CTSO和CTSL基因表达量上调,表明两基因编码的酶参与了肠道内蛋白质的消化[5]。家蚕Bombyx mori CTSL参与应对大肠杆菌、球孢白僵菌和蜡样芽胞杆菌的应激反应,推测其在昆虫的先天免疫系统中具有重要作用[6]。Song等[7]发现菜蛾盘绒茧蜂Cotesia vestalis寄生的小菜蛾Plutella xylostella体内CTSB水平会显著升高,推测CTSB可能参与免疫响应。
温度作为一种重要的非生物环境胁迫因子,会对昆虫的生长发育、生物学特性和种群动态造成影响[810]。极端温度(高温和低温)胁迫可能导致昆虫的发育历期延长、寿命缩短和繁殖力降低[1113]。为了减小由环境热或冷胁迫而造成的损伤,昆虫已经进化出了多种保护策略来增加它们的耐受性,进而适应多变的环境[14]。高温诱导家蚕5龄幼虫CTSB和CTSD的高表达,导致幼虫期缩短提前化蛹[1516]。柑橘木虱Diaphorina citri成虫在高温(40℃)胁迫下CTSB的表达水平显著上调,表明其积极参与柑橘木虱对高温胁迫的防御响应[17]。
紫外线B(UVB)(280~320 nm)是到达地球的最强光波,能够被大气中的臭氧层有效吸收,但仍约有10%穿透臭氧层并到达地球[18]。研究表明,CTSB在UV诱导下作为一种促凋亡介质,从溶酶体释放到细胞质基质,从而诱导细胞凋亡[19]。UVB辐射可导致昆虫体内活性氧(ROS)的形成和积累,从而对DNA、蛋白质、碳水化合物和脂质等造成破坏,并影响生长发育、生理生化和种群结构[2021]。如UVB辐射可提高白纹伊蚊Aedes albopictus和淡色库蚊Culex pipiens的代谢率,其存活率显著降低[22]。UV辐射诱导家蚕CTSL表达水平显著增加,并使其胚胎细胞程序性死亡,表明CTSL参与了胚胎细胞的程序性死亡[23]。然而,目前关于CTSB在桃蚜Myzus persicae(Sulzer)响应UV胁迫中的作用尚未见报道。
桃蚜属半翅目Hemiptera蚜科Aphididae,是烟区常见的害虫,其危害程度較大,世界各地均有分布。桃蚜寄主范围广,除为害烟草外,还取食十字花科、蔷薇科、豆科和茄科等400多种植物,是典型的多食性昆虫[24]。近年来,随着大气臭氧层被破坏,导致到达地面的紫外线辐射增强,以及全球气候变暖等问题,对昆虫的生长发育带来影响。然而,CTSB在抵御温度和UV胁迫中的作用尚不清楚。本研究通过克隆桃蚜CTSB16D和CTSB348基因并分析它们的序列特征,采用RTqPCR技术检测2个基因在不同发育阶段、高低温胁迫以及UVB胁迫下的表达情况,探索CTSB基因在桃蚜生长发育过程中的作用,为进一步揭示CTSB基因在昆虫应对环境胁迫中的功能奠定基础。
1 材料与方法
1.1 材料
供试虫源:试验所用桃蚜采集于贵阳市花溪区(106.68°E,26.43°N)周边烟田,在人工气候箱用烟苗饲养,每7 d更换1次烟苗,保证寄主新鲜,室内温度为(25±1)℃,光周期L∥D=14 h∥10 h(光期6:00-20:00;暗期:20:00-6:00),相对湿度(70±5)%。
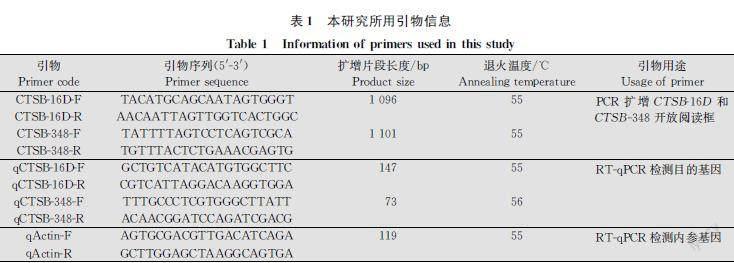
试剂和仪器:Eastep Super RNA提取试剂盒,上海普洛麦格生物产品有限公司;HiFiScript cDNA第一链合成试剂盒,北京康为世纪生物科技有限公司;SanPrep柱式DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;2×Taq PCR StarMix预混液,北京康润诚业生物科技有限公司;pMD19T载体、大肠杆菌Escherichia coli DH5α感受态细胞、TB Green Premix DimerEraser荧光试剂盒,宝生物工程(大连)有限公司;其余试剂均为国产分析纯。RXZ型智能人工气候箱,宁波江南仪器厂;58B01型UVB紫外灯(波长280~320 nm,强度300 μW/cm2),南京华强电子有限公司;UVB紫外辐照计,北京师范大学光电仪器厂;NanoPhotometerTMPClass超微量紫外分光光度仪,美国赛默飞世尔科技公司;T100 Thermal Cycler PCR仪、CFX96Touch荧光定量PCR仪、Imaging System PowerPac系列电泳仪,美国BioRad公司。HZ2111KB摇床,太仓市华利达实验设备有限公司。
1.2 方法
1.2.1 样品采集和胁迫试验
试验设置参照周吕等[25]和Yang等[26]的研究,并做了进一步优化。不同发育阶段材料:取桃蚜1、2龄若虫80头,3、4龄若虫60头,无翅和有翅成虫各30头,3次生物学重复;4、36℃和UVB胁迫试验材料:取桃蚜1日龄无翅成虫在培养箱中以4℃和36℃分别处理0(CK),30,60,90,120 min和150 min;取桃蚜1日龄无翅成虫暗适应2 h后,以UVB(280~320 nm)紫外灯为光源进行辐射处理0(CK),30,60,90,120 min和150 min,辐射强度为300 μW/cm2,在UVB辐射期间温湿度和正常饲养条件相同。每处理30头,3次生物学重复,所有样品处理后立即装入1.5 mL EP管,用液氮速冻后保存于-80℃冰箱备用。
1.2.2 桃蚜CTSB16D和CTSB348基因cDNA序列克隆
使用Eastep Super Total RNA Extraction Kit提取桃蚜总RNA,使用NanoPhotometerTM PClass分光光度仪检测其浓度,按照HiFiScript cDNA第一链合成试剂盒说明书完成cDNA第1链的合成。通过对已知同源昆虫CTSB序列比对,在保守区各设计1对引物CTSB16DF/CTSB16DR和CTSB348F/CTSB348R(表1),以合成的 cDNA 第1链为模板扩增桃蚜CTSB16D和CTSB348基因的中间片段。PCR反应体系(25 μL)为:2×Taq PCR StarMix (Dye) 12.5 μL,cDNA 模板(200 ng/μL)1.5 μL,正、反向引物(10 μmol/L)各1.5 μL,DEPC水8 μL。反应条件:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min。用1%琼脂糖凝胶电泳检测PCR产物,使用SanPrep柱式PCR产物纯化试剂盒回收目的片段,连接到pMDTM19T载体上并转化至感受态细胞DH5α,于LB培养基37℃条件下培养12 h,挑取单菌落做菌落PCR鉴定后进行扩大培养,菌液送往生工生物工程(上海)股份有限公司测序。
1.2.3 桃蚜CTSB16D和CTSB348基因的序列分析
应用在线网站NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)中的BLAST程序对桃蚜CTSB16D和CTSB348进行氨基酸序列分析,利用ORF Finder(https:∥www.ncbi.nlm.nih.gov/orffinder)查找其开放阅读框;使用ExPASy ProtParam Tool(https:∥web.expasy.org/protparam/)和ExPASyTools中的NetNGlyc预测蛋白质的理化性质;使用TMHMM Server 2.0(https:∥services.healthtech.dtu.dk/service.php?TMHMM2.0)預测蛋白跨膜结构;应用SMART(http:∥smart.emblheidelberg.de/)进行保守结构域的预测;应用网站(http:∥www.cbs.dtu.dk/services/NetPhos/)分析磷酸化位点。系统发育树由MEGA 6.0软件以邻接法(neighborjoining)构建,重复运行1 000次,进化树的节点处数值表示置信度。
1.2.4 桃蚜CTSB16D和CTSB348基因的表达分析
选用Actin基因作为内参基因,引物见表1,桃蚜各发育阶段和经4℃、36℃和UVB胁迫的无翅成虫RNA提取和cDNA合成同1.2.2,参照TB Green Premix DimerEraser荧光试剂盒说明书进行RTqPCR扩增。20 μL RTqPCR反应体系:cDNA模板1 μL,TB Green Premix DimerEraser 10 μL,上、下游引物(10 μmol/L)各1 μL,DEPC水 7 μL。反应条件:95℃ 3 min;95℃ 30 s,退火温度(表1) 30 s,39个循环;95℃ 10 s,65℃ 5 s。
1.3 数据分析
采用2-ΔΔCt法[27]计算桃蚜CTSB16D和CTSB348基因相对表达量。应用SPSS 19.0软件对数据进行单因素方差分析(Tukey氏法),采用Excel 2010软件绘图。
2 结果与分析
2.1 桃蚜CTSB16D和CTSB348基因克隆与序列分析
克隆桃蚜CTSB基因并命名为CTSB16D(GenBank登录号:MZ962352)和CTSB348(GenBank登录号:MZ962353),CTSB16D和CTSB348长度分别为1 096 bp和1 101 bp,开放阅读框(ORF)为1 017 bp和1 023 bp,编码338和340个氨基酸。蛋白相对分子量为38.14 kD和37.52 kD,等电点(pI)为5.46和5.99。计算得到不稳定性指数(Ⅱ)为27.31和25.79,即蛋白质均稳定,预测亲水性的平均值(GRAVY)为-0.537和-0.298,表明蛋白质均表现亲水性。两个蛋白质分别含有2个和1个N糖基化位点,均无跨膜结构域,SMART分析发现分别在86-334和89-338氨基酸处含有木瓜蛋白酶家族半胱氨酸蛋白酶Pept_C1保守结构域。
2.2 桃蚜CTSB16D和CTSB348系统进化分析
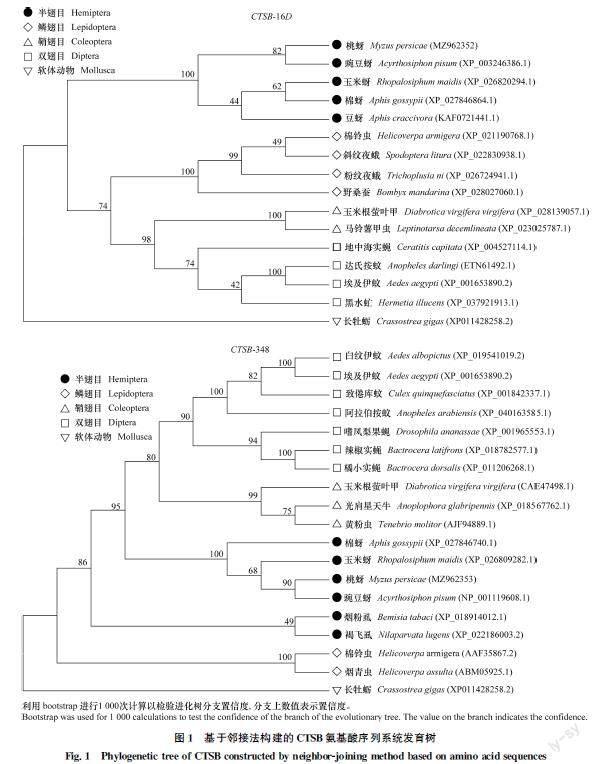
以软体动物长牡蛎Crassostrea gigas CTSB为外群,从NCBI数据库搜索鳞翅目、鞘翅目、双翅目和半翅目昆虫的CTSB氨基酸序列,与推导的桃蚜CTSB氨基酸序列采用邻接法构建系统发育树(图1)。结果表明,昆虫纲鳞翅目、鞘翅目、双翅目和半翅目昆虫CTSB各聚为一个分支,软体动物长牡蛎聚为另一分支;从目以下的分类阶元来看,桃蚜CTSB16D与豌豆蚜Acyrthosiphon pisum、豆蚜Aphis craccivora、玉米蚜Rhopalosiphum maidis和棉蚜Aphis gossypii聚为一支;桃蚜CTSB348与豌豆蚜、玉米蚜和棉蚜及烟粉虱Bemisia tabaci和褐飞虱Nilaparvata lugens聚为一支,说明同一分支中的昆虫亲缘关系较近,并且发现桃蚜CTSB16D和CTSB348均与同属的豌豆蚜亲缘关系最近,与其他目昆虫的同源性较低,分属不同支,表明CTSB的聚类结果能较好地反映昆虫种间的亲缘关系。
2.3 桃蚜CTSB16D和CTSB348基因的表达分析
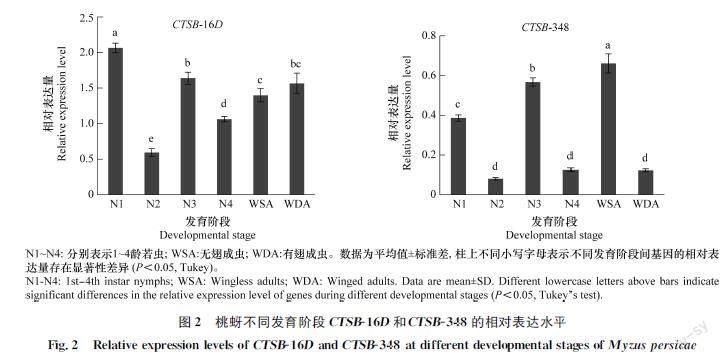
CTSB16D和CTSB348在桃蚜整个生长发育阶段均有表达(P<0.05)(图2),其中CTSB16D在1龄若虫中表达量最高,在2龄若虫期的表达量最低;CTSB348在无翅成虫期的表达量最高,在2龄、4龄若虫和有翅成虫中表达量较低。
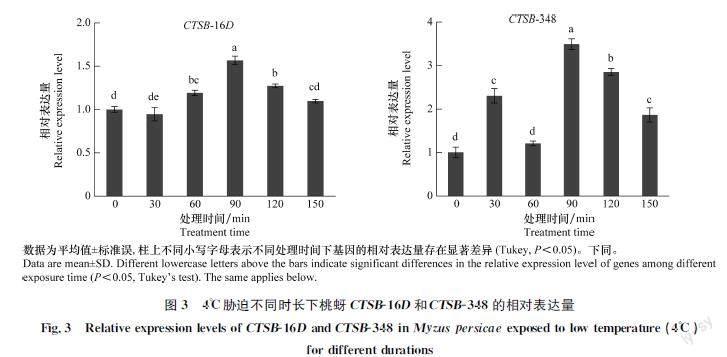
4℃胁迫下,桃蚜CTSB16D和CTSB348的表达量均随时间呈先上升后下降的趋势(P <0.05)(图3),其中CTSB16D在60、90 min和120 min时显著高于对照(0 min),在90 min时达到峰值,为对照的1.56倍;CTSB348的表达量在30、90、120 ;min 和150 min时显著高于对照,在90 min达到峰值,为对照的3.52倍。
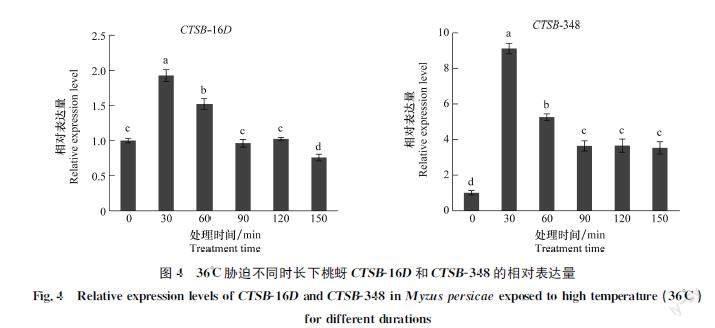
36℃胁迫下,桃蚜CTSB16D和CTSB348表达量均随时间延长呈先上升后下降的趋势(P<0.05)(图4)。CTSB16D在30 min和60 min表达量显著高于对照,在30 min达到峰值,为对照的1.92倍。CTSB348在30 min时达到峰值,为对照的9.11倍,此后CTSB348相对表达量开始下降,至90、120 min和150 min时稳定表达,且均显著高于对照水平。
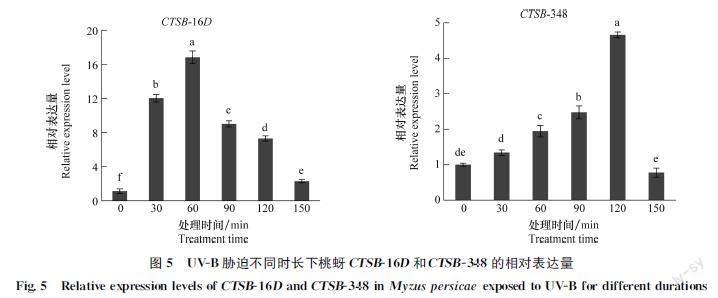
UVB胁迫下,桃蚜CTSB16D和CTSB348表达量随时间延长呈先上升后下降的趋势(P <0.05)(图5),CTSB16D表达量均显著高于对照,在60 min达到峰值,为对照的15.16倍,此后的表达量随时间延长逐渐降低;CTSB348相对表达量在60、90 min和120 min均显著高于对照,在120 min达到峰值,为对照的4.66倍。
3 结论与讨论
组织蛋白酶是生物体内溶酶体中重要的水解酶系,本研究克隆获得了桃蚜2个组织蛋白酶基因CTSB16D和CTSB348,序列长度分别为1 096 bp和1 101 bp,ORF为1 017 bp和1 023 bp,序列分析表明,2个基因编码的氨基酸分别含有2个和1个N糖基化位点,无跨膜结构域,均具有组织蛋白酶保守结构域Pept_C1[2]。系统发育分析结果表明,桃蚜CTSB与半翅目蚜科昆虫的CTSB聚为一支,说明它们在进化关系上同源关系更近,这与棉蚜的研究结果一致[28]。
组织蛋白酶参与昆虫的细胞凋亡,在其个体发育和变态反应等生命活动中具有重要作用[29]。本研究发现,CTSB16D和CTSB348基因在桃蚜不同发育阶段均有表达,CTSB16D在1龄若虫中的表达量最高,之后表现为下降趋势,发育到3龄若虫时达到第2个峰值。CTSB348表达量在无翅成虫期达到峰值。这与扶桑绵粉蚧Phenacoccus solenopsis CTSB基因在不同发育阶段表达模式不同[30]。可能CTSB基因在不同昆蟲生长发育过程中发挥的作用不同,如赤拟谷盗Tribolium castaneum CTSB在高龄幼虫中的表达量最高,柑橘木虱CTSB在若虫和成虫中高表达[3132]。棉铃虫Helicoverpa armigera CTSB活性随着胚胎发育逐渐降低,在蛹后期表达量升高,推测其参与棉铃虫组织分化[33]。这表明组织蛋白酶在不同物种发育阶段的表达具有不同的规律,CTSB在昆虫发育过程中表现出阶段特异性[4]。
昆虫属于变温动物,极端低温或高温都会影响其生存和生长发育[3435]。组织蛋白酶作为一种多功能水解酶系,在昆虫响应温度胁迫过程中发挥重要作用[4]。例如柑橘木虱、长角血蜱Haemaphysalis longicornis和家蚕在不同温度胁迫后,其体内的组织蛋白酶表达显著上调,推测组织蛋白酶响应温度的胁迫[1617,36]。本研究发现,高低温胁迫下桃蚜CTSB16D和CTSB348基因的表达被显著诱导,且表达量随时间延长整体呈先上升后下降的变化趋势,4℃胁迫下,CTSB16D和CTSB348表达量均在90 min时达到峰值;36℃胁迫下,CTSB16D和CTSB348表达量均在30 min达到峰值。在棉蚜CTSB基因响应不同温度胁迫时也得到了类似的结果[37]。我们推测短时间的极端温度刺激,能有效诱导桃蚜2个CTSB基因的表达,激发体内的保护机制,从而提高桃蚜对温度胁迫的耐受力。随着极端温度胁迫时间的延长,CTSB基因表达量下降,这可能与半胱氨酸蛋白酶对昆虫响应极端温度胁迫的保护作用存在阈值有关,当超过保护阈值后会导致CTSB的表达水平下降[38]。
UVB是環境中影响生物的重要胁迫因子[39]。UVB辐射会引起昆虫相关基因的差异表达,如氧自由基(ROS)、热激蛋白HSP70、细胞色素氧化酶和蛋白酶基因等,从而响应UVB胁迫[4042]。本研究发现,UVB能够诱导CTSB16D和CTSB348的表达,推测CTSB参与桃蚜对UVB胁迫的应激反应。二斑叶螨Tetranychus urticae在UVB胁迫下,体内CTSB基因的表达量也显著上调[43]。本研究还发现UVB胁迫下,CTSB16D和CTSB348相对表达量随时间呈先增高后降低的趋势,分别在60 min和120 min到达峰值,这可能与短时间的UVB胁迫对桃蚜细胞造成的损伤,能够通过其体内CTSB的上调表达来修复有关;而随着UVB胁迫时间的延长,CTSB16D和CTSB348表达量均显著下降,可能长时间的UVB胁迫对机体造成的损伤超出CTSB基因的阈值,导致表达量下降,这与Yoon等[44]的研究结果相符。
综上,本研究克隆了桃蚜CTSB16D和CTSB348基因,发现低温、高温和UVB胁迫会诱导桃蚜成虫CTSB基因的表达,该结果初步阐明了CTSB基因在桃蚜响应环境胁迫中具有重要的作用,为进一步深入研究桃蚜CTSB功能及其在响应环境胁迫中的作用机制等方面奠定了基础。
参考文献
[1] MORT J S, BUTTLE D J. Cathepsin B [J]. International Journal of Biochemistry and Cell, 1997, 29(5): 715720.
[2] 潘光照. 家蚕Cathepsin L的鉴定及功能初探[D]. 重庆: 西南大学, 2018.
[3] SUN Yuxuan, ZHU Baojian, TANG Lin, et al. Cathepsin O is involved in the innate immune response and metamorphosis of Antheraea pernyi [J]. Journal of Invertebrate Pathology, 2017, 150: 614.
[4] SAIKHWESKAR N, SUMMANWAR A, JOSHI R, et al. Cathepsins of lepidopteran insects: aspects and prospects [J]. Insect Biochemistry and Molecular Biology, 2015, 64: 5159.
[5] GE Zhaoyu, WAN Pinjun, LI Guoqing, et al. Characterization of cysteine proteaselike genes in the striped rice stem borer, Chilo suppressalis [J]. Genome, 2014, 57(2): 7988.
[6] SUN Yuxuan, CHEN Chen, XU Wenjie, et al. Functions of Bombyx mori cathepsin Llike in innate immune response and antimicrobial autophagy [J/OL]. Developmental and Comparative Immunology, 2021, 116: 103927. DOI: 10.1016/j.dci.2020.103927.
[7] SONG K H, JUNG M K, EUM J H, et al. Proteomic analysis of parasitized Plutella xylostella larvae plasma [J]. Journal of Insect Physiology, 2008, 54(8): 12711280.
[8] PAIM R M M, ARAUJO R N, LEIS M, et al. Functional evaluation of heat shock proteins 70 (HSP70/HSC70) on Rhodnius prolixus (Hemiptera, Reduviidae) physiological responses associated with feeding and starvation [J]. Insect Biochemistry and Molecular Biology, 2016, 77: 1020.
[9] SARKAR N, BARIK A. Effect of temperature on development and reproduction of Epilachna dodecastigma (Wied.) (Coleoptera: Coccinellidae) [J]. Proceedings of the Zoological Society, 2017, 70(2): 150155.
[10]ABRCA M, SPAHN R. Direct and indirect effects of altered temperature regimes and phenological mismatches on insect populations [J]. Current Opinion in Insect Science, 2021, 47: 6774.
[11]RWOMUSHANA I, EKESI S, OGOL C K, et al. Mechanisms contributing to the competitive success of the invasive fruit fly Bactrocera invadens over the indigenous mango fruit fly, Ceratitis cosyra: the role of temperature and resource preemption [J]. Entomologia Experimentalis et Applicata, 2009, 133(1): 2737.
[12]ROSSGILLESPIE V, PICKER M D, DALLAS F H, et al. The role of temperature in egg development of three aquatic insects Lestagella penicillata (Ephemeroptera), Aphanicercella scutata (Plecoptera), Chimarra ambulans (Trichoptera) from South Africa [J]. Journal of Thermal Biology, 2018, 71: 158170.
[13]PUMHAN N, TIAN Mi, XU Lili, et al. Effects of heat stress and exposure duration on survival characteristics of different developmental stages of Propylaea japonica, a dominant aphidophagous ladybeetle in China [J/OL]. Crop Protection, 2020, 130: 105054. DOI: 10.1016/j.cropro.2019.105054.
[14]陳兵, 康乐. 昆虫对环境温度胁迫的适应与种群分化[J]. 自然科学进展, 2005, 15(3): 1117.
[15]WU Fengyao, ZOU Fengming, JIA Junqiang, et al. The influence of challenge on cathepsin B and D expression patterns in the silkworm Bombyx mori L. [J]. International Journal of Industrial Entomology, 2011, 23(1): 129135.
[16]KIM B Y, LEE K S, SOHN M R, et al. Bombyx mori cathepsin D expression is induced by high temperature and H2O2 exposure [J]. Journal of AsiaPacific Entomology, 2011, 14(3): 285288.
[17]SHU Benshui, WU Yongxian, QU Mengqiu, et al. Comparative transcriptomic analyses revealed genes and pathways responsive to heat stress in Diaphorina citri [J/OL]. Gene, 2020, 727: 144246. DOI: 10.1016/j.gene.2019.144246.
[18]RNGER T M, KAPPES U P. Mechanisms of mutation formation with longwave ultraviolet light (UVA) [J]. Photodermatology Photoimmunology and Photomedicine, 2008, 24(1): 210.
[19]BIVIK C A, LARSSON P K, KAGEDAL K M, et al. UVA/Binduced apoptosis in human melanocytes involves translocation of cathepsins and Bcl2 family members [J]. Journal of Investigative Dermatology, 2006, 126(5): 11191127.
[20]MENG Jianyu, ZHANG Changyu, ZHU Fen, et al. Ultraviolet lightinduced oxidative stress: effects on antioxidant response of Helicoverpa armigera adults [J]. Journal of Insect Physiology, 2009, 55(6): 588592.
[21]ALI A, RASHID M A, HUANG Qiuying, et al. Influence of UVA radiation on oxidative stress and antioxidant enzymes in Mythimna separate (Lepidoptera: Noctuidae) [J]. Environmental Science and Pollution Research, 2017, 24(9): 83928398.
[22]VILLENA O C, MOMEN B, SULLIVAN J, et al. Effects of ultraviolet radiation on metabolic rate and fitness of Aedes albopictus and Culex pipiens mosquitoes [J/OL]. PeerJ, 2018, 6: e6133. DOI: 10.7717/peerj.6133.
[23]YANG Huan, ZHANG Renze, ZHANG Yuhao, et al. CathepsinL is involved in degradation of fat body and programmed cell death in Bombyx mori [J/OL]. Gene, 2020, 760: 144998. DOI: 10.1016/j.gene.2020.144998.
[24]劉金燕, 汤朝起, 董勇浩, 等. 烟蚜对不同寄主植物间的选择性分析[J]. 烟草科技, 2018, 51(7): 3639.
[25]周吕, 孟建玉, 杨昌利, 等. 草地贪夜蛾热激蛋白基因SfHsp90的克隆及在高低温和UVA胁迫下的表达分析[J]. 昆虫学报, 2020, 63(5): 533544.
[26]YANG Changli, MENG Jianyu, ZHOU Lü, et al. Induced heat shock protein 70 confers biological tolerance in UVB stressadapted Myzus persicae (Hemiptera) [J]. International Journal of Biological Macromolecules, 2022, 220: 11461154.
[27]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using realtime quantitative PCR and the 2-ΔΔCt methods [J]. Methods, 2001, 25(4): 402408.
[28]刘伟娇, 张肖丽, 高雪珂, 等. 5个棉蚜组织蛋白酶B基因克隆及在不同寄主专化型中的表达分析[J]. 环境昆虫学报, 2022, 44(4): 946955.
[29]程杏安, 叶静敏, 蒋旭红, 等. 草地贪夜蛾组织蛋白酶B的基因克隆、序列分析、三维结构预测及其分子对接模拟[J]. 生物技术通报, 2018, 34(1): 183194.
[30]罗梅, 董章勇, 宾淑英, 等. 扶桑绵粉蚧组织蛋白酶B基因的克隆、原核表达和不同发育阶段表达分析[J]. 昆虫学报, 2012, 55(3): 276283.
[31]魏璐婷. 赤拟谷盗四个半胱氨酸蛋白酶基因TccatB25、TccatL11、TccatL13和TcPigk的表达特性与RNAi效应分析[D]. 南京: 南京师范大学, 2019.
[32]FERRARA T F, SCHNEIDER V K, KISHI L T, et al. Characterization of a recombinant cathepsin Blike cysteine peptidase from Diaphorina citri Kuwayama (Hemiptera: Liviidae): a putative target for control of citrus Huanglongbing [J/OL]. PLoS ONE, 2015, 10(12): e0145132. DOI: 10.1371/journal.pone.0145132.
[33]杨晓梅, 侯立静, 董杜鹃, 等. 组织蛋白酶B在棉铃虫个体发育过程中的表达及活性研究[J]. 山东大学学报(理学版), 2005, 40(5): 124129.
[34]BOARDMAN L, SRENSEN J G, TERBLANCHE J S. Physiological and molecular mechanisms associated with cross tolerance between hypoxia and low temperature in Thaumatotibia leucotreta [J]. Journal of Insect Physiology, 2015, 82: 7584.
[35]MA Chunsen, MA Gang, PINCEBOURDE S. Survive a warming climate: insect responses to extreme high temperatures [J]. Annual Review of Entomology, 2021, 66: 163184.
[36]李孟孟. 温度对长角血蜱胚胎发育过程中卵黄蛋白降解及三种酶的影响[D]. 石家庄: 河北师范大学, 2020.
[37]刘金萍. 新疆棉区棉蚜和棉长管蚜对高温胁迫的响应及分子机制[D]. 北京: 中国农业科学院, 2021.
[38]LU Mingxing, DU Yuzhou, CAO Shuangshuang, et al. Molecular cloning and characterization of the first caspase in the striped stem borer, Chilo suppressalis [J]. International Journal of Molecular Sciences, 2013, 14(5): 1022910241.
[39]BURDICK S C, PRISCHMANNVOLDSETH D A, HARMON J P. Density and distribution of soybean aphid, Aphis glycines Matsumura (Hemiptera: Aphididae) in response to UV radiation [J]. Population Ecology, 2015, 57(3): 457466.
[40]刘志伟, 柳欣, 董尧, 等. 紫外线、高压静电和大麦黄矮病毒胁迫下荻草谷网蚜SOD基因表达[J].植物保护学报, 2023, 50(1): 91100.
[41]赵惠燕, 都二霞, 郭剑文, 等. UVB辐射胁迫下桃蚜差异基因表达的分子生态初步研究[J]. 西北农林科技大学学报(自然科学版), 2010, 38(3): 132138.
[42]WANG Xinru, WANG Chao, WANG Xingwei, et al. The functions of caspase in whitefly Bemisia tabaci apoptosis in response to ultraviolet irradiation [J]. Insect Molecular Biology, 2018, 27(6): 739751.
[43]MURATA Y, OSAKABE M. Developmental phasespecific mortality after ultravioletB radiation exposure in the twospotted spider mite [J]. Environmental Entomology, 2017, 46(6): 14481455.
[44]YOON J, BANG S H, PARK J S, et al. Increased in vitro lysosomal function in oxidative stressinduced cell lines [J]. Applied Biochemistry and Biotechnology, 2011, 163(8): 10021011.
(責任编辑:杨明丽)
