基于共振能量转移策略的电化学发光免疫传感器及肌红蛋白灵敏检测
2024-02-04曹俊涛王玉玲任书伟刘彦明
曹俊涛,林 霄,王玉玲,任书伟,刘彦明
(1. 信阳师范大学 化学化工学院, 河南 信阳 464000; 2. 信阳市中心医院, 河南 信阳 464099)
0 引言
急性心肌梗死(Acute Myocardial Infarction,AMI)是患者心源性死亡的主要原因之一,也是世界上死亡率较高的主要疾病之一[1]。因此,如何灵敏、快速地诊断AMI愈发受到重视。随着医疗技术不断进步及临床对AMI疾病的深入研究,发现患者发病时体内损伤的心肌细胞会出现游离现象,影响心肌膜的完整性和通透性,同时梗死处的细胞还会释放化学物质,使其进入外周血液循环。这些物质包括肌钙蛋白、肌酸激酶及肌红蛋白(Myo)等[2]。其中,Myo是最先被释放并进入循环的标志物,对于心肌损伤第一阶段的诊断尤为重要[3],因此,发展简单、灵敏检测血清中Myo含量的方法对心血管疾病的早期诊断及治疗具有重要意义。
目前检测Myo常用的方法有荧光分析[4]、电化学分析[5]和电化学发光(Electrochemiluminescence,ECL)分析[6]。其中ECL分析因具有背景信号低、灵敏度高、分析速度快等优点,被广泛用于蛋白质、核酸、药物等灵敏检测。ECL免疫传感器结合了ECL分析的高灵敏度和免疫反应的高特异性,在免疫生物学和临床研究中具有巨大的应用潜力[7]。根据是否引入被标记的抗体,ECL免疫传感器分为无标记型和夹心型两种,其中夹心型免疫传感器是通过固定在电极表面上的抗体捕获目标物,再加入具有标记物的抗体从而形成夹心结构的一类免疫传感器。与无标记型免疫传感器相比,夹心型免疫传感器由于抗体上的标记物有助于信号放大,因此灵敏度更高。
在进行ECL分析时,通常采用信号放大策略以进一步提高检测灵敏度。常用的信号放大策略有酶催化信号放大策略[8]、滚环扩增信号放大策略[9]和共振能量转移(resonance energy transfer,RET)信号放大策略[10-11]等。其中RET是当能量供体的ECL发射光谱和能量受体的紫外-可见吸收光谱重叠且二者之间的距离小于10 nm时,供体被激发产生的光被受体吸收,使供体的ECL信号降低的能量传递过程,是一种非常有效的ECL信号放大策略。AI等[10]报道了一种“on-off”型ECL免疫传感器,以石墨相氮化碳(g-C3N4)为RET供体、维生素B2修饰银纳米立方体作为受体,通过二者间的RET猝灭g-C3N4的ECL信号,从而实现对异常凝血酶原的灵敏检测。以苝二亚胺衍生物(PDI)与g-C3N4为双阴极发光材料,ZHANG等[11]报道了一种电位分辨的比率型ECL免疫传感器。由于PDI的紫外光谱与g-C3N4的ECL发射光谱可有效重叠,两个发光材料间可发生RET,从而猝灭g-C3N4的信号,同时激发电位更低的PDI与g-C3N4竞争消耗共反应物,进一步猝灭其ECL,实现对癌胚抗原的灵敏检测。上述工作反映了基于ECL-RET构建传感方法具有原理简单、易于操作等特点。该类传感方法的关键点在于能量供体和受体的光谱匹配程度会直接影响RET的效率,进而影响检测灵敏度。因此,寻找合适的供体-受体对是非常必要的。
硫化镉(Cadmium sulfide,CdS)是一种典型的II-VI族直接带隙半导体化合物,成本低廉,尺寸可调,光电转换性能优异。纳米线形态的硫化镉(Cadmium sulfide nanowires,CdS NWs)分散性良好,其形状上的各向异性使该形态所暴露的活性位点较多,具有突出且稳定的ECL性能[12],是一种具有高性价比的ECL能量供体。金纳米粒子(Gold nanoparticles,Au NPs)具有良好的生物相容性、出色的电导率、较高的比表面积,在生物传感领域得到广泛应用[13]。据报道,Au NPs的紫外吸收光谱在500 nm左右,可与CdS NWs的ECL发射光谱有良好的重叠,成为一对适配的ECL-RET供体-受体对。
基于此,本研究以高性能的CdS NWs为ECL发射体和能量供体,Au NPs为能量受体,借助CdS NWs ECL发射光谱与Au NPs紫外-可见吸收光谱之间的完美重叠,发展了一种以高效RET为信号放大策略的ECL免疫传感平台灵敏检测Myo。如图1所示,先在玻碳电极表面修饰CdS NWs,然后通过层层自组装的方法将目标蛋白Myo和Au NPs标记的抗体(Au NPs-Ab)固定在电极表面,构建一个夹心型免疫传感器。Au NPs-Ab不仅会产生空间位阻效应,还可作为RET探针。当施加一定的电压,探针上的Au NPs会与CdS NWs发生ECL-RET,使CdS NWs的ECL信号发生明显猝灭。根据ECL信号的猝灭程度计算Myo的含量。相比于直接修饰抗原的无标记免疫传感器,RET猝灭效应和空间位阻效应的协同效应可大大降低ECL信号,从而产生更显著的信号放大效果,实现高灵敏检测。
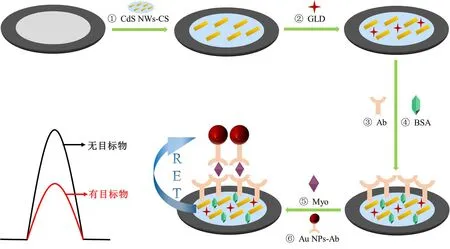
图1 ECL免疫传感器的构建过程
1 实验部分
1.1 药品和试剂
肌红蛋白(Myo,L4C00402)、肌红蛋白多克隆抗体(Ab,L3C00303)和人免疫球蛋白(hIgG)购于上海领潮生物科技有限公司。四水合硝酸镉(Cd(NO3)2·4H2O)购于天津光复化学试剂有限公司。硫脲(CH4N2S)和柠檬酸钠(C6H5Na3O7)购自天津永大化学试剂有限公司。乙二胺(C2H8N2)、四水合氯金酸(HAuCl4·4H2O)、壳聚糖(CS)、戊二醛(GLD)购自国药集团化学股份有限公司。牛血清白蛋白(BSA)、Tween 20和人血清白蛋白(HSA)购自上海西宝生物科技有限公司。
1.2 仪器
ECL信号用BPCL型微弱化学发光测量仪(中国科学院,北京)测得。电化学阻抗谱(EIS)测试在RST5200电化学工作站(郑州世瑞思仪器科技有限公司,郑州)上进行。采用三电极体系进行ECL和EIS测试,以表面进行了化学修饰的玻碳电极作为工作电极,铂电极作为辅助电极,Ag/AgCl电极作为参比电极。采用日立S-4800冷场发射扫描电子显微镜(SEM,东京,日本)和Rigaku-Mini Flex 600 X射线粉末衍射仪(XRD,东京,日本)对材料的形貌和晶型分别进行表征。Au NPs的紫外-可见吸收光谱由岛津UVmini-1240紫外-可见吸收光谱仪获得(东京,日本)。ECL最大发射光谱通过波长范围从435 nm到610 nm的光学滤光片(Omega光学公司,美国)获取。
1.3 CdS NWs的合成
参照已报道的方法合成CdS NWs[14]。首先将2.370 g CH4N2S和3.205 g Cd(NO3)2·4H2O溶解于50 mL C2H8N2中并搅拌20 min,然后将溶液转移到50 mL聚四氟乙烯内衬高压反应釜中,在180 ℃条件下反应72 h,冷却至室温。离心(7000 rpm,5 min)洗涤多次,最后在60 ℃下干燥10 h收集黄色产物,即为CdS NWs粉末。
1.4 Au NPs的合成
根据文献[15]合成了Au NPs。将50 mL 0.1%的HAuCl4煮沸,在剧烈搅拌下快速加入500 μL 2%的C6H5Na3O7。此时混合溶液的颜色由灰黄色变为深红色,表明已形成Au NPs。继续搅拌10 min后冷却至室温,在4 ℃下保存备用。
1.5 Au NPs-Ab的合成
取1 mL Au NPs与5 μL 10% Tween 20混合震荡30 min,离心后分散在1 mL 0.1 mol/L PBS中,再加入450 μL的50 μg/mL的Myo抗体(Ab),37 ℃下反应2 h。离心后用含有0.05% Tween 20的0.1 mol/L PBS(TPBS)洗涤,并分散在1 mL含0.1% BSA的TPBS中,37 ℃下震荡1 h。离心、收集沉淀并分散在1 mL TPBS中,得到Au NPs-Ab溶液。
1.6 ECL免疫传感器的构建及测试过程
进行化学修饰前,先用氧化铝粉末对玻碳电极进行抛光处理,乙醇和水超声洗涤后用N2吹干。随后,在玻碳电极界面上修饰6 μL 0.2 mg/mL CdS NWs-CS溶液并于60 ℃下干燥。再将6 μL 5% GLD滴加在电极上,室温下孵育30 min。将6 μL 40 μg/mL的Ab修饰于电极上,37 ℃下孵育1 h。接着再滴加6 μL 1% BSA封闭非特异性结合位点,37 ℃下孵育1 h后用0.01 mol/L PBS洗涤除去多余的BSA。之后将6 μL 不同浓度的Myo修饰到电极上,在37 ℃下孵育1 h。最后,将6 μL Au NPs-Ab修饰在电极上,在37 ℃下孵育1 h。修饰过程如图1所示。将修饰电极(工作电极)、辅助电极和参比电极置于0.1 mol/L含有0.1 mol/L K2S2O8的PBS溶液中进行检测。以循环扫描电压模式进行电化学激发,电位设置扫描范围为-1.3~0 V,扫描速率为0.1 V/s,光电倍增管的高压为-500 V。
2 结果与讨论
2.1 材料表征
通过SEM对CdS NWs的形貌进行表征,发现合成的CdS是一种平均直径约50 nm,长度约1~3 μm的纳米线,如图2A所示。随后采用XRD谱图对CdS NWs进行进一步表征(图2B)。由图可知CdS NWs与标准卡CdS(JCPDS No. 41-1049)的晶面产生良好对应,证明CdS NWs的成功制备。
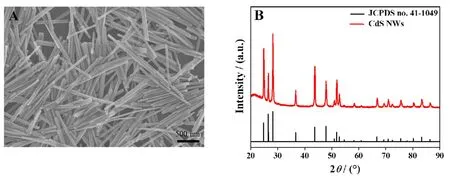
图2 CdS NWs的SEM图(A)和XRD图(B)
为探究CdS NWs与Au NPs发生ECL-RET的可能性,分别对CdS NWs的ECL发射光谱以及Au NPs的紫外-可见吸收光谱进行考察。通过叠加使用不同波长的滤光片,采集不同波长下的ECL信号,发现CdS NWs在500 nm处出现最大的ECL发射,见图3中的曲线a。通过对Au NPs的紫外吸收图谱进行研究,发现其最大吸收峰在500 nm处,见曲线b。二者之间良好的波谱重叠证明可发生高效的ECL-RET效应。

图3 CdS NWs的ECL发射光谱图(a)和Au NPs的紫外-可见吸收谱图(b)
2.2 传感器的电化学和ECL表征
EIS是通过测量电极的电荷转移阻抗值(Ret)考察电极表面电化学反应的电荷传递情况的一种手段。因此,通过EIS可对传感器的构建过程进行表征。如图4A所示,裸电极的Ret较小(曲线a),这归功于玻碳电极良好的电子传导能力。当在电极界面上先后修饰6 μL 0.2 mg/mL CdS NWs-CS溶液(曲线b)和6 μL 5% GLD(曲线c)溶液后,Ret值增大,这是由于半导体纳米材料、CS和GLD较差的电子传导能力所致。随后在电极上依次修饰6 μL 40 μg/mL Ab(曲线d)、1% BSA(曲线e)、1.0 × 10-10g/mL Myo(曲线f)和探针Au NPs-Ab(曲线g)后,Ret逐渐增加,这归因于蛋白质的空间位阻和绝缘作用阻碍了电子的传递效率。由Ret的变化趋势可初步证明传感器的成功构建。
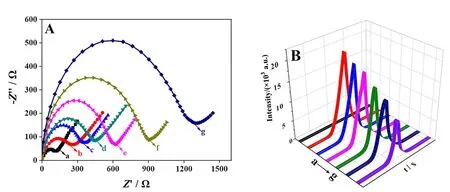
图4 传感器逐步修饰电极的EIS表征图(A)和ECL信号表征图(B)
通过记录电极在层层修饰过程中的ECL信号变化进一步表征传感器的构建过程。如图4B所示,裸电极几乎没有ECL信号(曲线a)。当电极界面上修饰CdS NWs-CS溶液后得到较强的ECL信号(曲线b)。依次修饰GLD(曲线c)、Ab(曲线d)、BSA(曲线e)和Myo(曲线f)后ECL强度逐渐降低,这是因为GLD和蛋白质的导电性较差,会阻碍电子的传递。最后将探针Au NPs-Ab修饰在传感器上,ECL显著降低(曲线g),这是由于供体CdS NWs与受体Au NPs发生了高效的RET效应及探针的空间位阻效应,猝灭了CdS NWs的ECL信号,进一步验证了传感器构建成功。
2.3 条件优化
为使传感器具有良好的分析性能,分别对共反应剂K2S2O8的浓度(c)、检测底液的pH值和探针的孵育时间等3个实验条件进行了优化。如图5A所示,当K2S2O8浓度从0.02 mol/L增加到0.10 mol/L,ECL信号强度逐渐升高;当浓度超过0.10 mol/L时,ECL信号达到一个平台。因此,选择0.10 mol/L为K2S2O8的最佳浓度。检测底液的pH值同样会对ECL强度产生影响。在图5B中,检测底液的pH值从6.0增加到7.4,ECL强度逐渐升高;当pH值超过7.4时,ECL信号略有降低后达到一个平台。所以选择7.4为最佳pH值。进一步研究了探针孵育时间对ECL性能的影响(图5C),发现孵育时间从12 min逐渐增加到60 min时,ECL信号强度逐渐降低;而孵育时间超过60 min时,ECL信号强度回升并达到一个平台,说明探针与抗原的特异性结合已饱和,因此选择60 min为探针的最佳孵育时间。

图5 共反应剂K2S2O8的浓度(A)、检测底液pH值(B)和探针的孵育时间(C)对ECL信号的影响
2.4 分析性能测试
随后,对该传感器的分析性能进行了研究。在优化条件下,测试在不同Myo浓度下传感器ECL响应,结果如图6A所示。由于RET效应和蛋白质空间位阻作用,随着Myo浓度的增加,在1.0×10-12~1.0×10-7g/mL浓度范围内,ECL信号强度逐渐降低。图6B为不同浓度Myo的ECL响应与相应浓度的对数的线性关系(a到k的浓度分别为: 1.0×10-12、 5.0×10-12、1.0×10-11、 5.0×10-11、1.0×10-10、 5.0×10-10、1.0×10-9、5.0×10-9、1.0×10-8、 5.0×10-8、1.0×10-7g/mL),I=-10 899.738-2 100.700lgc为线性回归方程,相关系数R2为0.998。测得检测Myo的检出限为8.8×10-13g/mL。
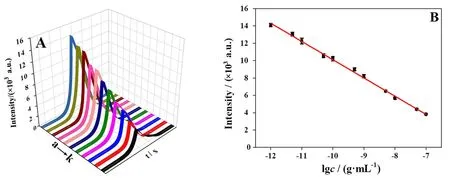
图6 不同目标物Myo浓度对应的体系ECL响应(A)和ECL 响应与目标物浓度对数之间的线性关系图(B)
2.5 传感器的选择性、稳定性和重复性
为了研究该传感器对Myo检测的特异性,选择HSA和HIgG两种蛋白质作为干扰物进行测试,结果如图7A所示。当体系中存在4.0×10-2g/mL HSA或者1.0×10-2g/mL HIgG时,体系的ECL信号强度与空白对照实验的ECL信号相近。当体系中加入HSA、HIgG和Myo(1.0×10-10g/mL)混合溶液时,ECL信号强度与只加入相同浓度Myo时基本一致。以上结果表明,该传感器具有良好的选择性。
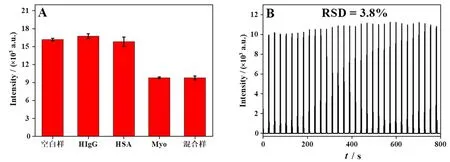
图7 免疫传感器的选择性(A)和稳定性(B)
通过对该传感器连续循环扫描800 s,探究该传感器的稳定性(图7B)。ECL信号强度的相对标准偏差(RSD)为3.8%,表明传感器具有良好的稳定性。此外,对相同批次(日内)和不同批次(日间)的传感器进行考察,实验结果得出日内和日间分析的RSD分别为4.0%和6.6%,表明传感器具有良好的重复性。
2.6 实际样品检测
为考察该ECL传感器的实际应用能力,对信阳市中心医院提供的7份人血清样品中Myo含量进行测定。由表1结果可见,本工作测得的实验结果与信阳市中心医院提供的参考值相对误差不超过7.5%,RSD不大于7.8%,证明构建的传感器具有良好的实用性。
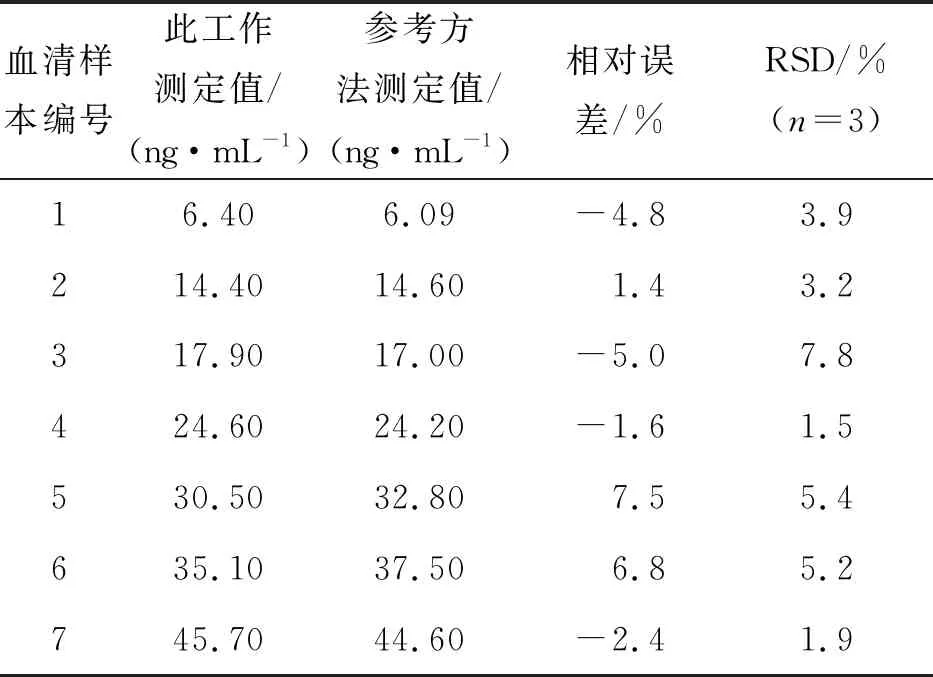
表1 本文方法与参考方法测定人血清中Myo的含量
此外,还进行了加标回收实验(表2),回收率为86.0%~110.0%,RSD不超过6.0%。证明该方法对血清中Myo的检测有良好的准确性。

表2 人血清标本中Myo的加标回收率
3 结论
以CdS NWs为能量供体,Au NPs为能量受体,基于两者间高效的ECL-RET效应建立了一种ECL免疫传感器,成功实现Myo的灵敏检测。该传感器具有简单、高灵敏度、高选择性等优点,可用于人体血清样品中Myo含量检测。
