黄连素通过诱导线粒体自噬干预呼吸道合胞病毒感染HEp-2细胞的作用机制
2024-02-04崔玉娟苏东霞胡丹东
崔玉娟,赵 辉,苏东霞,胡丹东
(1. 西北师范大学生命科学学院,甘肃 兰州 730070;2. 北京市延庆区疾病预防控制中心,北京 102100;3. 北京市延庆区市场监管检验检测监控中心,北京 102100)
呼吸道合胞病毒(respiratory syncytial virus,RSV)属于副黏病毒科、肺病毒属,是一种含有包膜的反义单链RNA病毒,直接或间接与患者的分泌物、飞沫接触均可感染,具有高度传染性。RSV是引起儿童下呼吸道感染的主要病原,感染初期与一般感冒无异,随着感染加剧可引起不同的组织病变,特别是引发肺炎等严重的呼吸系统疾病[1]。免疫功能较差的老年感染者,还可能影响心肺功能,引起心肌梗死或呼吸衰竭。RSV感染每年在全球造成约16万人死亡,至今缺乏有效的抗病毒药物[2]。因此,发现新的候选药物治疗RSV感染,并研究其潜在的机制是当务之急。
黄连素(berberine,BE)是一种从黄连等小檗属植物中分离得到的异喹啉类生物碱,具有抗炎、抗氧化、抗癌、抗衰老等多种药理作用,近年来的研究表明BE还具有抗病毒功能,可适用于治疗多种病毒感染性疾病。研究发现,BE对登革热病毒和人乳头瘤病毒具有直接的抗病毒活性[3]。BE能通过作用于TNF-α、STAT3、IL-6、CCL2等靶点,抑制炎症和纤维细胞活化,达到治疗新型冠状病毒感染所致肺纤维化的目的[4]。BE可抑制单纯疱疹病毒在细胞中的复制并抑制其感染诱导的炎症反应[5]。
病毒感染致组织损伤的一个重要原因与线粒体损伤有关。损伤的线粒体会释放大量活性氧(ROS),导致NLRP3炎性小体过度活化,激活炎症反应,进而导致细胞功能丧失,并诱导组织损伤。因此,细胞采用了线粒体自噬的策略来清除受损的线粒体。通过与溶酶体融合,受损的线粒体由各种水解酶完成降解,该过程在调节线粒体数量、维持线粒体功能以及维持细胞稳态和生存方面起着至关重要的作用[6]。本研究旨在探究BE对RSV感染HEp-2细胞的影响,通过分析线粒体功能和线粒体自噬标志蛋白的检测结果,讨论线粒体自噬在其中的作用机制,为RSV感染性疾病的药物开发提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器人喉表皮样癌细胞(HEp-2)、RSV病毒株购自美国ATCC公司。BE购自北京索莱宝科技有限公司(CAS号:2086-83-1,分子量:336.36,纯度:≥98%)。环孢素A(59865-13-3)、RPMI1640培养基、DMEM培养基、二甲基亚砜(DMSO)(200-664-3)、MitoSOX工作液(1821370-28-8),购买自西格玛奥德里奇(上海)贸易有限公司;CCK-8试剂(HY-K0301)购自德国默克公司;一抗抗体NLRP3、ASC、caspase-1、PINK1、Parkin、P62、Beclin1、LC3 Ⅰ、LC3 Ⅱ、BNIP3购自美国Cell Signaling Technology公司;IL-1β ELISA检测试剂盒(1025K7110)购自北京索莱宝科技有限公司;PBA缓冲液、JC-1试剂盒(C2005)、ATP试剂盒(S0026)、DAPI工作液(C1006)、MitoTracker Red工作液(C1049B)购自上海碧云天生物技术有限公司。流式细胞分析仪(型号CytoFLEX)购自美国美国贝克曼库尔特公司;酶标仪购自赛默飞世尔科技(中国)有限公司;全自动蛋白印迹系统(型号Qblot)购自上海曼博生物医药科技有限公司;激光共聚焦显微镜(型号OLS5100)购自日本奥林巴斯公司。
1.2 方法
1.2.1细胞培养、分组及处理 HEp-2细胞用含有10%胎牛血清的DMEM培养基在37 ℃、5% CO2培养箱中培养,取对数生长期HEp-2细胞按照1×105/孔接种于6孔板中,细胞生长度达80%~90%时备用。取适量BE在DMSO溶液中充分溶解,配置浓度分别为5、10、15 μmol·L-1的BE溶液。将HEp-2细胞随机分为:Control组(不用RSV和BE处理)、RSV组(用200 pfu/孔的RSV处理)、RSV+5 μmol·L-1-BE组(用200 pfu/孔的RSV和5 μmol·L-1的BE处理)、RSV+10 μmol·L-1-BE组(用200 pfu/孔的RSV和10 μmol·L-1的BE处理)、RSV+15 μmol·L-1-BE组(用200 pfu/孔的RSV和15 μmol·L-1的BE处理),对照组和感染组则加入DMSO 20 μL,BE处理组加入相应浓度的BE溶液20 μL。各组细胞在37 ℃、5% CO2的细胞培养箱中培养24 h后,收集细胞检测相应指标。环孢素A抑制线粒体验证实验中,随机分为:RSV组、RSV+环孢素A组。
1.2.2CCK-8实验检测HEp-2细胞存活率 收集培养24 h后的各组HEp-2细胞,加入100 μL CCK-8试剂,37 ℃孵育1 h,检测450 nm处的吸光度值,计算细胞存活率。细胞存活率=实验组吸光度值/对照组吸光度值×100%。
1.2.3Western blot检测HEp-2细胞相关蛋白表达 收集培养24 h后的各组HEp-2细胞,用RIPA裂解液提取总蛋白,用BCA法测浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转膜,用5%脱脂奶粉封闭,加入相应一抗(1 ∶1 000),4 ℃过夜。加入辣根过氧化物酶标记的二抗(1 ∶5 000),37 ℃孵育1 h。ECL显色、暗室曝光。以GAPDH为内参,利用Quantity One软件分析各条带灰度值。
1.2.4ELISA检测HEp-2细胞IL-1β分泌水平 收集培养24 h后的各组HEp-2细胞的培养液上清,按照ELISA试剂盒说明书检测IL-1β水平。
1.2.5检测HEp-2细胞中ATP水平 收集培养24 h后的各组HEp-2细胞的培养液上清,加入ATP检测溶液,用多功能酶标仪测量发光强度。随后根据标准曲线计算ATP含量(mmol·g-1Pro)。
1.2.6流式细胞术检测HEp-2细胞凋亡率和线粒体膜电位 HEp-2细胞培养48 h后,收集细胞,用冰冷的PBS洗涤两次,并在70%冰冷的乙醇中在4 ℃下固定过夜。在PBS中再水化15 min后,将细胞在黑暗中用PI溶液染色30 min,通过流式细胞术分析细胞凋亡率。HEp-2细胞培养24 h后2 000 r·min-1离心5 min,弃上清,加入500 μL的JC-1工作液,37 ℃下孵育20 min。2 000 r·min-1离心5 min,弃上清,缓冲液洗涤细胞,并重悬,用流式细胞仪分析各组HEp-2细胞线粒体膜电位。线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,呈红色荧光。线粒体膜电位较低时,JC-1为单体,不能聚集在线粒体基质中,呈绿色荧光。线粒体膜电位用红色荧光细胞的比例表示。
1.2.7MitoSOX染色检测mtROS水平 HEp-2细胞培养24 h后,加入终浓度5 μmol·L-1的MitoSOX工作液,37 ℃避光孵育20 min,PBS洗涤,加入DAPI工作液,室温避光孵育15 min,PBS洗涤,激光共聚焦显微镜下观察。红色为mtROS,蓝色为细胞核。
1.2.8免疫荧光染色检测线粒体-自噬小体共定位 HEp-2细胞培养24 h后,加入MitoTracker Red工作液,在37 ℃避光孵育30 min。PBS洗涤,4%多聚甲醛固定15 min,PBS洗涤,0.3% Triton X-100室温渗透10 min,PBS洗涤。加入山羊血清封闭液,室温孵育1 h。加入LC3一抗(1 ∶150),4 ℃孵育过夜。PBS洗涤,加入FITC偶联的驴抗兔二抗(1 ∶300),室温孵育1 h。PBS洗涤。加入DAPI工作液,室温孵育3 min。PBS洗涤,激光共聚焦显微镜下观察。MitoTracker Red标记的线粒体呈红色,LC3标记的自噬小体呈绿色,DAPI染色的细胞核呈蓝色。

2 结果
2.1 BE提高RSV感染HEp-2细胞的活性CCK-8法检测RSV感染HEp-2细胞的存活率,流式细胞术检测RSV感染HEp-2细胞的凋亡率。结果显示,Control组中HEp-2细胞的活力最高。在RSV感染后,细胞的存活率减半,与Control组比较,差异具有统计学意义(P<0.05),不同浓度的BE干预后提高了RSV感染的HEp-2细胞的存活率,且呈剂量依赖性(P<0.05),见Fig 1A。而RSV感染提高了HEp-2细胞凋亡率(P<0.05),BE干预降低了RSV感染HEp-2细胞的凋亡率(P<0.05),见Fig 1B、C。
2.2 BE降低RSV感染HEp-2细胞中NLRP3炎性小体活化水平Fig 2结果显示,与Control组比较,RSV感染后提高了HEp-2细胞NLRP3、ASC、caspase-1蛋白表达及IL-1β分泌水平(P<0.05),BE干预后降低了RSV感染的HEp-2细胞中NLRP3、ASC、caspase-1蛋白表达及IL-1β分泌水平,且呈剂量依赖性(P<0.05)。BE有效降低了NLRP3炎性小体活化水平,保护了HEp-2细胞。
2.3 BE升高RSV感染HEp-2细胞线粒体膜电位和ATP水平Fig 3结果显示,RSV感染后,HEp-2细胞中呈红色荧光细胞的数量占比减少至53.1%,降低了线粒体膜电位(P<0.05)。BE干预后,各浓度组中红色荧光细胞的比例均提升,且呈剂量依耐性(P<0.05),高浓度组中最高线粒体膜电位细胞比例达到84.2%,抑制了线粒体的损伤。随着线粒体膜电位的升高,细胞中ATP水平与RSV组相比明显升高(P<0.05)。
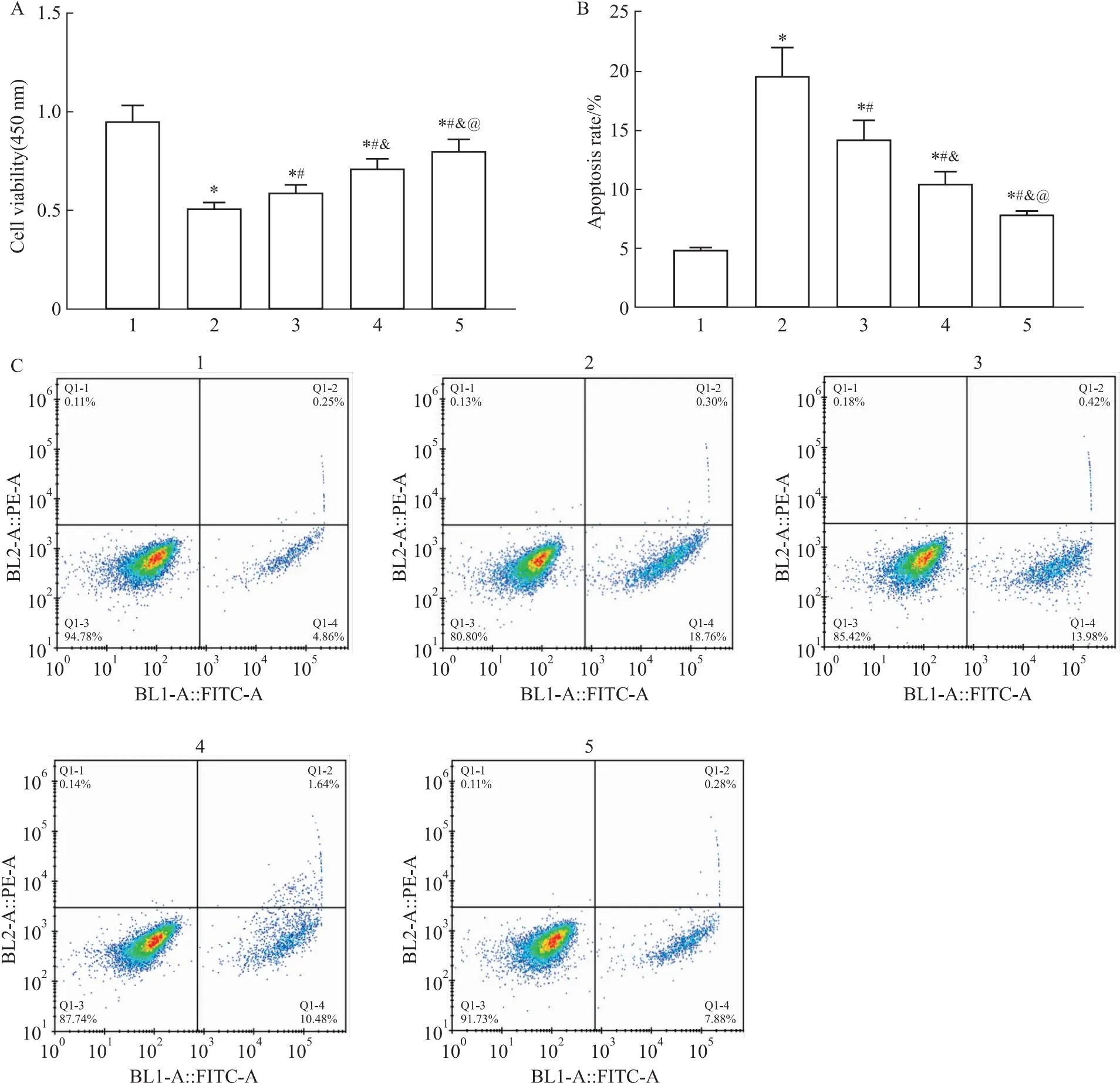
Fig 1 BE increased activity of

Fig 2 BE reduced NLRP3 inflammasome activationin RSV infected HEp-2
2.4 BE降低RSV感染HEp-2细胞mtROS水平Fig 4结果显示,Control组中mtROS水平最低,ROS在正常细胞中保持较低的水平。RSV感染HEp-2细胞后,与Control组相比,感染组中活性线粒体ROS红色荧光强度最高,细胞中mtROS水平明显升高(P<0.05),说明线粒体发生损伤,产生大量的ROS并释放到细胞质中。BE干预后,mtROS红色荧光强度逐渐减弱,与RSV组相比荧光强度明显降低,mtROS水平随BE浓度的升高而降低,同样呈浓度依赖性(P<0.05)。
2.5 BE提高RSV感染HEp-2细胞线粒体自噬水平Fig 5结果显示,与Control相比,在RSV感染后,HEp-2细胞中PINK1、Parkin、Beclin1蛋白的表达水平升高,p62蛋白的表达水平降低,BNIP3蛋白的表达水平降低,LC3Ⅱ/LC3Ⅰ比值提升,表明RSV的感染激活了PINK1/Parkin介导线粒体自噬,而线粒体的损伤导致BNIP3表达水平降低,差异具有统计学意义(P<0.05)。BE干预后,与RSV组相比,PINK1、Parkin、Beclin1蛋白的表达水平升高,p62蛋白的表达水平降低,BNIP3蛋白的表达水平升高,LC3Ⅱ/LC3Ⅰ比值提升,并随着BE浓度的增加,线粒体自噬标志蛋白表达水平越高(P<0.05)。免疫荧光结果显示,Control组HEp-2细胞线粒体(红色荧光)含量较高,自噬小体(绿色荧光)含量较低,没有观察到线粒体-自噬小体共定位。在RSV感染的HEp-2细胞中,线粒体含量降低,自噬小体含量提高,同样没有绿色荧光标记,未发现明显的线粒体-自噬小体共定位,共定位率与对照组相比无差异(P>0.05)。BE干预后自噬小体数量升高,线粒体数量同样升高,且能观察到明显的线粒体-自噬小体共定位,共定位率明显升高(P<0.05)。
2.6 抑制线粒体功能加重RSV感染Fig 6结果显示,在RSV感染HEp-2细胞中,环孢素A加入后细胞活性明显下降(P<0.05),炎性小体相关蛋白NLRP3、ASC、caspase-1蛋白表达水平明显升高(P<0.05),炎性因子IL-1β分泌水平升高(P<0.05),表明环孢素A的加入加重了细胞的炎症反应。进一步检测线粒体功能发现,线粒体膜电位与RSV组相比明显降低(P<0.05),细胞中ATP的水平也明显降低(P<0.05),提示线粒体的功能被进一步抑制。
3 讨论
RSV病毒感染在世界范围内普遍存在,严重威胁人类健康,BE作为一种传统的中药提取物,具有抗炎、抗菌和抗病毒活性等功效,是近期抗病毒研究中的热点之一,由于其效果稳定、安全性高,具有极大的临床应用前景。既往研究可知,BE通过LncRNA NRAV、RAB5C靶向竞争结合miR-299-3p,抑制JNK/p38 MAPK信号通路和PI3K/AKT信号通路提高了HSV-1感染HEp-2细胞的存活率,并降低凋亡率[7]。基于上述结果,本研究探究了BE对RSV感染HEp-2细胞活性的影响,RSV感染HEp-2细胞后,细胞存活率明显降低、凋亡率升高,BE干预则可显著提高感染细胞的活性,细胞凋亡率显著降低,表明BE减轻了RSV感染所致HEp-2细胞的损伤。

Fig 3 BE increased mitochondrial membrane potential and ATP levels in RSV infected HEp-2

Fig 4 BE reduced mtROS levels in RSV infected HEp-2
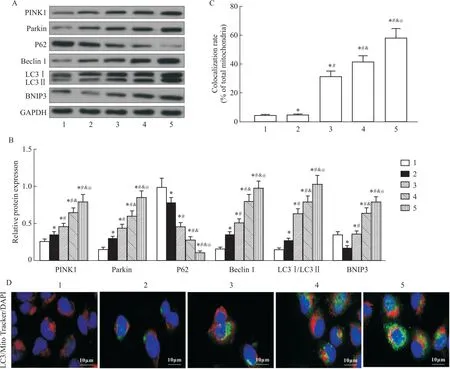
Fig 5 BE increased mitochondrial autophagy levels in RSV infected HEp-2
NLRP3炎性小体能被多种类型的病原体或危险信号激活,在机体免疫反应和疾病发生过程中具有重要作用,是机体介导免疫炎症的关键调控因子,主要由 NLRP3、ASC及caspase-1组成。NLRP3炎症小体在抵抗病毒感染中起重要作用[8]。病毒感染后,NLRP3识别入侵的病毒改变蛋白构象准备组装炎性小体,与ASC结合后,ASC构象变化与caspase-l结合,促进IL-1β等炎症因子成熟释放,诱导细胞高炎症状态,导致细胞损伤,进而发生细胞凋亡。大量的研究证明NLRP3炎性小体的过度活化是病毒感染导致细胞损伤的重要原因之一[9]。因此,作为炎症反应的核心,NLRP3炎症小体可能为各种病原体感染和炎症性疾病的治疗提供新的靶点。研究显示,RSV感染可提高HEp-2细胞内 NLRP3、ASC、caspase-l蛋白表达及IL-1β分泌水平,导致 NLRP3 炎性小体过度活化,使感染细胞的存活率降低,这与既往病毒感染的结果相似[10]。BE干预可降低RSV感染HEp-2细胞内NLRP3、ASC、caspase-l蛋白表达及IL-1β分泌水平,抑制NLRP3 炎性小体活化。结果提示BE对RSV感染HEp-2细胞的保护作用可能与BE抑制NLRP3 炎性小体活化有关。
线粒体很容易受损,在病毒感染后,细胞先天免疫反应或其他细胞应激产物会影响线粒体功能,一旦受损则会对细胞功能造成更加严重后果[11]。线粒体膜电位的异常会影响氧化磷酸化和线粒体ATP合成,进一步导致细胞受损[12],因此,评估磷酸化能力和电子传递能力、线粒体膜电位等,是研究病毒对线粒体功能的影响以及了解病毒性疾病发病机理的重要工具。在研究中,检测到RSV感染后细胞中表示线粒体高膜电位的红色荧光细胞比例由有96.5%下降至45.7%,ATP水平与未感染细胞相比降低60%,病毒感染使线粒体膜电位显著降低,并导致细胞质内的H+转运受阻,ATP合成大量减少。说明RSV感染使线粒体严重受损,线粒体膜电位去极化,提供细胞活动的ATP合成不足,导致细胞活性降低。BE干预后,线粒体膜电位逐渐升高,ATP合成增加,BE改善了线粒体功能,维持了细胞的稳定。线粒体膜电位的微量变化都会极大地影响线粒体的功能,并影响细胞的稳定,引发机体的各种疾病,BE的改善结果展示了对线粒体的保护作用,对病毒感染引起的线粒体功能障碍的治疗将具有重要意义。
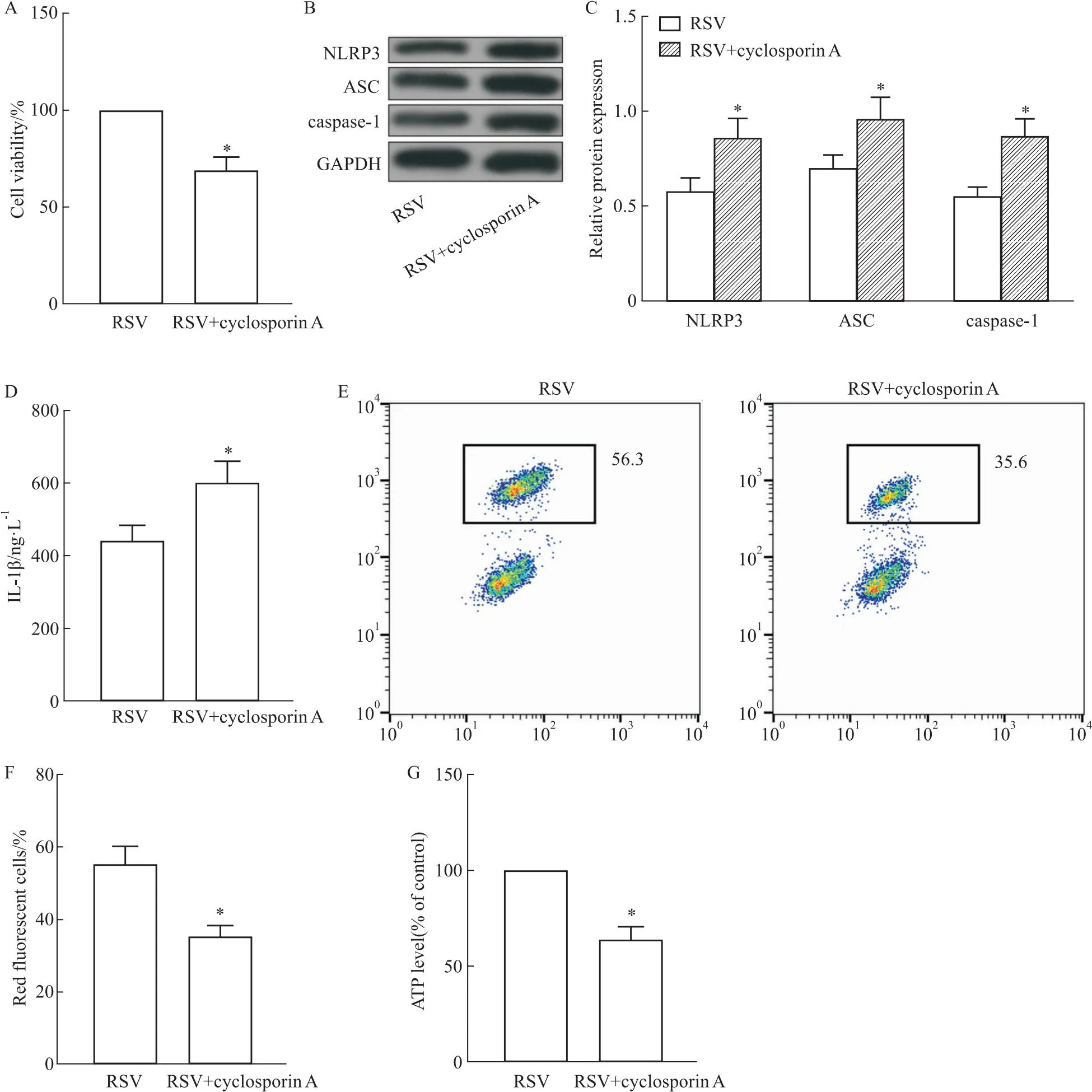
Fig 6 Inhibiting mitochondrial function aggravated RSV
NLRP3炎性小体的活化主要受mtROS调控,而ROS主要来自损伤的线粒体。ROS水平是细胞正常生理功能和环境因素导致细胞氧化损伤的重要标志,病毒感染使线粒体受损,导致线粒体释放ROS,并大量积累[13]。本研究发现,RSV感染可显著提高HEp-2细胞内mtROS水平,与既往研究腺病毒、流感病毒的结果相似[14-15],细胞受到病毒入侵后发生了严重的氧化应激反应,线粒体内膜在ROS高水平的环境中被破坏,同时NLRP3炎性小体和IL-1β炎性因子通过增加钙依耐性线粒体ROS和诱导ROS生成的基因来增加线粒体氧化,进一步加剧线粒体功能障碍,这也是导致细胞活性降低的主要原因之一。BE具有抗氧化的性质,干预后可显著降低RSV感染细胞内mtROS的水平。同时结合上文中得到BE能够提高线粒体膜电位并提高ATP水平的结果,对线粒体功能检测表明,RSV感染使细胞内抗氧化系统与氧自由基的平衡被打破,细胞内ROS水平过多,破坏线粒体的酶类、脂类和核酸,使机体出现氧化应激,同时ROS可攻击线粒体DNA产生氧化损伤,导致线粒体ATP合成减少、线粒体膜电位破坏等结构和功能变化。BE干预可减轻RSV病毒感染导致的线粒体损伤、抑制mtROS生成。
线粒体自噬是一种专一降解损伤或老化线粒体的选择性自噬,其对维持线粒体数量及正常功能、保持mtROS平衡非常重要[16]。线粒体自噬标志物根据自噬途径的不同,主要分为泛素依赖性和非泛素依赖性两种,目前研究最广泛的是PINK1/Parkin通路和BNIP3通路。线粒体受损后膜电位降低或消失,PINK1无法进入线粒体内膜并在线粒体外膜积累,这会募集激活Parkin,并泛素化自噬受体蛋白(p62、OPTN、NDP52)在线粒体外膜积累,导致泛素化产物通过与LC3结合被招募到自噬体中,成熟的自噬体与溶酶体融合形成自噬溶酶体,包含的线粒体随后被降解。非泛素依赖性线粒体自噬途径需要借助线粒体外膜上的BNIP3、NIX、FUNDC1等受体,通过与细胞自噬标志物蛋白LC3的相互作用,介导自噬体特异性识别受损的线粒体,进而诱导完成线粒体自噬[17]。本研究中,RSV感染提高HEp-2细胞内LC3Ⅱ/LC3Ⅰ比值,降低BNIP3、p62表达,升高PINK1、Parkin、Beclin1表达。免疫荧光实验显示,RSV感染可增强绿色荧光(LC3,标记自噬小体),降低红色荧光(标记线粒体),未观察到明显的线粒体-自噬小体共定位,表明病毒感染可增加细胞整体的自噬水平,但对线粒体自噬水平无显著影响。病毒感染破坏线粒体功能使线粒体膜电位降低导致PINK1在线粒体外膜积累,进一步招募Parkin并激活,PINK1/Parkin介导的线粒体自噬被激活。病毒感染所致BNIP3水平降低,这可能是由于病毒感染致线粒体损伤,线粒体含量降低,定位于线粒体的BNIP3随之降低。BE干预可显著提高RSV感染HEp-2细胞内LC3Ⅱ/LC3Ⅰ比值,表明自噬小体的自噬活性升高,PINK1/Parkin通路和BNIP3通路均被激活。BE的干预可增强RSV感染的HEp-2细胞中线粒体-自噬小体共定位水平,表明BE可诱导线粒体自噬,减轻RSV病毒诱导的线粒体损伤。有研究表明,BE可通过诱导线粒体自噬,降低线粒体ROS的产生,进而抑制流感病毒引发的巨噬细胞NLRP3炎性小体活化,减轻细胞炎症反应[18]。本研究结果与上述文献一致,提示BE可能通过调控线粒体自噬/ROS/NLRP3炎性小体通路,减轻RSV感染的HEp-2细胞损伤。为了验证改善线粒体功能对线粒体自噬的干预作用,用线粒体抑制剂环孢素A对RSV感染HEp-2细胞中的线粒体进行抑制,线粒体功能发生了更加严重的障碍,线粒体膜电位和ATP水平降低、NLRP3炎性小体活化程度提高、细胞的存活率比RSV感染后更低。环孢素A的使用抑制了线粒体的自噬水平,加重了RSV感染。
综上所述,BE对RSV感染的HEp-2细胞损伤具有保护作用,其机制可能与BE通过诱导PINK1/Parkin与BNIP3共同介导线粒体自噬,提高线粒体膜电位与ATP水平,抑制mtROS生成并抑制NLRP3炎性小体活化有关。然而,线粒体自噬是一个复杂的过程,我们后续实验将进一步探索是否存在其它分子机制在BE诱导线粒体自噬中发挥作用。
