奥沙利铂联合腹腔热灌注化疗在进展期胃癌根治术后早期应用的安全性和疗效评估
2024-02-03蔡高平
蔡高平,余 阳
(江汉大学 a.医学部,湖北 武汉 430056;b.附属医院胃肠外科,湖北 武汉 430015)
胃癌(GC)是常见的消化道恶性肿瘤,侵袭性能力较强,在亚洲地区发病率较高[1]。我国早期胃癌的诊断率较低,仅10%左右,大部分胃癌病例确诊时已为进展期。进展期胃癌即使行肿瘤根治术,腹膜复发转移率仍较高。大量临床研究表明,10%~20%的进展期胃癌病人在拟行手术时已存在腹膜种植转移[2]。此外,治疗性手术后的复发也比较常见,有研究[3-5]表明46%的患者出现术后腹膜复发,60%的患者因腹膜复发死亡。腹膜复发转移预后较差,中位生存期为3~6 个月,5 年生存率为0[4,6]。胃癌是所有胃肠道恶性肿瘤中腹膜转移最高的疾病[7]。如果胃壁发生全层侵犯,肿瘤细胞则通过直接接触扩散到腹膜腔。Roviello 等[6]的研究显示,伴有浆膜浸润的胃癌腹膜复发的几率更高。在手术操作中肿瘤细胞也可能脱离并形成腹腔转移。同时切除肿瘤周围淋巴管及血管时肿瘤细胞也可能会溢出而形成腹膜转移[8-9]。因此如何预防和治疗进展期胃癌腹膜复发转移,提高患者生存非常重要。近年来腹腔热灌注化疗技术被越来越多的医学中心应用在消化道恶性肿瘤并腹膜转移的患者中,且多数报道能明显降低腹膜复发转移、改善患者预后。腹腔热灌注化疗(HIPEC)是通过热灌注化疗机将化疗药物加热到41~43 ℃后持续作用于腹腔,一般时间为1 h,以清除游离肿瘤细胞,热疗可以增强化疗药物的效能,更有效地杀灭肿瘤细胞,热量通过破坏肿瘤细胞中的DNA 修复机制,并通过蛋白质变性诱导细胞凋亡,从而增加对药物的摄取[10-12]。通过持续的灌洗能让肿瘤细胞与化疗药物充分接触,最好地发挥化疗药物的效能,同时因为“腹膜-血浆屏障”,化疗药物能够在腹腔内形成高浓度,而血液浓度相较于全身化疗时的药物浓度低,没有明显的全身副作用。
临床上关于奥沙利铂联合腹腔热灌注化疗在进展期胃癌根治术后早期预防性应用中的报道较少,本研究主要探讨奥沙利铂联合腹腔热灌注化疗在有腹膜转移高风险的进展期胃癌患者行根治性手术后早期应用的安全性和有效性,为以后临床工作提供参考。
1 资料与方法
1.1 研究对象
回顾性分析江汉大学附属医院2018 年1 月-2020 年1 月收治的100 例局部进展期胃癌患者的临床资料,其中55 例于胃癌根治术后行腹腔热灌注化疗(HIPEC)治疗定义为观察组,同时收集患者灌注前后腹腔灌洗液,并行脱落细胞学检测;45 例行胃癌根治手术后未行HIPEC 治疗定义为对照组。所有患者术后均按替吉奥+奥沙利铂方案行6~8 周期的全身化疗。
1.2 入组标准
1.2.1 纳入标准 ①病理学确诊为结胃腺癌;②T分期为T2~T4a 期,依据美国癌症联合委员会(AJCC)第七版分期标准;③外周血检查、心、肺、肝肾功能检查结果经评估能耐受手术,术中探查无腹膜复发转移且所有手术患者手术均达到R0 切除;④年龄18~80 岁,病历资料完整。
1.2.2 排除标准 ①未进行胃癌根治术,仅应用HIPEC 行姑息性治疗的患者;②选择姑息性手术;③既往存在其他肿瘤病史者。
1.3 研究对象一般特征
根据纳入、排除标准,2018 年1 月-2020 年1 月共有100 例胃癌患者符合要求。55 例胃癌患者行胃癌根治术加腹腔热灌注化疗治疗定义为观察组(HIPEC 组),观察组(HIPEC 组)55 例患者中男性30 例,女性25 例,平均年龄为(64.89±10.23)岁;45 例胃癌患者只行胃癌根治术定义为对照组:45 例患者中男25 例,女20 例,平均年龄为(66.57±8.05)岁。术前均充分告知手术风险,患者在术前签署手术同意书,同时腹腔热灌注化疗组需签署腹腔热灌注化疗手术同意书,本研究经过江汉大学附属医院医学伦理委员会批准。
1.4 研究方法
所有患者均行腹腔镜下胃癌根治术,手术均由同一组手术经验丰富的手术医师团队严格按照腹腔镜胃癌根治术手术操作流程及标准完成,遵照日本胃癌协会(JGCA)的手术治疗指南,标准化进行腹腔镜胃切除术和D2 淋巴结清扫术,术中均达到R0 切除。行HIPEC 治疗的患者手术结束后在其脾窝、肝脏膈面及膀胱直肠陷凹(女性为子宫直肠陷凹)各放置一根有多个侧孔的引流管作引流,分别于左上腹、右上腹及右下腹壁引出并缝合固定。关闭腹腔后即刻行首次HIPEC,一般手术结束后1~2 d 可行第2 次,术后3 d 至一周内完成第3 次。将体外循环管道连接热化疗灌注机,设定热灌注化疗灌注温度为43 ℃,灌注流量200~500 mL/min,灌注时间一般为60~90 min,灌注袋内加入奥沙利铂100 mg+5%葡萄糖3 000~4 000 mL。将灌注液预热到38 ℃后打开进水阀开关开始进入治疗过程,逐步将温度升至43 ℃并控制温度在(43 ±0.5)℃,治疗结束后关闭循环管道并解除与引流管的连接,引流管接引流袋装置。
腹腔灌洗液收集及脱落细胞学检测:手术操作前用250 mL 生理盐水冲洗腹腔,并收集腹腔冲洗液200 mL 装入无菌标本袋并标记为热灌注化疗前腹腔灌洗液,手术及腹腔热灌注化疗结束后收集腹腔灌注液200 mL 装入无菌标本袋并标记为热灌注化疗后腹腔灌注液,将标本送病理科检测,离心沉淀后行细胞蜡片包埋制片。
热灌注组与对照组患者均于术后3~4 周内按替吉奥+奥沙利铂方案行全身化疗,所有病例术后均完成6~8 化疗周期。
1.5 观察指标资料收集
收集两组患者的一般临床资料包括如性别、年龄、BMI、肿瘤T 分期、肿瘤切除范围、淋巴结转移情况,收集两组围手术期严重并发症及不良反应包括吻合口瘘、感染、下肢深静脉血栓形成、出血、骨髓抑制等,收集腹腔热灌注化疗组患者前后腹腔脱落细胞学检测情况,同时收集两组患者1 年、3 年的腹膜复发转移情况及远处转移情况。
1.6 统计学分析
采用SPSS24.0 统计软件分析数据。计量资料采用t检验,计数资料采用卡方检验,部分单元格T<5 的计数资料则采用Fisher 精确概率法。P<0.05 为差异具有统计学意义。
2 结果
2.1 两组一般临床资料比较
2018 年8 月-2020 年1 月共有100 例胃癌患者符合要求,腹腔热灌注化疗组即观察组55 例,平均年龄为(64.89±10.23)岁,男性30 例,女性25 例;观察组BMI 为(21.49±2.57);T 分期为T2 期8 例,T3 期21 例,T4 期26 例;手术行近端胃切除患者9 例,远端胃切除39 例,全胃切除7 例;术后手术标本淋巴结转移阳性病例30 例。对照组45 例,平均年龄为(66.57±8.05)岁,男25 例,女20 例;BMI 为(21.76±2.01);T 分期为T2 期3 例,T3 期18 例,T4 期24 例;手术行近端胃切除患者7 例,远端胃切除30 例,全胃切除8 例;术后手术标本淋巴结转移阳性病例21 例。两组患者的性别、年龄、肿瘤部位、T 分期、淋巴结转移情况比较差异无统计学意义(P>0.05)。详见表1。

表1 两组患者临床资料情况Tab.1 Clinical data of two groups of patients
2.2 两组患者并发症及不良反应比较
腹腔热灌注化疗组中吻合口瘘1 例(1.81%,1/55)、腹腔内出血1 例(1.81%,1/55)、切口感染1 例(1.81%,1/55)、肠梗阻1 例(1.81%,1/55)、肺部感染2 例(3.63%,2/55)、下肢静脉血栓形成1 例(1.81%,1/55)、骨髓抑制10 例(18.18%,10/55);对照组:吻合口瘘1 例(2.22%,1/45)、切口感染2 例(4.44%,2/45)、肺部感染3 例(6.66%,3/45)、腹腔出血1 例(2.22%,1/45)、肠梗阻1 例(2.22%,1/45)、下肢静脉血栓形成1 例(2.22%,1/45)、骨髓抑制1 例(2.22%,1/45)。两组患者术后并发症及不良反应中吻合口瘘、腹腔出血、肠梗阻、切口感染、肺部感染以及下肢静脉血栓发生率比较均无统计学意义(P>0.05)。而HIPEC 治疗会增加骨髓抑制发生率(P=0.02)。见表2。

表2 两组患者并发症及不良反应情况Tab.2 Complications and adverse reactions of patients in both groups /n(%)
2.3 两组患者的腹膜复发转移及远处转移情况比较
表3 为患者随访情况,患者平均随访22 个月(5~36 个月),腹腔热灌注化疗组术后1 年腹腔内腹膜复发转移1 例,腹腔内腹膜复发转移率为1.81%(1/55);对照组6 例,腹腔内腹膜复发转移率为13.33%(6/45),两组术后1 年腹腔内腹膜复发转移比较差异有统计学意义(P<0.05)。术后3 年腹腔热灌注化疗组为3 例,腹腔内腹膜复发转移率为5.45%(3/55),对照组为12 例,腹腔内腹膜复发转移率为26.66%(12/45);两组术后3 年腹腔内腹膜复发情况比较有统计学意义(P<0.05)。腹腔热灌注化疗组术后1 年有2 例出现远处转移,1 例为肝转移、1 例为肺转移,对照组有3 例远处转移,1 例肝转移、1 例肺转移、1 例胸椎骨转移;术后3 年腹腔热灌注化疗组有7 例出现远处转移,肝转移3 例、肺转移2 例、脑转移1 例、骨转移1 例,对照组有9 例出现远处转移,肝脏转移4 例、肺转移3 例、脑转移1 例、胸壁转移1 例;两组患者1 年、3 年远处复发转移情况比较均无统计学意义(P>0.05)。
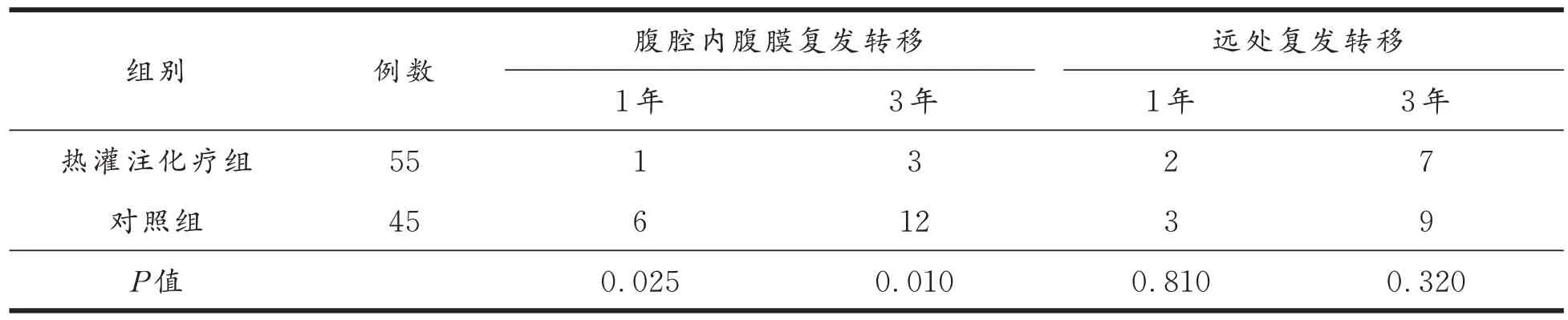
表3 两组患者术后1 年、3 年腹膜复发转移及远处转移情况Tab.3 Peritoneal recurrence,metastasis,and distant metastasis in two groups of patients at 1 and 3 years after operation/n
2.4 腹腔热灌注化疗组热灌注前后腹腔脱落细胞学检测情况
行热灌注化疗前所收集的腹腔灌洗液中共有11 例患者腹腔脱落细胞学检测出癌细胞,脱落细胞阳性率为20%(11/55),腹腔热灌注化疗后腹腔脱落细胞检测均未检测出癌细胞。
3 讨论
胃癌在我国属于高发的恶性肿瘤,病死率较高。腹膜复发转移被认为是影响患者预后的重要因素之一。过去腹膜复发转移被认为是恶性肿瘤的终末期表现,往往采取姑息性治疗,随着人们对肿瘤生物学的不断认识,腹膜复发被认为是肿瘤的局部复发,有的患者经过积极的治疗后生存期明显改善,部分患者可以治愈,因此国际腹膜肿瘤学会(PSOGI)已经提出使用细胞减瘤手术(CRS)联合腹腔内化疗作为一种新的治疗手段治疗胃癌腹膜转移[13]。关于使用细胞减瘤手术(CRS)和热腹腔内化疗(HIPEC)来改善腹膜转移方面预后报道一直在增加[1,14-15]。Allievi等[15]报道了一项单中心的回顾性研究,将患者分为两组:有腹膜转移高危风险的胃癌患者(辅助HIPEC 组)和胃癌并腹膜转移或腹腔肿瘤细胞学阳性患者(治疗性CRS 和HIPEC 组)。以总生存期(OS)和无病生存期(DFS)结果为研究终点指标。共41 例原发性胃癌患者接受了手术和HIPEC:辅助HIPEC 组14 例(34.1%),治疗性CRS 和HIPEC 组27 例(65.9%)。辅助HIPEC 组的1 年和3 年的OS 分别为85.7%和71.4%,而1 年和3 年的DFS 分别为71.4%和64.3%。在治疗性CRS 组和HIPEC 组中,1 年和3 年的OS 分别为60.3%和35.1%,而1 年和3 年的DFS 分别为38%和32.6%。治疗性CRS 组和HIPEC 组患者的单因素生存分析显示,淋巴结转移和组织学为印戒细胞癌是影响患者OS 的危险因素,而PCI >12 和淋巴结转移与DFS 的降低相关。因此CRS+HIPEC 治疗能明显提高有腹膜转移高危风险的胃癌患者和胃癌并腹膜转移患者的OS 和DFS,从而改善患者预后。Glehen 等[16]在法国进行了一项大型、多中心、回顾性研究,评估了159 例接受CRS 并在术中或术后腹腔热化疗的PC 患者。完成完整细胞减瘤切除术(CC-0)的患者生存期为15 个月,1 年和5 年生存率分别为61%和23%。CYTO-CHIP 研究比较了胃癌PC 患者的CRS 和CRS+HIPEC,发现与单独使用CRS 相比,CRS+HIPEC 的1 年(67.9% vs 48.5%)、3 年(27.1% vs 13.1%)和5 年(20.2% vs 7.4%)生存率更高,有研究[17-18]提示CRS+HIPEC 可以使PCI 评分在12~15 的胃癌患者生存获益。关于胃癌患者腹膜转移学说大部分学者现在普遍接受的Paget 的“种子和土壤”理论,最初,癌症细胞与原发肿瘤断开连接,迁移到腹膜,并附着在间皮细胞上。随后的阶段是它们通过基底膜侵入腹膜下组织,并随着血管生成而增殖[19]。大致过程为胃癌原发肿瘤细胞中黏附蛋白表达减少,引起肿瘤细胞脱离,脱离的肿瘤细胞与腹膜结合,由于表面上的CD44 黏附颗粒,细胞骨架发生变化并迁移到腹膜下间隙,细胞与暴露的腹膜上皮基底膜紧密结合。随后,它们分泌降解腹膜血屏障的蛋白酶,并深入腹膜下组织。侵袭的进一步阶段是新血管的形成,新血管给腹腔转移病症提供营养[20]。有研究[21]显示腹部手术后腹腔内会出现多种类型的免疫细胞,对于因肿瘤行腹腔手术的患者,在手术前后进行腹腔灌洗离心后从中间层回收细胞,并分析其表型和功能,与术前灌洗相比术后具有成熟表型的CD66b(+)肿瘤细胞患者的低密度中性粒细胞的数量显著增加,纯化LDN 的短期培养产生了许多SYTOX、核酸染色以及组蛋白和髓过氧化物酶阳性的线状结构,表明NETs 的形成。人胃癌癌症细胞MKN45、OCUM-1 和NUGC-4 选择性地附着在NETs 上,这被DNAse I 预处理完全消除。裸鼠腹膜内(IP)LDN 与MKN45-共转移强烈增加腹膜转移形成,而随后的IP 给药DNAseⅠ强烈抑制了腹膜转移的形成。在胃切除的大网膜组织表面发现许多NETs 样结构。腹膜表面的NETs 有助于腹腔内游离肿瘤细胞的聚集和生长。
腹腔热灌注化疗在刚开始应用时并发症发生率高,关于腹腔热灌注化疗的安全性问题一直以来都是大家关注的重点。本研究结果表明:腹腔热灌注化疗组与对照组在围手术期并发症如吻合口瘘、腹腔出血、肠梗阻、切口感染、肺部感染以及下肢静脉血栓发生率比较差异均无统计学意义(P>0.05),但腹腔热灌注化疗组有10 例出现骨髓抑制不良反应,对照组有1 例,两组在骨髓抑制不良反应的比较差异有统计学意义(P=0.02 <0.05)。腹腔热灌注化疗一定程度上会增加骨髓抑制不良反应的发生率,但骨髓抑制情况较轻,多无需特殊处理,可自行恢复。本研究认为腹腔热灌注化疗技术在规范的操作下应用是安全的,但仍需要做好术前评估、选择合适的病例、术中注意密切监测患者生命体征、术后定期复查血、生化相关指标。Yang 等[22]将患者随机分为CRS+HIPEC 与单独CRS 组,注意到HIPEC 组的中位生存期更长(11.0 个月vs 6.5 个月,P=0.046),而两组严重不良事件发生率相似。在一项单一机构的研究中,Kim 等[23]报道了CRS+HIPEC 治疗胃癌合并PM(腹膜转移)患者的CRS 没有改善。一篇关于通过随机对照试验(rct)评价热腹腔化疗(HIPEC)患者进展期胃癌(AGC)的短期和长期生存期研究[24],1 091 例患者被随机分为HIPEC 组和对照组。结果显示,在1 年、2 年和3 年随访时,HIPEC 组与对照组之间的生存率无显著差异,而在5 年随访时,总生存率差异有统计学意义。肠吻合口瘘、骨髓抑制、恶心呕吐的风险差异无统计学意义。与对照组相比,HIPEC 可改善AGC 伴/无腹膜癌的患者的长期OS,而不增加不良反应的风险,但短期OS 无获益。
本研究提示两组患者术后1 年、3 年远处复发转移率比较差异无统计学意义,两组术后1 年、3 年腹膜复发转移率比较差异有统计学意义,腹腔热灌注化疗组术后1 年、3 年腹膜复发转移率较对照组低,且差异比较有统计学意义,腹腔热灌注化疗能明显降低患者术后腹膜复发转移。笔者认为腹腔热灌注化疗主要清除的是腹腔内游离的肿瘤细胞和腹腔内微小转移病灶,远处转移不属于腹腔热灌注化疗的治疗范畴。胃癌发生腹膜转移的初始阶段多属于区域性转移,较少同时发生其他远处转移[2]。
Sugarbaker 等[25]发表的一篇对胃癌患者使用HIPEC 联合顺铂和阿霉素的随机对照试验没有显示出总体生存获益(P=0.2),治疗组和对照组早期的腹膜复发转移分别为19.6%和47.1%,HIPEC(P<0.001)治疗组能降低腹膜复发转移。本研究结果与之相似。Granieri 等[26]对关于胃癌腹膜转移的12 项研究进行荟萃分析,CRS+HIPEC 治疗的患者可以使患者术后1 年、2 年、3 年和5 年的生存收益。接受CRS+HIPEC 的患者的1 年、2 年、3 年和5 年生存率分别为86.9%、70.5%、63.7%和55.7%。CRS+HIPEC 在预防和治疗两方面均可改善局部进展期胃癌患者的预后。然而,由于术后并发症和病死率远不可忽略不计,严格的患者选择对获得最佳结果至关重要。若合并有远处转移则CRS+HIPEC 应用受限制。Brandl 等[27]通过对1994 年至2014 年接受治疗的448 例胃癌并腹膜转移患者进行队列研究分析,共纳入28 例患者,平均年龄为53.0 岁,平均PCI 值为3.3。总中位生存期为11.0 年(最小5.0 年,最大27.9 年)。细胞减瘤手术(CC-0)和PCI <6 为影响预后的重要因素。12/28 例患者的肿瘤复发时间中位数为9.6 年,与无复发的患者相比,其中位总生存期较低(P=0.002)。采用CRS 和HIPEC 治疗的胃癌PM患者可长期生存甚至治愈。患者预后与完整的细胞减瘤手术和低PCI 有关。
Rosa 等[28]对85 例进展期胃癌患者行回顾性分析,分别为单纯手术组、CRS+治疗性HIPEC 组和手术+预防性HIPEC 组,三组5 年OS 分别为9%、27%和33%。预防性HIPEC 组与单纯手术组(P=0.05)、治疗性HIPEC 组与单纯手术组(P=0.03)、治疗性HIPEC 组与预防性HIPEC 组(P=0.04)的比较差异均有统计学意义。单纯手术组、CRS+治疗性HIPEC 组和手术+预防性HIPEC 组的5 年DFS 分别为9%、20% 和30%。预防性HIPEC 组与单独手术组(P<0.000 1)、治疗性HIPEC 组与单独手术组(P=0.008)、治疗性HIPEC 组与预防性HIPEC组(P=0.05)比较差异均有统计学意义。AGC 接受手术加HIPEC 的患者比单纯手术治疗的患者有更好的OS 和DFS。Yonemura 等[29]报道,PCI ≤6 以及完成的细胞减瘤手术与较高的生存率相关,但确切的PCI 临界值尚未确定。Yang 等[30]使用了PCI ≤20,而有的人认为PCI ≤12 是CRS+HIPEC 治疗更好预后的指标[31-32]。Chia 等[33]报道了81 例接受CRS+HIPEC 的胃癌患者中,PCI ≤7 的这部分患者被证实5 年OS 最高。这一结论也得到了其他多项研究的支持[34-35]。虽然尚未确定PCI 的临界值,但对于在该患者群体中使用PCI ≤7 来考虑CRS+HIPEC 已达成共识。
本研究对腹腔热灌注化疗组行了术前、术后腹腔脱离癌细胞学检测,HIPEC 组中共有11 例患者腹腔脱落细胞学检测出癌细胞,脱落细胞阳性率为20%(11/55),腹腔热灌注化疗后腹腔脱落细胞检测均未检测出癌细胞,证实腹腔热灌注化疗对腹腔内游离癌细胞有较好的清除作用。腹膜内播散是胃癌转移形成的典型机制,根据美国癌症联合委员会(American Joint Committee on Cancer)第8 版TNM 分类,腹腔内游离癌症细胞(IFCC)的诊断与M(转移)分类同等对待。IFCC 是通过剥离进入腹腔而从原发肿瘤脱离的细胞。IFCC 的来源可能是医源性的,因为在肿瘤切除过程中手术技术不当,可能导致腹腔内播散。腹腔灌洗的细胞学检查被认为是确认IFCC存在的金标准;然而,它的灵敏度普遍很低。为了提高检查的灵敏度和可靠性,应用分子生物学技术。在GC 患者中检测到IFCC 的情况下,患者应具备化疗资格,或者可能应考虑使用温热腹腔化疗。不同国家对胃癌腹腔内腹膜转移的分期也有区别,美国癌症委员会把从腹腔穿刺细胞学制剂中检测到的癌症细胞将此特征归类为M1,而《日本胃癌分类》第13 版中,腹腔内游离的癌症细胞被归类为IV 期疾病[20]。临床工作中应充分认识进展期胃癌发生腹膜转移的高危因素,有研究[36-39]认为一般与T 分期、淋巴结转移、Borrmann 分型相关,T3、T4 胃癌病人发生腹膜转移的风险较T1、T2 病人高6 倍以上;有淋巴结转移病人较无淋巴结转移者高3.8 倍;Borrmann Ⅲ型和Ⅳ型较Ⅰ型和Ⅱ型高2 倍以上;淋巴结外浸润病人腹膜转移风险上升18 倍之多。Cotte 等[40]观察到GC 分期与腹腔灌洗液细胞学检查阳性率之间的相关性。该研究纳入了1 334 名胃肠道癌症患者,包括200 名GC 患者。细胞学检查的材料是用200 mL 盐水腹腔灌洗获得的。等待2 分钟后,从Douglas 袋中吸出50 mL 腹腔液;癌症患者pT3/T4 期细胞学检查阳性率为95.8%,提示癌症细胞直接从原发肿瘤脱落。La Torre 等[41]还强调,IFCC 细胞学检查的阳性结果取决于癌症的分期。该研究包括64 名GC 患者。打开腹腔后,将200 mL 生理盐水冲洗腹腔;将液体均匀分散到Douglas 袋、结肠旁沟以及右侧和左侧腹膜下区域。随后,从腹腔的各个部位收集50 mL 灌洗液用于细胞学检查。在研究中,11%的患者IFCC 的细胞学检查结果为阳性;86%的患者分期为pT3/T4 期。此外,71%的患者观察到GC G3/G4 的分化程度。这项研究的结果表明,在腹膜细胞学检查结果为阳性的患者中,癌症进展更快,预后更差。早期腹膜转移的诊断较困难,CT 检查对微小的转移病灶诊断价值有限,一般对高度可疑的病人可考虑行腹腔内取腹水取样,检测有无游离的肿瘤细胞,对可疑病灶行组织病理学检查,还可以行腹腔镜探查。2019 年中国临床肿瘤学会发布的胃癌诊疗指南推荐术前检查怀疑腹膜转移,则应行诊断性腹腔镜检查与腹腔灌洗液细胞 学检测[42]。Wong 等[43]的研究 证实,RT-PCR 检测提高了GC 患者腹腔内IFCC 检测的敏感性。156 名患者在腹腔镜手术期间进行了腹腔灌洗。所获得的灌洗液被设计用于细胞学检查和使用RT-PCR 检测癌胚抗原(CEA)。31 名(19.9%)患者在细胞学检查中观察到IFCC 的存在,而使用RT-PCR 的58 名(37.2%)患者获得了阳性结果。与经典细胞学检查相比,CEA 的RT-PCR 检查具有更高的亚临床腹腔内播散检测能力和更高的敏感性。Takebayashi 等[44]评估了IFCC 的生存能力及其在体内形成转移的能力,从102 例GC 患者的腹腔灌洗中获得IFCC,随后癌症细胞在细胞培养物上增殖;研究的后续阶段是将癌症细胞注射到小鼠的腹腔。在研究中,使用了24 只裸鼠,在注射IFCC 后,将其培育6 周,然后用戊巴比妥安乐死。剖腹术后,收集腹膜结节进行组织病理学检查。在4 只小鼠中发现了组织学上与低分化腺癌相当的腹膜结节。这项研究证实IFCC 能够形成腹腔内转移。本研究认为在具有腹膜转移高危因素的胃癌患者中早期使用腹腔热灌注化疗是安全的,并且预防腹膜复发转移疗效显著,值得临床推广和应用。
