论政府数据开放视域下的药品试验数据强制披露
2024-02-02刘宇飞
刘宇飞
引 言
药品试验数据是指制药企业在药品申请上市许可之前,为了证明药品安全有效而进行的一系列实验室试验与临床试验所获得的数据。(1)参见褚童:《TRIPS协定下药品试验数据保护研究》,知识产权出版社2015年版,第14页。作为关系药品安全有效性的重要数据,药企为获得药品试验数据付出了不菲的成本投入,故TRIPS协定第39.3条要求各成员国对该类数据予以保护,即政府不得披露药企所提交的用于上市申请的药品试验数据,以防止不正当的商业利用。但此种保护并不具有绝对性,TRIPS协定也为药品试验数据保护设置了两项例外性限制:一是出于保护公众之需;二是已采取措施保证数据不被不正当的商业使用。(2)参见《与贸易有关的知识产权协议》(TRIPS协定)第39.3条。只有满足二者之一,政府方能披露药品试验数据。药品试验数据披露关涉公共利益与药企私益的平衡,我国药品管理法律制度也对药品试验数据披露作出了规定,但只是对TRIPS协定的简单援引,尚需完善。
大数据时代,由于数据蕴藏着丰富的经济社会价值,逐渐作为一种生产要素得以广泛运用。数据的流通性是决定数据价值的必要条件,而数据流通的首要方式即为数据开放(3)参见朱扬勇编:《大数据资源》,上海科学技术出版社2018年版,第13页。,数据只有对外开放才能被应用并形成显著效益。其中,由于政府数据具有公共性、全面性与高价值性(4)参见杨涛主编:《数据要素:领导干部公开课》,人民日报出版社2020年版,第34页。,故政府数据开放对于数据产业发展至关重要。药品试验数据虽属于药企的财产性利益,但当药企将试验数据提交药品监管部门后,药品试验数据便处于政府药监部门的控制之下,基于公共利益所需药监部门可将试验数据强制披露。可见,药品试验数据强制披露与政府数据开放制度有着紧密联系,《促进大数据发展行动纲要》等中央文件也多次提及要向社会开放医疗卫生领域的公共数据资源。鉴于此,将药品试验数据强制披露置于政府数据开放视域下进行深入研究,具有实现理论调适与制度融贯之积极意义。本文将首先探讨药品试验数据纳入政府数据范畴的正当性,继而分析药品试验数据在政府数据开放类型中的基本定位,从而在政府数据开放视域下检视我国药品试验数据强制披露制度存在的不足之处。最终运用政府数据开放的价值理念与原则规范来对我国药品试验数据强制披露制度予以优化,以期实现药品试验数据强制披露与政府数据开放的有效衔接,为我国药品试验数据强制披露制度的完善提供一定的智识支持。
一、理论前提:强制披露的药品试验数据可纳入政府数据范畴
理解不同法律制度之间的相互联系是明晰法律制度结构和功能的重要方面。(5)参见约瑟夫·拉兹:《法律体系的概念》,吴玉章译,商务印书馆2018年版,第205页。故欲在政府数据开放的背景下研究药品试验数据强制披露制度,有必要在厘清政府数据界定标准的基础上,先行发掘将药品监管部门控制下的药品试验数据纳入政府数据之正当性。
(一)政府数据的界定标准厘清:履职行为生成+公共使用目的
明晰政府数据的界定标准是将药品试验数据强制披露纳入政府数据开放范畴的逻辑起点。目前学界关于政府数据的基本内涵尚无统一定义。有学者认为政府数据是在行政机关、法律法规规章授权的组织进行管理或服务活动中产生、收集的包括其组织机构、行为内容和方式、规则、程序及影响的状态和变化的总和。(6)参见汪梦:《政府数据开放的法律问题研究》,中国社会科学出版社2020年版,第46页。国内首部政府数据地方性法规《贵州省政府数据共享开放条例》将政府数据定义为行政机关在履行职责过程中制作或者获取的,以一定形式记录、保存的各类数据。(7)参见《贵州省政府数据共享开放条例》第3条第1款。上述界定模式着眼于政府数据的形式标准或行为标准,即政府数据必须是在行政机关等公共职能组织在履行职责的过程中生成。但该行为标准尚不能廓清政府数据的核心特质,因为政府数据在行政机关等公共职能组织履行职责的行为中生成仅是其充分而非必要条件,如果只以此形式性标准来界定政府数据的范围有欠妥当。
为进一步寻求政府数据更为可靠的界定标准,有必要关切政府数据的法律性质。从政府数据的功能与用途出发,其核心特征在于鲜明的公共属性。一方面,政府数据的产权具有公共性。政府数据不同于个人数据、企业数据,并非由特定私权主体独占使用。我国不少地方数据立法已经明确写入了政府数据为国家所有之规定(8)参见《福建省政务数据管理办法》第3条、《重庆市政务数据资源管理暂行办法》第4条、《山西省政务数据资产管理试行办法》第7条等。,这为政府数据国家所有奠定了制度基础。而“国家所有”意味着政府数据应当由全体国民所共同拥有,政府只是为了保证政府数据这一公共资源的公共性而代表国民进行管理。(9)参见雷晓明等编:《中国公共资源问题:理论与政策研究》,西南交通大学出版社2011年版,第5页。另一方面,政府数据与公共利益具有密切联系。如交通、医疗、科技、农业等领域的政府数据往往蕴含着与民生保障服务息息相关的信息,不仅可以满足社会公众的基本需求,保障数字人权的实现(10)参见齐英程:《作为公物的公共数据资源之使用规则构建》,载《行政法学研究》2021年第5期。,还可以推动社会创新与进步。由此可见,对于政府数据的法律属性应当定位为一种新型之“公物”。所谓公物,是在行政主体支配下服务于行政活动或服务于公共利益并供公众使用的物品。(11)参见肖泽晟:《公物法研究》,法律出版社2009 年版,第8 页。于公物而言,其核心的构成条件为“公共使用的设定”(12)王名扬:《法国行政法》,北京大学出版社2016年版,第249页。,即公物的用途必须是基于社会公共使用目的。故政府数据的实质界定标准便呼之欲出,政府数据必须具有公共使用目的,且事实性地服务于公共利益。
综上,对政府数据的界定标准予以锚定既需要考虑政府数据生成行为的客观表征,也需要服膺于政府数据应当基于公用目的而使用这一实质内核。具言之,政府数据的界定标准有二:一是基于数据生成行为的形式标准。政府数据必须是在政府履行职责的行为中形成或采集。至于数据生成主体是否政府本身则在所不问,政府可以是数据生成者,也可以只是数据提供者和保有者。二是基于数据使用目的之实质标准。政府数据必须出于公用目的而使用。既然政府数据是在政府履职中形成或采集的,那么必然对政府活动和社会公共事务存在涵射力。“政府的角色定位于确保公共利益居于支配地位。”(13)珍妮特·V.登哈特、罗伯特·B.登哈特:《新公共服务:服务,而不是掌舵》(第3版),丁煌译,中国人民大学出版社2016年版,第48页。换言之,政府数据的公物属性要求其必须服务于公共利益,确保公众得以平等使用。
(二)药品试验数据的公共属性是其转化为政府数据的基本前提
在明确政府数据的界定标准后,需要以此双重标准来审视药品试验数据能否转化为政府数据。首先,药品试验数据符合政府数据的形式界定标准,药品试验数据是原研药企在研发阶段获取的一系列关于药品安全有效性的测试数据,需要提交药品监管部门作为上市申请的审批依据。药企在将药品试验数据提交药品监管部门审批后,药品试验数据便满足了政府数据的形式标准。即该数据由药品监管部门在履行职务过程中获取,政府药监部门可以成为药品试验数据的保有者。
其次,探讨药品试验数据是否符合政府数据的实质标准同样需要从药品试验数据的法律属性入手。关于药品试验数据的法律性质,学界通说大致可分为商业秘密说和未披露信息说(新型知识产权)两种,或认为药品试验数据是药企的财产性利益,应为一种特殊的商业秘密;(14)参见董春华:《论药品试验数据的保护与公开——兼谈中国药品试验数据保护模式的路径选择》,载《科技与法律(中英文)》2022年第4期。或认为药品试验数据只有在药企手中未披露时才属于商业秘密,一旦药企将其提交药品监管部门用作上市申请后,便不再绝对保密,只能视为一种特殊的未披露信息。(15)参见褚童:《TRIPS协定下药品试验数据保护研究》,知识产权出版社2015年版,第27页。但无论是商业秘密还是未披露信息,都属于知识产权客体。而知识产权是一种典型的私权(16)TRIPS协定开篇序言中便宣示:“认识到知识产权是私权”。参见联合国贸易与发展会议,国际贸易和可持续发展中心编:《TRIPS协定与发展:资料读本》,中华人民共和国商务部条约法律司译,中国商务出版社2013年版,第1页。,可见,药品试验数据本质上具有私权属性。
既然药品试验数据是药企的私权,而政府数据具有公物属性,那么是否意味着药品试验数据与政府数据截然对立。答案是否定的,药品试验数据的私权属性并不妨碍其转化为政府数据。这是缘于药品试验数据在具备私权属性的同时还具有公共属性,药品试验数据作为药企在研发试验中获得的与药品安全性、有效性相关的系列数据,彰显着突出的公共利益价值,对于国家安全、公共健康及本国医药产业发展具有重大影响(17)参见周婧:《药品试验数据的保护与限制》,载《知识产权》2017年第3期。,出于保障公共健康必要之考虑,药品试验数据可被视为一种具有国家乃至国际公益属性的公共物品(18)See Jerome H.Reichman,Rethinking the role of clinical trial data in international intellectual property law:the case for a public goods approach,13Marquette Intellectual Property Law Review1,29-30(2009).,理应服务于社会公用目的,此种公共属性构成了药品试验数据转化为政府数据的基本前提。由于药品试验数据兼具私权属性与公共属性的特质,故需要国家行政权力介入对药企掌控的药品试验数据予以保护和限制,来实现公益与私益的平衡。尽管此种行政措施的介入并不能使得药品试验数据“从私权内化为私权与公权的混合体”(19)吴汉东:《知识产权总论》,中国人民大学出版社2013年版,第15页。,但药品试验数据的公共属性使其脱离了药企的专有掌控,当药品试验数据被提交药品监管部门后,药品监管部门便代表国家对该类试验数据进行管理与监督,可以对试验数据进行审查,还可在审批药品上市的目的范围内拥有使用、处置试验数据的权利。这也意味着当药企将药品试验数据提交药品监管部门后,药品试验数据便也具有公物属性,而公物是“为实现和维护公共利益,由行政主体支配或管理的物”(20)姜广俊:《公物与公产概念辩析》,载《求索》2008年第4期。。据此来看,在行政主体将公物用于公益之时,需要对物有一定的权利根据,但该权利根据并不一定是所有权,也可以只是支配权。(21)参见 盐野宏:《行政法》,杨建顺译,法律出版社1999年版,第751页。易言之,公物并不排斥私权,也可为私人所有。药品试验数据虽然本质上是一种私权,但仍然有成为公物之可能。此外,TRIPS协定以及我国的《药品管理法实施条例》等法律规范明确对药品试验数据进行了公物“命名”,确定了该类数据的公用目的与公法支配权。(22)参见 汉斯·J.沃尔夫、奥托·巴霍夫、罗尔夫·施托贝尔:《行政法》(第2卷),高家伟译,商务印书馆 2002 年版,第 464页。即在涉及公众健康等公益目的所必需时,药品监管部门有权将药品试验数据向社会披露,此种公共使用目的之设定,使得药品试验数据具备成为政府数据之实质要素。
当然,药品试验数据转化为政府数据需要满足特定条件:其一,能转化为政府数据的仅仅是提交药品监管部门作为上市审批依据的药品试验数据而非全部药品试验数据。广义上的药品试验数据泛指通过研发试验获得的关于药品药理、性能、疗效的数据集合,法律要求药企提交药品监管部门的并非研发过程中获取的全部药品试验数据,完整的药品试验原始数据仍然由药企或研发机构自行保有。(23)参见褚童:《TRIPS协定下药品试验数据保护研究》,知识产权出版社2015年版,第17页。换言之,能被政府数据外延所囊括的必须是处于药品监管部门控制下的药品试验数据。其二,能转化为政府数据的必须是在获得上市批准前未披露的药品试验数据。药品试验数据强制披露是由药品试验数据保护的例外情形引申而来,故能够为政府所披露的药品试验数据也必须先符合药品试验数据保护制度的规定。即药企在新药获得上市许可前不得自行披露药品试验数据,否则便不能作为药品监管部门审批新药上市申请的依据,且一旦药品试验数据在审批前被披露便无需政府再次进行公开,自然也不存在转化为政府数据的必要性。
二、基本定位:药品试验数据于政府数据开放类型中的三阶配置
依前文所述,药品监管部门控制下的药品试验数据可以被纳入政府数据范畴,但政府数据开放制度内容丰富,数据开放类型也具有多样化特征,因此需要进一步明确药品监管部门控制下的药品试验数据在政府数据开放类型中的基本定位,这也是将政府数据开放制度与药品试验数据强制披露制度相融贯之基础。
(一)政府数据开放类型的多元化呈现
政府数据开放制度的核心意蕴在于通过实现社会公众对政府控制数据的公平获取与利用,促进数据流通价值的最大化,但这并不意味着需要一视同仁地对所有的政府数据予以开放。政府数据应当以开放为原则,不开放为例外,且对于不同类型的政府数据,其开放要求也存在显著差异性。简言之,凡是向社会开放不会减损数据主体权益或公共利益,且有助于创造公共价值的政府数据,都应予以开放。如果开放可能会减损数据主体权益或公共利益的,对该类政府数据的开放应当慎重,需要通过各种技术措施甚至禁止该类数据开放来避免数据主体权益和公益不当减损之风险。
纵览我国关于政府数据或公共数据的地方立法,均采取了对数据实行分类管理的原则,相关立法依据政府数据的特性及开放程度不同,将政府数据开放类型大体分为了三种:无条件开放、有条件开放和不予开放,其数据开放程度依次递减。无条件开放类政府数据是指该类政府数据的安全保护和处理能力要求较低,可以通过数据开放平台向所有的公民、法人或其他组织非歧视性地开放获取和利用,且开放的内容应当是完整、原始、未经修改的政府数据。有条件开放类政府数据因其数据安全保护和处理能力要求较高、时效性较强或需要持续获取(24)参见《上海市数据条例》第41条第2款。,故只有在满足特定条件时才能向社会公众开放获取,而所谓的特定条件通常指开放对象具备对政府数据的技术处理和安全保障能力。(25)参见宋烁:《论政府数据开放中个人信息保护的制度构建》,载《行政法学研究》2021年第6期。不予开放类政府数据对数据安全保护和处理能力要求最高,因其高度敏感性而禁止向社会开放。地方立法对该类数据往往以明示列举的形式进行规定,豁免开放的情形包括涉及国家安全、公共利益、个人信息、个人隐私、商业秘密、保密商务信息等。(26)参见《贵州省政府数据共享开放条例》第21条第4款、《浙江省公共数据条例》第30条第1款、《上海市数据条例》第41条第2款等。
(二)药品试验数据于政府数据开放类型中的具化配置
药品试验数据是原研药企获得新药专利权的前提与基础,内含药企的核心商业秘密,对此类数据予以保密将使原研药企获得在新药市场上作为首次开发者的市场优势。(27)参见梁志文:《药品数据的公开与专有权保护》,载《法学》2013年第9期。但同时药品试验数据作为一种新型知识产权客体,具有公开性特征,“公开性是知识产品所有人获得知识产权的前提”(28)吴汉东:《知识产权法》(第5版),法律出版社2014年版,第21页。,因此药企需要以药品试验数据专业知识的公开来换取法律对药品试验数据专有权的保护。而当药品试验数据转化为药品监管部门控制下的政府数据并符合法定披露情形时,尚需考虑药品监管部门披露的药品试验数据应当归于何种政府数据开放类型。基于药品监管部门控制下的药品试验数据兼具私权属性与公物属性的复杂性,并不能武断地将药品试验数据归于任何一种单独的政府数据开放类型之中,而应当根据不同时间、不同情形来对药品试验数据披露予以精细化定位。(详见图1)
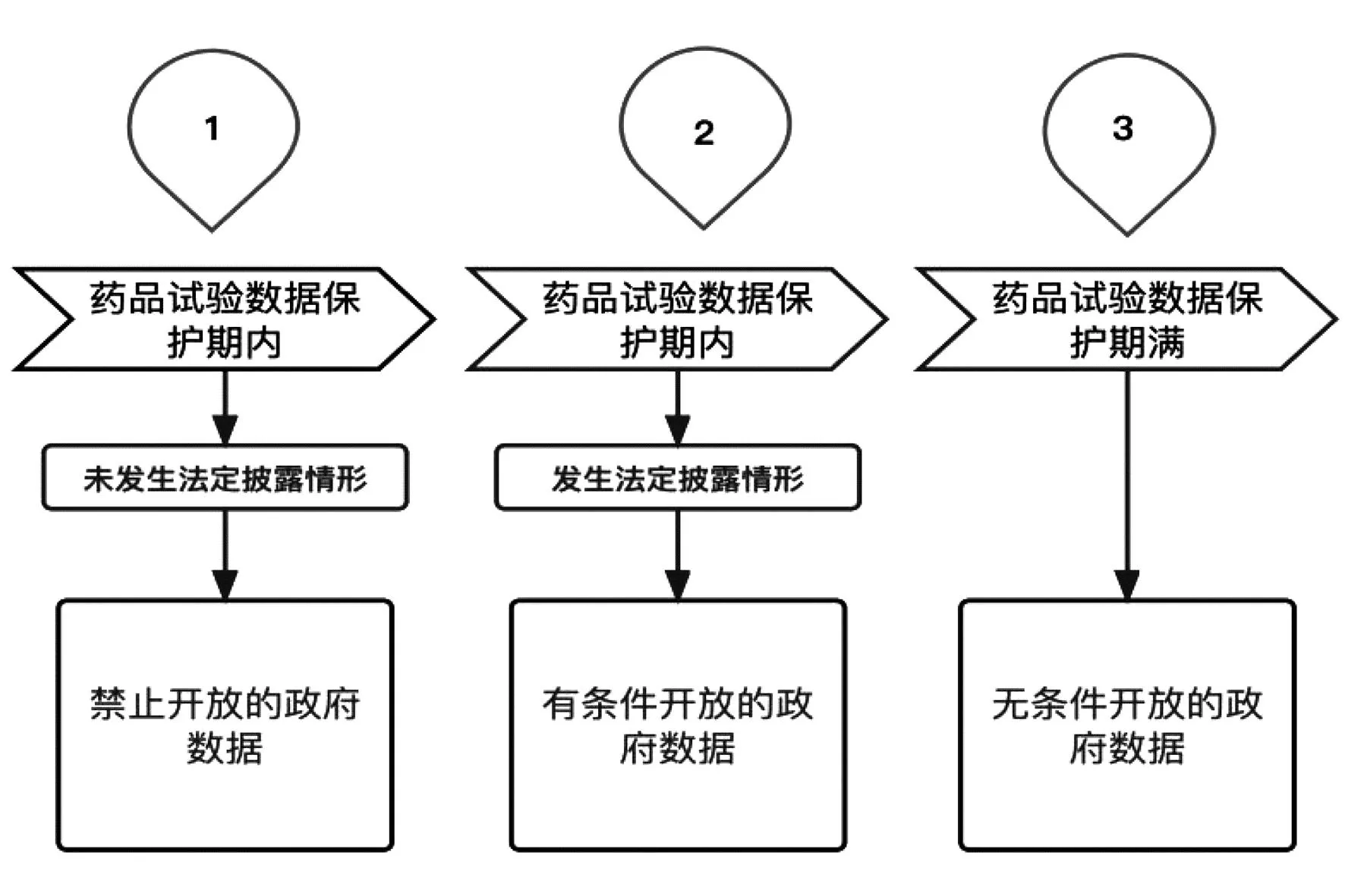
图1 药品试验数据于政府数据开放类型中的三阶定位
其一,药品试验数据保护期内,未发生符合法定披露情形的事由时,药品监管部门控制下的药品试验数据因涉及药企核心商业秘密,故属于禁止开放的政府数据。其二,药品试验数据保护期内,出现符合法定披露情形的事由,即TRIPS协定第39.3条规定的因公共利益需要而披露和防止不正当商业利用的披露,此时药品监管部门控制下的药品试验数据应当属于有条件开放的政府数据。为避免泄露药企的商业秘密,药品监管部门必须对药品试验数据进行脱敏、脱密处理并严格限制其使用范围后,才能向社会公众披露。此时所披露的数据实际是基于对药品试验原始数据进行整合处理而形成的次生数据。(29)参见马颜昕等:《数字政府:变革与法治》,中国人民大学出版社2021年版,第218页。其三,药品试验数据保护期满后,药品监管部门控制下的药品试验数据应当归于无条件开放的政府数据。当药品试验数据独占期满后,法律默认药企已经对试验数据的商业价值进行了充分利用,故数据保护权利人不再享有试验数据的独占权,此时药品监管部门控制下的药品试验数据可以向社会公众无条件开放。
三、现状检视:政府数据开放下药品试验数据强制披露的不足
作为WTO成员方,我国在药品管理法律法规中也规定了药品试验数据强制披露制度,但囿于种种原因,相关规定较为原则与粗疏,导致药品试验数据强制披露制度与政府数据开放制度存在龃龉,不利于药品试验数据强制披露与政府数据开放制度的融贯契合。主要缺憾在于药品试验数据强制披露制度的价值取向与政府数据开放制度相错位、药品试验数据强制披露立法的精细化不足、强制披露的方式和范围有限。
(一)理念层面:药品试验数据强制披露的价值取向存在偏差
“法的价值的确定对于法律制度的建立具有首要意义。”(30)卓泽渊:《法律价值论》(第3版),法律出版社2017年版,第439页。故有必要基于政府数据开放制度的价值取向来审视药品试验数据强制披露制度,可以发现二者的价值取向存在一定偏差,不利于药品试验数据强制披露制度融入政府数据开放制度之中。
政府数据开放制度是对政府信息公开制度的延伸与拓展。(31)参见黄贤达、高绍林:《论中国公共数据开放的双重路径与规范重塑》,载《江西师范大学学报(哲学社会科学版)》2022年第3期。其制度目标既涵盖了政府信息公开制度下对公民知情权的保障、提高政府透明度等传统面向,还涉及促进公众参与,提升协同治理能力的制度目标。提升公众参与实效性是巩固社会协同治理机制的重要环节,而政府数据开放正逐渐成为“公众参与的关键赋能者和推动者”。(32)丁晓东:《从公开到服务:政府数据开放的法理反思与制度完善》,载《法商研究》2022年第2期。政府数据开放的基本原则之一为采取机器可读的格式向公众开放,此种电子化的开放形式增强了政府数据的获取便捷性与可利用性,使得公众得以便利地运用政府公开的数据了解并参与公共事务,且有利于提高公众监督公共事务、有效表达自身意愿的能力。(33)参见宋华琳:《中国政府数据开放法制的发展与建构》,载《行政法学研究》2018年第2期。此外,政府数据开放制度最为重要的价值旨趣应当是促进数据要素的流通,实现政府数据价值的最大化利用。与政府信息公开制度聚焦于保障公众知情权不同,政府数据开放制度更侧重于政府数据公开后的利用,政府数据的公开仅仅是释放数据要素价值的必要环节而非最终环节。“开放数据的目标一开始就定位于数据的再使用,而非知晓政府决策制定的过程和依据”(34)高富平、张晓:《政府数据开放的边界如何厘定》,载《人民论坛》2017年第21期。,可见,政府数据开放制度的重心在于充分实现政府数据的经济效应与社会价值(35)参见郑磊:《开放政府数据的价值创造机理:生态系统的视角》,载《电子政务》2015年第7期。,也正是这一制度目标使得政府数据开放制度相较于政府信息公开制度发生了本质性变革。
目前,我国药品试验数据强制披露制度的价值追求仍主要建立在保障公众知情权的基础上:一方面,药品试验数据强制披露制度通过保障公众的知情权从而有助于社会公众健康权的实现。药品获取是公众实现健康权的决定因素,健康权应内含知悉药品相关信息的权利。而药品试验数据作为关涉药品功效的重要信息,提高药品试验数据透明度正是公众获取药品信息的重要途径(36)参见梁志文:《药品数据保护的比较分析与立法选择》,载《政法论丛》2014年第5期。,有助于公众在充分了解药品信息的基础上做出自主选择,最终服务于公众健康权之实现。另一方面,药品试验数据强制披露制度通过保障公众的知情权从而提高药品审批透明度,促进药品安全性之保障。药品试验数据是药品上市许可审批的重要依据,且该数据的真实性、有效性与可靠性对于药品的安全性至关重要。公开药品试验数据既有助于社会公众对药企提交审批的试验数据之真实性、有效性与可靠性进行监督,同时也便于在药品上市后继续跟踪药品数据,确保上市药品的后续安全性与有效性。(37)参见董春华:《论药品试验数据的保护与公开——兼谈中国药品试验数据保护模式的路径选择》,载《科技与法律(中英文)》2022年第4期。
然而,从制度发展历程来看,药品试验数据强制披露虽然名为数据披露(公开),但并不仅局限于药品试验数据的简单对外公开与获取,其被披露后也存在数据利用环节的延伸。如世卫组织临床试验注册平台在2015年便发布了支持共享临床试验原始数据的声明,并主张推动试验原始数据的有偿开放与免费使用。可见,药品试验数据正在由非结构化的、开放授权要求较为模糊且开发利用受限的“数据公开”迈向结构化的、获得开放授权并能被自由再利用的“数据开放”。(38)参见郑磊:《开放的森林:政府数据开放的中国故事》,上海人民出版社2018年版,第34页。显然,我国现有以知情权为权利基础的药品试验数据强制披露制度对于药品试验数据的流通利用关涉不足,这与政府数据开放制度的核心价值追求即充分释放数据的经济与社会价值存在一定出入。药品试验数据强制披露制度侧重于“知”而忽视“用”,不仅限缩了药品试验数据的开放范围,妨碍了药品试验数据强制披露制度纳入政府数据开放制度范畴,也与当前培育数据要素市场、提升数据资源价值的理念背道而驰。
(二)规范层面:药品试验数据强制披露的立法设计阙如
当前我国政府数据开放的立法现状总体呈现政策引导、中央立法缺位、地方立法先行之态势。尽管尚未出台政府数据中央立法,但不少政策文件曾多次对加快政府数据开放提出明确要求,关于政府数据开放的地方先行立法也已此起彼伏,可见我国政府数据开放的制度建构已然颇具规模。但反观药品试验数据强制披露制度却缺乏必要的规范设计,我国药品试验数据强制披露制度的直接立法体现在现行《药品管理法实施条例》第34条(39)参见《药品管理法实施条例》第34条第3款。,但该规定只是对TRIPS协定中药品试验数据保护例外内容的简单援引和复述,并未对药品试验数据强制披露制度的具体内容予以细化。2018年国家药监局公布的《药品试验数据保护实施办法(暂行)》(征求意见稿)也纳入了药品试验数据强制披露相关内容(40)参见2018年《药品试验数据保护实施办法(暂行)》(征求意见稿)第12条。,该意见稿在TRIPS协定的基础上新增一项药品试验数据保护例外情形,即当“药品审评审批机构依法公开审批信息”时,药品监管部门也可以强制披露药品试验数据,但囿于种种原因该意见稿并未能正式公布实施。2022年《药品管理法实施条例》(修订草案征求意见稿)虽然对于药品试验数据保护对象有所拓展,不再区分规定创新化学药或创新治疗用生物制品,但药品试验数据强制披露仍然延续了对TRIPS协定相关内容的重复规定。(41)参见2022年《药品管理法实施条例》(修订草案征求意见稿)第40条第3款。
总体而言,我国药品试验数据强制披露制度对于以下内容欠缺精细化设计:一是对强制披露法定情形的具体解释。对于何种情形下国家药品监管部门可以强制披露药品试验数据,《药品管理法实施条例》只是直接照搬TRIPS协定中药品试验数据保护的两项例外情形,即基于公共利益需要而披露和因已采取措施防止不正当的商业利用而披露。但这两项例外情形具有较强的原则性与模糊性,可操作性较差,其具体意涵仍需进一步厘清,否则将会导致理解上的分歧与适用中的差异性。如对于何为“不正当的商业利用”,TRIPS协定并未给出权威解释,导致发达国家与发展中国家法律规定中也存在较大争议,核心争议即国家药品监管部门利用原研药企提交的药品试验数据审批仿制药上市申请是否属于“不正当的商业利用”。(42)参见梁志文:《论TRIPS协议第39.3条之数据保护》,载《法治研究》2014年第2期。二是试验数据的具体披露方式。当前我国立法虽然规定国家药监管部门有权在符合法定情形时强制披露药品试验数据,但对于可以采取何种方式披露却未作细化规定,如对于药品试验数据注册实行强制性登记还是自愿性登记。三是药监部门对试验数据的披露限度。关于药品试验数据的披露限度一直存在全部披露还是部分披露之争议,我国药品管理法律制度并未明确药监部门可以在何种限度上披露药品试验数据。而完整的药品试验数据包括临床前的试验数据、临床试验数据和新药生产流程、生产设施等三类数据(43)参见杨莉、宋华琳、赵婕:《药品试验数据保护与专利保护之平行并存性研究》,载《中国新药杂志》2013年第22期。,药品试验数据尤其是临床试验数据含有诸多药企的商业秘密、患者个人信息等敏感信息,国家药品监管部门对于此类敏感信息的处理态度决定了试验数据披露限度的范围。四是试验数据强制披露的权益救济渠道。药品试验数据强制披露制度关涉试验数据保护权利人、社会公众与药品监管部门之间的利益冲突,因此必然会产生各种法律矛盾。如药品监管部门强制披露药品试验数据有可能会侵犯药企的试验数据保护权与患者的个人隐私,但如果不予披露,又可能阻碍社会公众知情权、健康权等权利的实现。对于药品监管部门作出的披露决定,各方当事人应当如何寻求法律救济,是否可以提起行政复议或行政诉讼等,我国药品试验数据强制披露制度对此尚缺乏相关规定。
(三)实践层面:药品试验数据强制披露的方式和范围有限
法律制度是由一般性规范同适用与执行规范的特殊性行为所构成的综合体,这意味着法律制度既有规范的一面,也有事实的一面。(44)参见 E.博登海默:《法理学:法律哲学与法律方法》,邓正来译,中国政法大学出版社1998年版,第238页。因此对于药品试验数据强制披露制度的考察不应局限于其应然层面的规范性结构,还应着眼于该法律制度在实然层面的事实性影响。
当前我国药品试验数据强制披露制度的实施主要集中于临床试验数据的公开披露,现有的药品试验数据登记平台为中国临床试验登记注册中心(ChiCTR)和药物临床试验登记与信息公示平台(CTR)。其中,中国临床试验登记注册中心(ChiCTR)成立于2005年,是世卫组织临床试验注册平台的一级注册机构,但本质上只是一个非营利性的学术机构。该平台接受在中国和全世界实施的临床试验注册,将临床试验的设计方案及一些必要的研究信息向公众开放获取。虽然该平台原则上实行自愿登记,但中国临床试验注册和发表协作网(ChiCTRPC)宣布其成员期刊自2007年优先发表已注册的临床试验,并逐步过渡到只发表已注册的临床试验报告,使得基于该平台的临床试验注册具有了一定之软强制性。药物临床试验登记与信息公示平台(CTR)由国家药监局药品审评中心于2012年组建,根据2013年原国家食品药品监督管理总局发布的《关于药物临床试验信息平台的公告》可知,该平台虽然对临床试验实行强制登记与信息公示,但只适用于获得临床试验批件并在我国进行临床试验的申请人,并且登记注册的试验数据并非全部对社会公示,还包括仅用于监督管理而不向社会公示的情形。
从实践现状来看,我国药品试验数据强制披露制度存在着一定之局限性。其一,药品试验数据强制披露路径单一。无论是中国临床试验登记注册中心(ChiCTR)还是药物临床试验登记与信息公示平台(CTR),均由政府和公共组织推动或组建,缺乏社会力量的多元化参与。此外,药品试验数据强制披露方式也仅限于药企在相关数据库进行登记注册和公示,开放形式较为匮乏。其二,药品试验数据强制披露范围有限。临床试验数据的透明化流程包括三部分:临床试验注册、结果报告和共享原始数据。而目前药物临床试验登记与信息公示平台(CTR)对药品试验数据强制披露主要还停留在临床试验注册公开阶段,从披露范围来看一般只提供临床试验基本信息的公开,尚未触及临床试验结果摘要和原始数据的开放共享。相较而言,中国临床试验登记注册中心(ChiCTR)对药品试验数据的披露要更为深入。该平台自2016年3月起逐步将临床试验原始数据和结果数据列入注册内容,并向公众开放共享。但总体来看,实践中我国药监部门强制披露的药品试验数据本质上并非完整的原始数据,而是呈现为服务于药监部门管控目的下且经过编辑的信息性内容。这与政府数据开放制度原则上要求将完整的原始数据或粒度数据(granular data)向公众开放之要求相去较远(45)See Victoria Wang,David Shepherd,Exploring the extent of openness of open government data-A critique of open government datasets in the UK,37Government Information Quarterly1,2(2020).,一定程度上只是一种流于形式的,信息公开式的“小数据开放”。
四、未来展望:政府数据开放下药品试验数据强制披露的优化理路
如前所述,我国药品试验数据强制披露制度还存在一系列问题。这些问题若不能得以妥善解决,不仅药品试验数据强制披露制度的功效将大打折扣,也不利于药品试验数据强制披露制度顺利纳入政府数据开放制度范畴。唯有基于政府数据开放制度的价值引领,对我国药品试验数据强制披露制度予以整体优化与应对,方能有效纾解药品试验数据强制披露制度的现有困境。
(一)药品试验数据强制披露应以公共数据权为权利基础
目前我国的药品试验数据强制披露制度以保障公众知情权为主要面向,此种权利定位不利于充分释放药品试验数据之流通性与公共性带来的经济效应与社会价值,也导致药品试验数据强制披露制度与政府数据开放制度的价值取向存在偏差。为促进药品试验数据强制披露制度与政府数据开放制度的价值基础相吻合,应当以公民的公共数据权代替知情权重塑药品试验数据强制披露制度的权利定位。
随着大数据、人工智能等信息技术的冲击,公民数据权也应运而生,成为一项新兴的公民基本权利,且具有复合性特征。(46)参见龚子秋:《公民“数据权”:一项新兴的基本人权》,载《江海学刊》2018年第6期。公共数据权正是公民数据权体系中的重要内容,社会公众可以“向行政主体请求开放政府数据资源,以平等获取和使用政府数据的权利”(47)朱峥:《政府数据开放的权利基础及其制度构建》,载《电子政务》2020年第10期。。政府数据开放必须以实现公民的基本数据权利为出发点(48)参见吕廷君:《数据权体系及其法治意义》,载《中共中央党校学报》2017年第5期。,药品试验数据强制披露制度要想真正纳入政府数据开放范畴,将公共数据权代替知情权作为制度生成运行的权利基础是必然选择。这主要出于以下三方面的考量:
其一,药品试验数据具有公共属性是公共数据权作为药品试验数据强制披露权利基础的逻辑起点。前文提及,国家药品监管部门控制下的药品试验数据具有公物属性,可以转化为国家所有的政府数据。而宪法关系中的“国家所有”本质是履行全民利益的国家职责,根本目的在于实现“全民所有”。(49)王广辉、谭家超:《“国家所有”的本质回归及其现代法理》,载《学术研究》2018年第1期。故基于此种理论基调,以药品试验数据为代表的政府数据应当是一种为全体公民共同所有,并用于公共服务的资源,只是为了摆脱全民共有物的价值宣示意义而进入可操作领域,才交由代表公益的政府部门进行实际占有和支配。(50)参见徐国栋:《罗马法与现代意识形态》,北京大学出版社2008 年版,第180 页。而政府部门应当将政府数据向全社会公开以发挥数据资源价值并保障公众公共数据权的实现。遵循“政府数据全民所有—公民享有公共数据权—政府履行数据开放义务”的三阶逻辑结构,既然药监部门控制下的药品试验数据为全民所有,社会公众便可行使公共数据权,请求政府披露药品试验数据,从而对药品试验数据进行平等获取与利用。
其二,公共数据权作为药品试验数据强制披露的权利基础,可以满足信息社会中公众对药品试验数据资源需求由知情需求升级为使用需求的客观要求。(51)参见陈尚龙:《大数据时代政府数据开放的立法研究》,载《地方立法研究》2019年第2期。提高药品试验数据的透明度,不仅可以更好地保障公众之健康权,还具有激发试验数据科研价值与商业价值的效应,可助推药品创新研发及医药产业的发展。而此目的之达成有赖于通过药品试验数据从数据控制者到数据使用者之间的流通实现其分析价值(52)参见高富平:《数据流通理论:数据资源权利配置的基础》,载《中外法学》2019年第6期。,可见,药品试验数据价值的实现应以数据的流通利用为前提。但公众知情权强调对信息的知悉与获取(53)参见王万华编:《知情权与政府信息公开制度研究》,中国政法大学出版社2013年版,第1-2页。,该权利的实现仅仅是药品试验数据强制披露制度的权利效果之一,并不能完全涵盖药品试验数据强制披露的制度目的。公共数据权既可以囊括知情权的权能,又侧重于公众对数据获取后的利用,因而更适宜作为药品试验数据强制披露的权利基础。
其三,公共数据权兼具自由权和社会权属性,药品试验数据强制披露将其作为权利基础,也更贴合政府数据开放的价值追求。一方面,公共数据权的自由权属性表现在政府应消极对待公共数据权的正常行使,原则上不应干预公众行使公共数据权的目的、过程与结果。政府数据开放的核心原则之一为非歧视性,即政府数据应当对每个社会成员平等开放,普遍受益。故作为公共数据权主体,公众获取并利用药品试验数据的动机多样,行使权利的形式也不尽相同,但只要是在法定范围内基于公共数据权获取利用药品试验数据,便不应受任何控制与约束。另一方面,公共数据权的社会权属性表现在政府对公众实现公共数据权的积极保障。政府数据开放本质上是政府提供的公共服务(54)参见郑磊:《开放不等于公开、共享和交易:政府数据开放与相近概念的界定与辨析》,载《南京社会科学》2018年第9期。,因此公众获取利用政府数据主要依赖行政主体的积极作为。为了保障公众可基于公共数据权而获取使用药品试验数据,政府需通过搭建试验数据平台、存储加工试验数据等多种形式为药品试验数据的开放创造条件。综上,公共数据权的双重权利属性可以更好地契合药品试验数据强制披露的权利旨趣。
(二)合理调整与细化药品试验数据强制披露的法定情形
药品试验数据强制披露的立法完善应当首先聚焦于药品试验数据强制披露情形的优化与解释。《药品管理法实施条例》规定了国家药监部门可以强制披露药品试验数据的两种情形:基于公共利益需要和已采取措施防止不正当的商业利用。但这两种法定披露情形均直接援引自TRIPS协定,其科学性有待加强。
一是对基于公共利益需要而强制披露试验数据的情形予以具化。药品试验数据强制披露的第一项情形为“公共利益需要”,具有较强的抽象性。为使该法定情形更具明确性与实操性,一方面要对公共利益予以限缩。因为公益并非绝对、单一的概念(55)参见李建良:《行政法基本十讲》,元照出版有限公司2011年版,第6页。,涉及国家安全、公共秩序、公共安全等诸多类型(56)参见高志宏编:《公共利益:界定、实现及规制》,东南大学出版社2015年版,第80-81页。,如果公共利益范围过宽,将不利于药品试验数据专有权的保护。药品试验数据强制披露所涉之公益应当为公共健康,即只有当危及公共健康时,药监部门才能强制披露药品试验数据。另一方面应当结合比例原则对基于公益强制披露试验数据的政府行为予以严格限制。虽然强制披露试验数据可以保障公共健康,但保障公共健康的可选手段往往并不只有强制披露药品试验数据一种。比例原则的核心内容是要求采取最温和手段的必要性子原则(57)参见周佑勇:《行政法基本原则研究》(第2版),法律出版社2019年版,第46页。,故发生公共健康危机时,政府部门应当基于必要性原则在可达至目的之诸多手段中进行权衡,只有当强制披露药品试验数据是保障公共健康的唯一或者损益最小、最具合理性措施时,药监部门强制披露药品试验数据才具有正当性与合理性。
二是不再保留因已采取措施防止不正当的商业利用而披露试验数据之情形。核心原因在于我国采取了药品试验数据独占保护模式,此种保护模式下第二项法定披露情形即已采取措施防止不正当的商业利用已属冗余。为此有必要先行厘清“不正当的商业利用”之外延,在原研药企向药监部门提交试验数据后,其他药企以不正当手段获取此数据用于仿制药申请无疑属于不正当的商业利用。而药监部门利用原研药企提交的药品试验数据审批仿制药上市申请也应属于不正当的商业利用,因为此种审批行为实际上构成了竞争药企对原研药企药品试验数据的间接利用,具有一定的商业效应。即药监部门利用原研药企的试验数据审批仿制药上市申请,事实上消除了仿制药进入市场的阻碍。而在试验数据独占保护模式下,既禁止独占期内仿制药企直接利用原研药企的试验数据进行上市,也禁止药监部门依赖原研药企提交的试验数据评估仿制药上市申请。(58)参见褚童:《药品试验数据保护义务国内实施的制度困境与解决——以药品获取为视角》,载《河北法学》2017年第9期。可见政府已经采取了实际措施防止试验数据被不正当地进行商业利用,故第二项披露情形已无保留必要。
(三)丰富药品试验数据强制披露的方式与限度层次
提升药品试验数据强制披露的法制化程度应坚持综合性立法与专门性立法相结合。在对《药品管理法实施条例》中的药品试验数据强制披露条款进行完善细化的同时,另一方面还应当加快制定药品试验数据专门立法,为此可在《药品试验数据保护实施办法(暂行)》(征求意见稿)的基础上,吸纳药品试验注册与公示的相关内容并进一步拓展,对药品试验数据强制披露的对象、方式、程序、限度等具体要求予以明确。其中,最为重要的是对药品试验数据强制披露的方式和限度进行规范化设定,这关系到药品试验数据强制披露能否顺利纳入政府数据开放范畴。为促使药品试验数据强制披露制度与政府数据开放制度的融贯衔接,应以政府数据开放的基本原则为遵循,对药品试验数据强制披露的方式和限度予以重点优化。
其一,以政府数据开放中的完整性原则为指导,尽可能扩大药品试验数据强制披露的限度。政府数据的质量对于开放政府数据的获取和再利用至关重要,故政府数据开放对数据质量有着较高标准。开放政府工作组在2007年便指出,开放的政府数据首先应当具备完整性。完整性是指政府数据应力求完整地反映记录事项的全部内容,除个人隐私等例外情形,开放的政府数据必须是原始数据,具有源头性、精细性且未经修改。(59)参见焦海洋:《中国政府数据开放应遵循的原则探析》,载《图书情报工作》2017年第15期。不完整的数据开放将妨碍政府数据的再利用,当前我国药品试验数据强制披露基本限于临床试验基本信息的公开,且存在选择性、偏倚性等不规范现象,距原始试验数据开放尚有一定距离。因此需要在药品试验数据强制披露制度中坚持数据完整性原则,当然,这并不意味着对药企数据保护权的忽视,而是在符合法定披露情形下,妥善处理药品试验数据中的商业秘密与隐私等敏感信息,对药品试验数据予以个案分析,逐步披露。
其二,恪守政府数据开放中的公众参与原则,实现药品试验数据强制披露的方式多元化。政府数据开放需要建构在数据控制者与数据使用者及数据使用者彼此之间的互动基础上,故公众参与也应当作为政府数据开放的基本原则之一,且贯穿于政府数据的开放与利用全过程。(60)参见宋烁:《论政府数据开放的基本原则》,载《浙江工商大学学报》2021年第5期。目前我国药品试验数据强制披露多依赖于政府部门和公共组织推动,缺乏社会力量的深度参与,不利于社会公众对药品试验数据的充分获取与利用。当今社会私主体已经深度介入到管制、提供服务、政策设计与实施当中,对管制的贡献也从咨询性作用延伸至决策权力的承担。(61)参见朱迪·弗里曼:《合作治理与新行政法》,毕洪海、陈标冲译,商务印书馆2010年版,第323页。为此需要在药品试验数据的披露过程中广泛开展公私合作,如在药品试验数据开放平台的建设中引入互联网公司、科研机构等第三方提供数据分析、数据安全监管、平台运营维护等技术支持;在药品试验数据的利用环节可与特定主体签订数据开放许可协议,以法律协议明确数据控制者(政府部门)的责任和开放许可用户的权利与义务,调和试验数据价值释放与风险监管之间的矛盾等。(62)参见范佳佳:《中国政府数据开放许可协议(CLOD)研究》,载《中国行政管理》2019年第1期。
其三,结合药品试验数据在政府数据开放类型中的定位,明晰药品试验数据强制披露的具体方式与限度。首先,完善既有的临床试验注册与公示机制。临床试验注册与公示是我国提高药品试验数据透明度的重要举措,也是药品试验数据强制披露制度的核心机制。应当继续推进并提升其规范化程度,充分利用药物临床试验登记与信息公示平台(CTR)作为统一的官方数据登记平台,并对标世卫组织临床试验注册的要求,逐步扩大对临床试验结果数据和原始数据的登记与开放共享。其次,细化我国赋予创新药的6年数据保护独占期,并相应设置“X+Y”层级性的药品试验数据披露方式与限度。目前我国规定对创新药数据保护独占期内的仿制药上市申请采取一刀切的“不予批准”。此种保护方式较为单一,可将现有的6年数据保护独占期调整为2年的“不受理”期限与4年的“不批准”期限:(1)在独占期前两年,药监部门不得受理仿制药的上市申请,原研药企对试验数据“绝对垄断”,但药监部门可以基于公共健康需要强制披露与药品安全性、有效性相关的试验结果数据;(2)在独占期后四年,仿制药可以提交上市申请,药监部门可以受理但不得批准其上市,原研药企对试验数据“相对垄断”。此阶段内除可披露试验结果数据外,药监部门还可与科研机构等特定主体签订数据开放许可协议,允许相关利益者出于非商业目的获取和利用涉及安全性和有效性的药品试验详细数据;(63)参见褚童:《全球公共卫生危机背景下药品试验数据披露的可能与路径》,载《知识产权》2020年第9期。(3)最后,药品试验数据独占期满后,原研药企不再享有数据保护独占权,可向公众开放完整的药品试验原始数据。(详见图2)

图2 国药品试验数据强制披露的分阶段设想
(四)完善药品试验数据强制披露的权益保障机制
政府数据开放行为中政府作为数据控制者居于支配和主导地位,故“政府数据开放法律关系是一种行政法律关系”(64)吕廷君:《政府数据开放的法治思维》,载《理论探索》2017年第4期。。而制度上不能给政府侵犯公民权利留有可乘之机是法治对行政法的总体要求(65)参见孙笑侠:《法律对行政的控制》(修订二版),光明日报出版社2018年版,第22页。,药品试验数据强制披露制度作为政府数据开放范畴中的重要内容,亦应秉持保障相对人合法权益的基本法治理念,在充分释放试验数据利用价值的同时还需推进相应权益保障及救济机制的配套实施。
法律制度中总是存在着诉求多元化的各方利益主体,不同主体之间的利益需求整合正是塑造制度价值取向的重要基础。(66)参见阮青:《价值哲学》,中共中央党校出版社2004年版,第168-169页。一般而言,药品试验数据强制披露制度涉及试验数据保护权利人、试验数据使用者和药品监管部门三方主体的利益博弈,需要通过限制原研药企的试验数据保护权利,调适试验数据保护权利与公众健康、医药产业发展对试验数据的合理需求这对基本矛盾,在药品试验数据的保护与限制之间寻求平衡支点。“多元主义模式的逻辑,要求行政机关必须适当考虑每一个竞争的利益。”(67)理查德·B.斯图尔特:《美国行政法的重构》,沈岿译,商务印书馆2021年版,第134页。试验数据保护权利人和试验数据使用者既是利益的核心竞争者,也是药品试验数据强制披露这一行政行为的相对人,应当基于药品试验数据强制披露行为的全过程为二者构筑起完善的权益保障机制。原因在于对行政过程进行控制,其保障相对人权益或实现行政职能的意义远大于对行政结果的控制。(68)参见杨海坤、黄学贤:《中国行政程序法典化——从比较法的视角研究》,法律出版社1999年版,第5页。
首先,在药品试验数据强制披露的事前阶段,药品试验数据相关立法中应当先行征询试验数据保护权利人即原研药企对试验数据披露的方式、范围等内容的意见,力求试验数据披露规范在数据的保护与披露之间达成和解。同时药品监管部门对于药品试验数据中涉及商业秘密、个人隐私等敏感信息的内容,还应制定切实可行的数据编辑处理规则。其次,在药品试验数据强制披露的事中阶段,一方面,为保护药企的试验数据独占保护权,药品监管部门强制披露试验数据必须符合形式法治要求,即符合公共健康需要等法定情形时方可披露;并应同时具备实质法治要素,即接受比例原则的审查,强制披露试验数据的行政行为必须是对药企试验数据权益损害最小之手段。另一方面,行政机关往往掌握先进的技术手段(69)参见哈特穆特·毛雷尔:《行政法学总论》,高家伟译,法律出版社2000年版,第438页。,药品监管部门在对试验数据进行强制披露时,必须按事先制定的编辑规则对试验数据中所涉及的敏感信息进行脱敏、脱密等技术处理,在确保客观完整性的前提下尽可能消除试验数据中蕴含的敏感元素。最后,在药品试验数据强制披露决定作出后,如试验数据保护权利人和试验数据使用者不服披露决定,或者药品监管部门未能全面履行试验数据保护与披露职责的,应当允许试验数据保护权利人和试验数据使用者提起行政复议或行政诉讼。此外,若因药品监管部门的不当披露行为给试验数据保护权利人造成实际损失的,药品监管部门还应履行行政赔偿义务。
结 语
药品试验数据虽是药企的私有财产性利益,但由于其具有的内在公共属性,政府有权基于公共健康所必需对药品试验数据予以披露。在政府信息公开迈向政府数据开放的当下,将药品试验数据强制披露纳入政府数据开放范畴既有必要性也有可行性。然而,我国药品试验数据强制披露制度与政府数据开放充分发掘数据利用价值的核心理念尚有一定差距,为此需在政府数据开放制度的统领下,对药品试验数据强制披露的权利基础与规范程度予以优化,努力实现药品试验数据强制披露制度与政府数据开放制度的融贯契合。这不仅有利于进一步完善药品试验数据强制披露制度,平衡试验数据权利人的私益与公众健康保障之公益,也对充分实现药品试验数据的创新增值价值具有深远意义。
