定量血流分数对非ST 段抬高型急性冠状动脉综合征患者冠状动脉临界病变功能性狭窄的诊断价值
2024-02-02肖亚楠肖文涛叶发民郭素萍张晶晶屈永生高传玉张静李建朝
肖亚楠 肖文涛 叶发民 郭素萍 张晶晶 屈永生 高传玉 张静 李建朝
目的:定量血流分数(QFR)是一项基于冠状动脉造影的无导丝功能学检查。本研究以血流储备分数(FFR)为参考标准,验证QFR 对非ST 段抬高型急性冠状动脉综合征(NSTE-ACS)患者冠状动脉临界病变(冠状动脉狭窄程度40%~70%) 功能性狭窄的诊断价值。
方法:回顾性分析2018 年6 月1 日至2023 年2 月1 日就诊于阜外华中心血管病医院并行冠状动脉FFR 检查的168 例NSTE-ACS 患者。通过第二代QFR 检测仪(AngioPlus,上海搏动医学影像技术有限公司)离线分析目标血管的QFR,并记录病变血管的解剖学参数,包括最小管腔直径(MLD)、直径狭窄百分比(DS%)、最小管腔面积(MLA)、面积狭窄百分比(AS%)。当FFR ≤0.80 时,认为冠状动脉狭窄存在功能学意义,即为冠状动脉功能性狭窄。
结果:以FFR 为金标准,对比剂血流模型QFR(cQFR)和固定血流模型QFR(fQFR)识别NSTE-ACS 患者冠状动脉临界病变功能性狭窄的AUC 分别为0.829(95%CI:0.773~0.885,P<0.001)和0.821(95%CI:0.766~0.875,P<0.001),诊断准确度、灵敏度、特异度分别为81.30%、56.00%、98.63%和76.83%、59.00%、99.04%。DeLong 检验表明,在NSTE-ACS 患者中,cQFR 对冠状动脉临界病变功能性狭窄的诊断价值显著优于fQFR(P=0.03)。
结论:以FFR 为金标准,QFR 尤其cQFR 对NSTE-ACS 患者冠状动脉临界病变功能性狭窄具有一定的诊断价值。
目前,全球冠心病的发病率及死亡率仍呈逐年上升趋势[1]。在人口老龄化和代谢危险因素持续流行的双重压力下,我国心血管疾病负担持续增加[2]。2022 年中国心血管健康与疾病报告显示,自2012年以来,我国冠心病死亡率始终保持上升趋势[3]。准确识别有功能学变化的冠状动脉病变并及时进行干预对于改善冠心病患者的预后有重要价值。冠状动脉造影是诊断冠心病的金标准,可评估冠状动脉狭窄的严重程度。但冠状动脉造影仅能展示病变冠状动脉管腔轮廓信息,无法评价病变血管的功能学变化。而血流储备分数(FFR)虽可准确评估冠状动脉病变的生理学意义,但其测量离不开压力导丝并需药物诱发冠状动脉充血,操作繁琐、风险较大且价格高昂,因此其临床使用较为受限。
在此背景下,基于冠状动脉造影的无导丝FFR系统即定量血流分数(QFR)则很好地解决了FFR的局限性。QFR 仅需两幅体位相差≥25°的冠状动脉造影图像即可进行冠状动脉三维重建,并利用TIMI 计帧法测量血流速度及时间,通过三维重建技术和血液动力学分析系统重建QFR 的pull-back 曲线,最终计算出靶血管各个位置的QFR 值[4]。目前,QFR 对冠状动脉功能性狭窄的诊断价值已经得到诸多临床研究的验证,但其在非ST 段抬高型急性冠状动脉综合征(NSTE-ACS)患者中应用的临床证据仍不足。本研究旨在以FFR(FFR ≤0.80)为金标准,评估QFR 对NSTE-ACS 患者冠状动脉临界病变(冠状动脉狭窄程度40%~70%)功能性狭窄的诊断价值。
1 资料与方法
1.1 研究对象
回顾性纳入2018 年6 月1 日至2023 年2 月1日就诊于阜外华中心血管病医院并行冠状动脉FFR检查的168 例NSTE-ACS 患者。入选标准:(1) 接受有创冠状动脉造影及FFR 检查;(2)NSTE-ACS 患者;(3)冠状动脉临界病变(目测病变冠状动脉狭窄程度40%~70%)患者。排除标准:(1)冠状动脉造影图像质量不佳或对比剂充盈不佳;(2)血管严重扭曲或重叠;(3)病变位于左主干或右冠状动脉开口;(4)缺少两幅体位相差≥25°的冠状动脉造影图像;(5)病变狭窄由心肌桥所致;(6)急性ST 段抬高型心肌梗死患者或既往曾行冠状动脉旁路移植术的患者;(7)严重心力衰竭或血液动力学不稳定的患者;(8)腺苷或三磷酸腺苷等血管扩张剂过敏。本研究符合国家制定的涉及人的生物医学研究伦理标准和世界医学协会最新修订的《赫尔辛基宣言》的要求。
1.2 基线资料收集
FFR 测量:FFR 的测量遵循《中国冠状动脉血流储备分数测定技术临床路径专家共识》[5],由两名主治及以上级别的医师操作。扩血管药物使用腺苷[140~180 μg/(kg· min)]。当FFR ≤0.80 时,认为狭窄具有功能学意义,即为冠状动脉功能性狭窄。
QFR 测量:在对FFR 结果设盲情况下进行QFR分析,通过第二代QFR 检测仪(AngioPlus,上海搏动医学影像技术有限公司)采用对比剂血流模型离线分析目标血管QFR 值。QFR 测量时应选择病变暴露最充分、重叠最少且两幅体位相差≥25°的心脏舒张末期图像。QFR 的计算有三种不同的血流模型[4]:(1)固定血流模型QFR(fixed-flow QFR,fQFR),以大量FFR 研究数据为基础得到血流速度经验值(0.35 m/s);(2)对比剂血流模型QFR(contrast-flow QFR,cQFR),从常规冠状动脉造影影像上运用TIMI 计帧法获得平均血流速度(可反映患者真实的个体特异性血流),通过模拟计算得到最大充血血流速度,无需药物诱导充血;(3)药物诱导充血血流模型 QFR(adenosine-flow QFR,aQFR),应用腺苷等微循环扩张药物诱导达到最大充血状态,冠状动脉造影影像上运用TIMI 计帧法计算充血血流速度。本研究计算了病变血管的fQFR 及cQFR。
本研究同时记录三维定量冠状动脉造影(3-dimensional quantitative coronary angiography,3D-QCA)所测得的病变血管的直径狭窄百分比(percent diameter stenosis,DS%)、面积狭窄百分比(percent area stenosis,AS%)、最小管腔直径(minimal luminal diameter,MLD)、最小管腔面积(minimal luminal area,MLA)。
1.3 统计学方法
利用SPSS 26.0、MedCalc version 11.4.2 和GraphPad Prism 8 等软件统计分析数据。连续变量采用±s或M(四分位数间距)表示,分类变量采用频数和百分比表示。采用Spearman 双变量相关性分析探索cQFR、fQFR、DS%、AS%、MLD、MLA 与FFR的相关性。通过绘制ROC 曲线并计算AUC,判断cQFR 和fQFR 对冠状动脉临界病变功能性狭窄的诊断价值。通过DeLong 检验判断不同参数的AUC值差异有无统计学意义。P<0.05 为差异有统计学意义。
2 结果
2.1 患者的基线资料
本研究纳入168 例NSTE-ACS 患者,其中男性119 例(70.8%),平均年龄(58.50±10.52)岁;不稳定性心绞痛患者168 例(100%),其中变异性心绞痛患者7 例(4.2%);有心肌梗死发作病史者8 例(4.8%),有冠心病家族史者40(23.8%),吸烟、喝酒者分别有100 例(59.5%)和80 例(47.6%)。
168 例患者共有246 支病变血管,其中左前降支169 支(68.7%),左回旋支35 支(14.2%),右冠状动脉42 支(17.1%);100 支(40.7%)病变血管的FFR ≤0.80,病变血管最大管腔直径狭窄程度为64%。与FFR >0.80 的病变血管相比,FFR ≤0.80的病变血管中左前降支占比更高(56.2% vs. 87.0%),而左回旋支(19.9% vs. 6.0%)和右冠状动脉占比(24.0% vs. 7.0%) 均较低,cQFR(0.91 vs. 0.79)和fQFR(0.89 vs. 0.78)均较低,DS%(37.0% vs.44.5%)和AS%(61.0 % vs. 68.5% )均较高,MLD(1.72 mm vs. 1.46 mm)和MLA(1.69 mm2vs. 2.31 mm2)均较低,以上差异均有统计学意义(P均<0.001),见表1。
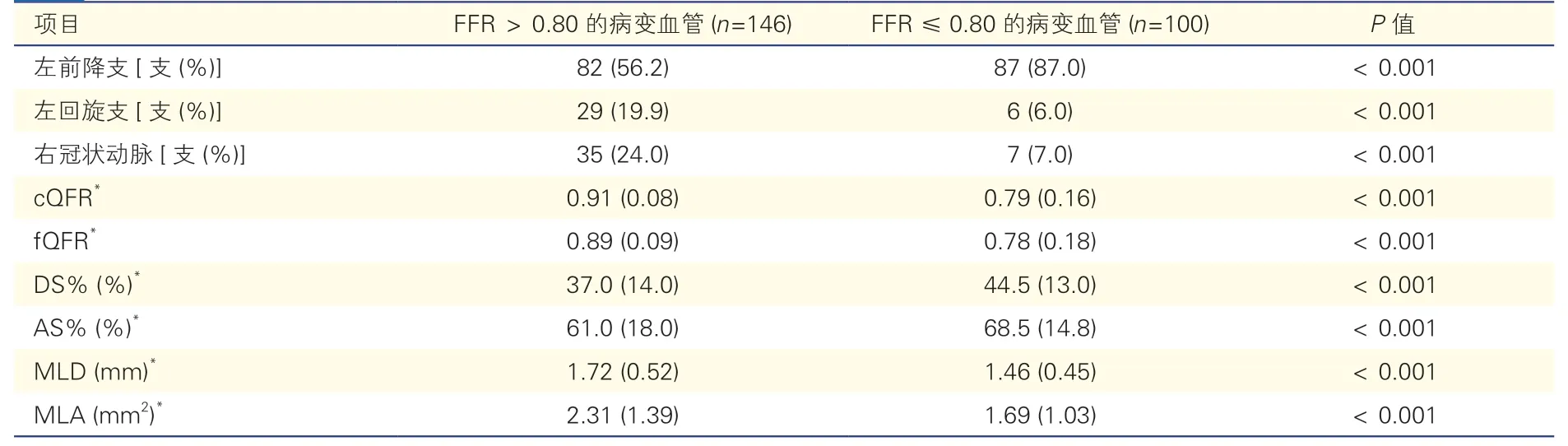
表1 FFR>0.80 和FFR ≤0.80 的病变血管基线特征比较
2.2 QFR 及3D-QCA 参数与FFR 的相关性
通过Spearman 相关系数评估QFR 及3D-QCA相关参数与FFR 的相关性,结果表明,cQFR、fQFR 与FFR 均有中等程度的相关性,相关系数分别为0.603 和0.582(P均<0.001);而3D-QCA 所测DS%、AS%、MLD、MLA 与FFR 的相关性均较低,相关系数分别为-0.350、-0.347、0.343、0.343(P均<0.001)。
2.3 QFR 对NSTE-ACS 患者冠状动脉临界病变功能性狭窄的诊断价值
以FFR ≤0.80 定义冠状动脉功能性狭窄时,cQFR 和fQFR 诊断NSTE-ACS 患者冠状动脉临界病变功能性狭窄的AUC 分别为0.829(95%CI:0.773~0.885,P<0.001)和0.821(95%CI:0.766~0.875,P<0.001),cQFR 和fQFR 的诊断准确度、灵敏度、特异度分别为81.30%、56.00%、98.63%和76.83%、59.00%、99.04%。通过DeLong 检验比较cQFR 和fQFR 的AUC 后发现,cQFR 对NSTE-ACS 患者冠状动脉临界病变功能性狭窄的诊断性能显著优于fQFR(P=0.03,图1)。
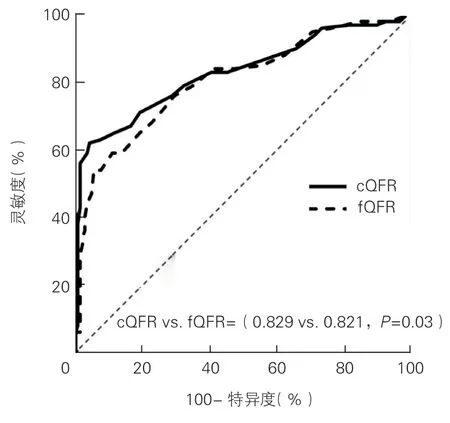
图1 cQFR 和fQFR 对NSTE-ACS 患者冠状动脉临界病变功能性狭窄的诊断价值
3 讨论
2014 年,Tu 等[6]首次提出并验证了基于3D-QCA 以及TIMI 计帧法计算的FFRQCA技术在冠状动脉临界病变(狭窄程度40%~70%)功能性狭窄中的诊断价值。在该研究中,FFRQCA不仅与FFR 具有良好的相关性(r=0.81,P<0.001),在判断临界病变功能学意义上也具有很高的诊断价值(AUC=0.93)。而在本研究中,cQFR 和fQFR 诊断NSTE-ACS 患者冠状动脉临界病变功能性狭窄的AUC 均小于Tu 等[6]的研究,这可能是因为后者样本量较小(77 支病变血管),且仅针对冠状动脉原发病变,因此得出的诊断准确度较高。
FAVOR Pilot 研究首次探索了二代QFR 技术对冠状动脉临界病变(狭窄程度30%~80%)功能性狭窄的诊断价值[4]。该研究基于三种计算原理分别测定了病变血管的fQFR、cQFR 和aQFR。结果表明,fQFR 和cQFR 与FFR 的相关系数分别为0.77和0.69;在血管水平,fQFR 和cQFR 识别冠状动脉临界病变功能性狭窄的AUC 分别为0.88 和0.92,其诊断准确度分别为80%和86%。而在本研究中,fQFR 和cQFR 与FFR 的相关系数分别为0.582 和0.603。同时,fQFR 和cQFR 诊断冠状动脉临界病变功能性狭窄的AUC 分别为0.821 和0.829,其诊断准确度分别为76.83%和81.30%。本研究中fQFR 和cQFR 的诊断性能均不如FAVOR Pilot 研究得出的结果,这可能是因为本研究纳入的人群均为NSTEACS 患者,而FAVOR Pilot 研究中相当一部分患者为稳定性心绞痛患者。
考虑到FAVOR Pilot 研究中QFR 的计算全部由核心实验室完成,我国科学家设计了FAVORⅡ China 研究,进一步验证了经皮冠状动脉介入治疗(PCI)术中实时计算的QFR 的诊断准确度为92.7%[7]。
除上述两项研究外,还有一些研究探索了QFR对冠状动脉临界病变功能学意义的诊断价值。2018年公布的FAVOR Ⅱ Europe-Japan 研究评估了导管室实时计算的QFR 对稳定性冠心病患者冠状动脉临界病变(狭窄程度30%~90%)功能性狭窄的诊断价值[8]。结果显示,导管室实时计算的QFR 对于识别此类患者冠状动脉临界病变的功能学意义具有较高的诊断价值(AUC=0.92),且计算耗时更短(5 min)。而同年公布的WIFI Ⅱ研究则对QFR 在可疑冠心病(冠状动脉狭窄程度30%~90%)患者中的诊断性能进行了探索,结果同样喜人:在240 支病变血管中,QFR 诊断冠状动脉功能性狭窄的AUC 为0.86,其诊断灵敏度和特异度分别为77%和86%[9]。但FAVOR Ⅱ Europe-Japan 研究[8]和WIFI Ⅱ研究[9]的研究对象为稳定性冠心病患者或可疑冠心病患者,而非ACS 患者。
既往研究表明,由于存活心肌减少,陈旧性心肌梗死患者的冠状动脉即使存在严重的解剖学狭窄,该病变也不一定具有功能学意义[10]。FFR 可准确评估梗死相关冠状动脉狭窄的功能学意义,但QFR 计算时并未考虑存活心肌数量。因此,在陈旧性心肌梗死患者中,QFR 对于识别冠状动脉功能性狭窄的准确度有所下降[10]。本研究中陈旧性心肌梗死患者占4.76%,这在一定程度上降低了QFR 的诊断准确度。而且,本研究中QFR 是依据冠状动脉造影提供的血管解剖和血流情况计算所得,因此,能影响血管解剖和血流情况的任何因素都可能影响QFR 的诊断准确度。例如,在左主干或右冠状动脉开口病变、血管重叠、病变严重扭曲成角的情况下,病变暴露不清晰也会影响QFR 的诊断准确度;对比剂推注的力度、冠状动脉微循环障碍也会带来QFR的诊断准确度[11]。FFR 则不受上述因素影响。这也是QFR 的诊断准确度低于FFR 的原因。
Emori 等[12]对100 支冠状动脉临界病变(狭窄程度40%~70%)进行分析后发现,cQFR 与FFR 的相关性良好(r=0.89),且cQFR 诊断冠状动脉临界病变功能性狭窄的准确度、灵敏度和特异度分别为94%、97%和87%。尽管在该研究中cQFR 对冠状动脉临界病变展示出了良好的诊断性能,但该研究并未明确指出ACS 患者在研究对象中所占的比例。而本研究的对象均为ACS 患者,为QFR 对ACS 患者冠状动脉临界病变功能性狭窄的诊断价值增添了新的临床证据。
1996 年Pijls 等[13]首次提出,FFR 可对冠状动脉狭窄程度进行功能学评价。此后,冠状动脉病变的生理学评估技术不断发展,而影像学及生理学评估技术的不断创新使得PCI 施行的病变部位精准度大大提高。
冠状动脉临界病变能否处理以及如何处理才能有最大获益始终是困扰临床医师的难题。COURAGE研究表明,在稳定性心绞痛患者中,无论是PCI+最佳药物治疗还是单纯最佳药物治疗,单光子发射计算机断层成像显示的残余心肌缺血均与死亡和心肌梗死风险成正比[14]。DEFER 研究则表明,当FFR ≥0.75 时,延迟PCI 组与PCI 组的死亡风险相似(RR=1.06,95%CI:0.69~1.62,P=0.79),且与PCI 组相比,延迟PCI 组的心肌梗死风险显著下降(RR=0.22,95%CI: 0.05~0.99,P=0.03)[15]。上述两项研究提示,只有对具有血液动力学意义的冠状动脉狭窄进行血运重建才能带来获益。
因此,在进行血运重建时,不仅要考虑二维造影结果,更应考虑是否存在心肌缺血的客观证据[16],因为影响心肌血供的因素非常多,除冠状动脉狭窄程度外,还受是否存在侧支循环、病变血管供血范围及下游心肌质量等诸多因素的影响[17]。冠状动脉的解剖学狭窄与功能学改变存在错配现象,只有引起心肌缺血的冠状动脉病变才能称为冠状动脉功能性狭窄[18]。
FFR 作为冠状动脉生理学评估的金标准,目前国内外指南均将FFR 作为冠状动脉临界病变血运重建策略的Ia 类推荐[19-22]。但随着临床实践经验的积累,有创功能学评价技术的局限性也逐渐显露[23]。而QFR 作为一项基于冠状动脉造影的FFR 计算技术,不仅具有较高的诊断准确度,而且无需压力导丝和药物负荷,安全、经济、有效,临床适用范围更广。QFR 的临床价值不仅体现在冠心病诊断方面,在冠心病患者的临床治疗决策及预后评估中也具有广阔的应用前景。2022 年公布的FAVOR ⅢChina 研究证实,与冠状动脉造影指导的PCI 相比,QFR 指导的PCI 可将主要不良心血管事件风险降低34%[24]。而在判断预后方面,有研究指出,即使冠状动脉造影无明显狭窄,当存在任意一支主要血管QFR ≤0.80 时,患者发生主要不良心脑血管事件的风险仍显著增加(HR=3.14,P=0.0001)[25]。也有研究探索了PCI 术后QFR 在血管导向复合终点上的预测价值[26]。随着QFR 的循证医学证据不断累积,我们相信QFR 在促进精准医疗、改善患者预后及卫生经济学领域将有无限潜力。
需要注意的是,作为一项回顾性研究,本研究中的QFR 均为离线计算所得。但即使不是即时获得冠状动脉造影结果,QFR 对NSTE-ACS 患者仍具有重要的诊断价值。Tu 等[6]的研究验证了回顾性分析所得的QFR 对稳定性和不稳定性心绞痛患者的诊断价值。而且,AngioPlus 检测所得的QFR(QFRAngioPlus)也可在冠状动脉造影术中实时进行,后续伦理审批通过后将进行前瞻性研究,进一步验证QFRAngioPlus在NSTE-ACS 患者中的诊断价值。目前,实时QFR在稳定性冠心病患者中的诊断价值已经得到FAVOR Pilot 研究的证实[4]。
综上所述,以FFR 为金标准时,QFR(尤其是cQFR)对NSTE-ACS 患者冠状动脉临界病变功能性狭窄具有一定的诊断价值。但本研究为单中心、回顾性研究,后续仍需开展大规模前瞻性研究来验证其结论;其次,本研究所纳入人群并不包括ST 段抬高型急性心肌梗死患者,因此其结果尚不能外推至此类人群。
利益冲突:所有作者均声明不存在利益冲突
