低氧条件下HIF-1α对骨生理中成骨和破骨的影响
2024-02-01范智博魏绵兴李胜鸿综述徐晓梅审校
范智博,魏绵兴,李胜鸿 综述 徐晓梅 审校
1.西南医科大学附属口腔医院正畸科(泸州646000);2.四川大学华西口腔医院唇腭裂外科(成都 610041)
【关键字】低氧;缺氧诱导因子-1α;成骨;破骨
诸多研究表明缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在机体中扮演着重要角色,除了参与了糖代谢[1]、肿瘤的发展[2]、免疫反应[3]等,还与成骨和破骨有着密切的联系[4]。正常生理状态下成骨与破骨事件一直处于动态平衡的状态,但当机体环境发生变化或者受外部刺激的影响而使其中一方呈现优势时,便会导致骨质的增生或者吸收。这种不对等的状态在骨的发育、骨折的愈合、正畸牙的移动(图1)以及肿瘤的转移中均有体现,且在这些事件中均可观察到低氧条件存在的踪迹。而作为低氧标志物的HIF-1α也被证明在这些成骨及破骨过程中发挥着重要的作用。本文将从HIF-1α 的角度出发,分析低氧条件下HIF-1α对骨生理中成骨和破骨的影响。

图1 骨发育、骨折愈合以及正畸牙移动中的低氧区域Figure 1 Hypoxic areas in bone development,fracture healing,and orthodontic tooth movement
1 不同氧浓度与低氧时间下HIF-1α的特性
研究表明,HIF 家族主要包括了3 个亚型:HIF-1、HIF-2和HIF-3[5]。它们是由β亚基和氧敏感α亚基组成的异源二聚体转录因子[6]。HIF-1 是目前HIF 家族中研究较多的因子,其α 亚基中包含一个基本的DNA结合域(C-TAD)和一个保守的NH2端结构域(N-TAD)。而在HIF-1 α亚基上的N-TAD区域还含有一个氧依赖结构域(oxygen-dependent degradation,ODD),它是位于PAS(Per ARNT Sim)结构域羧基末端的200 个氨基酸(人类HIF-1α 蛋白的826 个氨基酸中400~600 个残基)的功能域,并介导了HIF-1α 蛋白降解的O2依赖降解途径[7-8]。由于HIF-1α 结构的特点导致HIF-1α在不同的氧浓度下会展现出不同的特性。
1.1 不同氧浓度下HIF-1α的特性
当细胞处于常氧状态时HIF-1α会降解,这一特性也使得HIF-1α 成为了低氧的标志物。在常氧状态下HIF-1α主要是通过C-TAD的羟基化及ODD的乙酰化和羟基化而进一步诱导其活性的降低甚至降解。在常氧状态时,HIF-1α C-TAD内的一个保守的天冬酰胺残基会在缺氧诱导因子-1 抑制因子(factor inhibiting HIF-1,FIH-1)和氧的共同作用下发生羟基化,导致CTAD 活性降低从而影响HIF-1α α 亚基的活性。而由于HIF-1α 的C-TAD 比HIF-2α 对FIH-1 的抵抗力更低[9],这使得HIF-1α 相较于其他亚型在常氧状态下的活性更容易受到影响。除此之外,在常氧条件下HIF-1α 的ODD 中的脯氨酸残基在脯氨酸羟化酶(pyruvatedehydrogenase,PHD)的作用下还会被选择性地羟化,并且其多肽段内赖氨酸还会发生乙酰化。而羟化和乙酰化后的HIF-1α 会以Fe3+、O2、α-酮戊二酸和抗坏血酸等作为底物[10-11],使肿瘤抑制蛋白(von-Hippel-Lindau tumor suppressor protein,pVHL)能够结合α 亚基上的ODD。而VHL 作为E3 泛素连接酶复合体的底物识别成分[12],会通过与延伸蛋白C结合,再进一步与E3泛素连接酶的延伸蛋白B、结构蛋白CUL2(cullin 2 polypeptide)及亚基RBX1(Ring-box protein 1)结合进而诱导HIF-1α 发生泛素化并使HIF-1α 通过泛素-蛋白酶体(26S)途径被26S蛋白酶体降解[8,13]。正由于在常氧状态时存在着这种降解途径,故HIF-1α在常氧的状态下降解非常迅速,其半衰期只有5 min[10](图2A)。
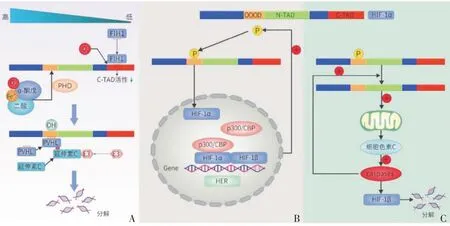
图2 HIF-1α在不同氧浓度下的状态Figure 2 HIF-1α state at different oxygen concentrations
而在中度低氧时由于HIF-1α 在细胞内的降解减少,使HIF-1α 在细胞内能稳定存在,其还可以通过与下游基因的HRE(hypoxia response element)区域结合而进一步发挥调控作用。中度低氧时HIF-1α 的降解减少主要是因为N-乙酰基转移酶(N-acetyltransferase2,NAT2)的表达减少,从而使HIF-1α 的乙酰化减少。此外,磷酸化后的HIF-1α 还会通过与HIF-1β 结合从而转位至胞核内再与CREB(cAMP-response element binding protein)结合蛋白(CBP)/p300 相互作用,从而形成有活性的HIF。而HIF-1α 只在核内表达也证实了HIF-1α 存在着核内转位这一特点[14]。与此同时HIF-1β还会促进HIF-1α的磷酸化[6-7]。有活性的HIF-1生成后即会与靶基因上的特定区域结合从而发挥作用,这个特定的区域被称为缺氧响应元件(hypoxia response elements,HRE)[15-16]。常见的与骨生理有关的靶基因包括了葡萄糖转运体1(glucose transporter-1,GLUT-1)、骨保护素(osteoclastogenesis inhibitory factor,OPG)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、促红细胞生成素(erythropoietin,EPO)等[5]。
研究表明靶基因的HRE 区域通常为增强子,当HIF-1α 与靶基因的HRE 区域结合后可以通过顺式相互作用调控其相邻的启动子的表达[17],且在靶基因的HIF-1α 结合区域与靶基因启动子之间还存在长期相互作用(图2B)[18]。在这种中度低氧条件下HIF-1α 通过与靶基因HRE 区域结合的调控方式参与了机体的多种生理活动,如在椎间盘内、组织损伤处及肿瘤内部均存在缺氧区域,而HIF-1α参与了椎间盘内稳态的维持[19]、组织损伤的修复[20]及肿瘤的发展[21]。
当细胞处于重度低氧时HIF-1α 对下游基因的调控作用便会被抑制。这主要是因为重度低氧的状态会使HIF-1α去磷酸化并使p53稳定,从而诱导Bcl2相关蛋白X(BCL-2-associated X protein,Bax)介导的细胞色素c 从线粒体释放并进一步激活天冬氨酸特异性半胱氨酸蛋白酶(cystine-containing aspirate-specific proteases,caspases),而被激活的caspases 便会引起HIF-1β的裂解,且其还可以促进HIF-1α 的去磷酸化(图2C)[7]。HIF-1β 的裂解会导致有活性的HIF-1 的产生被抑制从而间接抑制了HIF-1α 对其它基因的调控作用。
1.2 不同低氧时间下HIF-1α的特性
除了低氧浓度外,低氧时间也影响着HIF-1α的特性。从缺氧的持续时间上来说,在急性缺氧时HIF-1α会高表达。但当细胞处于长期的低氧状态时HIF会发生亚型转化,表现为细胞内HIF-1α 表达降低而HIF-2α、HIF-3α 的表达增高[5],故在适应高海拔环境时HIF-2α发挥着更重要的作用[6]。MARCIN 等认为出现这样的亚型转化,一方面可能是由于在持续性低氧条件下T细胞识别的鳞状细胞癌抗原1(squamous cell carcinoma antigen recognized by T-cells,SART1)及热休克蛋白70/热休克蛋白70 羧基端相互作用蛋白(heat shock protein70/carboxyl terminus of the hsc70-interacting protein,Hsp70/CHIP)会选择性作用于HIF-1α 从而使其降解。且HIF-1 到HIF-2 信号转导过程还会通过促进RACK1 的表达从而促进HIF-1α 的PHD/VHL 非依赖性蛋白酶体降解;另一方面,他们认为非编码RNA中的microRNA(miR-429、miR-155 和miR-200b)在此种亚型的转化过程中也发挥了重要的调控作用[22]。除microRNA 外,反义的非编码RNA 如HIF1A-AS1 也被证实了参与这个过程[23]。细胞内的调节是一个复杂的过程,由多种因素共同参与完成,但以上的研究都只单独谈论了一种因素对HIF-1α的影响,故目前相关机制研究还未完全将这种亚型转化的机制阐明,需要更进一步研究。
2 低氧状态下HIF-1α参与成骨事件
2.1 低氧下HIF-1α促进成骨反应的调控机制
HIF-1α 一方面可以通过促进成骨相关因子的表达从而直接促进成骨,另一方面还可以通过促进糖酵解以及血管的形成[24]从而间接促进成骨反应。在体外实验中,学者们通过研究HIF-1α和VHL的表达对小鼠模型骨量的影响,发现HIF-1α 缺失会导致骨量减少,而当VHL 缺失或者PHD1、PHD2 和PHD3 等引起HIF分解的因子联合缺失时都会导致骨量的增加[25],这说明HIF-1α 对于骨生成有着重要的作用。这是因为在低氧时被激活的HIF-1 会与成骨相关基因VEGF、OPG、Runt相关转录因子(Runt-related transcription factor 2,Runx2)及Ⅰ型胶原蛋白(collagen type Ⅰ,Col1aⅠ)等的HRE区域结合从而促进这些成骨因子的表达。KOVÁCS等进一步的研究发现成骨相关因子OPG还能抑制破骨细胞的生成[26]。除此之外,HIF-1还可以促进糖酵解相关基因的表达,使细胞在低氧下仍能维持成骨所需的能量从而间接促进骨的形成[27-28](图3)。HIF-1α 还可以通过影响成血管过程进而参与骨的发育以及骨再生过程[24]。
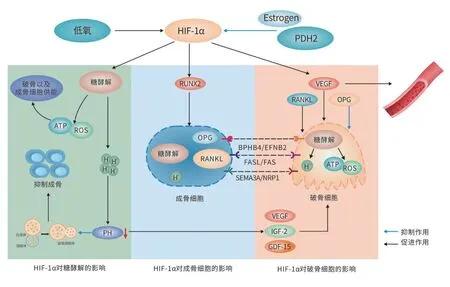
图3 低氧下HIF-1α对成骨与破骨细胞及糖酵解的调控Figure 3 HIF-1α regulates osteoblasts,osteoclast and glycolysis under hypoxia
2.2 HIF-1α参与的成骨相关事件
2.2.1 HIF-1α通过促进成骨参与骨的发育 由于VEGF、OPG 及Col-1 等成骨相关因子均存在HRE 区域,故在适宜的低氧条件下机体能通过促进HIF-1α 与下游因子的HRE 区域结合进而刺激骨及血管的形成,这对早期骨的形成有着重要的意义。骨形成的早期,胎儿生长板及胎芽的间充质细胞聚集区域处于缺氧的状态,在此区域HIF-1α表达增高并生成大量有活性的HIF-1,随即与VEGF、Runx2 及Col-1 的HRE 区域结合并促进其表达,通过此种方式HIF-1α可促进骨的形成。研究表明若细胞HIF-1α 缺失将会使间充质细胞的成软骨分化和软骨细胞的最终分化时间延长[29-30],这可能与依赖HIF-1α 的关键软骨转录因子SOX9(SRYrelated high mobility group-box gene9)的调控有关。HIF-1α除了促进软骨的分化外,对于维持软骨细胞的存活也有着重要的意义,若HIF-1α受抑制将导致该区域细胞的死亡[29]。除此之外,HIF-1α还可以通过促进糖酵解,增加氧气和营养物质的输送从而维持软骨细胞的活性[31-32]。另外,有研究发现HIF-1 还可以通过调控H型血管的形成从而影响骨发育的过程[33]。当然过高水平的HIF-1α 也会对骨骼的发育产生不良的影响,会引起骨代谢失调从而限制软骨细胞增殖和纵向骨生长导致骨骼发育不良[34]。
在骨发育不断成熟的过程中,骨髓腔和骨骺生长板的骨内膜区也都存在着缺氧的区域,机体可通过HIF-1α 调控这些区域的软骨细胞和成骨细胞的功能从而影响骨的进一步发育[35]。
在骨发育成熟后,HIF-1α依然发挥着对骨功能的调节作用。HIF-1α 可以通过促进局部分泌骨生理的调控因子血清骨硬化蛋白(sclerostin)、VEGF、OPG 和EPO 等从而间接影响骨髓内皮细胞、破骨细胞和造血细胞的功能。通过此种方式HIF-1α 实现了在骨发育成熟后对骨生理的调控作用[36]。
2.2.2 HIF-1α 通过促进成骨参与骨折愈合 HIF-1α在骨折愈合中也发挥着重要的作用。当骨折发生时,骨折处的血管破裂会造成局部的缺氧,会使成骨细胞的氧气摄入不足,导致HIF-1α表达增高进而诱导骨的生成[37]。为探究HIF-1α在骨折愈合过程中作用,学者们通过人为制造SD大鼠胫骨的骨折,再通过腹腔注入CoCl2使骨折部位HIF-1α 水平增加,结果发现骨折部位的Runx2等成骨标志物表达与HIF-1α的表达一致,且骨折部位的X线片提示,HIF-1α增高组胫骨骨折的愈合速度较对照组明显增快[38-39]。
2.2.3 HIF-1α 通过促进成骨参与成牙槽骨 HIF-1α除了能促进胫骨的成骨外,在促进成牙槽骨方面也有着重要作用。研究发现低氧培养牙周膜干细胞(periodontal ligament stem cells,PDLSCs)或者利用CoCl2建立PDLSCs 低氧模型后,在前6 h ALP、Runx2 等成骨标志物表达水平逐渐升高,之后其表达水平逐渐降低,这提示处于低氧最初时间可以刺激PDLSCs 的成骨分化能力。在这其中HIF-1α与PDLSCs的成骨标志物表达趋势一致。且当抑制了HIF-1α 表达后,PDLSCs 的成骨能力也出现明显的下降趋势[23,40]。由此可见低氧环境中HIF-1α可促进PDLSCs中的成骨分化。
综上所述,HIF-1α在骨的发育、骨折的愈合、促进成牙槽骨等多方面发挥着重要的调控作用。
3 低氧状态下HIF-1α参与破骨事件
低氧状态所产生的HIF-1α 不仅能刺激成骨还能刺激破骨事件的发生,且两个事件调控的机制具有诸多共通点。
3.1 低氧状态下HIF-1α促进破骨反应的调控机制
HIF-1α 对于破骨细胞的存活及激活均有着重要的意义。骨表面结构较为致密,此处氧含量较低,而这也正是破骨细胞的栖息之地,在该处破骨细胞中也能检测到了HIF-1α 的表达[41]。且研究发现在低氧条件下破骨事件会活跃发生,这是由于HIF-1α一方面可以通过与促破骨细胞因子直接结合而促进破骨,另一方面还可以通过促进糖酵解导致微环境的酸化从而间接促进破骨的发生。在低氧环境下,细胞为适应环境的变化会增加其糖酵解能力[42],低氧环境中糖酵解的增强不仅对成骨细胞能量代谢的维持有着重要意义,并且其对破骨细胞的激活及低氧环境中能量的提供也起着重要的作用。低氧环境下在破骨细胞中被激活的HIF-1会增加GLUT等大量糖酵解基因的表达,从而刺激葡萄糖转运体和糖酵解酶的增加。除此之外,被激活的HIF-1 还可以通过调控磷酸果糖激酶(phosphofructokinase,PFK)从而增加糖酵解途径通量[43-44]。通过这些途径,细胞即使处在缺氧条件下也能产生足够的ATP 及ROS 维持骨的吸收[45-46]。众所周知,细胞代谢的方式主要是通过氧化磷酸化(oxidative phosphorylation,OXPHOS)或者糖酵解来实现的,一般来说生物体内95%的ATP 来自于OXPHOS,但在低氧的条件下由于氧供给不足导致细胞代谢会以糖酵解为主[47],故微环境中代谢的酸性物质会不断累积,且随着时间的延长会引起酸中毒,而酸中毒又可以进一步刺激促破骨细胞因子(RANKL、VEGF、IGF-2和GDF-15)及OPG的生成从而促进破骨细胞的形成,且RANKL、VEGF等促破骨细胞因子同时也受HIF-1α的调控[33,48](图3)。
此外,除上述两种主要机制外,低氧环境下HIF-1α还可以通过激活自噬进而调控破骨反应[49]。一方面HIF-1α 可以通过诱导B 淋巴细胞瘤-2 基因/腺病毒E1819KD 相互作用蛋白3(Bcl-2/adenovims E1819KD interacting protein3,BNIP3)的产生从而使自噬相关蛋白Beclin-1 从Bcl-2 中释放出来从而直接引发自噬[49]。另一方面HIF-1α 还可以通过促进糖酵解过程诱导酸性代谢产物的累积使局部PH 下降从而间接促进自噬的表达,虽然PH降低引发的自噬对成骨细胞呈现出一定的保护作用,但当局部PH 低于6.0时,最终还是会触发成骨细胞凋亡[50]。除此之外,低氧诱导的自噬还会抑制细胞成骨分化[34](图3),这表明在低氧环境下自噬虽然对成骨细胞存活有着重要意义但也会抑制成骨。虽然在低氧环境中HIF-1α可以促进自噬的表达,但当随着微环境中的酸性产物堆积过多导致PH值过低时,HIF-1α 更多的是以促进成骨细胞的凋亡进而增加骨吸收的发生为主。
低氧状态下除了HIF-1α 对破骨的直接调控外,HIF-1α 依赖的调控因子也影响着破骨的发生,如与HIF分解有关的重要因子PDH2和作为HIF-1α拮抗剂的雌激素缺乏时都会引起HIF-1α 蛋白在破骨细胞中积累,从而导致破骨细胞活化和骨丢失[51-52]。
3.2 HIF-1α参与的破骨相关临床事件
3.2.1 HIF-1α通过促进破骨参与骨肿瘤的转移 HIF-1 信号通路对破骨细胞的刺激对骨肿瘤中的转移有着不可或缺的作用。当肿瘤体积不断增大,而营养物质及氧气供给又出现不足时,肿瘤内部会出现缺血缺氧的情况。这种低氧条件会刺激HIF-1α 的产生并激活HIF-1,被激活的HIF-1会促进破骨细胞的形成[53]并通过调控VEGF 促进肿瘤内血管的形成从而进一步促进肿瘤的转移。低氧条件下HIF-1α 会通过调控糖酵解相关基因从而增加糖酵解量,导致乳酸大量产生,在肿瘤微环境中也是如此,在肿瘤细胞中随着乳酸阴离子及氢离子移到细胞外,会引起肿瘤微环境(tumor micro-environment,TME)的酸化。研究表明这种酸化的微环境将会促进肿瘤的转移,而乳酸的存在也可以通过抑制PDH从而更进一步的稳定HIF-1α的存在[54]。SCOTT 等认为抑制HIF 的降解在破骨过程中尤为重要[55]。因此科学家们也旨在通过研发抑制HIF-1α 生成的药物从而抑制肿瘤的进展,目前已有相关药物得到了临床印证如二硫代哌嗪、反义寡核苷酸EZN-2968等[56]。
3.2.2 HIF-1α 通过促进破骨参与正畸牙的移动HIF-1α 在正畸牙移动过程中的压力侧牙槽骨骨吸收过程中也发挥着重要的作用。在正畸力作用下,受到压力的一侧会出现缺血缺氧的情况,随之发生骨的吸收及改建。研究表明在正畸力的作用下氧张力降低侧会导致局部HIF-1α 的表达增加[57]。在牙周膜干细胞的相关实验中也证实了持续性压应力作用下HIF-1α可以稳定存在[58],且RANKL 与VEGF 作为其下游调控因子,表达也会增加。这也进一步刺激了破骨细胞的形成进而引发压力侧的骨吸收[59-60]。作为HIF-1 拮抗剂的雌激素也侧面证实了HIF-1α 在正畸牙的移动过程中发挥的调控作用,研究表明雌激素水平与牙移动速度成反比[61],而降低的雌激素主要通过减轻对HIF-1的抑制作用从而导致骨吸收增加。
4 小结与启示
在骨微环境中,骨生理是由破骨细胞和成骨细胞共同调控所决定,而低氧刺激下的骨转化过程中HIF-1α发挥着重要的作用。它一方面可以通过调控成骨及糖酵解相关基因参与骨的发育、形成以及骨折的修复等成骨现象;另一方面还可以通过调控破骨及糖酵解相关基因从而参与正畸牙移动及肿瘤的转移中的破骨现象。研究表明低氧环境中糖酵解代谢对破骨细胞激活尤为重要[62-63],随着低氧时间的延长会引起酸的不断堆积,从而更有力地刺激破骨。而对于低氧状态会产生成骨或破骨哪种现象,可能是由低氧的程度和持续的时间所共同决定的[64-65]。
作为低氧下的关键调控因子的HIF-1α 在不同氧浓度以及持续时间下也展现出不同的特性,那么能否合理利用这一特性通过对调控低氧浓度以及时间进而使HIF-1α对成骨的作用发挥到极致,这是一个值得思考的问题。在心血管研究方面,已将这种交替低氧的模式应用于低氧治疗心血管疾病[66]。而这种模式在骨缺损方面的调控却还缺乏证据,这是未来可以深入探究的方向。除此之外,在机制方面,持续性低氧的状态下HIF-1α 的表达会出现先升高后降低的趋势,而HIF-2α 会逐渐增加,对于HIF 出现的这一亚型变化的相关研究也还较少,这也是未来值得我们去探索HIF相关调控机制的新方向。
