滤过型固相萃取柱净化-超高效液相色谱-串联质谱法测定鸡蛋中15种全氟化合物的含量
2024-02-01吴玉田周贻兵
吴 坤,吴玉田,赵 君,周贻兵
(1.贵州师范学院 化学与材料学院,贵阳 550018; 2.贵州省疾病预防控制中心 实验中心,贵阳 550004)
全氟化合物(PFCs)是一类烷基上氢原子全部被氟原子取代的人工合成化合物,因具有独特的疏水疏油性、耐热性及高表面活性等理化性质,被广泛应用于纺织、灭火剂、杀虫剂等领域[1-2]。随着PFCs规模化生产和使用,大量的PFCs被排放到环境中。由于PFCs具有持久性、生物积累性,难以光解、水解和被生物降解,潜在毒性以及长距离迁移等特性,从而导致环境介质、生物体和食品中普遍检出PFCs。研究表明,PFCs可通过食物链逐级放大并蓄积在人或动物体内,从而产生多种毒性效应,甚至导致器官衰竭或癌变[3-6]。因此,PFCs污染已成为全球性问题,对人类健康构成潜在威胁。近年来,为了降低PFCs的健康风险,各国政府和行业逐渐重视PFCs的源头管控,逐步减少、限制含PFCs原料的生产、贸易和使用,逐步加强食品接触材料在内的产品风险管控。2020年欧洲食品安全局建议全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟己烷磺酸(PFHxS)和全氟辛烷磺酸(PFOS)等4种PFCs的每周允许摄入量为8 ng·kg-1(根据体重计算),但是世界各国没有明确食品中PFCs的限量要求,仅提示关注PFCs的使用和风险管控。膳食暴露被学术界公认为是非职业暴露人群暴露PFCs的主要原因,高蛋白类食物是膳食暴露PFCs的重要来源[7-9]。鸡蛋作为百姓日常膳食中最主要的动物源性蛋白之一,其食用安全不容忽视,但PFCs通常为痕量水平,因此开发鸡蛋中PFCs的快速、灵敏、准确的检测技术具有重要的实际应用价值。
PFCs带有极性基团,沸点较高,难挥发,若使用气相色谱法[10]、气相色谱-质谱法[11]检测则需要衍生化前处理,操作繁琐;而且PFCs分子结构中没有紫外吸收基团或荧光发射基团,不能直接利用液相色谱-紫外检测器或荧光检测器进行检测[12]。液相色谱-串联质谱法具有灵敏度高、重现性好、抗干扰性强等特点,结合不同类型样品前处理手段成为PFCs的主流分析方法[13-16]。目前,PFCs前处理主要采用酸、碱或离子对试剂使其离子化后,用混合型弱阴离子交换固相萃取小柱(WAX柱)净化[17],此过程操作繁琐、耗时长,且容易堵塞净化柱。因此,本工作采用乙腈溶液振荡和超声提取后,使用滤过型Captive EMR-Lipid柱净化,提出了超高效液相色谱-串联质谱法测定鸡蛋中全氟丁酸(PFBA)、全氟戊酸(PFPeA)、全氟己酸(PFHxA)、全氟庚酸(PFHpA)、PFOA、PFNA、全氟癸酸(PFDA)、全氟十一酸(PFUnDA)、全氟十二酸(PFDoDA)、全氟十三酸(PFTrDA)、全氟十四酸(PFTeDA)以及全氟丁烷磺酸(PFBS)、PFHxS、全氟庚烷磺酸(PFHpS)、PFOS等15种PFCs含量的方法。
1 试验部分
1.1 仪器与试剂
Exion LCTM型超高效液相色谱仪;6500+Q-TRAP型三重四极杆-线性离子阱复合质谱系统;BSA 224S-CW型电子天平;Milli-Q型超纯水仪;KEYINTECH型混匀器;HS 6150 T型超声波清洗器;3-18K型高速冷冻离心机;N-EVAP 112型氮吹仪。
15种PFCs混合标准溶液:2 000 μg·L-1,包括PFBA、PFPeA、PFHxA、PFHpA、PFOA、PFNA、PFDA、PFUnDA、PFDoDA、PFTrDA、PFTeDA、PFBS、PFHxS、PFHpS、PFOS等15种PFCs。使用时,用甲醇稀释至所需质量浓度。
11种PFCs同位素混合内标溶液:2 000 μg·L-1,包括13C4-PFBA、13C5-PFPeA、13C2-PFHxA、13C4-PFHpA、13C4-PFOA、13C5-PFNA、13C2-PFDA、13C2-PFUnDA、13C2-PFDoDA、18O2-PFHxS、13C4-PFOS等11种PFCs同位素内标。使用时,用甲醇稀释至所需质量浓度。
甲醇、乙腈均为色谱纯;乙酸铵为质谱级;试验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Agilent Eclipse Plus C18RRHD色谱柱(100 mm×2.1 mm,1.8 μm);柱温40 ℃;流动相A为2 mmol·L-1乙酸铵溶液,B为甲醇;流量0.3 mL·min-1;进样体积5 μL;梯度洗脱程序见表1。
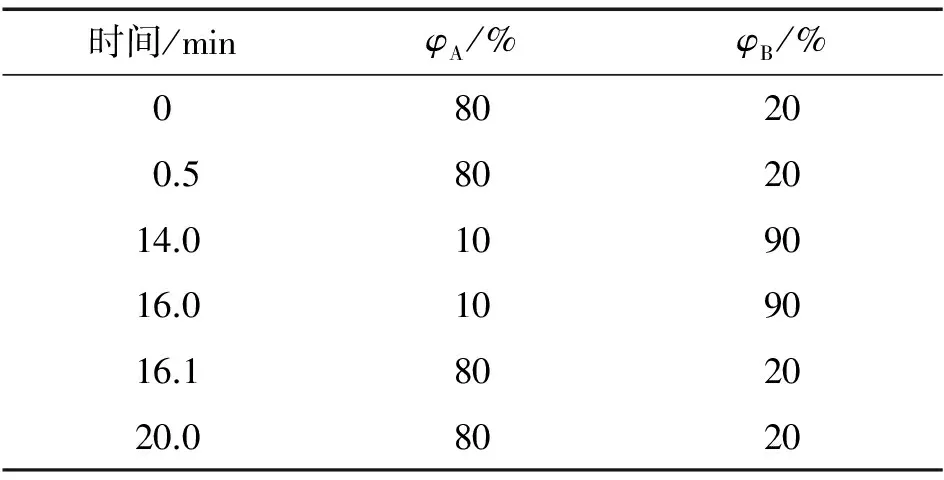
表1 梯度洗脱程序
1.2.2 质谱条件
电喷雾离子(ESI)源,负离子(ESI-)模式;多反应监测(MRM)模式;喷雾电压-4 000 V;离子源温度450 ℃;气帘气压力241 kPa,雾化气压力344 kPa,去溶剂气压力310 kPa;其他质谱参数见表2,其中“*”代表定量离子。

表2 质谱参数
1.3 试验方法
鸡蛋样品采集于超市,每份采集10个。将鸡蛋去壳后,搅拌均匀,置于聚丙烯塑料离心管中,于-20 ℃保存备用。检测前,将样品恢复至室温,摇匀。称取2 g(精确至0.001 g)于15 mL聚丙烯离心管中,加入0.1 mL 20.0 μg·L-1混合内标溶液、10 mL 80%(体积分数,下同)乙腈溶液,振荡10 min,超声15 min后,于4 ℃以转速10 000 r·min-1离心5 min。分取5 mL滤液(样品提取液),直接过Captive EMR-Lipid柱,收集流出液于聚丙烯离心管中,于60 ℃水浴氮吹至近干,加入500 μL甲醇,涡旋混匀,以转速10 000 r·min-1离心5 min,取上清液,按照仪器工作条件测定。
2 结果与讨论
2.1 质谱条件的优化
PFCs中的氢原子被氟原子取代,且含有羧基和磺酸基,是酸性化合物,在ESI源中易形成[M-H]-离子,常采用ESI-模式进行检测。将50.0 μg·L-1的PFCs混合标准溶液和混合内标溶液以8 μL·min-1的流量注入质谱仪进行全扫描,优化去簇电压、雾化气压力等参数;然后对[M-H]-母离子进行碰碎。结果表明,羧酸型PFCs易发生中性丢失CO2产生[M-H-44]-子离子,磺酸型PFCs易断裂生成[FSO3]-和[SO3]-子离子。分别选择响应值高、稳定且无干扰的[M-H-44]-和[FSO3]-为定量离子,优化后的去簇电压、碰撞能量等质谱参数见1.2.2节。
2.2 色谱条件的优化
PFCs既有疏水性,又有亲水性,多采用较低硅羟基活性填料的C18反相色谱柱实现分离。试验分别考察了Agilent Eclipse Plus C18RRHD色谱柱(100 mm×2.1 mm,1.8 μm)、Thermo Hypersil Gold色谱柱(100 mm×2.1 mm,1.9 μm)、 Acquity Waters BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)对15种PFCs分离效果的影响。结果表明,在相同梯度洗脱程序下,PFBA在Agilent Eclipse Plus C18RRHD色谱柱上有较好的保留,且其余目标物的分离效果较佳。因PFCs具有羧酸或磺酸官能团,具有一定极性,在流动相中加入适量乙酸铵可提高目标物的离子化效率,减少溶剂效应,改善峰形。
选用Agilent Eclipse Plus C18RRHD色谱柱作为分析柱,考察了PFCs在2,5,10 mmol·L-1乙酸铵溶液中的分离及响应情况。结果表明:随着乙酸铵溶液浓度的增加,PFCs在色谱柱上的保留增强,出峰时间延迟,但组分间分离度无显著变化;乙酸铵溶液浓度对磺酸型PFCs的响应值影响不显著,而羧酸型PFCs的响应值随着乙酸铵溶液浓度的增加有所下降。因此,试验采用2 mmol·L-1乙酸铵溶液进行梯度洗脱。
在优化的色谱、质谱条件下,15种PFCs混合标准溶液的总离子流色谱图见图1。
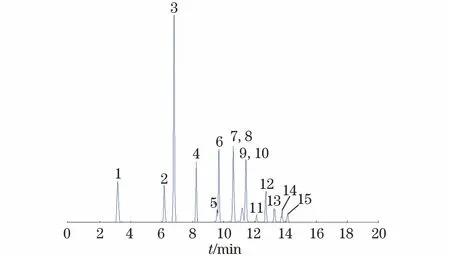
1-PFBA;2-PFPeA;3-PFBS;4-PFHxA;5-PFHpA;6-PFHxS;7-PFOA;8-PFHpS;9-PFNA;10-PFOS;11-PFDA;12-PFUnDA;13-PFDoDA;14-PFTrDA;15-PFTeDA图1 总离子流色谱图Fig.1 Total ion chromatogram
2.3 提取溶剂的优化
试验选择穿透力强、蛋白沉淀效果好的乙腈作为有机提取溶剂,考察了体积分数分别为70%,80%,90%的乙腈溶液对目标物回收率的影响。结果表明,15种目标物回收率分别为76.5%~119%,78.0%~111%,75.3%~108%均在痕量分析合理的回收率范围内,但是加水量过多,蛋白沉淀效果变差,提取液中水溶性成分含量增加,基质效应增强,影响后续的净化效果,延长净化液的氮吹时间。因此,试验选择以80%乙腈溶液提取目标物。
2.4 净化柱的优化
鸡蛋基质复杂,含有大量蛋白质、卵黄素、胆固醇等内源性物质,需要选择合适的净化方法来降低基质干扰。滤过型Captive EMR-Lipid柱可利用排阻和疏水相互作用机制高效去除鸡蛋样品中脂质等基质。通过低、中、高等3个浓度水平的基质加标回收试验,样品提取液经滤过式Captive EMR-Lipid柱净化后,15种目标物的回收率为78.0%~111%,而采用碱性离子对试剂提取,WAX柱净化后,PFTrDA、PFTeDA等长链PFCs的回收率均小于50.0%,且净化过程中易出现WAX柱堵塞的现象。因此,试验选择以滤过型Captive EMR-Lipid柱净化,从而减少传统固相萃取柱活化、淋洗等步骤,操作更加简单、快速,并且长碳链PFCs的回收率得到了显著改善。
2.5 基质效应
食品中的内源性成分及样品前处理过程中的外源性成分会影响目标物的离子化效率,由此可能产生基质效应(ME)。根据(1-目标物在鸡蛋基质提取液中的峰面积/目标物在溶剂甲醇中的峰面积)×100%计算ME值。当ME绝对值为0~20.0%时,表明基质效应在可接受范围内;当ME绝对值为20.0%~50.0%时,表明存在弱基质效应;当ME绝对值大于50.0%时,表明存在强基质效应。15种PFCs的ME值见表3。
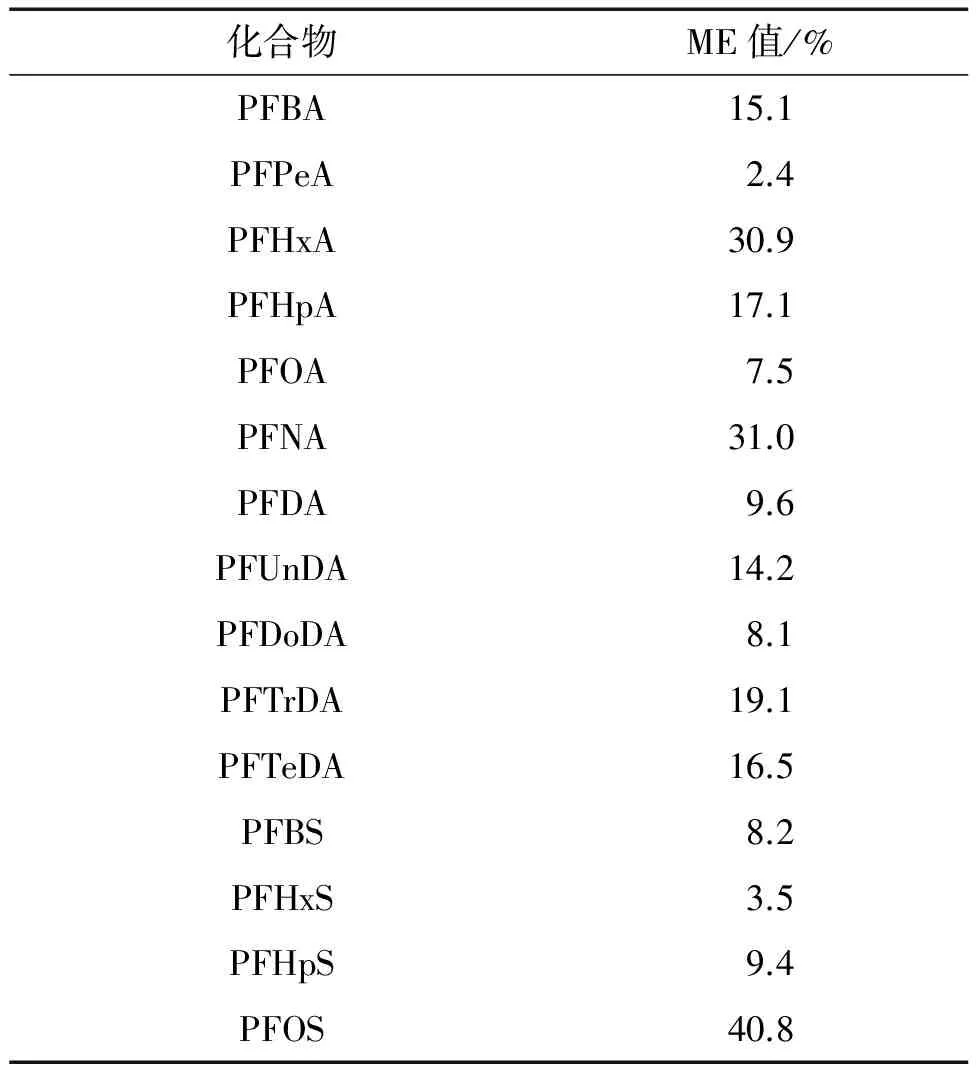
表3 基质效应
由表3可知:使用滤过型Captive EMR-Lipid柱净化后,15种目标物的ME绝对值均不大于50.0%,绝大部分目标物的基质效应在可接受范围内,但PFHxA、PFNA、PFOS的ME绝对值为20.0%~50.0%,表明存在弱基质效应。因此,试验选择采用同位素内标法进行定量,以降低基质效应对PFCs的影响,提高定量结果的准确度。
2.6 标准曲线和测定下限
用甲醇将15种PFCs混合标准溶液逐级稀释成质量浓度为0,0.125,0.250,0.500,1.00,2.00,4.00,8.00,12.0,16.0,20.0 μg·L-1的混合标准溶液系列,同时加入适量的同位素混合内标溶液,使内标质量浓度均为2.00 μg·L-1,按照仪器工作条件进行测定。以目标物质量浓度为横坐标,目标物和内标峰面积比值为纵坐标进行线性回归。结果表明,15种PFCs标准曲线的线性范围均为0.125~20.0 μg·L-1,线性回归方程及相关系数见表4。
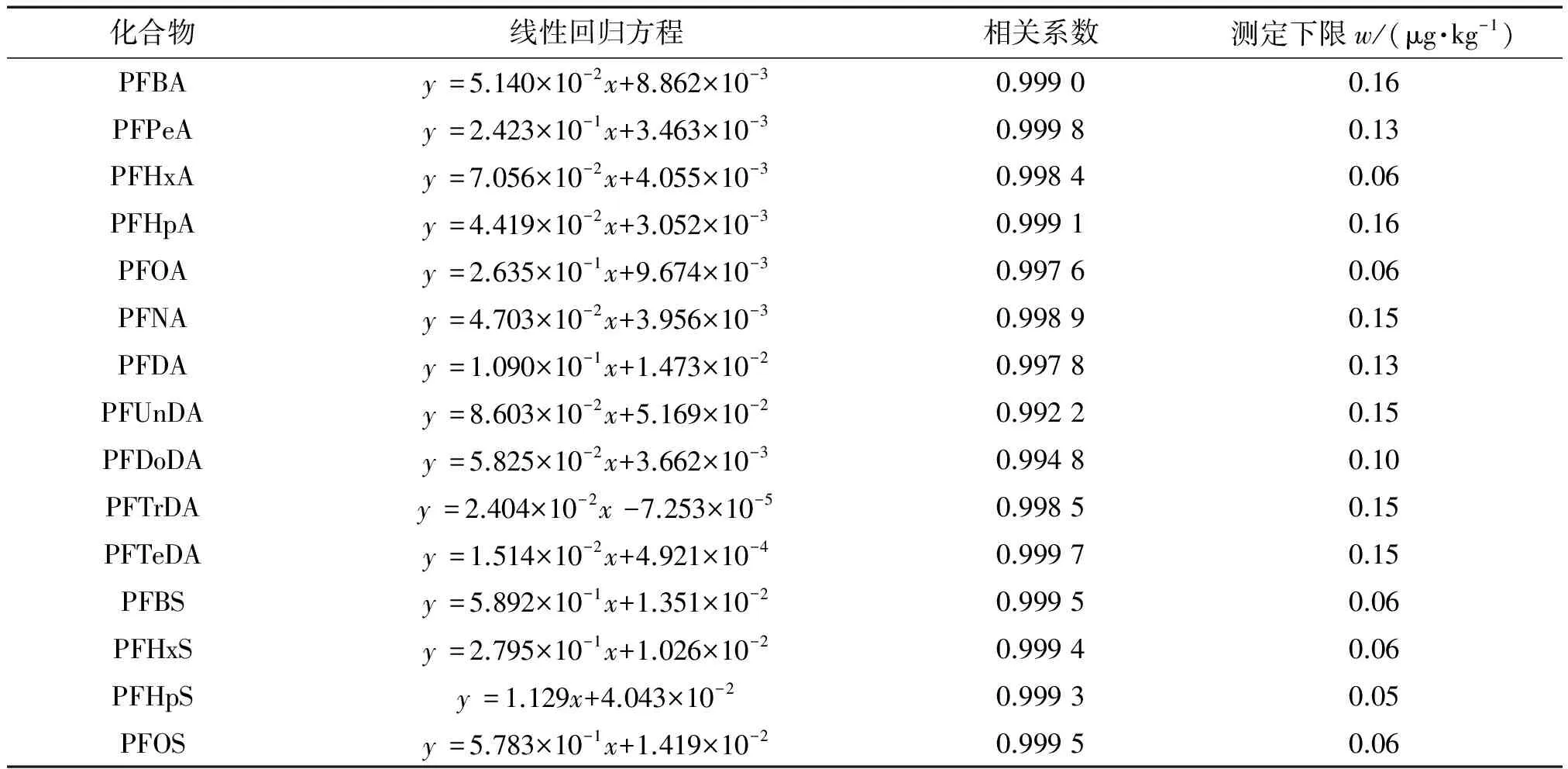
表4 线性回归方程、相关系数和测定下限
以10倍信噪比(S/N)计算测定下限(10S/N),结果见表4。
目前,我国发布的食品中PFCs检测的相关标准主要包括GB 5009.253-2016《食品安全国家标准 动物源性食品中全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)的测定》、SN/T 3544-2013《出口食品中全氟辛酸和全氟辛烷磺酸盐的测定》、SN/T 4588-2016《出口蔬菜、水果中多种全氟烷基化合物测定 液相色谱-串联质谱法》、SN/T 5222-2019《蜂蜜中20种全氟烷基化合物的测定 液相色谱-串联质谱法》,标准方法的测定下限为0.01~1 μg·kg-1,与之相比,本方法测定下限为0.05~0.16 μg·kg-1,满足痕量分析的基本要求。
2.7 精密度和回收试验
在空白鸡蛋样品中加入一定量的混合标准溶液,使15种PFCs加标量为0.500,4.00,16.0 μg·kg-1,涡旋混匀,放置过夜,使样品基质与目标物充分接触,然后按照1.3节试验方法进行处理及测定,每个加标浓度水平测定6份平行样,计算回收率和测定值的相对标准偏差(RSD),结果见表5。

表5 精密度和回收试验结果(n=6)
结果显示,15种PFCs的回收率为78.0%~111%,测定值的RSD为0.87%~14%,回收率和精密度均满足实际样品的分析要求。
2.8 样品分析
按照试验方法对10份市售鸡蛋样品进行检测。结果显示:有6份样品检出PFCs,检出的PFCs有PFPeA、PFHxA、PFHpA、PFOA、PFNA、PFDA、PFUnDA、PFDoDA、PFTeDA、PFOS,检出量为0.045~0.670 μg·kg-1,且PFOA、PFOS的检出率高达60%,其余PFBA、PFTrDA、PFBS、PFHxS、PFHpS均未检出。
本工作提出了滤过型固相萃取柱净化-超高效液相色谱-串联质谱法测定鸡蛋中15种PFCs含量的方法,该方法具有操作简便、快速、准确、灵敏等特点,为开展鸡蛋中PFCs的检测提供了方法参考。
