通过Mo 掺杂诱导低Li/Ni 混排程度增强Li1.2Ni0.13Fe0.13Mn0.54O2 可逆容量与循环稳定性*
2024-02-01冉沛林吴康赵恩岳王芳卫毋志民
冉沛林 吴康 赵恩岳 王芳卫‡ 毋志民
1) (重庆师范大学物理与电子工程学院,重庆 401331)
2) (松山湖材料实验室,东莞 523808)
3) (中国科学院物理研究所,北京凝聚态物理国家研究中心,北京 100190)
1 引言
可充电锂离子电池(Li-ion batteries,LIBs)广泛应用在移动设备和电动汽车中,但传统层状过渡金属正极材料LiTMO2(TM=Ni,Co,Mn 或Al)具有较低的能量密度,无法满足商业应用需求,而富锂层状氧化物(Li-rich Mn-based layered oxides,LRLO)因比容量超过200 mAh/g,是现有层状正极材料的有力竞争者[1,2].富锂材料的化学式通常为xLi2MnO3·(1–x)LiTMO2(0<x<1,TM=Mn,Ni,Co,Fe 等),其阳离子氧化还原机制与传统的层状氧化物类似,阴离子氧化还原反应(the anionic redox reaction,ARR)则源于Li2MnO3中独特的Li-O-Li 构型[3–5].由于ARR 发生在高截止电压区域中(≥4.5 V),涉及过渡金属的移动,进一步导致晶格氧损失、过渡金属溶解并向邻近的Li 空位迁移,加剧阳离子混排,引起结构退化和电压衰减[6–11].此外,Li2MnO3组分中Li+的扩散缓慢,反应动力学性能较差.这些问题一直阻碍着富锂材料的商业化进程[12–14].
富锂材料中的钴成本昂贵且具有毒性,而铁因资源丰富、环境友好,是钴的潜在替代品.铁取代的富锂材料表现出更少的电压衰减,但仍受制于严重的过渡金属溶解,循环过程中连续的不可逆容量衰减和电压衰退,不可逆的氧释放和较差的Li+扩散动力学仍有待解决[13,15–17].通过晶格掺杂,表面涂层和电解质设计等有效策略有望克服上述问题,而掺杂因简单有效应用最为广泛,例如,在材料中掺杂Mg2+,Al3+,Zr4+和Ti4+增大了Ni2+离子从过渡金属(TM)位点向锂离子位点迁移的热力学势垒,降低了阳离子无序的程度[18–21].掺杂元素能加强过渡金属与氧的结合,有利于提高结构稳定性,抑制晶格氧损失.然而用于稳定正极材料结构的常规掺杂元素价态通常低于+4 价,根据缺陷化学机制[22,23],高价离子掺杂可以诱导Ni 还原或Li 空位的形成,促进Li+的扩散传输.近期研究表明,使用Nb5+,Ta5+,Mo6+和W6+等高价态元素掺杂的正极材料明显优于低价态元素掺杂的正极材料[24–27],引入与氧共价性强的离子可以极大地抑制晶格氧的释放,提高化学稳定性,从而实现优异的循环性能.
基于此,我们使用Mo 作为高价态掺杂剂,研究其对富锂材料Li1.2Ni0.13Fe0.13Mn0.54O2(LNFMO)循环稳定性的影响.发现当Mo 的含量为0.5%时表现出最优的电化学性能.Mo6+的掺杂能有效抑制阳离子混排,扩展锂层间距,为Li+的传输提供更宽的通道,降低Li+的扩散能垒,改善Li+的扩散动力学.同时抑制了材料不可逆的相转变,减少表面副反应的发生,降低了正极-电解质界面(cathode–electrolyte interface,CEI)厚度,进一步稳定了体相晶体结构.经电化学性能测试表明,在0.5 C 的电流密度下循环50 次后LNFMO 和LNFMO-Mo 的放电比容量分别为147 mAh/g 和165 mAh/g,容量保持率从76.06%提高到84.05%;1 C 电流密度下的初始放电比容量为165.15 mAh/g,循环300 次后仍有117.49 mAh/g 的放电比容量,平均中值电压的衰减每圈仅有1.66 mV.循环性能的提升和电压衰减的有效抑制,使Mo 掺杂LNFMO有望在未来的商业化LIBs 中广泛应用.
2 实验
2.1 材料合成
Li1.2Ni0.13Mn0.54Fe0.13O2(LNFMO)与Li1.2(Ni0.13Fe0.13Mn0.54)0.995Mo0.005O2(LNFMO-Mo)富锂正极材料使用溶胶凝胶法制备而成.首先取乙二醇(纯度为98%)、无水柠檬酸(纯度为99.5%)于烧杯中,加入去离子水50 mL,搅拌至溶液澄清.按物质的量称取乙酸锂(纯度为99%,过量3%,以补偿高温下的锂损失)、乙酸镍(纯度为99.9%)、硝酸铁(纯度为99.99%)、乙酸锰(纯度为99%)、钼酸铵(纯度为99%),分别加入烧杯中搅拌均匀,用氨水调节pH 值至中性.随后将混合溶液加热至80 ℃连续搅拌6 h,待溶剂蒸发后得到棕红色凝胶.将凝胶放入鼓风烘箱中,190 ℃烘烤过夜.随后研磨均匀,装入氧化铝坩埚,置于马弗炉中400 ℃预烧4 h,900 ℃煅烧20 h 后淬火.取出样品后立即转移至充满氩气的手套箱中(H2O<0.01×10–6,O2<0.01×10–6).
2.2 电池组装
按质量比8∶1∶1 取活性物质、导电剂超级炭黑(Super P)和黏接剂聚偏氟乙烯(PVDF)在适量N-甲基吡咯烷酮(NMP)中混合均匀,将搅拌均匀的正极浆料均匀涂覆在铝箔上,在80 ℃鼓风烘箱中烘干有机溶剂,再放入120 ℃真空烘箱中烘烤12 h,得到干燥的正极片,裁切为Φ8 圆片,其面密度约为1 mg/cm2.电解液为1.0 mol/L 的LiPF6溶液,溶剂为EC 和DMC 的混合溶液(体积比3∶7).以锂片为对电极、Celgard 2500 聚丙烯薄隔膜装配2032 型纽扣电池.使用Neware 测试仪在2.0—4.8 V 的电压范围内进行恒电流充放电循环(电流密度为1 C=200 mA/g)和恒电流间歇滴定技术(GITT)测量.
2.3 实验表征
材料的晶体结构采用装配Cu 靶(λ=1.5418 Å)的粉末X 射线衍射仪(XRD,Bruker D8 Advance)进行表征,粉末样品的采集角度为10°—80°,并使用GSAS-II 软件对衍射数据进行Rietveld 精修.非原位的XRD 对样品的未充电、首次充电至4.5 V,4.8 V 与放电至2.0 V 四种状态进行采集,采集角度为10°—50°.材料的表面形貌采用扫描电子显微镜(SEM,Gemini 300,ZEISS)和透射电子显微镜(TEM,JEM-F200,JEOL)进行表征.采用X 射线光电子能谱仪(XPS,ESCALAB XI+,Thermo Fisher)表征元素价态与含量.正极材料中元素的氧化还原反应过程采用电化学工作站(CHI660E,上海辰华)在2.0—4.8 V 的电压范围内以0.1 mV/s 的扫描速率进行循环伏安(CV)测量.
3 结果与讨论
3.1 形貌与结构
对LNFMO 与LNFMO-Mo 正极材料进行XRD 测试,结果如图1(a),(d)所示.Rietveld 精修表明,LNFMO 与LNFMO-Mo 的所有衍射峰尖锐,归属于六方α-NaFeO2型的R-3m空间群层状氧化物结构;20°—30°之间的超晶格衍射峰属于单斜C2/m空间群,表明Li+进入了过渡金属层.Mo 掺杂后没有杂峰出现,(006)/(012)和(108)/(110)衍射峰的分裂清晰,表明样品结晶性良好,未破坏原有的层状结构.

图1 Rietveld 精修的样品LNFMO (a)和LNFMO-Mo (d) XRD 图谱;样品LNFMO (b)和LNFMO-Mo (e)的SEM 图;样品LNFMO(c)和LNFMO-Mo (f)的TEM 图及层间距;LNFMO-Mo (g)表面不同元素的EDS 分布图Fig.1.Rietveld refined XRD patterns of samples LNFMO (a) and LNFMO-Mo (d);SEM images of samples LNFMO (b) and LNFMO-Mo (e);TEM images and layer spacing of samples LNFMO (c) and LNFMO-Mo (f);EDS images of distributions of different elements on the surface of LNFMO-Mo (g).
在R-3m结构的层状氧化物中,Li 占据3a位置,TM 占据3b位置,O 占据6c位置.Ni2+的离子半径(0.69 Å)和Li+的离子半径(0.76 Å)在Li-TM-O结构中最接近,容易发生Li/Ni 混排.Li(或TM)在(003)晶面上均匀分布,而Li,TM 间隔分布在(104)晶面上,故在XRD 中使用(003)/(104)峰的比值来衡量Li/Ni 混排程度[28,29].在XRD 谱图中,LNFMO-Mo 的I(003)/(104)的强度从1.571 提高到1.637,Ni2+占据3a位置Li+的比例由5.72%下降至1.02%,表明阳离子混排的程度下降.此外,使用GSAS-II 精修后的结果表明Mo 掺杂后的层状R-3m相晶格常数从a=2.867 Å,c=14.279 Å扩大为a=2.869 Å,c=14.283 Å.锂层间距可以通过c/3 计算得出,因此,原始材料以及掺杂后材料的锂层间距分别为4.759 Å和4.761 Å.此外,TEM观察到Mo 掺杂材料R-3m空间群(003)晶面的晶格条纹变宽,同样表明Mo 掺杂扩大了锂层间距.以上结果表明扩大到锂层间距可为锂离子的快速脱嵌提供更宽的通道,有利于提高材料的倍率性能与结构稳定性.
为了研究Mo 掺杂对微观结构影响,对LNFMO与LNFMO-Mo 正极材料进行SEM 测试,结果如图1(b),(e)所示.两种样品的粒径与形貌无较大差异,约为200—300 nm,Mo 掺杂后的样品团聚现象减少,粒径均匀性更好.图1(g)为LNFMO-Mo的X 射线能谱(EDS).EDS 结果表明Ni,Mn,Fe,O,Mo 元素在颗粒中分布均匀.
3.2 电化学性能
为了评估Mo 对LNFMO 电化学性能的影响,对所制备材料组装了半电池,并在2.0—4.8 V 的电压范围之间测试.首先,使用循环伏安法(CV)以0.1 mV/s 的扫描速度对两种材料在循环过程中的氧化还原反应进行分析.两种样品的前3 次循环伏安曲线如图2(a),(b)所示.在第一次充电过程中,出现了2 个氧化峰: 第1 个峰在4.2 V 左右,是Ni2+/Ni4+与Fe3+/Fe4+的氧化,第2 个峰位于4.6 V,归因于Li2MnO3组分的不可逆电化学活化,同时伴随着Li2O 的脱出与MnO2的形成.在初始放电过程中,3.8 V 处的还原峰对应于Ni4+/Ni2+和Fe4+/Fe3+,3.3 V 处的峰则对应Mn4+/Mn3+的还原.在第2、3 次循环的曲线中,几乎所有的氧化和还原峰都相互重叠,证明样品具有良好的可逆性.值得注意的是,在LNFMO 第1 次至第3 次循环的放电曲线中,3.3 V 左右的峰向左移动,形成了不可逆的尖晶石相,而LNFMO-Mo 中该峰几乎没有移动,表明高价阳离子Mo 的掺杂抑制了尖晶石相的形成,阻止了该不可逆相变的发生.
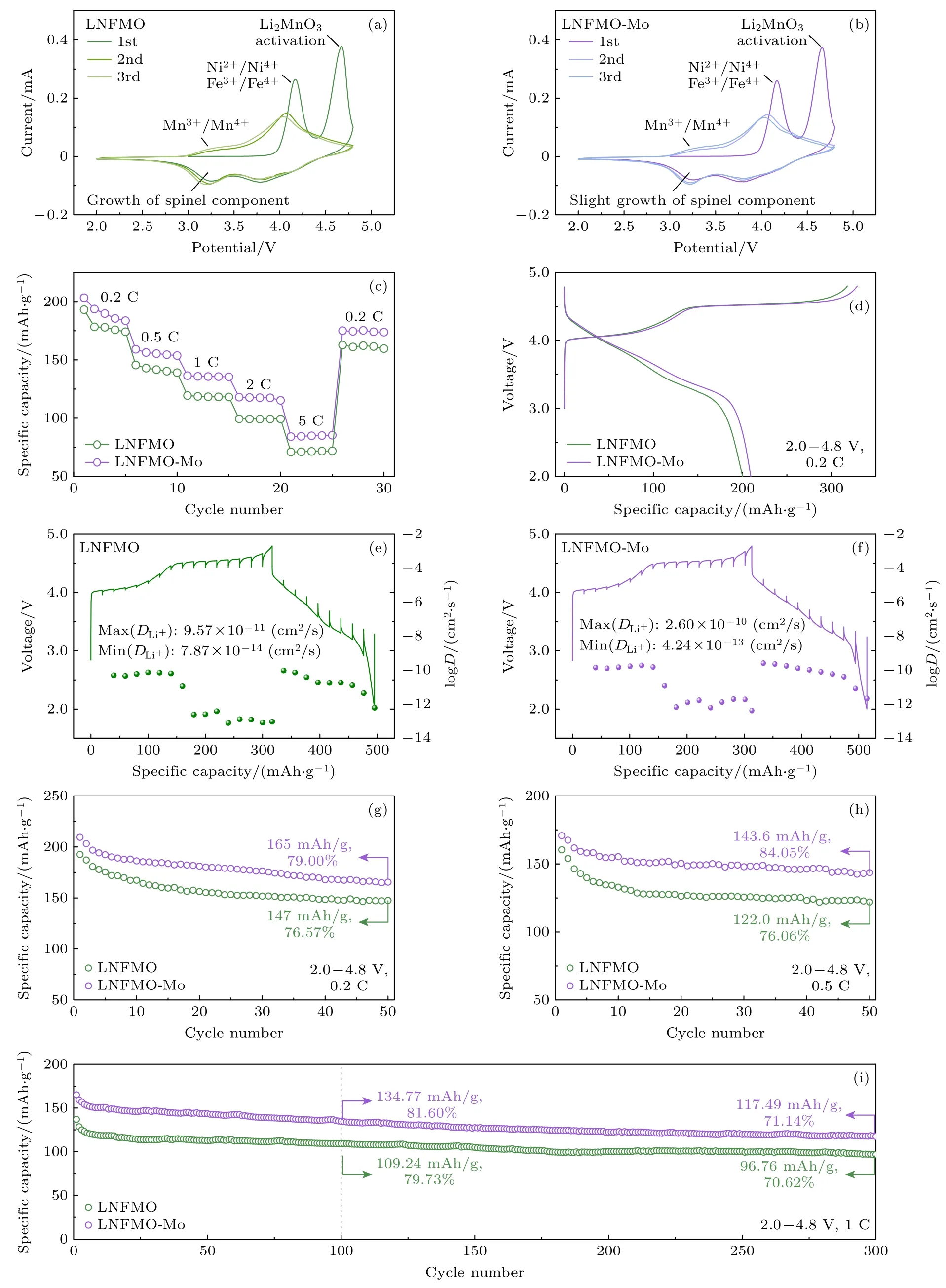
图2 样品LNFMO (a)和LNFMO-Mo (b)前3 次循环的CV 曲线;在不同电流密度下的倍率性能 (c);0.2 C 电流密度下的初始循环曲线 (d);LNFMO (e)和LNFMO-Mo (f)的GITT 曲线;两种样品0.2 C (g)、0.5 C (h)、1 C (i)电流密度下的长循环性能Fig.2.CV curves for the first 3 cycles of samples LNFMO (a) and LNFMO-Mo (b);rate performance at different current density(c);initial cycling curves at 0.2 C current density (d);GITT curves of samples LNFMO (e) and LNFMO-Mo (f);the long-cycle performance of the two samples at 0.2 C (g),0.5 C (h),and 1 C (i) current density.
两种材料在0.2 C 电流密度下的初始充放电曲线如图2(c)所示.两个样品都表现出相似的充电曲线,由开路电压(OCV)到4.5 V 的倾斜区域和4.5 V 以上的长平台区域组成.低于4.5 V 的倾斜区域与LiTMO2组分中Li+的脱出有关,其中Fe3+和Ni2+分别氧化为Fe4+和Ni4+,LNFMO-Mo 在4.5 V 前的倾斜区域增大.充电至4.5 V 后的长平台归因于Li2MnO3组分中Li+的脱出,与阴离子氧化和不可逆的氧释放有关.对比首次循环的放电容量,LNFMO-Mo 的放电比容量由LNFMO 的200.26 mAh/g 提高至209.48 mAh/g,初始库仑效率(ICE)也由62.99%提高至63.68%,这是由于Mo 抑制了阳离子混排,增强了过渡金属的氧化还原活性.
为了验证Mo 对层间距扩大的影响,在不同倍率下对LNFMO 与LNFMO-Mo 的性能进行测试.两个样品在0.2,0.5,1,2 和5 C 的倍率充放电测试如图2(d)所示.LNFMO 的最大放电比容量分别为193.07,145.57,119.44,99.48,71.01 mAh/g,相同倍率条件下LNFMO-Mo 的最大放电比容量分别为203.31,159.09,136.48,118.00,84.18 mAh/g.在使用不同倍率各测试5 个循环,恢复至0.2 C后,LNFMO-Mo 仍有175.06 mAh/g 的放电比容量,而LNFMO 仅为162.77 mAh/g.
为了进一步揭示Li+在两个样品中的扩散动力学与LNFMO-Mo 的高可逆容量来源,使用恒电流间歇滴定技术(GITT)对两种材料进行测试.如图2(e),(f)所示,在过渡金属氧化区域LNFMOMo 显示出较高的锂离子扩散系数DLi+=2.60×10–10cm2/s,而LNFMO 中DLi+=9.57×10–11cm2/s.在ARR 反应区域,由于晶格氧析出、Li+从TM层中脱出,过渡金属离子发生不可逆的短程迁移,阻断了Li+的扩散通道,使Li+的扩散动力学降低.此区域中LNFMO-Mo 最低的DLi+仍有4.24×10–13cm2/s,而LNFMO 因严重的阳离子混排和表面缺陷,DLi+降低为7.87×10–14cm2/s.
为了探究Mo 对长循环性能的影响,在0.2,0.5 和1 C 的电流密度下分别进行长循环测试.如图2(g)所示,在0.2 C 的电流下循环50 次后,LNFMO 和LNFMO-Mo 的比容量分别为147 mAh/g和165 mAh/g,容量保持率为76.57%和79.00%.如图2(h)所示,在0.5 C 的电流下循环50 次后LNFMO 和LNFMO-Mo 的比容量分别为147 mAh/g和165 mAh/g,容量保持率为76.06%和84.05%.1 C 电流下的长循环如图2(i)所示,循环100 次后LNFMO 和LNFMO-Mo 的比容量分别为109.24 mAh/g 和134.77 mAh/g,容量保持率为79.73%和81.60%,而循环300 次后的比容量分别为96.76 mAh/g 和117.49 mAh/g,容量保持率为70.62%和71.14%,平均中值电压的衰减由每圈2.09 mV 降低为1.66 mV.上述结果表明Mo 的掺入拓展了Li+的脱嵌通道,有利于Li+的扩散,抑制了晶格氧的损失、有害相变的发生,倍率和循环性能均有提高.
3.3 结构演化
为了研究两种材料在循环过程中的阳离子混排的变化,通过非原位XRD 测试进行分析.如图3(a),(b)所示,LNFMO 在充电至4.5 V 时,I(003)/(104)的比值下降,阳离子混排程度增加,LNFMO-Mo 的I(003)/(104)比值稍有上升,没有加剧阳离子混排.充电至4.8 V 时,TM 层中大量的Li 脱出,两种样品的I(003)/(104)的比值下降.在放电至2.0 V 时,两种样品的I(003)/(104)比值均有增大,但LNFMO-Mo的I(003)/(104)比值一直大于LNFMO,表明其阳离子混排程度更小.这可能是由于Mo 的掺入扩大了两相的晶格常数,保证了Li+在充放电过程中嵌入TM 层Li 空位的可逆性,从而增强结构稳定性.
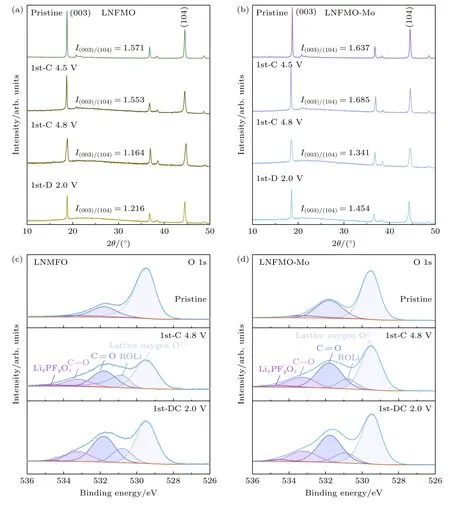
图3 LNFMO (a)和LNFMO-Mo (b)在原始、第1 次充电至4.5 V、4.8 V,第1 次放电至2.0 V 状态下的XRD 谱图及I(003)/(104)比值的变化;LNFMO(c)和LNFMO-Mo(d)在原始、第1 次充电至4.8 V,第1 次放电至2.0 V 状态下的O 1s XPS 光谱Fig.3.XRD spectra of LNFMO (a) and LNFMO-Mo (b) in the pristine,first charge to 4.5 V,4.8 V,and first discharge to 2.0 V states and the variation of the I(003)/(104) ratio;O 1s XPS spectra of LNFMO (c) and LNFMO-Mo (d) in the pristine,first charge to 4.8 V,and first discharge to 2.0 V states.
在循环过程中,电解液通常在正极材料的表/界面处发生氧化或催化分解等,形成正极-电解质界面(CEI).高截止电压下的ARR 会加剧这些副反应,如形成尖晶石相,析出晶格氧.为了研究两个材料在循环过程中CEI 的变化,使用非原位的X 射线光电子能谱测试两种材料表面的O 1s,如图3(c),(d)所示.
在O 1s 能谱中,529.5,530.8,531.8,533.2 和534.5 eV 附近的峰分别属于晶格氧、电解质分解产物(ROLi)和碳酸根(CO3/O—C=O)、酯或聚醚(C—O)和锂盐分解产物(LixPFyOz).LNFMO 与LNFMO-Mo 的晶格氧变化表现出相同的变化趋势,即第一次充电至4.8 V 时,晶格氧的峰持续降低,放电至2.0 V 时又逐渐升高.
根据晶格氧在O 1s 能谱中比例,通过公式D=ln(Ia/Ib)λadscosθetfactor可以计算出CEI 的厚度[30].其中Ia/Ib表示原始晶格氧的原子百分比的比值;λads表示晶格氧峰处光电子穿过整个CEI 薄膜的平均自由程,为2.84 nm;θe为发射角,值为0;tfactor是指表面面膜对球形颗粒的修正系数,值为0.67.通过上述公式计算可知: 充电至4.8 V 时,CEI 厚度增加,LNFMO 与LNFMO-Mo 分别为11.65 Å和6.58 Å,放电至2.0 V 时CEI 溶解,两种材料中的厚度分别为9.97 Å与6.01 Å.在首次充放电循环中,LNFMO-Mo 比LNFMO 表现出更薄的CEI,表明Mo 掺杂后副反应减少,增强了表面结构稳定性,不可逆相变得到了有效抑制.
4 结论
本文通过掺杂改性的策略,在富锂材料Li1.2Ni0.13Fe0.13Mn0.54O2中用Mo 取代过渡金属,制备了Li1.2(Ni0.13Fe0.13Mn0.54)0.995Mo0.005O2长循环稳定的正极材料.通过XRD 测试发现Mo 的加入可以扩大c轴以及Li 层间距,为Li+提供了更宽的传输通道,增强Li+传输的动力学性能,降低阳离子混排,GITT 测试同样确定Mo 的掺杂可以提高充放电过程中的动力学性能.通过XPS 分析了表面CEI 变化,发现Mo 掺杂减少了CEI 生成,抑制了界面副反应的发生.非原位XRD 测试发现Mo 掺杂后可以更好地抑制阳离子混排.因此,Mo 掺杂后的材料表现出更优异的电化学性能: 在0.5 C 的电流密度下循环50 次后LNFMO 和LNFMO-Mo的比容量分别为147 mAh/g 和165 mAh/g,容量保持率从76.06%提高到84.05%;1 C 电流密度下的初始放电比容量165.15 mAh/g,循环300 次后仍有117.49 mAh/g 的放电比容量,平均中值电压的衰减每圈仅有1.66 mV.综上,高价离子掺杂剂Mo 提升了富锂正极材料的循环稳定性,对该正极体系的设计具有重要意义.
