淫羊藿苷对心力衰竭血清中DCs与CD4+T细胞共培养的影响*
2024-02-01赵玲婕陈波洋柴艺汇陈云志
赵玲婕,李 倩,陈波洋,周 艳,高 洁,柴艺汇,陈云志△
(1.贵州中医药大学,贵阳 550025;2.德江县民族中医院,贵州德江 565200)
心力衰竭是由于心脏的结构或功能异常导致的一种临床综合征[1]。现代医学治疗心力衰竭虽可缓解患者的临床症状,但长期联合用药会对人体产生诸多不良反应[2]。因此,有必要寻找更加有效的治疗策略,提高心衰患者的生活质量,降低其医疗成本。
淫羊藿苷(icariin,ICA)是中药淫羊藿的活性成分提取物,现代药理研究发现其对心力衰竭、心肌缺血等疾病具有明显的减缓作用[3]。研究表明,维生素D系统与心血管系统疾病的发病密切相关[4-5],维生素D与淫羊藿部分作用机制相似,ICA可通过影响维生素D系统有效改善心血管疾病[6]。树突状细胞(dendritic cells,DCs)作为机体内能直接激活初始T细胞的最强专职抗原提呈细胞,在心力衰竭免疫调节中起着至关重要的作用。DCs可调控T细胞的分化,以维持和诱导机体的免疫耐受[7]。而T细胞中的CD4+T细胞已被证明在心力衰竭中发挥关键作用[8]。另有研究发现,维生素D的主要活性形式1,25-二羟维生素D3[1,25(OH)2D3]能抑制DCs的成熟[9],且DCs介导T细胞的分化会被ICA影响[10]。故推测,ICA与维生素D治疗心力衰竭,可能是通过调节DCs干预CD4+T细胞的分化来实现的。综上,本研究拟探讨ICA对心力衰竭血清处理DCs共培养中CD4+T细胞分化的影响,为ICA改善心力衰竭提供实验支撑。研究方案经重庆医科大学第一附属医院实验动物伦理委员会审查,审查批号:2019年科研伦理(2019-217)。
1 材料
1.1 动物
50只雄性Dahl盐敏感大鼠,SPF级,5周龄,10只同龄SPF级雄性Dahl盐抵抗大鼠,大鼠均购自北京维通利华实验技术有限公司,体质量(200±20)g,动物许可证号:SCXK(京)2016-0006。动物每日保持自由饮水、进食,动物房光照与通风良好,实验室温度22~26 ℃,湿度40%~70%。
1.2 药品
淫羊藿苷,中国上海麦克林生化科技有限公司,纯度95%,批号:C10464466。
1.3 主要试剂与仪器
流式抗体CD4-FITC(货号:70-AR00401-20)、白细胞介素(interleukin,IL)-17-PE(货号:70-AM0I1704-20)均购自中国MultiSciences公司;流式抗体CD3-PC5.5(货号:100217)购自美国Biolegend公司;流式抗体CD8-PB450(货号:ab242255)购自英国Abcam公司;流式抗体Foxp3-PE(货号:320008)、CD25-APC(货号:202114)均购自美国Biolegend公司;组织淋巴细胞分离液(货号:P5780)购自美国Solarbio公司; IL-6(货号:SEA079Ra),IL-10(货号:SEA056Ra),IL-17 ELISA试剂盒(货号:SEA063Ra)均购自中国云克隆公司;转化生长因子(transforming growth factor,TGF)-β1 ELISA试剂盒(货号:E-EL-0162c)购自中国欣博盛公司。
QL-901型旋涡振荡器,中国其林贝尔公司;NanoDrop One/One C型微量紫外-可见光分光光度计、CMax Plus型多功能酶标仪,美国Thermo公司;CytoFLEX型流式细胞仪,美国Beckman公司。
2 方法
2.1 制备心力衰竭血清
将50只5周龄SPF级雄性Dahl盐敏感大鼠作为模型组,给予低盐饲料(含0.3%NaCl)适应性喂养1周后,再给予含8%NaCl动物饲料喂养[11]。10只5周龄SPF级雄性Dahl盐抵抗大鼠作为对照组。对照组以普通啮齿类动物饲料喂养,2组大鼠分别喂养至18周龄后麻醉行心脏超声检测心功能。模型组大鼠确定心衰后,将2组大鼠分离血清,过滤除菌分装,-20 ℃保存备用。
2.2 骨髓源性DCs分离及培养
将分离血清后的模型组大鼠在无菌条件下取出双侧股骨胫骨,加入红细胞裂解液裂解红细胞,用含有胎牛血清的RPMI-1640培养基悬浮细胞,接种于24孔培养板,每孔1×106个/mL[12]。加入GM-CSF(10 ng/mL)、IL-4(20 ng/mL)诱导,以后隔日半量换液,第7天将收集的悬浮细胞加入1 μg/mL脂多糖(lipopolysaccharide,LPS)刺激成熟,再继续培养2 d后收集悬浮细胞。按上述方法,取对照组大鼠骨髓源性DCs备用。
2.3 流式细胞术分选CD4+T细胞
无菌条件下分离模型组大鼠脾脏,加入含2%胎牛血清的磷酸缓冲盐溶液(phosphate buffer solution,PBS)20 mL,经过研磨后获得脾脏单细胞悬液,在细胞悬液中加入大鼠组织淋巴细胞分离液,离心,PBS洗涤2次,调整细胞浓度为1 × 108个/mL。收集细胞悬液即为CD4+T细胞。按上述方法取对照组大鼠CD4+T细胞保存备用。
2.4 流式细胞仪检测CD4+T细胞纯度
取获得的CD4+T细胞,加入流式抗体CD4-FITC,CD3-PC5.5荧光标记抗体各20 μL。混匀,置25 ℃避光孵育30 min后离心10 min,弃上清;加入PBS缓冲液洗除多余未结合的抗体,再次离心10 min,重复2次,流式细胞仪检测。
2.5 骨髓源性DCs与CD4+T细胞共培养
收集2.2培养的DCs与2.3项下培养的CD4+T细胞,将DCs和CD4+T按照1:10的比例共培养,培养2 d后,将共培养的细胞分为对照组(正常血清),模型组(心力衰竭血清),模型组+维生素D组(1×10-8mol/L),模型组+ICA低剂量组(10 μmol/L ICA),模型组+ICA中剂量组(20 μmol/L ICA),模型组+ICA高剂量组(40 μmol/L ICA)。药物干预24 h后收集细胞标本。
2.6 流式细胞仪检测DCs诱导CD4+T细胞分化情况
收集药物干预24 h后的共培养细胞,离心重悬106/100 μL,滴加相关抗体。Th17细胞表面标记抗体:PC5.5-CD3、PB45O-CD8、PE-IL-17;Treg细胞表面标记抗体:FITC-CD4、APC-CD25、PE-Foxp3。使用流式细胞仪检测分析。
2.7 ELISA检测共培养细胞上清液相关细胞因子的水平
按试剂盒说明书进行检测IL-17、TGF-β1、IL-6、IL-12、IL-10的水平,用酶标仪在450 nm处依序测量各孔的光密度,计算样品浓度。
2.8 统计学方法
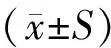
3 结果
3.1 2组18周龄大鼠心脏超声功能检测结果
心脏超声结果显示,与对照组比较,模型组大鼠左室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end systolic diameter,LVESD)水平均明显上升(P<0.01),左室射血分数(left ventricular ejection fractions,LVEF)明显降低(P<0.01)。提示模型组大鼠心功能异常,心力衰竭模型建立成功,见图1。

注:与对照组比较##P<0.01;左室舒张末期内径(LVEDD),左室收缩末期内径(LVESD)图1 2组大鼠心功能相关指标比较
3.2 流式细胞仪鉴定CD4+T细胞纯度
经流式鉴定结果可看出,分选出来的CD4+T细胞的纯度为分别为94.34%、95.79%,提示分选出的CD4+T细胞纯度与活性均较高,见图2。
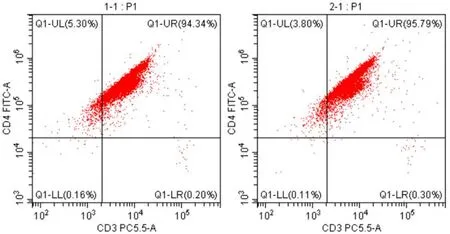
1-1.模型组CD4+T细胞; 2-1.对照组CD4+T细胞图2 流式细胞术检测CD4+T细胞纯度
3.3 ICA对DCs诱导CD4+T细胞分化为Th17、Treg的影响
与对照组比较,模型组中辅助性T细胞(T helper cell, Th)17阳性表达率显著上升,Th17/调节性T细胞(T regulatory cells,Treg)比值显著升高(P<0.01),Treg阳性表达率明显降低(P<0.01);与模型组比较,维生素D组与ICA 3个剂量组的Th17细胞阳性表达率及Th17/Treg比值明显降低(P<0.01),Treg阳性表达率明显升高(P<0.01)。提示ICA与维生素D均能明显提高Treg阳性表达率,减少Th17细胞阳性表达率及Th17/Treg比值,维持体内Th17/Treg稳态,见图3、图4。

注:与对照组比较##P<0.01;与模型组比较*P<0.01;辅助性T 细胞17(Th17),调节性T细胞(Treg),树突状细胞(DCs)A.共培养细胞中Th17阳性表达率;B.共培养细胞中Treg阳性表达率;C.共培养细胞中Th17/Treg比值图3 淫羊藿苷对DCs诱导CD4+T细胞分化为Th17、Treg的影响
3.4 ICA对DCs和CD4+T细胞共培养上清液相关细胞因子的影响
与对照组比较,模型组IL-17、TGF-β1、IL-6、IL-12水平明显升高,IL-10水平显著下降(P<0.01);与模型组比较,维生素D组与ICA高、中剂量组的IL-10水平显著升高,IL-17、TGF-β1、IL-6、IL-12水平显著降低(P<0.01)。ICA低剂量组的IL-17、TGF-β1、IL-6、IL-12表达下调,IL-10表达上升(P<0.05)。其指标升高或降低的程度与ICA剂量呈依赖关系。提示ICA与维生素D可增加抑炎细胞因子IL-10的水平,降低促炎细胞因子IL-17、TGF-β1、IL-6与IL-12的表达,改善机体炎症状态,见图5。
4 讨论
心力衰竭是各种心血管疾病的终末阶段,临床上常用LVEF、LVEDD、LVESD等作为评价心衰患者心功能的重要指标[13]。而心功能状况是判断心力衰竭程度的关键依据[14]。心力衰竭与炎症标志物上调密切相关,促进炎症反应发生的关键因素之一是免疫系统,不断的免疫激活可引起炎症加速心衰的病理过程[15]。T细胞作为免疫细胞的重要组成部分,其激活后参与了心力衰竭的发生发展[16]。DCs是机体内强大的抗原呈递细胞,在T细胞反应的启动中起着至关重要的作用,其表面共刺激分子表达上升可活化T细胞,诱导免疫应答反应[17]。DCs能够介导CD4+T细胞分化为效应T细胞群[18],即Th17或Treg细胞等[19-20]。Th17和Treg均来自未成熟的Th细胞。Th17可通过抑制Treg的分化和产生较多的IL-6介导促炎反应[21-22]。IL-17作为Th17的主要效应因子,也能通过增加IL-6、IL-β1的分泌来加剧炎症[23]。Treg细胞不仅能控制自身免疫反应,还是调节炎症、感染等的重要细胞群。Treg的抑制性细胞因子IL-10直接参与T细胞的抑制功能以维持免疫稳态[24]。研究发现,心力衰竭大鼠Th17/Treg处于失衡状态[25]。体内Th17与Treg细胞的平衡与心功能密切相关,其比例失衡可导致免疫应答和自身免疫的发生[26]。
维生素D是人体内的重要物质。有研究发现,1,25(OH)2D3不仅可与DCs上维生素D受体(vitamin D receptor,VDR)结合而发挥生物学效应,影响T淋巴细胞的分化和功能,还对DCs的成熟具有调节作用,降低促炎细胞因子IL-12水平,促进抑炎细胞因子IL-10表达上升,使Treg细胞数量增加[27]。维生素D补充较少的心衰患者体内CD4+T细胞向Treg细胞分化减少[28]。
中医认为,心力衰竭虽病位在心,但病源在肾。肾为先天之本,主藏精,肾精不足会致肾阴肾阳亏虚,肾阴肾阳为五脏阴阳之根本,其虚损不足最终致使心衰[29]。因此,治疗心力衰竭的途径之一是调控肾的生理功能。淫羊藿为传统补肾中药,具有补肾阳、祛风湿之功效。《日华子本草》也有记载淫羊藿可“强心力”。ICA作为淫羊藿的主要成分之一,亦可抑制心脏纤维化,改善心功能[30]。ICA与维生素D有较多关联。课题组前期研究发现,ICA通过调节维生素D系统不仅能对心肌重塑模型产生保护作用[31],还可影响VDR mRNA的表达水平达从而达到保护小鼠肥大心肌细胞的作用[32]。另有研究发现,ICA可影响小鼠骨髓源性DCs成熟,协调共刺激分子CD80、CD86等表达[33]。本研究通过ICA干预Dahl盐敏感大鼠骨髓源性DCs与CD4+T细胞,通过比较不同剂量ICA与维生素D对Dahl盐敏感大鼠骨髓源性DCs和CD4+T细胞共培养后Th17、Treg阳性表达比例以及其上清液中IL-17、TGF-β1、IL-6、IL-12、IL-10的影响,探讨ICA与维生素D防治心力衰竭的机制。
本实验结果显示,ICA与维生素D的治疗结果趋势一致,均可显著降低Th17细胞比率及Th17/Treg比值,升高Treg比率;显著升高IL-10水平,降低IL-17、TGF-β1、IL-6、IL-12水平。推测ICA与维生素D通过调节DCs介导CD4+T细胞的分化来治疗心力衰竭。综上,本研究发现ICA与维生素D能通过调节机体内Th17/Treg的平衡,降低促炎细胞因子IL-17、TGF-β1、IL-6、IL-12与升高抑炎细胞因子IL-10的表达来治疗心力衰竭。这为ICA治疗心力衰竭的临床应用提供了实验依据。
