对短肽型肠内营养制剂不耐受的克罗恩病活动期患者药学监护1例
2024-02-01马晶晶王昌季文莹陈凌周婧
马晶晶,王昌,季文莹,陈凌,周婧
炎症性肠病(IBD)是一组病因尚未明确的慢性非特异性肠道炎性疾病。近几十年来,全球IBD发病率持续增高,首例病例出现在经济社会高度发达的北美及欧洲,近十年来我国病例明显增多[1-2]。克罗恩病(CD)属于IBD的一种,以腹痛、腹泻、体质量下降为主要临床表现,青少年多发,发病高峰年龄为18~35岁,男性略多于女性[3-4]。多数患者预后较差,病情迁延不愈,故治疗目的多为诱导和维持缓解,同时预防并发症,改善生存质量[2]。
在CD治疗中,肠内营养不仅是营养支持,还是控制炎性反应的治疗手段之一,除纠正营养不良和降低营养风险外,还可诱导和维持CD缓解[5-6]。本文以1例CD活动期患者营养方案为例,探讨临床药师在肠内营养的品种选用及实施过程的监护及分析。
1 病例资料
患者,女,39岁,18年前出现无明显诱因右腹间断性剧烈疼痛,伴里急后重,经止痛针治疗可缓解。17年前于肠镜检查后提示CD,予美沙拉秦等药物治疗。3个月前行肠道彩超示“炎性肠病,2~6组小肠节段性增厚,血供丰富,考虑活动期改变;左上腹小肠可疑狭窄”。1个月前诊断为“CD(回结肠型,狭窄穿透型,活动期,中度)”,予英夫利西单抗生物治疗2次后出院。本次入院3天前,患者再次出现右下腹持续性刀割样疼痛,痛感强烈且伴腹胀,排气、排便减少,无其他伴随症状。急诊查腹平片示“可疑右下腹局限性肠梗阻”。予屈他维林注射液肌内注射、塞来昔布胶囊口服,腹痛无缓解,遂转入消化科。患者CD史18年,先后服用过美沙拉秦缓释颗粒剂、柳氮磺胺吡啶肠溶胶囊、醋酸泼尼松片控制炎性反应;规律服用中药调理10余年。自起病以来,患者精神、睡眠、胃纳较差,大便次数较前增多,小便正常,近6个月体质量无明显变化。
患者无特殊既往史、个人史、家族史、婚育史,5年前住院期间,曾接受经鼻胃管连续输注的短肽型肠内营养混悬液SP,常温下慢速输注1次后即发生腹泻,解水样便数次,停用后腹泻缓解。本次入院前1月内,间断性口服整蛋白型肠内营养粉剂TP,可耐受。
入院查体:T 36.6 ℃,P 86 次/min,R 20 次/min,BP 114/80 mmHg。身高151 cm,体质量38 kg,体质指数(BMI)16.7 kg/m2。腹部可见色素沉着,腹部柔软,右下腹存在压痛,肠鸣音3 次/min且减弱,有气过水声,无其他阳性体征。入院腹平片示可疑右下腹局限性肠梗阻。入院诊断:(1)肠梗阻;(2)CD(回肠型,狭窄穿透型,活动期,中度);(3)重度营养不良伴消瘦。
2 主要治疗经过及营养方案调整
患者入院营养风险筛查简表(NRS2002)评分为4分(BMI 16.7 kg/m2且一般情况差,慢性疾病的并发症入院,非卧床,蛋白质需求轻度增加,但可通过强化膳食或口服营养剂补充),有营养风险[7-8]。患者入院可诊断为营养不良(根据GLIM营养不良诊断标准[9-10],该患者BMI<18.5 kg/m2且一般情况差,由于CD并发肠梗阻导致营养吸收障碍,满足临床表现及病因指标)。
根据该患者CD活动期并发肠梗阻的入院情况,给予禁食、纠正水电解质紊乱、抗感染(静脉输注头孢曲松联合甲硝唑)及口服整蛋白型肠内营养粉剂TP。入院第3天腹痛减轻,营养科会诊后予停禁食,给予低渣半流饮食,建议使用肠内营养混悬液SP。临床药师提示患者既往使用肠内营养混悬液SP出现过腹泻不耐受,营养科遂改方案为整蛋白型肠内营养粉剂TP联合即食谷粉随餐服用,此方案患者服用后可耐受。入院第8天,经多学科会诊讨论,认为患者有手术必要,考虑患者目前营养状况差,建议改善后再行评估。由于患者未同意中心静脉置管给予肠外营养以及鼻胃管置管给予管饲肠内营养,营养科医师建议禁食予经口全肠内营养支持,医嘱予短肽型肠内营养粉剂口服,遵嘱执行。患者执行此营养方案单日解水样便>7次,遂停用该方案,腹泻缓解。患者于第10日出院,出院后继续全肠内营养(整蛋白型肠内营养粉剂TP联合即食谷粉)。住院期间主要辅助检查及具体营养支持方案见表1、表2。

表1 患者住院期间主要辅助检查
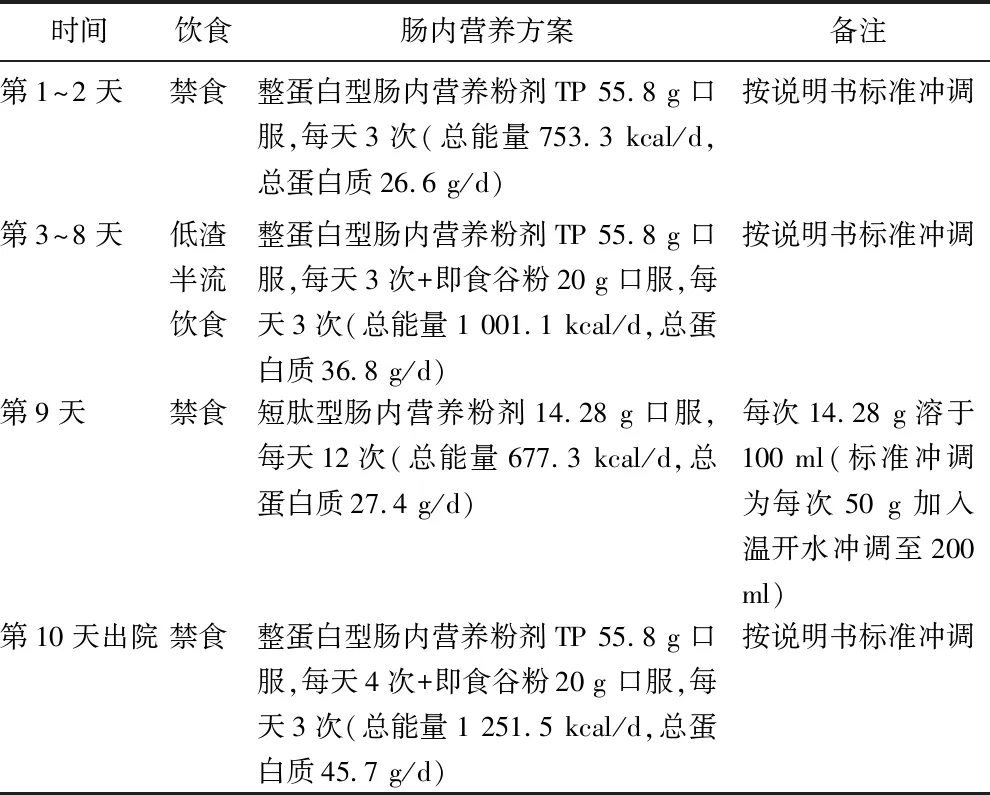
表2 患者住院期间营养支持方案
3 分析与讨论
3.1 能量及蛋白质目标及达标情况 根据2020年欧洲临床营养与代谢学会(ESPEN)的IBD营养指南,
CD成人患者的能量需求与正常人相当,虽然疾病导致的高代谢需更多的能量需求,但认为患者的低活动性能抵消这部分能量[11-12]。而2021年中华医学会肠外肠内营养学分会(CSPEN)《中国炎症性肠病营养诊疗共识》中提出,CD缓解期能量供给为25~30 kcal·kg-1·d-1,活动期高8%~10%,认为疾病活动期需更多的能量需求。临床药师认为,患者病史18年,BMI较低,营养吸收存在障碍,需尽快改善其营养状况,达到手术要求。因此,建议参考国内共识中能量稍高的供给要求。
ESPEN指南及国内共识对CD的蛋白质需求量推荐一致,认为CD缓解期的蛋白质需求为1 g·kg-1·d-1,活动期为1.2~1.5 g·kg-1·d-1。该患者体质量38 kg,处于疾病活动期,每日能量需求1 026~1 254 kcal,每日蛋白质需求45.6~57 g。
该患者入院禁食,营养及蛋白质供给不足,于第3日调整方案后肠内营养能量满足79.8%~105.4%,蛋白质满足64.6%~80.7%,其余部分由饮食补充,能量及蛋白质补充适宜。第9日开始全肠内营养,短肽型肠内营养方案初期为建立耐受,给予较低剂量,患者服用1天腹泻即停用,遂出院予整蛋白型全肠内营养方案,为满足目标能量及蛋白质需求,增加服用次数。
3.2 住院期间药学及营养监护重点 患者入院时诊断肠梗阻,电解质(钠、钾、钙)紊乱,住院期间肠外补充电解质,并给予口服肠内营养,监护电解质情况并调整方案,第8天复查电解质正常。入院经验性抗感染治疗(静脉输注头孢曲松及甲硝唑),应注意监护静脉输注头孢曲松与钙离子时不可同时给药,防止出现头孢曲松—钙沉淀物,使用时二者给药之间需充分冲洗输液管路。
CD多见于回肠末端及结肠,可累及整个消化道,而维生素B12在回肠被吸收,能保护叶酸在细胞内的转移和贮存;叶酸参与血红蛋白合成,因此常见CD相关性贫血[12]。住院期间需监测维生素B12及叶酸,若发现偏低应予以补充,防止由于吸收不良导致贫血。该患者存在轻度贫血,但住院期间查维生素B12及叶酸均在正常范围内。
CD患者缺乏25-羟维生素D与营养摄入不足、吸收障碍及患者病情有关,如户外活动减少等因素影响维生素D生成[5]。对活动性的CD患者,应监测和补充血清钙和25-羟维生素D,以预防骨质疏松。该患者血浆总25-羟维生素D较低但血钙正常(血钙值由血白蛋白值校正),若增加营养摄入量后复查血浆25-羟维生素D仍偏低,建议予以补充并进一步评估骨质疏松情况。
CD主要临床症状之一为腹泻,患者既往接受鼻饲肠内营养制剂发生过腹泻不耐受。本次住院期间多次更换肠内营养方案,应详细询问患者既往肠内营养史,并建立适宜的初始肠内营养方案,监护包括腹泻在内的胃肠道并发症。
3.3 住院期间发生肠内营养相关性腹泻的原因分析及判别思路 临床常用的肠内营养制剂根据氮源分为整蛋白型(又名非要素型)、短肽型及氨基酸型,后两者统称为要素型[13]。理论上,要素型肠内营养制剂可直接或接近直接吸收,而整蛋白型则需经过肠道消化吸收,因此要素型更适合消化功能相对较弱的患者。肠内营养制剂的渗透压主要取决于游离氨基酸和电解质的含量,故要素型肠内营养制剂的渗透压通常比整蛋白型高,而制剂渗透压与胃肠道耐受性密切相关,高渗制剂易引起腹泻或其他胃肠道反应,故给予要素型肠内营养制剂需关注渗透压。此外,要素型肠内营养制剂口感较整蛋白型差,需关注患者服用依从性。
虽现有资料未发现不同氮源的肠内营养制剂对IBD的临床疗效有明显差异,但鉴于IBD患者肠道微生态失衡、肠道黏膜屏障结构和功能异常以及免疫功能紊乱,而整蛋白型肠内营养制剂又具有一定免疫原性,需进一步消化后才能被吸收,因此,要素型肠内营养制剂在理论和临床实践中都更适合于肠道病变严重或有严重消化吸收不良的IBD患者。无论管饲还是口服,选择整蛋白型还是要素型,CD患者对肠内营养治疗常有不同程度的不耐受,且肠道炎性反应越明显,不耐受可能越严重,不同程度降低患者对肠内营养治疗的依从性[5]。
根据ESPEN关于肠内营养相关性腹泻的终身学习教程,导致肠内营养相关性腹泻的因素有配方污染、温度、速度、浓度、膳食纤维添加等,具体实践检查见图1。其中,添加膳食纤维是解决腹泻的措施之一,但出现肠狭窄的CD患者不宜选用含膳食纤维的肠内营养制剂,该患者肠道彩超显示小肠狭窄,本次住院期间的肠内营养制剂均不含膳食纤维。
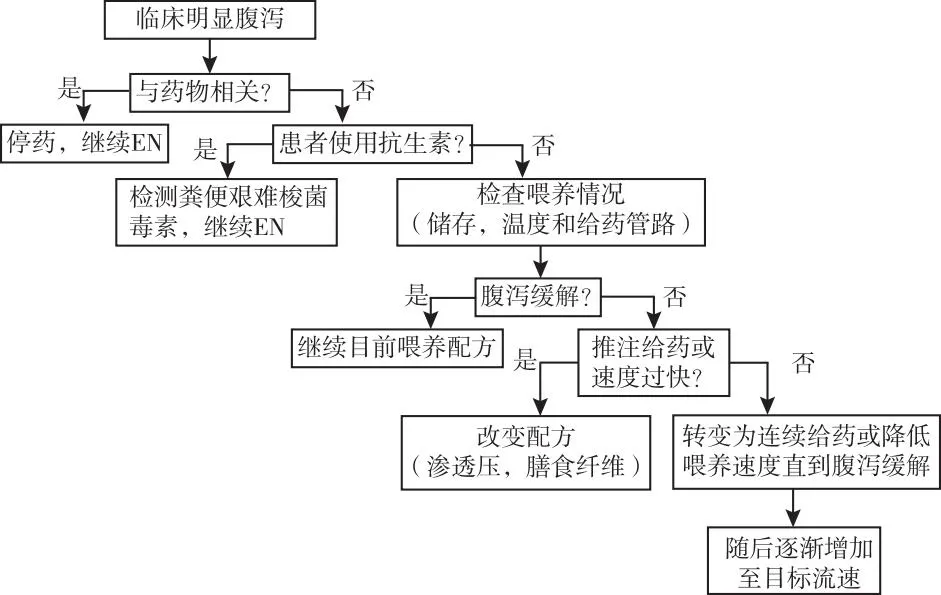
图1 肠内营养实施期间发生腹泻的实践检查
对既往有肠内营养腹泻不耐受的患者,应调研既往相关营养制剂使用史,筛查可能存在不耐受的制剂类型。使用肠内营养的患者发生腹泻原因很多,除不能耐受制剂类型外,还有其他药物及疾病影响、肠内营养不适宜的实施过程及不能忽视的制剂本身问题。因此,为给患者更多营养选择,在未排除其他因素时,不能判定其不能耐受的制剂类型。
本研究中,理论上该CD患者使用要素型肠内营养制剂能更多获益,即使曾出现使用短肽型肠内营养混悬液SP不耐受腹泻情况,也不能判定该患者不能耐受这种类型的肠内营养制剂,而需排除其他因素后综合判断,具体思路见图2。根据患者既往史,怀疑该患者可能对短肽类肠内营养制剂不耐受。首先,应排除其他药物及疾病引起的腹泻,患者使用药物无特异性致腹泻作用,虽CD临床表现也为腹泻,但可通过观察肠内营养给予时机及发生腹泻的次数、程度判断是否相关。还应排除肠内营养不适宜的实施过程,如制剂污染、过低温度、过快速度、过高浓度(过高的渗透压)。该患者尝试另一种短肽型肠内营养制剂给予低剂量,低浓度,单日多次的方式建立初始耐受,但患者仍在执行方案1天内出现严重腹泻,考虑为该患者对短肽型肠内营养制剂不耐受。

图2 肠内营养制剂类型不耐受的判别思路
3.4 患者出院及再入院营养支持建议 根据营养干预阶梯及指南推荐,结合患者情况,出院后建议全肠内营养,疗程通常为6~8周[14]。更长的疗程或许是有益的,但会降低患者对肠内营养治疗的依从性,也会影响患者生活质量。
若营养不达标再次入院,建议在肠内营养基础上,增加补充性肠外营养[15]。该患者由于疾病所致的经肠道营养吸收障碍,导致营养不良伴消瘦。根据既往史,考虑即使给予其充分全肠内营养,也未必能达到营养干预目的。因患者有手术必要,若再次入院建议补充肠外营养,短期内改善营养状况的效果更优。
4 小 结
近年来,医疗机构对营养规范化管理日渐重视。由医师、护师、营养师、药师及其他相关医疗工作者等跨学科专业技术人员组成营养支持团队不断探索临床营养的应用与实践。营养支持药师也是其中一员,应对CD患者进行动态营养筛查,给予适宜营养建议,监护营养摄入情况并随访[5,16]。
CD患者由于摄入量减少、营养丢失、吸收障碍等原因易发生营养不良,营养干预不仅是支持手段,更是治疗手段,能促进肠黏膜修复,溃疡愈合,保护肠黏膜屏障,诱导及帮助维持缓解。CD主要临床症状之一为腹泻,给予肠内营养也可能发生腹泻等常见胃肠道不良反应,因此,CD患者给予肠内营养时,更应监护胃肠道并发症,防止由于不良耐受性及依从性,延误治疗。在此过程中,营养支持药师应详细询问患者既往营养史,积极参与营养方案的制定及监护,并定期随访,使CD患者更多获益。
利益冲突:所有作者声明无利益冲突。
