小分子药物筛选技术研究现状及其应用进展
2024-01-31武瑞君李玮琦杨阳王晶张鑫方子寒张小奕苏月
武瑞君,李玮琦,杨阳,王晶,张鑫,方子寒,张小奕,苏月
(中国生物技术发展中心,北京 100039)
近年来,以抗体药物为代表的生物大分子药物研究热度持续增高,但小分子药物因具有分子量小、给药途径多、免疫原性低、可以穿透细胞膜、研发成本低、生产工艺成熟、易于储存和运输等优势[1],依然是创新药物研发的主战场。先导化合物的发现与优化在小分子药物研发过程中处于至关重要的环节,高质量的活性先导化合物能够大大缩短药物研发周期、节约成本、提高研发成功率[2]。随着生命组学、系统生物学、结构生物学等新兴学科以及高性能计算、大数据分析、人工智能等信息技术深度融入药物研发,小分子药物筛选新技术伴随着药物的发现正在不断更新和拓展,在基于已知活性化合物(Known)的药物发现和高通量筛选(high-throughput screening,HTS)[2]等传统筛选技术的基础上,基于结构的药物发现(structure-based drug discovery,SBDD)、基于片段的药物发现(fragment-based drug discovery,FBDD)、DNA编码化合物库(DNA encoded compound library,DEL)、蛋白降解靶向联合体(proteolysis targeting chimeras,PROTAC)等药物筛选新技术应运而生[3-7]。笔者在本文将介绍目前小分子药物筛选技术整体现状,系统综述HTS、SBDD、FBDD、DEL、PROTAC等技术平台及其优劣势,分析小分子药物筛选新技术研发的重要性,为小分子药物筛选新技术的未来发展提供参考。
1 小分子药物筛选技术整体发展现状
新药研发具有周期长、投入大、风险高等特点。以小分子药物为例,研发周期平均需要约10年,包括发现苗头化合物(Hit)并经过层层结构优化得到先导化合物的药物发现阶段(2~4年)、针对候选化合物(candidate)的临床前研究阶段(1~3年)和临床阶段(3~7年)。其中,药物发现阶段是小分子药物研发中最重要的基础环节,且药物筛选技术直接关系到先导化合物质量、研发效率、研发成本以及成药可能性,是新药研发持续进行的关键。1985年之前,先导化合物的发现主要是通过人工进行,每周处理的样本数仅有数百个[8]。随着分子生物学、结构生物学等现代科学的快速发展,小分子药物发现进入基于靶点的药物设计时代,传统药物筛选方法如基于Known的药物发现由于效率低、较难研发出原创性成果、容易陷入专利陷阱等缺点,无法满足新药研发需求,药物筛选新技术不断更新迭代,HTS大大缩短先导化合物开发在药物研发中的时间,SBDD、FBDD等也逐渐成为小分子药物研发的常见手段[2-5]。通过对2022年至今在JournalofMedicinalChemistry期刊上发表的文章进行分析统计,结果发现基于HTS、SBDD、FBDD、DEL和PROTAC的应用占比分别约为17.4%、51.2%、19.5%、4%、6.3%,在一定程度上反映目前SBDD、FBDD等新策略在新药研发领域发挥越来越重要的作用。
2 不同小分子药物筛选技术的最新研究进展与应用
2.1HTS HTS技术出现于20世纪80年代末和90年代初,是指以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,以灵敏快速的检测仪器采集实验结果数据,运用计算机对实验数据进行分析处理,并以相应的数据库支持运转的技术体系。该技术可在短时间内对数以千万的样品进行检测,具有高度标准化、筛选速度快、灵敏度高、自动化程度高、特异性强、所需样品量小等优点[9]。经过几十年的发展,HTS已经发展成为目前主流的小分子药物筛选方法之一,大量获批药物均由该技术筛选得到,例如治疗糖尿病的二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)抑制剂西格列汀(sigliptin)、治疗乳腺癌的酪氨酸激酶抑制剂拉帕替尼(lapatinib)、治疗胃肠道基质肿瘤和转移性肾细胞癌的酪氨酸激酶抑制剂舒尼替尼(sunitinib)等[10]。但该技术仍具有筛选成本较高、耗时较长、分子多样性受制于化合物筛选库、较难对某些复杂靶点进行筛选等缺点。目前各研发团队仍在积极创新HTS技术,并广泛应用于创新药物研发。
根据待测样品的种类,HTS可分为分子水平筛选和细胞水平筛选两大类。分子水平的筛选主要是检测受体功能的改变、蛋白质结合的抑制以及受体-配体结合的结构、动力学和亲和力等,常见的检测方法有荧光法(荧光偏振、荧光共振能量转移、酶联免疫吸附等)和非荧光法[表面等离子体共振(surface plasmon resonance,SPR)、核磁共振(nuclear magnetic resonance,NMR)、质谱分析(mass spectrum,MS)等]。中国医学科学院医药生物技术研究所联合皖南医学院开发一种基于荧光偏振和生物素-亲和素反应的新冠病毒主蛋白酶(Mpro)小分子抑制剂高通量筛选方法。研究团队合成一种异硫氰酸荧光素和生物素双标记的小分子肽(FITC-S-Biotin)作为荧光偏振示踪剂和Mpro的水解底物,活性化合物可以通过抑制Mpro对FITC-S-Biotin的水解作用,改变荧光强度。研究团队应用该模型从天然产物化合物库中筛选到新冠病毒Mpro竞争性抑制剂二鹅掌菜酚(Dieckol),半数抑制浓度(IC50)为(4.5±0.4) μmol·L-1[11]。上海科技大学研究团队建立一种高通量、无标签的亲和质谱筛选技术,用于筛选靶向G蛋白偶联受体(G protein-coupled receptors,GPCR)的小分子配体,通过对4 333个化合物进行筛选,发现了1个5-羟色胺(5-ydroxytryptamine,5-HT)受体拮抗剂和4个胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)阳性变构调节剂[12]。
细胞水平的筛选是在细胞个体水平完成的检测,常见的检测方法有离子通道检测、报告基因检测和细胞增殖检测,分别用于原发性电障碍等离子通道类疾病、瑞特综合征(rett syndrome,RTT)和阿尔兹海默病等脑部疾病、肿瘤和病毒感染等疾病的药物筛选[13]。中国科学院上海药物研究所研究人员利用表达钾离子通道蛋白家族KCNQ2的仓鼠卵巢细胞(CHO),建立一种改进的HTS方法,通过铊通量测定法从80 000个化合物中筛选出565个比阳性化合物活性更强的KCNQ2通道激动剂,然后使用384孔自动化膜片钳和传统膜片钳,筛选得到ZG1732和ZG208,半数有效浓度(EC50)分别为(31.04±0.18),(1.37±0.06)μmol·L-1[14]。麻省理工学院怀特黑德生物医学研究所研究人员使用CRISPR-Cas9基因编辑技术,将荧光素酶报告基因插入人胚胎干细胞内源性K+/Cl-共转运蛋白2(KCC2)基因位点中,通过检测荧光强度,从900个化合物中筛选得到14个KCC2表达增强化合物(KEECs),有望用于RTT的治疗[15]。美国默克公司研究团队以β干扰素(IFN-β)的分泌为表型,在单核细胞系THP-1中进行高通量筛选,发现口服非核苷酸干扰素基因刺激因子(stimulator of interferon genes,STING)激动剂MSA-2,能够以二聚体形式结合并激活STING,靶向肿瘤组织发挥持久高效的抗肿瘤免疫活性[16]。
2.2SBDD SBDD技术起源于20世纪末,是指从配体和靶点的三维结构出发,以分子识别为基础而进行的药物设计方法,主要目的是预测与靶点结合位点产生最佳相互作用的化合物,可分为基于受体结构的药物设计和基于配体结构的药物设计两大类。其中,基于受体结构的药物设计是根据受体大分子的三维结构,通过计算机辅助药物设计(computer aided drug design,CADD)等方法,确定小分子与受体的结合构象,评价结合活性,筛选出有潜力的配体小分子;基于配体结构的药物设计是依据现有药物的结构、理化性质与活性关系的分析,建立定量构效关系或药效基团模型,设计新的化合物或具有新骨架的活性分子[17]。1995年,基于该策略有2个药物首次获得美国食品药品管理局(FDA)批准,分别为用于降低开角型青光眼和高眼压症眼压增高的碳酸酐酶抑制剂多佐胺、治疗艾滋病的人类免疫缺陷病毒(human immunodeficiency virus,HIV)蛋白酶抑制剂沙奎那韦[18]。在CADD等技术的辅助下,SBDD显著提高了药物筛选命中率,具有开发成本较低、可从少量化合物筛选获得先导化合物、可直接预测受体和配体结合能力等优点。截至目前,FDA批准的药物大多基于该技术演化而来。但该技术需要受体完整的三维立体结构,且仅考虑受体和配体的结合强度而不能预测药效。
随着结构生物学、人工智能与深度学习等不断突破,SBDD也在快速发展。麻省理工学院研发团队使用含有2 335个已知抗菌活性的分子集合训练深度神经网络,该算法无需对药物进行标记,就可以分析化合物的分子结构并筛选潜在的抗生素。研究人员利用该算法筛选出的抗生素Halicin,与传统抗生素结构不同,显示出对包括结核分枝杆菌和碳青霉烯类耐药肠杆菌科在内的广泛病原菌系统发育谱的杀菌活性,并能有效治疗小鼠模型中难辨梭状芽孢杆菌和泛耐药鲍曼不动杆菌感染。Halicin是首次在没有任何人为假设的前提下,从零开始发现的全新抗生素[19]。印度TCS公司研发团队利用深度学习开发一种由图注意力网络和递归神经网络组合形成的条件生成模型,该模型利用图注意力网络学习活性位点的残基结构和相互作用,在药物靶向亲和力预测模型的指导下产生特定于靶向活性位点的小分子。研究人员在Janus激酶2(JAK2)和多巴胺受体D2(DRD2)上验证该方法,生成类似已知蛋白抑制剂的分子[20]。
2.3FBDD 1981年JENCKS等[21]提出FBDD技术的概念和理论框架,认为某个类药性分子可以视为两个或多个具有生物活性小分子碎片的叠加。FBDD是利用NMR、SPR、X-射线单晶衍射(X-ray)以及TSAs等方法筛选出与靶蛋白具有相互作用的小分子弱活性片段,然后基于其结构信息对活性片段进行优化,得到具有更高活性的先导化合物的方法。该技术主要包括片段库的构建、活性小片段的筛选、片段的结构优化等步骤。其中,在构建片段库阶段,ERLANSON等[22]在先导化合物设计类药“五原则”的基础上,提出构建片段库的“三法则”,即片段的分子量<300,脂水分配系数<3,氢键供体与受体的数量分别<3。除此之外,片段库的大小需要根据所选择的筛选方法进行考虑,例如采用NMR或X-ray时,片段库的大小通常为1×102~1×103;采用SPR时,因其具有高通量的特点,片段库大小可以达到1×105。片段的筛选是FBDD技术的核心,由于片段与靶点的结合作用较弱,因此需要高灵敏度和高稳定性的筛选方法检测,以满足所需的灵敏度和稳定性。随着技术的发展,微量热泳动、热迁移分析(TSAs)、弱亲和色谱等检测手段对NMR、SPR、X-ray等经典方法进行补充。通常经过筛选得到的初始片段活性很低,所以筛选后的关键是通过片段自组、片段连接或片段生长对片段进行结构优化,改善片段对靶标的选择性、生物利用度、生物转化等性质,使之成为候选药物,这也是FBDD技术最具挑战的环节[22]。
与HTS比较,FBDD有以下优点,一是收集、维护和筛选片段库比化合物库更加容易,且筛选包含几千个片段的片段库就可以达到筛选化合物库的效果,研发周期更短;二是具有更高的筛选命中率,可以实现对复杂靶标尤其涉及蛋白-蛋白相互作用靶点的处理;三是片段的尺寸小、溶解度高,通常具有更好的药物属性,后期易于结构优化,有潜力成为活性高、选择性高的药物分子。截至目前,共有4个获批上市的药物利用FBDD技术筛选得到,分别为治疗黑色素瘤的丝氨酸/苏氨酸蛋白激酶B-raf(BRAF)抑制剂维莫非尼(vemurafenib)、治疗慢性淋巴细胞白血病的B细胞淋巴瘤因子2(Bcl-2)抑制剂维奈克拉(venetoclax)、治疗尿路上皮癌的成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)抑制剂厄达替尼(erdafitinib)、治疗腱鞘巨细胞瘤的集落刺激因子1/干细胞因子受体(CSF1R/cKit)抑制剂Pexidartinib,其中维莫非尼从片段筛选到获批上市仅用6年时间[23-24]。该技术同样具有一定的局限性,如技术门槛要求较高,需要有较好的片段储备,且很大程度依赖于靶蛋白的三维结构信息,对纯化蛋白的需求量较大,片段经过结构优化后得到的先导化合物可能与片段分子结合位点不同,对筛选所需检测手段的灵敏度要求较高。
各研发团队仍在积极开展相关研究工作。上海科技大学和复旦大学研究人员构建一种基于亲和质谱的FBDD筛选技术,与基于SPR或NMR的FBDD比较,该技术通过使用亲和质谱富集特定结合物,可减少2~4倍目标蛋白质和片段库化合物的使用量,分析速度可以提高2~3倍。研究人员利用该技术成功筛选到一种潜在的GPCR负变构调节剂Fg754,Fg754能够与钠离子变构位点特异性结合,且结合模式不同于已知的负变构调节剂[25]。印度昌迪加尔医学教育研究所研究人员以新冠病毒Mpro为靶点,利用FBDD技术对一个含有约20万化合物片段的片段库进行筛选,并将任何与相邻子口袋具有高亲和力的片段进行连接,最终得到17个与Mpro关键结合位点具有较高结合活性的分子,为新冠病毒候选药物研发提供更多选择[26]。
2.4DEL DEL技术是一项基于组合化学和DNA技术的药物筛选方法,于1992年由美国Sydney Brenner和Richard Lerner提出,主要包括DNA编码化合物库的构建、DEL筛选以及先导化合物的产生等步骤[27]。该技术首先将每个化合物与一段特定的DNA分子序列进行连接,进行DNA编码,用作可扩增的识别条形码,构建经DNA编码的化合物库;然后将活性靶蛋白和经DNA编码的化合物库进行亲和筛选,洗脱除去与靶蛋白亲和力弱或不结合的化合物,得到亲和力强的化合物集合;由于化合物与DNA编码信息一一对应,筛选完成后利用高通量测序对筛选出化合物连接的DNA序列进行识别,确定编码对应的化合物分子;最后重新合成不带DNA标签的化合物进行活性验证及结构优化,得到先导化合物[28]。
DEL技术使用DNA标签作为条形码,可构建和筛选规模达几百万至数十亿种化合物的化学文库,具有库容量巨大、分子多样性好、对靶标蛋白需求量少等优点,DEL技术并非传统的一对一筛选,是将靶蛋白和整个编码化合物库同时孵育,具有显著的时间和成本优势,筛选周期为3~6个月,每个化合物筛选成本平均0.002美元。但DEL技术要求较高,暂无利用该技术获批上市的药物,且大体积的DNA编码标签以及组合化学在一定程度上增加筛选的复杂性和不确定性,需要进一步开发和优化与DNA相容的化学反应以保持化合物的类药性和库的纯度。此外,该技术的筛选对象主要针对纯化的生物靶点,对于难以表达的靶点或者活细胞体系等功能性靶点筛选较为困难[28-29]。
目前,DEL技术已被国内外制药公司广泛应用,成为筛选先导化合物的重要手段,国内外DEL技术较为成熟的公司有4家,分别为英国葛兰素史克公司(GSK)、美国X-Chem公司、成都先导公司和丹麦Nuevolution公司。其中,GSK是对DEL技术应用最为成熟的企业,DEL库达几十亿量级,分子库筛选的靶点种类繁多,几乎涵盖所有疾病类型,但其DEL库的化学结构类型只有一种,为三嗪类杂环化合物,其技术仅供自用。GSK已有3个在研药物处于Ⅱ期临床试验阶段,分别为用于治疗糖尿病或心脑血管疾病等的可溶性环氧化物水解酶抑制剂GSK2256294、用于治疗银屑病或类风湿关节炎以及溃疡性结肠炎的ATP竞争型受体相互作用蛋白1(RIP1)抑制剂GSK2982772、用于治疗胰腺癌的RIP1抑制剂GSK3145095,其中GSK2256294是第一个由DEL技术发现并进入临床试验的小分子化合物[30]。成都先导公司是国内首个开展DEL研究的制药公司,目前已建立一个基于DEL的早期药物开发平台,该DEL库分子数量已超过1.2万亿,合成分子骨架的种类超过6 000种,已有3个在研药物进入临床试验阶段,分别为用于治疗骨髓瘤或实体瘤的组蛋白去乙酰化酶(HDAC)抑制剂HG146、用于治疗晚期实体瘤的STING激动剂HG381、用于治疗具有神经营养受体酪氨酸激酶(NTRK)或C-ROS原癌基因1酪氨酸激酶(ROS1)基因融合的原肌球蛋白受体激酶(TRK)抑制剂HG030。美国贝勒医学院和德克萨斯儿童医院研究人员致力于筛选人类蛋白溴域和末端外亚群(BET)中第一个溴域(BD1)的特异性抑制剂,BD1是癌症等疾病的潜在靶标。该团队利用DEL技术,在一个试管中同时对40亿个DNA编码分子进行筛选,得到对BD1具有高度选择性的化合物CDD-724,该化合物抑制BD1的能力约是抑制其他人类溴化结构域的2 000倍[31]。
2.5PROTAC PROTAC是将靶向蛋白募集到E3泛素连接酶进行泛素化标记,然后通过泛素-蛋白酶体系统(UPS)将其降解的新型药物分子体系的方法。UPS是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解。该系统由泛素(Ub)、3种泛素化酶(泛素活化酶E1,泛素结合酶E2s,泛素连接酶E3s)、蛋白酶体及其底物蛋白质等构成,在ATP供能的情况下,蛋白通过一系列酶的作用,被标记上多泛素化并转移到蛋白酶体内进行降解。PROTAC就是利用UPS原理设计的一种双功能小分子,由3部分构成,中间的连接体(Linker)一端连接可靶向目标蛋白的配体,另一端连接E3泛素连接酶配体分子,利用UPS识别、结合并降解疾病相关的靶蛋白[32]。该技术是一种全新药物设计策略,理论上可以将任何过表达和突变的致病蛋白清除,达到治疗疾病的目的[33]。PROTAC的发展经历了第1代基于多肽片段的设计,到2008年开始的第2代小分子PROTAC设计,降解的靶蛋白包括甲硫氨酰氨肽酶2、雄激素受体、细胞视黄酸结合蛋白、雌激素受体、Tau微管相关蛋白、激酶类等,涉及的疾病包括癌症、类风湿疾病、神经退行性疾病等[32]。
基于作用机制,PROTAC主要有以下优点:一是PROTAC分子不直接抑制靶蛋白的功能活性,不需要与靶蛋白发生长时间和高强度的结合,可以靶向转录因子、支架蛋白和非酶蛋白等对于传统小分子药物“无成药性”的蛋白;二是相比于传统小分子药物的“占位驱动”模型,PROTAC分子属于“事件驱动”,只需要瞬态结合就可以直接催化降解靶蛋白,因此使用催化剂量即可发挥药物疗效,耐药性更低;三是由于靶蛋白与E3泛素连接酶之间的协同作用,PROTAC分子具有更高的选择性。尽管PROTAC技术从肽到全小分子有了显著的提升,但是与传统的小分子药物相比,PROTAC分子作为三元复合物,分子量较大,提高水溶性、稳定性、口服生物利用度、血管穿透能力等需进一步研究。此外,由于泛素化标记不仅涉及到蛋白质的降解,还关系到甲基化、乙酰化、磷酸化等过程以及DNA,其脱靶毒性仍是目前面临的难题[6,32]。
PROTAC作为一种新兴的小分子药物研究领域,吸引了众多制药企业和学术机构开展研究。创立于2013年的美国Arvinas公司是该领域的领头羊,研发管线主要包括抗肿瘤药物和神经疾病药物,目前共有Bavdegalutamide(ARV-110)、ARV-471、ARV-766三款候选药物处于临床阶段。其中,Bavdegalutamide选择性靶向降解雄激素受体(androgen receptor,AR),主要用于治疗转移性趋势抵抗性前列腺癌(mCRPC),是全球首个进入临床试验的口服PRAOTC小分子药物,目前处于Ⅱ期临床试验阶段。2022年2月,Arvinas公布的Ⅱ期临床试验结果显示,Bavdegalutamide展现出持续抗肿瘤活性和患者获益证据,在携带AR T878X/H875Y突变的肿瘤患者中,可以使46%患者的前列腺特异性抗原(prostatic specific antigen,PSA)水平降低≥50%。ARV-471靶向雌激素受体(estrogen receptor,ER),用于治疗ER阳性/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性(ER+/HER2-)的乳腺癌,于2022年12月启动Ⅲ期临床试验,是目前研究进展最快的PRAOTC分子。2022年11月,公布的Ⅱ期临床试验初步结果显示,ARV-471具有良好的耐受性,显示出38%的临床获益率(CBR:确认完全缓解率、确认部分缓解率或疾病稳定率>24周),对于ESR1突变患者,CBR为51.2%[34]。国内多家药企也在积极开展相关研究,如海思科公司的HSK29116、开拓药业的GT20029、百济神州公司的BGB-16673等均处于Ⅰ期临床试验阶段;珃诺生物公司的RNK05047处于Ⅰ/Ⅱ期临床试验阶段,于2022年8月在美国完成首例患者给药。上述不同技术优劣势比较见表1。
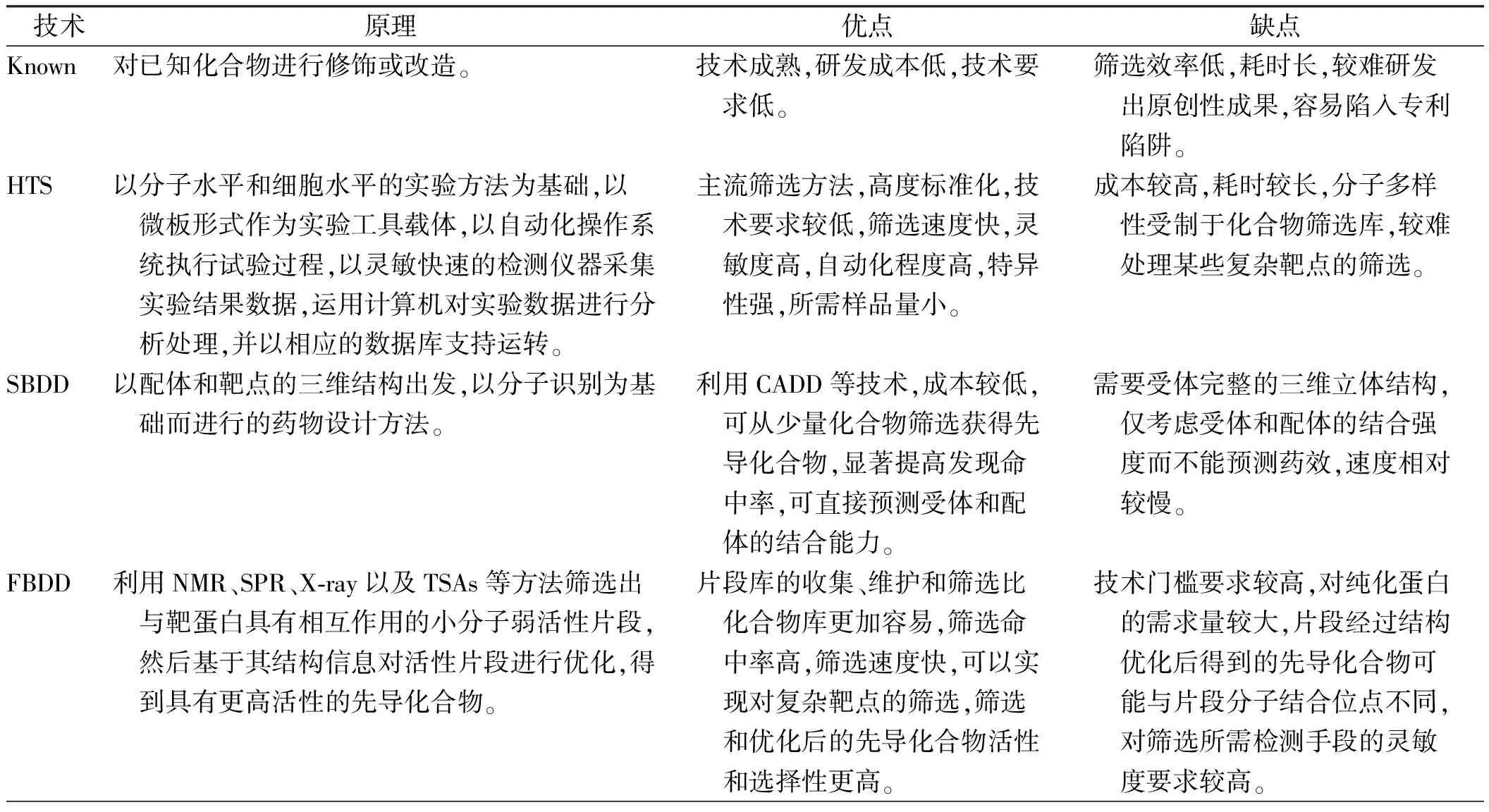
表1 不同小分子药物筛选技术对比
3 展望
随着生物技术的飞速发展,以重组蛋白质药物、治疗性抗体、基因治疗、干细胞治疗等为代表的生物技术药物成为新药研发的热点,小分子药物受到一定冲击,小分子药物分子类型和多样性的增速降低。但是,小分子药物作为最传统的药物形式,以其难以替代的优势,仍是药物研发领域的重要组成部分。通过对上述小分子药物筛选技术的发展现状分析可以发现,美国是该领域的领头羊,我国虽然在相关领域取得了一定进展,但仍落后于美国。因此,一是要以全面提升我国药物研发创新能力为导向,持续加强基础研究,积累原创性成果,提高源头创新力。二是要以更好的解决小分子药物研发过程中的共性问题为牵引,对于人工智能药物设计技术、智能药物制备技术、氘代药物开发技术等能够优化我国新药创制体系的关键共性技术,加强集中攻关,促进我国制药产业转型升级。三是要以直击现阶段小分子药物研发的痛点为目的,对于DEL、PROTAC、小分子辅助受体靶向技术等具有前瞻性、先导性和一定探索性的前沿引领技术,要提前优先布局,并不断将变革性新技术应用于小分子药物的研发,为生物医药产业发展注入新动力,为未来新药创制领域技术更新换代和新兴产业的发展奠定基础。
