蟛蜞菊内酯通过PI3K/Akt/mTOR信号通路对人脐静脉内皮细胞氧化损伤的影响*
2024-01-31刘素连谢凯叶冬宁李汶静陈杰许静
刘素连,谢凯,叶冬宁,李汶静,陈杰,许静
(1.南方医科大学皮肤病医院药剂科,广州 510091;2.中山大学附属第一医院药学部,广州 510080)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病,主要有氧化损伤、氧化应激等病理过程,不良反应事件风险增加[1]。近年来,已发现自噬与AS密切相关[2]。适度的自噬对AS具有保护作用,细胞通过自噬降解细胞内受损的结构[3],使其能够适应氧化应激等环境,防止细胞凋亡和坏死[4]。但过度的自噬活动可能引起细胞死亡,称为自噬性细胞死亡,也称为Ⅱ型程序性死亡[5]。PI3K/Akt/mTOR是一条参与调节细胞重要生理过程的经典信号通路[6],同样是一条重要的抗自噬通路。研究发现,通过Ⅲ类PI3K/Beclin-1和Ⅰ类PI3K/Akt通路过表达自噬相关基因LC3Ⅱ以减少ox-LDL诱导的内皮细胞损伤和凋亡[7]。蟛蜞菊内酯(wedelolactone,WEL)[8]为墨旱莲主要成分之一,能抗炎、降脂和保护内皮细胞等药理作用[9-10]。近年来,WEL因广泛的药理作用而引起关注[4]。笔者前期研究发现WEL可以抑制脂多糖(LPS)所致的RAW264.7细胞生成白细胞介素(interleukin,IL)-6、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等炎性细胞因子,并能抑制肝纤维化,呈现较好的护肝作用[11]。另外,WEL对过氧化氢(hydrogen peroxide,H2O2)诱导人冠状动脉内皮细胞氧化损伤有保护作用。但其是否通过调节自噬抑制动脉粥样硬化内皮细胞损伤发生发展尚不清楚。笔者基于PI3K/Akt/mTOR 信号通路研究WEL对人主动脉内皮细胞自噬的作用,为临床治疗AS提供理论参考。
1 材料与方法
1.1材料
1.1.1细胞株 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)(武汉普诺赛生命科技有限公司,货号:CP-H082)。
1.1.2药物与试剂 WEL(美国TargetMol,批号:T3384,含量:99.4%);内皮细胞培养基ECM(Sciencell,批号:1001);噻唑蓝(MTT)检测试剂盒(碧云天,批号:C0009S);BCA蛋白含量检测试剂盒(碧云天,批号:P0012S);Ad-mcherry-p62(碧云天,批号:C3016)。β-actin抗体(批号:AF7018),Bcl-2抗体(批号:AF6139),BAX抗体(AF0120),PI3K抗体(AF6241),p-PI3K抗体(批号:AF3241),Akt抗体(批号:AF6259),p-Akt抗体(批号:AF0016),mTOR抗体(批号:AF6308),p-mTOR抗体(批号:AF3308)均购自Affinity公司;SOD1抗体(Cell Signaling Technology,批号:2770S)辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天,批号:A0208);C11-BODIPY 581/591(ABclonal,批号:RM02821)。
1.1.3仪器 全自动倒置荧光显微镜(德国Leica公司,型号:Dmi8);电泳和电转系统、ChemiDoc Touch化学发光成像系统、Multiskan MK3型酶标仪(美国Bio-Rad公司)。
1.2方法
1.2.1HUVECs细胞培养及传代 HUVECs使用ECM完全培养基培养,每500 mL ECM培养基含FBS25 mL、P/S 5 mL、ECGs 5 mL,于37 ℃、5%二氧化碳(CO2)培养箱中培养。
1.2.2HUVECs氧化损伤模型制备 参照文献[12]。取对数生长期的HUVECs细胞,0.25%胰酶消化后,将细胞数量调整至1×106个·mL-1,贴壁生长至70%,进行下一步实验。设置分组为正常对照组:正常培养;溶媒对照组:0.1%二甲亚砜(dimethyl sulfoxide,DMSO)培养;H2O2组:200 μmol·L-1H2O2;WEL小、中、大剂量组(10,20,40 μmol·L-1)与200 μmol·L-1H2O2共处理HUVECs细胞24 h,根据MTT检测结果最终选取20 μmol·L-1WEL进行后续实验。
1.2.3MTT检测HUVECs细胞存活率 给药前1 d,取对数生长期的HUVECs细胞,用ECM完全培养基配成单个细胞悬液,以每孔3 000个接种到96孔板中,置于37 ℃、5% CO2细胞培养箱中继续培养。H2O2及WEL处理24 h后,加入5 mg·mL-1MTT溶液10 μL,37 ℃孵育4 h,弃上清液。每孔DMSO 150 μL,摇床低速振摇10 min,多功能酶标仪波长570 nm测定吸光度(A)值。
1.2.4Ad-mCherry-p62腺病毒检测细胞自噬情况 6孔板接种HUVECs细胞,分为3组。对照组,H2O2组:200 μmol·L-1H2O2处理24 h,WEL组:200 μmol·L-1H2O2+ 20 μmol·L-1WEL,处理24 h。将Ad-mCherry-p62腺病毒置于冰上解冻,并计算感染复数(multiplicity of infection,MOI)为20的病毒量。从培养箱取出细胞,弃培养基,每孔加入新鲜ECM 1.2 mL,并加入MOI为20值的病毒液。Ad-mCherry-p62腺病毒感染24 h后,除去含有病毒的培养基,每孔加入新鲜ECM 2 mL,继续观察24 h。感染48 h,除去培养基,Hoechst33258染色液加入0.5 mL,孵育5 min,磷酸盐缓冲液(phosphate buffer solution,PBS)洗2次×3 min,荧光显微镜下观察p62的表达情况。
1.2.5ROS的检测 将1 mg C11 BODIPY 581/591溶于DMSO 198.2 μL中,制备10 mmol·L-1的C11 BODIPY 581/591储存液。取生长状态良好的细胞,胰酶消化后使用血细胞计数板计数,将细胞接种到6孔板中,经H2O2或WEL给药对应时间后加入终浓度为10 μmol·L-1的C11 BODIPY 581/591适量,避光孵育1 h。用PBS清洗细胞2次以除去多余的染料。细胞用0.25%胰酶消化,每孔加入培养基1 mL终止消化。细胞悬液收集至15 mL离心管中,室温,1 000 r·min-1,离心3 min,离心后弃上清液,细胞团重悬在5%FBS的PBS中,注意避光。利用流式细胞仪检测ROS荧光探针的荧光值,再用波长488 nm激光器激发,在FL1通道测量505~550 nm对应的信号,在FL2通道测量波长>580 nm的信号。根据流式细胞仪FL1和FL2通道信号分别制作直方图,根据直方图荧光信号算数平均值±SEM,来量化脂质过氧化细胞比例。
1.2.6免疫印迹(Western blotting)法检测蛋白表达水平 提取细胞总蛋白,BCA法定量蛋白含量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,5% BSA室温封闭1 h,加入一抗4 ℃孵育过夜,洗涤3次后加入二抗,室温孵育1 h。电致化学发光(electrochemiluminescence,ECL)发光液显影。
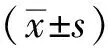
2 结果
2.1WEL对HUVECs细胞氧化应激损伤的影响 与对照组比较,H2O2组细胞存活率下降,差异有统计学意义(P<0.05),说明H2O2对HUVECs增殖具有抑制作用。与H2O2组比较,WEL小、中、大剂量组细胞存活率明显升高,差异有统计学意义(P<0.05),说明WEL对HUVECs的氧化损伤有较好的保护作用,见图1。综合比较选择20 μmol·L-1进行后续实验。

A.正常对照组;B.DMSO组;C.H2O2组;D.WEL小剂量组;E.WEL中剂量组组;F.WEL大剂量组。①与正常对照组比较,t=9.686,P<0.05;②与H2O2组比较,t=3.091,10.09,6.851,P<0.01。
2.2WEL抑制人脐静脉内皮细胞自噬 用Ad-mCherry-p62腺病毒感染细胞后,细胞质和细胞核中通常存在红色点状或较为弥散的斑块状荧光。在自噬被抑制的情况下,红色点状或斑块状变大,而且数目会变多。荧光检测结果显示,与对照组比较,p62蛋白在200 μmol·L-1的H2O2诱导24 h后表达下调,红色点状变小且数目明显减少,而使用WEL进行干预后,斑块状红色荧光分布增多,说明H2O2诱导的HUVECs细胞自噬可以被WEL抑制(图2)。

A.对照组;B.H2O2组;C.WEL组;①与对照组比较,t=4.355,P<0.05;②与H2O2组比较,t=5.183,P<0.01。
2.3WEL对HUVECs氧化应激指标的影响 流式检测 C11-BODIPY 581/591的平均荧光强度,结果显示,与对照组比较,H2O2组ROS显著增加,差异有统计学意义;与H2O2组比较,WEL组ROS减少,提示WEL干预可以减少ROS的产生,缓解细胞产生氧化应激反应(图3)。
超氧化物歧化酶(superoxide dismutase,SOD)是细胞内天然的抗氧化酶,对维持细胞氧化还原平衡具有重要作用[13]。为了确定WEL对H2O2诱导的HUVECs细胞有抗氧化特性,检测抗氧化应激保护因子SOD酶的活性。图3结果表明,WEL处理显著抑制H2O2诱导的HUVECs细胞中SOD1活性的降低。H2O2显著增强细胞ROS生成,减弱细胞抗氧化能力,表现为SOD1蛋白表达降低,WEL处理可以阻断H2O2诱导的HUVECs细胞,发挥抗氧化作用。
2.4WEL对HUVECs凋亡相关蛋白表达的影响 HUVECs在200 μmol·L-1的H2O2诱导24 h后,检测凋亡相关蛋白BAX、Bcl-2及Caspase3的表达情况,结果见图4。与对照组比较,H2O2组BAX蛋白的表达上调,而Bcl-2蛋白下调;与H2O2组比较,WEL组BAX蛋白表达下调,而Bcl-2蛋白上调,且各组之间BAX/Bcl-2的值差异有统计学意义(F=8.855,P<0.05)。结果提示,WEL能抑制H2O2致HUVECs细胞凋亡,发挥细胞保护作用。
2.5WEL对H2O2刺激的HUVECs细胞中p-I3K、p-Akt、p-mTOR蛋白表达的影响 Western blotting实验结果见图5。与对照组比较,H2O2组p-PI3K、p-Akt、p-mTOR蛋白表达水平明显减少(P<0.01);与H2O2组比较,WEL组中p-PI3K(Tyr607)、p-Akt(Ser473)、p-mTOR(Ser2448)蛋白表达水平显著增加(P<0.01),mTOR蛋白在各组表达水平无明显变化。结果提示,WEL能抑制H2O2致HUVECs细胞自噬作用。
3 讨论
3.1WEL拮抗H2O2诱导的细胞凋亡 Caspase-3 是细胞凋亡早期阶段激活的关键蛋白,抑制caspase-3 蛋白的表达,提示细胞凋亡被抑制。因此,caspase-3的激活可以作为判断细胞凋亡严重性的关键指标之一[14-15]。研究表明,使用红景天中提取的生物活性化合物红景天苷对脂多糖诱导的HUVECs细胞损伤具有保护作用,红景天苷可以增加HUVECs中SOD的活性,及抑制caspase-3的活性发挥作用[16]。Bcl-2基因具有抑制凋亡的作用,BAX则为Bcl-2家族中细胞凋亡促进基因。Bcl-2可与BAX形成同源的蛋白二聚体作为细胞死亡信号通路的分子开关。本研究结果显示,与模型组比较,WEL组HUVECs细胞caspase-3 蛋白表达显著下调,另外WEL组可使BAX蛋白表达下调而Bcl-2蛋白上调,进而降低BAX/Bcl-2的比值。以上结果提示WEL可以抑制HUVECs细胞凋亡,对H2O2诱导的HUVECs细胞损伤具有保护作用。
3.2WEL抑制人脐静脉内皮细胞自噬 细胞自噬是真核细胞通过自噬相关基因调控,利用溶酶体降解自身细胞蛋白和受损细胞器的过程。自噬分为正常生理条件下的基础型自噬和应激条件下的诱导型自噬,前者对细胞氧化损伤具有保护作用,但过度的自噬可以导致代谢应激、降解细胞成分,甚至引起细胞死亡等[17]。在饥饿、缺氧和营养缺乏等应激条件下,PI3K/AKT信号通路通过介导内皮细胞中mTOR的表达来负调控自噬[18]。研究表明,足够的内皮细胞自噬通量通过防止内皮细胞凋亡、衰老和炎症以限制动脉粥样硬化斑块的形成[19]。一方面,自噬的过度激活可导致内皮细胞死亡和斑块失稳[20]。本研究结果发现,与对照组比较,p62蛋白在200 μmol·L-1H2O2诱导24 h后表达下调,红色点状变小且数目明显减少,而使用WEL进行干预后,斑块状红色荧光分布增多,说明H2O2诱导的HUVECs细胞自噬可以被WEL抑制。
mTOR通过磷酸化使形成的自噬调节复合物失活,进而影响自噬小体的形成。PI3K/Akt下游靶点是mTOR,而mTOR的下游转录因子则包括了HIF-1α、c-MYC、FoxO等明星分子,mTOR信号通路对细胞的生长、增殖、分化和凋亡等生理过程具有中心调控的作用,是细胞内一个重要的信号途径。在缺血缺氧等饥饿状态下,自噬的发生主要由mTOR通路调控。缺氧的信号使mTOR信号通路失活,从而引起自噬信号通路的激活。雷帕霉素是mTOR通路的抑制剂,可抑制mTOR 的磷酸化,诱导和促进细胞自噬的发生[21]。许多证据表明 mTOR是自噬关键调节剂,为调控自噬极具潜力的靶标[22]。因此,本研究Western blotting实验结果中显示,与对照组比较,H2O2组p-Akt、p-PI3K蛋白表达量下降。结果表明H2O2会抑制PI3K、Akt的磷酸化,诱导自噬。而加入WEL后,可诱导 PI3K与生长因子受体结合,可使Akt的蛋白结构改变并使其活化,以磷酸化作用抑制下游一系列底物如凋亡相关蛋白活性,减少细胞凋亡,减少氧化应激损伤。WEL组p-Akt表达升高,活化mTOR,抑制自噬,从而抵抗HUVECs细胞氧化应激损伤[10]。
综上所述,WEL可以抑制H2O2引起的内皮细胞损伤,其作用机制可能与PI3K/Akt/mTOR 信号通路抑制细胞自噬有关。尚需要进行深入研究,对以上问题作进一步探讨,寻找WEL可能的药物靶点,缓解氧化应激损伤,为相关疾病的预防和治疗开创未来。
