斑块内新生血管分级与颈动脉粥样硬化程度相关性的新进展
2024-01-31范佳煜董亚男竹综述王丽娟审校
范佳煜, 董亚男, 白 竹综述, 陈 盈, 王丽娟审校
严重的颈动脉粥样硬化是导致缺血性事件发生的重要危险因素[1]。斑块负荷和颈动脉狭窄均与缺血性事件的发生密切相关,除了斑块负荷和颈动脉狭窄外,颈动脉斑块内成分与缺血性事件的发生也有关系[2]。斑块内出血(intraplaque hemorrhage,IPH)、斑块内新生血管(intraplaque neovascularization,IPN)作为易损斑块重要的形态学特征,既往文献证实了IPH 在颈动脉粥样硬化疾病中起着至关重要的作用,IPH 使动脉管腔狭窄进展更快[3,4]。IPN作为易损斑块的另一个重要的组成成分,越来越多的证据表明,IPN 旨在向斑块壁内的组织提供营养,IPN 的形成似乎更有助于动脉粥样硬化斑块的发展[5,6]。因此,本文将重点关注IPN 分级与颈部动脉粥样硬化程度的关系。
1 斑块内组成成分参与动脉粥样硬化的形成
1.1 斑块内出血通过扩张坏死核心参与动脉粥样斑块进展 斑块内出血(intraplaque hemorrhage,IPH)是易损斑块的一个重要特征,也是缺血性事件发生的一个重要风险因素[7]。既往病理学研究证实IPH 与缺血性事件的发生的关系相较于其他斑块内成分更密切[8]。IPH 是稳定斑块向不稳定斑块过渡的重要驱动因素,其中涉及多种机制。斑块进展过程中,在缺氧或各种炎症因素刺激下,IPH 由不稳定的斑块内新生的微小血管破裂形成。管腔内血液通过斑块表面破裂处渗漏到斑块内部,也可作为IPH 的来源[9]。IPH 被认为是动脉粥样硬化斑块微血管中红细胞渗漏的结果,红细胞渗漏的过程将巨噬细胞吸引到斑块中,斑块内微环境会再次触发新的未成熟IPN 的形成[10]。动脉粥样硬化斑块中的脂质能够与血红蛋白相互作用,增强斑块中的氧化能力导致IPN 损伤。红细胞膜中含有更多的游离胆固醇,因此IPH 是晚期坏死核心中游离胆固醇的主要来源,IPH 通过扩张坏死核心促进游离胆固醇的沉积,游离胆固醇为红细胞沉积提供条件,进而引起斑块基质的快速变化来破坏动脉粥样斑块的稳定。斑块生长和斑块微血管密度增加又会增加进一步出血的风险。此外,由白细胞和血小板驱动的IPH 可触发各种氧化及炎症反应,促进斑块事件的发生[11-14]。总之,IPH 通过扩张坏死核心改变斑块内微环境来破坏颈动脉粥样硬化斑块的稳定。
1.2 斑块内新生血管在缺氧及炎症刺激下破裂形成斑块内出血促进斑块生长 斑块内新生血管(intraplaque neovascularization,IPN)是易损斑块的一个重要的组织学特征,与动脉粥样硬化斑块发展密切相关[15,16]。IPN 在斑块的生长和脆弱性中起着至关重要的作用,是斑块破裂最有力的独立预测因子[17]。IPN 是斑块生长趋于破裂的重要刺激因素,而坏死核心的微环境是IPN 生长的主要触发因素。IPN 主要特征为基底膜不连续和内皮细胞间的紧密连接较少,结构完整性受损表现脆弱。因此极易受到循环细胞渗漏的影响。IPN 渗漏是炎症细胞进入斑块组织的途径,血管炎症在诱导IPH 和炎症细胞募集起主要作用,由此形成了恶性循环[18]。动脉粥样硬化导致脂质沉积,巨噬细胞吞噬脂质以及渗漏的红细胞可能导致胆固醇进一步沉积,在缺氧条件下有助于坏死核心的产生,与持续流入的白细胞相结合,促进内膜扩张和IPN 生长,最终斑块稳定性下降从而导致IPH[19,20]。生长中的动脉粥样硬化斑块一方面由于脂质和炎症细胞的积聚,增加斑块组织对氧气需求量,另一方面对氧气及营养物质需求量增加诱导产生IPN;缺氧产生诱导因子调控血管生成,同时刺激动脉粥样硬化斑块生长[21]。IPN 在动脉粥样斑块形成与生长的过程中发挥至关重要的作用。因此,我们有必要关注IPN 来了解颈动脉粥样硬化严重程度。
2 斑块内新生血管的检测方法
2.1 对比增强超声造影用于评估斑块内新生血管 对比增强超声造影(contrast-enhanced ultrasound,CEUS)具有较高的时空分辨率,能够实时评估组织微血管系统的动态时空异质性,将微血管系统血流可视化处理。CEUS 中常用的造影剂为六氟化硫,使用的造影剂是比红细胞小且直径为1~4 μm的充气微球,造影剂由微气泡组成,微气泡由脂质和气体核心组成,它们是超声信号的强反射物。因此在静脉注射造影剂后,可以获得血管造影术样图像。CEUS 血管内造影剂与普通超声结合使用可以改善血管系统的图像描绘,它们是真正的血管内示踪剂,可直接显示出颈动脉IPN[22,23]。获取的视频图像存储在超声系统的硬盘上,然后将存储的CEUS 视频图像转移到工作站并进行分析,对颈动脉CEUS 对比增强后IPN分级进行分析。
最近的一项研究证实了CEUS 上斑块增强的强度与IPN 的程度显著相关,Tan 等[24,25]证明了颈动脉斑块增强程度与斑块的组织学微血管密度密切相关。然而,CEUS 属于一项侵入性检查,需要静脉注射具有相关风险的造影剂,这一定程度上限制了其在临床实践中的使用[26]。
2.2 超微血管成像用于检测斑块内新生血管 超微血管成像(superb microvascular imaging,SMI)是一种新型多普勒超声技术,它可以仅抑制背景组织运动,通过先进的滤波算法从微小血管中提取流量信号来提供血管信息。因此,SMI 可以在没有造影剂的情况下实现斑块内微血管流动的可视化[27]。SMI 技术参数设置为1.5 的机械指数、40~50 fps 的帧速率、55~60 dB 的动态范围和1.0~2.0 cm/s的SMI 速度范围。SMI 分为彩色SMI 和单色SMI 视图模式,通常使用单色SMI 和双视图显示器并排显示斑块,并在整个斑块周围定位SMI 特异性理想区域,最后在单色SMI 模式下观察IPN。SMI 检测到的斑块内微血管血流(intraplaque microvascular flow,IMVF)按视觉分级如下:0 级,斑块内无IMVF 或IMVF 局限于邻近外膜;1 级,活动IMVF 位于斑块的外膜侧和肩部;2 级,IMVF 移到斑块核心或广泛IMVF[28](见图1)。
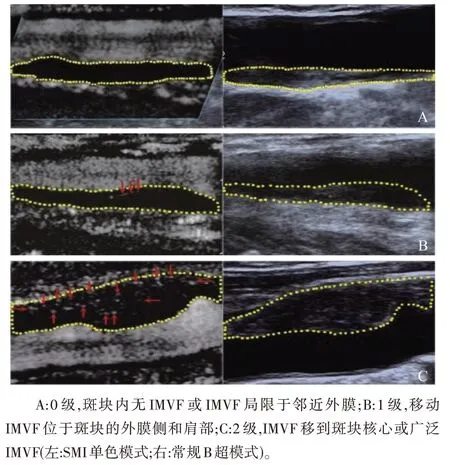
图1 超微血管成像检测到的斑块内新生血管等级的典型案例
在Oura 等[29]的研究中,对比CEUS 斑块增强的结果,所有12 例SMI 患者均检测到斑块内血流及增强斑块;然而,在15 例未检测到SMI 的患者中,有8例在CEUS 上显示出增强斑块。因此,SMI的特异性和灵敏度分别为100%和63%。在一篇Meta 分析中,纳入了10 项独立研究共评估了608 个颈动脉斑块,研究结果强烈表明SMI 和CEUS 在检测颈动脉IPN 方面表现出良好的一致性(Kappa=0.743,P<0.05)[26]。Zamani 等[30]证实了SMI 上IMVF 分级越高,与组织学评估中观察到的新生血管数量增加呈正相关(P=0.041,r=0.460),该研究在组织学上验证了SMI 评估IPN 的准确性与可靠性。SMI 作为一项新兴无创检查克服了传统技术的局限,可以使斑块内微血管血流(IMVF)信号可视化,可以通过SMI 探测的IPN来分析与颈部动脉粥样硬化程度的关系。
3 斑块内新生血管分级与颈动脉粥样硬化程度的相关性
IPN 分级与颈部血管动脉硬化程度具有显著的相关性,IPN 分级对颈部血管的动脉硬化程度有很好的指示作用。颈动脉粥样斑块破裂可以导致堵塞远端分支,造成严重的血栓栓塞事件。高风险狭窄斑块的特征为IPH 及大量炎症细胞,而炎症在斑块进展破裂中起着重要作用。丰富的IPN 似乎是维持局部炎症的重要机制,同时使斑块富含各种血源性成分,如红细胞和脂蛋白,这些成分也可以直接促进斑块炎症;此外,红细胞膜中游离胆固醇的积累可能会增加坏死核心的大小。因此研究表明,高密度IPN 与更高的动脉狭窄程度相关[31,32]。动脉粥样硬化环境刺激异常IPN 发育,从而使脂质核心扩张;同时IPN 为脂质渗入斑块内提供了通道,这可能导致斑块内脂质弧变大和脂质长度增加。IPN 引起局部胆固醇晶体形成,胆固醇晶体会破坏IPN,从而诱导脂质核心进一步扩张[33,34]。渗漏的IPN 引起白细胞和红细胞外渗,斑块中富含胆固醇的红细胞聚集也可能导致脂质池增大和核心坏死[35]。因此,IPN 作为斑块易损性的一个重要特征,在缺氧、炎症及其他因素下促进颈动脉粥样硬化斑块的进展。
4 斑块内新生血管分级评估动脉硬化程度的展望
本文综述关注了IPN 分级与颈部动脉粥样硬化间的相关性,颈动脉粥样硬化促进缺血性事件的发生,IPN 在颈动脉粥样硬化斑块形成过程中扮演着重要角色,评估IPN 分级可为颈部动脉粥样硬化严重程度的评估提供有价值的指导。SMI 和CEUS 均可评估IPN,然而CEUS 是一项需要注射造影剂的侵入性检查而限制了其在临床上的应用,SMI 是目前临床实践中评估IPN 有价值的一项检查,重要的是SMI 评估的斑块内微血管血流信号强度与组织学上观察到的新生血管数量密切相关。目前的研究多是评估颈部血管动脉硬化程度的单中心回顾性分析,未来可以联合分析冠脉及四肢大血管的情况,进行大样本多中心的临床研究,综合评估IPN 分级与全身动脉粥样硬化严重程度。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:范佳煜负责论文设计、撰写论文及修改;董亚男、白竹负责拟定写作思路、文献收集;陈盈、王丽娟负责指导撰写文章并最后定稿。
