脑神经血管功能体系及其评估方法的展望
2024-01-31张攀登王秋颖
刘 嘉, 张攀登, 刘 畅, 王秋颖, 高 峰
在人类身体的奇妙构造中,大脑展现了其卓越的神经血管功能体系,以满足脑细胞对能量代谢急迫需求的复杂要求。然而,尽管人脑的这一生理系统的精密性,目前的仪器设备却仅能单一地探测神经血管功能,导致对相关科学问题的碎片化认知,许多与神经血管疾病相关的问题仍然未得到解决。本文的目标在于审视在应对严重疾病时,脑血流自动调节功能、脑血管反应性功能、神经血管耦联功能以及自主神经功能等神经血管功能在其中扮演的角色,并探讨开发多功能、多范式、高分辨率的人体多模态跨尺度神经血管功能测量系统的可行性。这一探索将为深入研究脑血管病以及神经退行性疾病等重大神经血管疾病的新理论和新机制提供科学工具,推动我们对人脑神经血管系统的全面理解。
1 脑神经血管功能体系的构成
1.1 神经血管功能体系复杂精妙,孤立考虑体系中的某一种神经血管功能已不能满足科学研究需求,亟待研制能够全面评估神经血管功能体系的测量系统 大脑是人体能量代谢最活跃的器官,虽然大约只占体重的2%,却要消耗全身约20%的能量。与其他组织器官不同,大脑没有能量储备功能,因此,神经元等脑细胞需要从血液中不断获取足够的氧和葡萄糖[1]。另外,大脑的高度代谢活动会产生大量的代谢废物和毒素,需要不断地清除。所幸,人体有极为复杂精妙的神经血管功能体系,见图1,主要包括脑血流自动调节功能、脑血管反应性功能、神经血管耦联功能和自主神经功能,这些神经血管功能可以独立或者协同工作,在数秒钟内迅速作出反应,以应对各种变化无常的挑战[2]。
(1)脑血流自动调节功能(cerebral autoregulation,CA)。脑血管维持脑血流不受血压波动影响的生理机能[3]。例如,快速站立导致体直立性低血压脑供血不足导致晕眩或者短暂黑视(blackout),正常情况下,脑血管会迅速扩张降低阻力,使血流量快速回升。
(2)脑血管反应性功能(cerebrovascular reactivity, CVR)。脑血管对二氧化碳、氧等气体水平的变化做出的调节反应[2]。例如,过度通气(持续深呼吸)可导致头晕、眩晕和胸闷,这是因为血液二氧化碳分压下降同时氧分压上升,脑血管反应性功能导致血管收缩。
(3)神经血管耦联功能(neurovascular coupling,NVC)。当神经元的代谢需求增加时,微血管迅速扩张降低阻力,产生功能性充血,使之与神经元需求相匹配[4]。例如,当视神经受到刺激,位于顶枕叶的后部视觉皮质的血管舒张,产生局部功能性充血以满足视神经的代谢需求。
(4)自主神经功能(autonomic function,ANF)。自主神经功能主要由交感和副交感神经功能构成,二者共同作用可以调节血管管径,从而控制脑血流量。压力感受器敏感性(baroreflex sensitivity,BRS)也是反映交感神经对血压调控的指标[2]。例如,老龄人血压变异增加,往往是因为自主神经功能变弱,特别是副交感神经功能下降明显,无法有效地、及时地调节心率和血管。
无论是满足日常生活需求,还是应对脑血管病和神经退行性疾病等重大疾病的挑战,神经血管功能在维持大脑的能量代谢中都扮演着至关重要的角色。然而,目前仍然没有建立全面评估神经血管功能的方法,许多与之相关的科学问题悬而未决。例如,研究发现,在阿尔茨海默病和帕金森病等神经退行性疾病出现前脑血流就已经降低了,说明血管性因素可能是神经退行性疾病致病的“原因”。然而,另有研究发现,神经元突触功能受损可导致脑血流量下降并产生神经血管耦联功能障碍,此时血管性病变则是神经退行性疾病的“结果”[1]。这样就出现了一个矛盾的情况,到底是血管病变诱发了神经退行性疾病,还是神经性的病变导致了血管功能的损伤?2021 年,Javits 神经科学研究者奖(美国神经疾病及脑卒中研究院颁发)获得者Iadecola教授在神经科学领域顶级期刊Nature Neuroscience提出的新理论。他指出了传统“神经血管单元”(neurovascular unit)概念的局限性,这种单一局限的概念已经不能满足神经血管功能研究的需求,因而提出应全面考虑各种神经血管功能的“神经血管复合体”(neurovascular complex)新概念(见图2)[5,6]。若能明确神经血管功能在神经退行性疾病致病机制中扮演的角色,对于研究这类疾病的早期诊断和干预都具有极其重要的意义。近20年,仅阿尔茨海默病,就有约200种针对经典致病机制研发的药物宣告失败,因此无论是理论机制还是方法手段都亟待突破[16]。
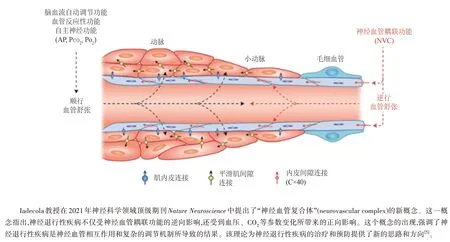
图2 神经血管复合体的概念图
事实上,针对单一神经血管功能,科研团队已经搭建或者建立了相应的评估方法。但是这些方法已经不能满足科学家对复杂精妙的神经血管功能的研究需求。近年来,越来越多的研究团队呼吁要将各种神经血管功能视为一个整体来研究[3,5,7-10]。因此,研究能够全面评估神经血管功能的方法是必要且迫切的。
1.2 医学成像技术不能满足全面评估神经血管功能体系的要求,研究多模态跨尺度测量技术融合是该困境的必要途径 因为神经血管功能的重要性极为突出,几乎所有模态的医学成像技术已经都被用于相关研究中。医学成像技术发展迅速,已经逐渐从结构成像拓展至功能成像。不仅可以观察全局脑血流量,还可以进一步探测局部脑区的血流量变化,实现神经血管耦联功能的评估。例如,在核医学成像技术中,单光子发射计算机断层成像(single photon emission computed tomography,SPECT)技术(SPECT 采用放射性药物,如99mTc)和正电子发射计算机断层成像技术(positron emission tomography,PET)(PET 采用放射性药物,如FDG-PET)可以测量神经递质受体、神经元代谢、脑血流量等参数反映神经血管耦联功能[11]。在核磁共振成像技术中,动态磁共振脑血流成像技术(arterial spin labeling magnetic resonance imaging,ASL-MRI)可以用于测定局部和全局的脑血流量。血氧水平依赖性功能磁共振成像(blood oxygen level dependent functional magnetic resonance imaging,BOLD-fMRI)技术对神经元活动导致血红素的氧化比率敏感,也可用于观察神经血管耦联功能和脑血管反应性功能[12]。在光学和超声成像技术中,功能近红外光谱成像(functional near-infrared spectroscopy, fNIRS)技术通过探测脑组织中的氧合血红蛋白和去氧血红蛋白的浓度变化,反映皮质脑血流变化情况[13]。功能经颅多普勒成像(functional transcranial doppler imaging,fTCD)通过超声多普勒信号探测颅内大动脉血流速度,反映大动脉脑血流变化情况等[14,15]。
然而,如图3 所示,既往研究表明,仅仅使用医学成像技术是不能全面探测神经血管功能的。因为部分神经血管功能(例如,脑血流自动调节功能和脑血管反应性功能)受到血压和二氧化碳(CO2)对脑血管的影响,因此还需要结合基于容积束定法(volume clamping method,VCM)连续血压和呼吸末二氧化碳(end tidal CO2,ETCO2)测量技术才能进一步完善对神经血管功能的评估。此外,神经血管反应还涉及信号传递时间、血管管径变化所需的时间以及心率变化的时间等一系列与时间相关的因素,因此,神经血管功能测量需要具备较高的时间分辨率。最后,神经血管功能测量还需要考虑多种实验范式场景,例如,神经血管耦联功能测量需要受试者配合完成特定实验范式(例如背单词、做数学题等),脑血管反应性功能需要受试者配合完成过度通气实验等,所以测量仪器的便携性、移动性和易用性也是必须考虑的因素。
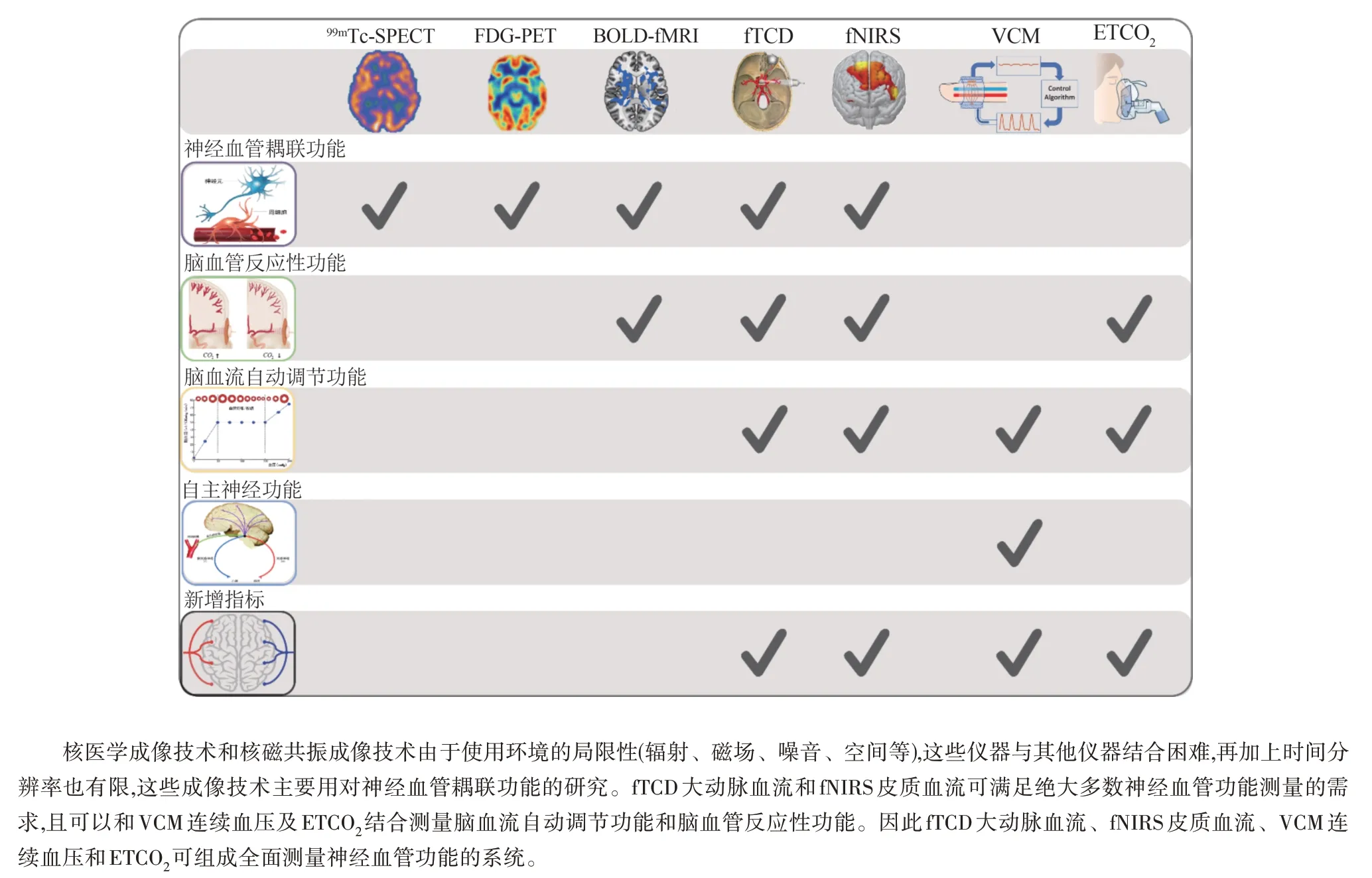
图3 神经血管复合体的概念图
综上所述(见图3、图4),fNIRS皮质血流和fTCD大动脉血流测量技术可以满足神经血管功能测量对脑血流探测的所有需求。这2 种技术可以分别对大血管和皮质微血管的血流进行探测,优势各异(fNIRS 皮质血流只能探测位于皮质的脑功能区,海马体、小脑、基底节等功能区的血流变化可以通过fTCD 大动脉血流反映)。因此,二者结合形成优势互补。VCM连续血压和ETCO2是满足神经血管功能测量的必要条件,因为血压和CO2对血管的影响非常显著。另外,这4 种测量技术都具有很好的便携性和移动性,可满足多种实验范式的需求。所以,融合fNIRS皮质血流、fTCD大动脉血流、VCM连续血压和ETCO24种模态技术,然后进一步拓展全局神经血管功能指标,才能为后续的科学研究提供更丰富的数据支持。
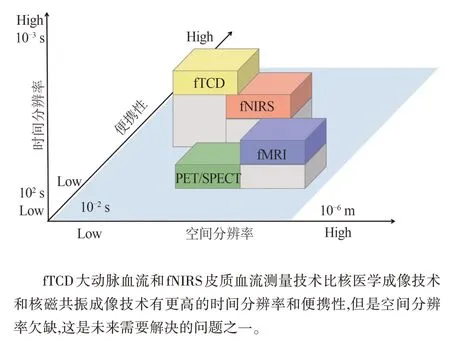
图4 神经血管功能测量技术的优势对比图
2 国内外研究现状和未来展望
2.1 全面测量神经血管功能是研究脑血管病和神经退行性疾病的必经之路 2014年,Willie等[8]发表综述论文,首次提出神经血管功能由3 个方面组成(见图5):(Ⅰ)神经代谢功能(作者将神经血管耦联功能和脑血管反应性功能归为一类);(Ⅱ)脑血流自动调节功能;(Ⅲ)自主神经功能。由于这些功能是通过微血管管径调节血流来实现。因此作者指出,研究神经血管功能不应该孤立地分析某一种功能,而应该分析血流调节是由哪些功能协同作用产生的,这样才能更准确地理解神经血管功能与相关疾病的病理生理机制。
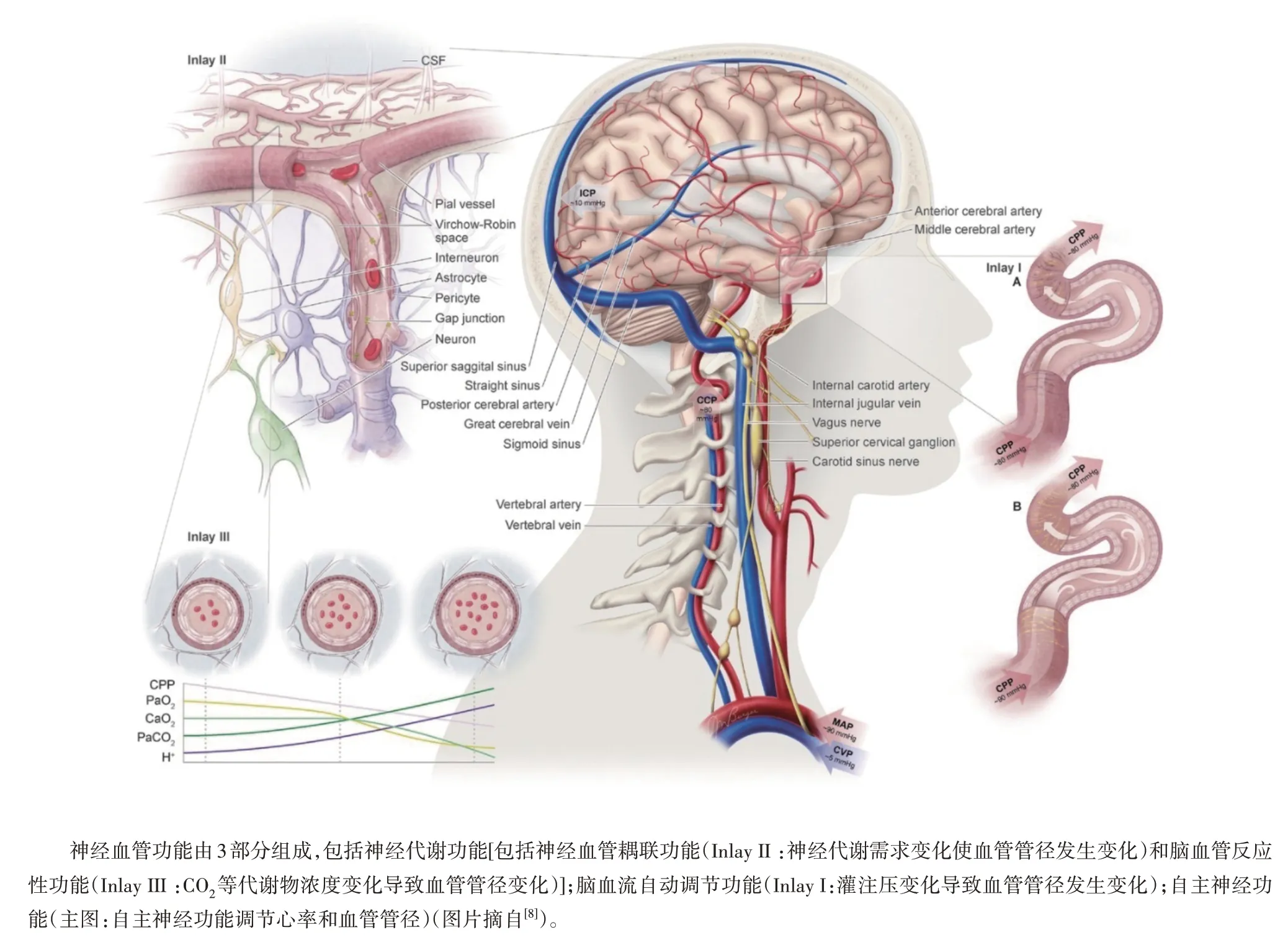
图5 神经血管功能分类
与神经血管功能最相关的疾病是脑卒中。脑卒中是一种严重的脑血管病,常常伴随神经功能损伤。脑卒中是世界范围内的重大疾病,对脑卒中的研究从未停歇,其中最突出的问题之一是脑卒中患者的血压管理。自2011 年起,国际上针对缺血性脑卒中和出血性脑卒中的降压治疗开展了一系列大型临床试验,包括针对缺血性卒中降压治疗的SCATST 研究、CATIS 研究、ENOS 研究、RIGHT-2 研究和ENCHANTED 研究,以及针对出血性卒中降压治疗的INTERACT2 研究和ATACHⅡ研究等[7]。超过2 万名脑卒中患者参与了这些研究,研究结果发表于Lancet、New England Journal of Medicine、JAMA等顶级临床医学期刊[17-20]。然而,至今我们仍不清楚如何降压才能使患者获益。基于这些研究,我们只知道降压不会增加患者的风险,但降压似乎也不能使患者获益。事实上,近年越来越多的研究呼吁针对脑卒中患者的血压管理应该全面地考虑神经血管功能[3,9,10]。然而非常遗憾的是,目前连一套可以全面测量神经血管功能的仪器都没有。科研人员缺乏这样的手段,没有办法开展相关研究,就无法阐明血压管理和神经血管功能之间的关系。
神经退行性疾病是更为棘手的重大疾病。众所周知,神经退行性疾病与脑血管疾病有很多共同的危险因素,如高血压、糖尿病、代谢综合征、高脂血症、高同型半胱氨酸血症、动脉粥样硬化等。近年来,越来越多的研究表明血管病变贯穿于神经退行性疾病致病及进展的整个过程。以阿尔茨海默病为例,局部微血管改变发生于神经退行性变和认知功能障碍之前,且局部脑血流量降低先于临床症状的现象已经大量研究证实,提示血管功能改变可能是阿尔茨海默病进展过程中的“催化剂”,参与其发生与发展。为此,Potamkin 奖获得者(痴呆研究领域最高级别的奖项)Zlokovic教授在神经科学领域顶级期刊Nature Review Neuroscience提出神经血管功能紧密作用的“血管双重打击”(vascular two-hit)假说,即血管病变促使神经退行性病变,然后二者又相互促进最终导致痴呆症[1]。虽然已经有越来越多的证据支持这一假说[4,21-24],但是目前还没有被证实。若能明确神经血管功能在神经退行性疾病致病机制中扮演的角色,对于研究这类疾病的早期诊断、靶点跟踪以及药物开发都具有极其重要的意义。
综上分析,对神经血管功能全面的测量评估是解决以上世界性难题的必经之路。因此,相关评估方法的研究是必要且迫切的。
2.2 我国建立多模态跨尺度脑神经血管评估方法的历史机遇 脑血管病和神经退行性疾病的发病率和死亡率呈上升趋势,是严重危害人类生命与健康的重大疾病。北京天坛医院的团队[25,26]、吉林大学第一医院团队[27-29]、北京协和医院团队[30]针对神经脑血管功能测量开展了一系列研究。由于神经血管功能的重要性,目前我国已经撰写了《缺血性卒中脑侧支循环评估与干预中国指南(2017)》[25]《动态脑血流自动调节功能评估在神经系统疾病中的临床应用专家共识(2021)》[27]。中国科学院深圳先进院团队参与撰写了国际专家共识《动态脑血流自动调节传递函数分析白皮2022 更新版》《Journal of Cerebral Blood Flow & Metabolism》[31]。
这些工作说明,无论是在中国还是在世界范围内,神经血管功能的在疾病发病机制和临床诊疗甚至预后康复所扮演的角色已经越来越重要。
另外,从前述分析来看,采用单一模态的测量技术对单一功能的探测已经无法满足科学家对复杂的脑血管和神经退行性疾病的研究需求。见图6,多模态跨尺度的测量技术将大幅度提升甚至颠覆人们对精妙的神经血管功能体系的认知。为实现这一目标,需要解决一系列材料科学、计算机视觉、人工智能、数学建模等核心科学技术问题。因此,研究团队需要在相关领域累积充分的技术实力,并针对目标把握历史机遇。

图6 多模态跨尺度脑神经血管评估方法的概念图
随着ChatGPT(chat generative pre-trained transformer,由美国OpenAI 开发的聊天机器人程序)在2022 年11 月问世,大数据、人工智能再次被推向科学技术的风口浪尖。未来科学家对疾病的认知也必将建立在多模态、长时程(或全生命周期)、多范式的人体医学数据基础上[32]。因此,未来开展基于多功能、小型化、轻量化仪器系统开展脑神经血管功能体系评估方法的研究具有重要的意义。
伦理学声明:本研究方案经由深圳市康宁医院伦理委员会初步审批(批号:2023-02-28-2),患者均签署知情同意书。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:刘嘉负责论文设计;刘畅负责撰写论文;张攀登负责实验操作、研究过程的实施;王秋颖负责数据收集、统计学分析、绘制图表;高峰负责文献收集;王秋颖负责论文修改;刘嘉、张攀登拟定写作思路、指导撰写文章并最后定稿。
