同种异体移植物炎性因子-1在糖尿病睾丸大鼠模型中的表达及意义
2024-01-30李德朝张明津蓝一笔马春雷付伟金
李德朝 张明津 蓝一笔 马春雷 付伟金
1贺州市中医医院泌尿外科(广西贺州 542899);2广西医科大学第一附属医院泌尿外科(南宁 530022)
糖尿病(diabetes mellitus,DM)是一种代谢性疾病,表现为全身内环境的血糖增高,可引起全身多个系统和器官发生病变[1],如糖尿病肾病(DKD)、糖尿病视网膜病变、糖尿病心肌病、糖尿病足溃疡等[2-4],严重影响患者身体健康。近年,DM 对男性生殖系统特别是对睾丸功能的影响逐渐引起了研究者的重视。DM 可引起氧化应激及炎症反应[5-6],激活相关信号通路如胰岛素和血糖调控通路FoxO1 等[7],导致睾丸细胞凋亡和生精细胞减少[8-9],影响睾丸功能,具体机制仍有待研究。
同种异体移植物炎性因子-1(allograft inflammatory factor-1,AIF-1)是一种与巨噬细胞免疫调节活动密切相关的炎症因子[10-11],已经证实AIF-1 参与DKD 发病过程,并促进炎性因子IL-6、TNF-α 等过表达[12],提示AIF-1 诱发的炎症反应可能在DM发生及发展中起重要作用。那么AIF-1 在DM 睾丸中表达情况及是否会引起炎症反应,目前研究相关报道较少。本研究拟建立Ⅰ型DM 睾丸大鼠模型,探讨AIF-1 在DM 睾丸大鼠模型中的表达及意义,为DM睾丸病变诊断和治疗提供新策略和思路。
1 材料与方法
1.1 实验动物4~6 周龄,雄性Sprague Dawley(SD)大鼠,购自广西医科大学实验动物中心,SD大鼠饲养在SPF 级屏障环境,湿度40%~70%,温度20~26 ℃,光照12 h,所有大鼠自由饮水及饮食。动物实验获得广西医科大学第一附属医院医学伦理委员会批准(编号:2022-KT-国基-254),所有操作均根据国家研究委员会的实验室动物护理和使用指南进行。
1.2 实验试剂及仪器链脲佐菌素(STZ)、柠檬酸钠缓冲液、磷酸盐缓冲液(PBS)购至美国Sigma公司,AIF-1 兔抗鼠单克隆抗体(ab283319)、NFκB p65 鼠单克隆抗体(ab32536)购至美国Abacm公司,HRR 标记羊抗鼠二抗IgG(GB21302)、组织自发荧光淬灭剂(G1221)购至武汉赛维尔公司,免疫组化染色试剂盒购至北京中杉金桥生物技术有限公司,分析天平购至盛平公司,电子天平购至力辰公司,血糖仪(卓越型)购至ROCHE 公司,病理切片机(RM2016)购至上海徕卡仪器有限公司,白光显微镜(E100)和正置荧光显微镜(Eclipse C1)购至上海尼康仪器有限公司。
1.3 动物实验分组42 只雄性SD 大鼠随机分为实验组(DM 组,n=24)和正常对照组(normal control,NC 组,n=18)。空腹时,DM 组单次腹腔注射pH=4.5,0.1 mmol/L 的柠檬酸缓冲液溶解的STZ,50 mg/kg。注射STZ 后3 d,尾静脉采血,随机血糖高于16.7 mmol/L 时,出现多饮、多食、多尿等症状时,判定为糖尿病大鼠模型成功[13-14];NC 组仅腹腔注射等量柠檬酸缓冲液。
24 只实验组大鼠中,造模成功20 只,将DM 大鼠随机分组:(1)糖尿病睾丸4 周组(DMT4W 组,n=6):成模4 周后处死。(2)糖尿病睾丸8 周组(DMT8W,n=6):成模8 周后处死。(3)糖尿病睾丸12 周组(DMT12W,n=6):成模12 周后处死。NC 分组:(1)正常对照4周组(NC4W,n=6):4 周后处死。(2)正常对照8 周组(NC8W,n=6):8 周后处死。(3)正常对照12 周组(NC12W,n=6):12 周后处死。
1.4 测量大鼠血糖和体质量每周记录大鼠的进食量和饮水量,用天平测量空腹时各组大鼠体质量;尾静脉采血,血糖仪测定各组大鼠随机血糖值。
1.5 标本采集断颈法处死各组大鼠后摘取双侧睾丸,天平称量睾丸重量。PBS 液清洗后将睾丸组织置于4%多聚甲醛中固定,石蜡包埋,4 μm切片。左侧睾丸组织用于HE染色,行组织病理学检查;右侧睾丸组织用于免疫组化和免疫荧光检查。
1.6 组织病理学检查切片放入酒精脱蜡后,浸泡苏木素3 min,自来水清洗后1%盐酸酒精分化5 s,返蓝5 min,伊红液浸泡20 s,洗涤后,切片浸没于不同梯度酒精和二甲苯液体脱水,中性树胶封片,显微镜观察,细胞核染为蓝色,胞质染为红色,按100 ×、200 ×、400 ×倍数拍片。
1.7 免疫组织化学检查切片脱蜡后进行抗原修复,滴加3%过氧化氢阻断内源性过氧化物酶,室温孵育15 min 后,滴加一抗AIF-1(浓度1∶2 000),4 ℃孵育过夜,滴加HRR标记羊抗兔二抗(1∶300),37 ℃孵育20~30 min,PBS 洗涤后室温下孵育30 min。PBS 洗涤后滴加DAB 显色剂。自来水冲洗,苏木素复染30~60 s,1%盐酸乙醇分化后,返蓝,无水乙醇,二甲苯脱水透明后封片镜检。显微镜观察,拍片。
AIF-1 蛋白阳性主要定位于细胞膜和细胞浆。免疫组化结果判定参考既往文献[15-16],随机检测4 个高倍视野(400 ×),结果采用半定量计分方法,根据细胞染色强度和染色阳性细胞比例(阳性细胞数占同类细胞数的比例)的乘积来判定。染色强度评分:0 分为无特异性着色,1 分为浅黄色,2 分为棕黄色,3 分为棕褐色;染色阳性细胞占比评分:0 分为<5%,1 分为5%~25%,2 分为6%~50%,3 分为>51%。两种评分相乘(A×B),将结果分为:0~3 分为低表达;4~9 为高表达。
1.8 免疫荧光检查清洗及浸泡切片后,山羊血清封闭,室温孵育60 min 后滴加一抗AIF-1(浓度1∶300)和NF-κB p65(浓度1∶500),4 ℃过夜。PBS清洗,滴加荧光素标记二抗(浓度1∶200),室温孵育60 min 后PBS 清洗,DAPI 染核15 min,PBS 清洗,加抗荧光淬灭剂,封片后荧光显微镜下观察(400 ×)。AIF-1 和NF-κB p65 蛋白阳性表达为红色特异性荧光。
1.9 统计学方法用SPSS 20.0 统计软件进行统计学分析,Graphpad Prism 5 软件作图。计量资料用均数±标准差表示;成组设计两样本过均数比较,满足独立性、正态性、方差齐性检验,采用独立样本t检验,若不满足方差齐性及正态分布,采用非参数检验。以P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 各组大鼠体质量、血糖、睾丸情况实验前,各组大鼠体质量、随机血糖,差异无统计学意义(P>0.05,表1)。DMT组大鼠于造模成功6周、9周时各死亡1 只,最后共存活16 只,分别为DMT4W组6 只,DMT8W 组5 只及DMT12W 组5 只,总体来说,STZ 诱导1 型DM 大鼠模型成模率较高,诱导周期短,能满足实验要求。NC 组18 只,在饲养过程中无死亡,分别为NC4W 组6 只,NC8W 组6 只,NC12W 组6 只。
表1 实验前糖尿病组和对照组大鼠体质量、血糖比较Tab.1 Body weight and blood glucose in diabetic and control rats before experiment ±s
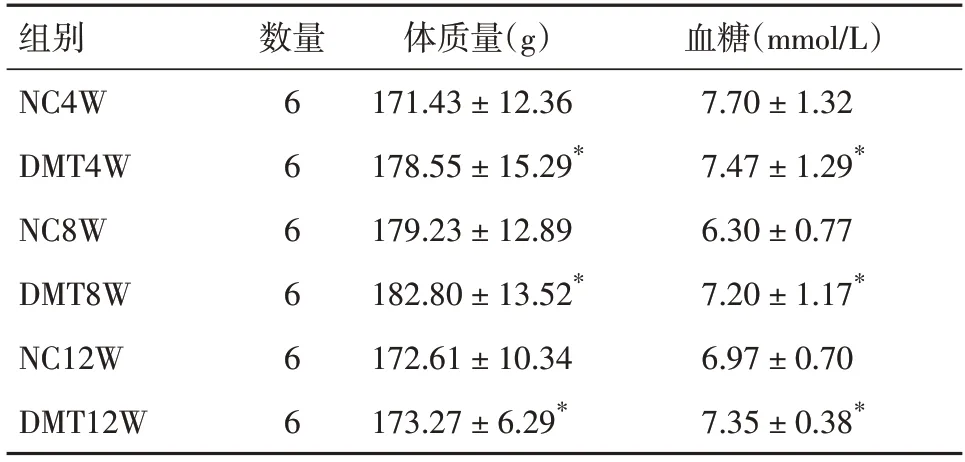
表1 实验前糖尿病组和对照组大鼠体质量、血糖比较Tab.1 Body weight and blood glucose in diabetic and control rats before experiment ±s
注:与NC组相比,*P<0.05
组别NC4W DMT4W NC8W DMT8W NC12W DMT12W血糖(mmol/L)7.70±1.32 7.47±1.29*6.30±0.77 7.20±1.17*6.97±0.70 7.35±0.38*数量6 6 6 6 6 6体质量(g)171.43±12.36 178.55±15.29*179.23±12.89 182.80±13.52*172.61±10.34 173.27±6.29*
各实验组大鼠每周称量体质量及监测随机血糖。与NC 组比较,DWT 组大鼠饮食、饮水增加,从4 周开始体质量显著下降(P<0.01),血糖升高(P<0.01);到了8、12 周各实验组体质量大鼠持续下降(P<0.01);而血糖继续升高(P<0.01,表2)。
表2 糖尿病组和对照组大鼠体质量、睾丸重量、血糖比较Tab.2 Body and testicular weight,and blood glucose in diabetic and control rats ±s
注:与NC组相比,*P<0.05;**P<0.01
组别NC4W DMT4W NC8W DMT8W NC12W DMT12W睾丸(g)1.67±0.11 1.64±0.10 1.87±0.10 1.65±0.11*1.94±0.16 1.52±0.03*数量6 6 6 5 6 5体质量(g)289.55±32.16 201.47±28.12**384.85±17.84 203.44±23.11**469.93±29.37 231.52±36.86**血糖(mmol/l)7.23±0.94 28.30±3.22**7.23±0.86 26.92±1.98**8.21±1.95 26.20±3.72**
分别于造模成功4、8、12 周后处死各组大鼠,与NC 组相比,DWT4W 组大鼠睾丸重量虽然降低,但差异无统计学意义(P>0.05,表2),8、12 周时,睾丸重量持续下降(P<0.01,表2)。
2.2 各组大鼠睾丸组织病理学变化组织病理学结果表明,与NC 组相比,DMT4W 组大鼠生精小管形态不规则,睾丸间质和支持细胞减少,生精细胞从基底膜分离,形状不规则、排列紊乱,精母细胞和精子细胞数量减少、畸形增多。到了DMT8W、DMT12W 时,生精小管进一步萎缩,精母细胞和精子细胞进一步减少,提示随着DM 病程加重,DM 组睾丸组织萎缩,结构改变明显(图1)。

图1 各组大鼠睾丸组织病理学图片Fig.1 Histopathological images of the rat testicular tissues in different groups
2.3 各组大鼠睾丸AIF-1 蛋白表达情况免疫组织化学结果显示,NC 组睾丸组织中AIF-1 为低表达或阴性表达,与NC 组相比,DMT 各组大鼠睾丸组织内AIF-1 阳性表达明显增加(P<0.05)。DMT4W 组中AIF-1 蛋白阳性表达最明显。虽然DMT8W、DMT12W 组AIF-1 蛋白阳性表达相对减弱,但仍高于NC 组(表3、图2)。
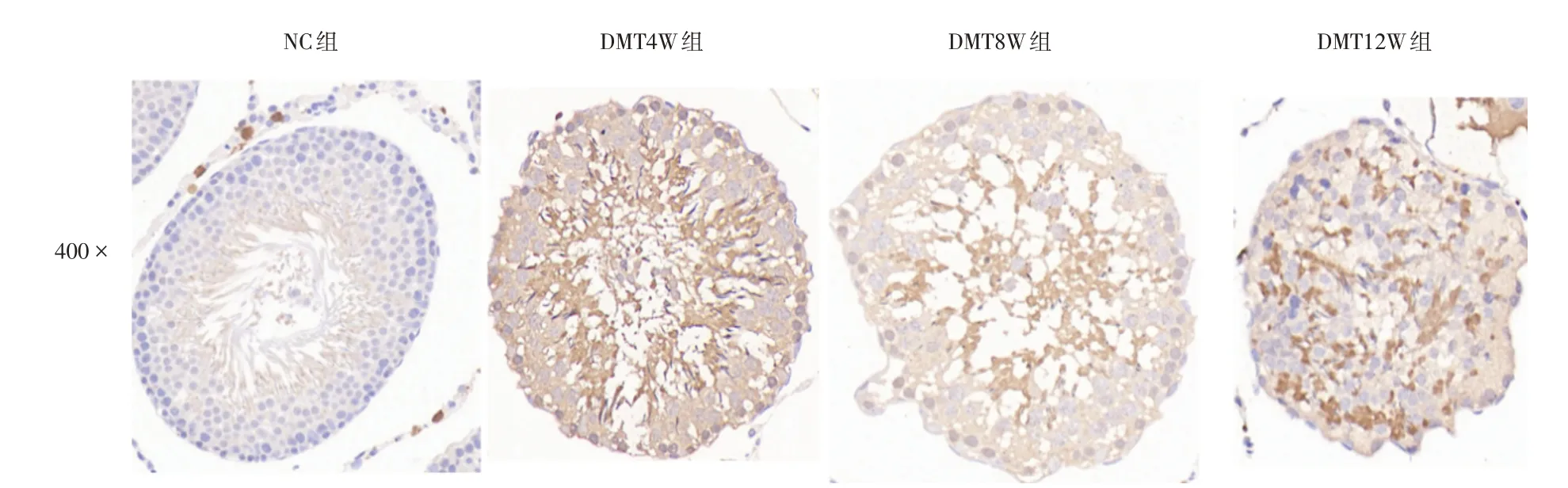
图2 各组大鼠睾丸组织AIF-1 蛋白表达Fig.2 The expression of AIF-1 protein in the rat testicular tissues of different groups
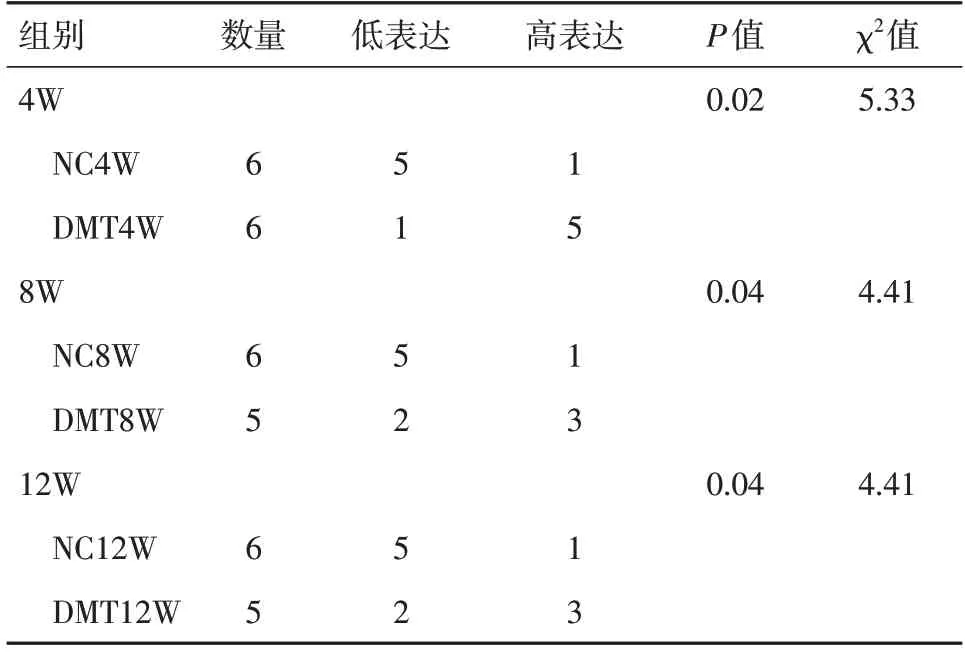
表3 AIF-1 蛋白在各组睾丸组织的表达Tab.3 The expression of AIF-1 protein in the testicular tissues of different groups
2.4 各组大鼠睾丸AIF-1 和NF-κB p65 免疫荧光表达情况免疫荧光染色结果显示,AIF-1 和NFκB p65 主要表达在细胞膜和细胞质。与NC 组相比,DWT 各组睾丸组织AIF-1 和NF-κB p65 荧光染色强度明显增加。DMT4W 组中AIF-1 和NF-κB p65荧光染色最明显,DMT8W、DMT12W组AIF-1和NF-κB p65 荧光表达相对减弱,但仍高于NC 组。阳性表达除见于细胞膜和细胞质,细胞核也呈阳性表达(图3、4)。
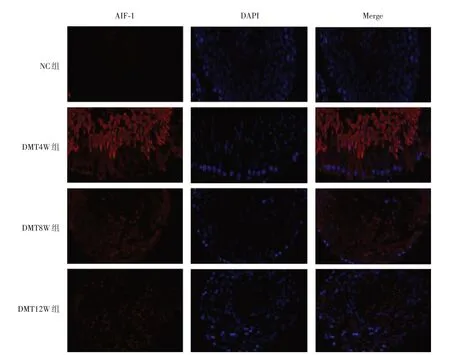
图3 各组大鼠睾丸组织AIF-1 蛋白免疫荧光表达Fig.3 The immunofluorescence staining expression of AIF-1 protein in the rat testicular tissues of different groups
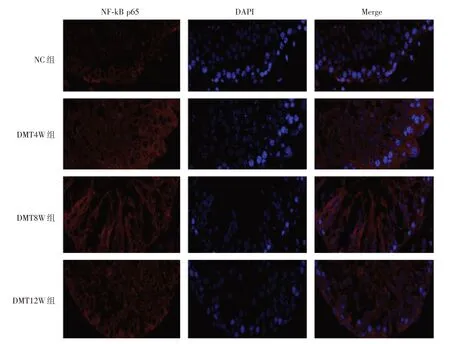
图4 各组大鼠睾丸组织NF-kB p65 蛋白免疫荧光表达Fig.4 The immunofluorescence staining expression of NF-kB p65 protein in the rat testicular tissues of different groups
3 讨论
DM 患者长期处于高血糖环境,睾丸结构及生精功能受到损害,表现为少精、弱精症等,其损伤机制可能与DM 时产生的持续高血糖内环境,导致活性氧(ROS)及炎性因子IL-1、IL-6 等表达增加,激活氧化应激及炎症反应[17-18],提示炎症反应可能参与了DM 诱导的睾丸损伤。
AIF-1 是一种17 千道尔顿(17 kDa)单位的钙结合蛋白。它是INF-Y 合成,由单核细胞、巨噬细胞和淋巴细胞诱导产生炎性细胞因子,可与多种靶点相互作用,与多种炎症性疾病如类风湿性关节炎、动脉粥样硬化、间质纤维化等发病密切相关[19-20]。在1 型DM 大鼠模型和胰岛素分泌Ⅰ型细胞(INS-1)中,AIF-1 可诱导一氧化氮(NO)增多和免疫细胞活化,促进细胞凋亡。在Ⅱ型DKD 患者血清AIF-1 表达水平与蛋白尿增加呈正相关。AIF-1 在DKD 动物模型肾组织和高糖诱导的小鼠肾小球内皮细胞(MRGECs)中过表达,可激活炎症和氧化应激反应[12]。
目前还不清楚AIF-1 在DM 患者睾丸中表达情况,是否激活相关炎症因子调控的相关信号通路。由于伦理学原因,真实世界中无法对人DM患者睾丸组织的AIF-1 表达进行检测。本研究拟对DM 大鼠模型睾丸进行体内研究。目前有1 型和2 型DM 动物模型,相比2 型,1 型DM 大鼠模型成功率高,是大多数DM 研究首选动物模型[21-22],因此本研究选取1 型DM 大鼠模型。
本研究首先对雄性SD 大鼠腹腔注射SMZ,破坏胰岛素功能,制作1 型DM 大鼠模型。为模拟体内DM 真实发病进程,本研究分别在诱导DM 大鼠模型成模4、8、12 周时,检测各组大鼠体重和血糖,与NC 组相比,在4、8、12 周时,DMT 各组大鼠体重持续下降(P<0.05);同时DMT 各组大鼠血糖持续增高(P<0.05),提示DM 造模成功,可模拟体内DM 疾病的发展过程。
组织病理学结果表明,与NC 组相比,DMT4W组大鼠生精小管形态不规则,间质和支持细胞减少,生精细胞从基底膜分离,形状不规则、排列紊乱,精母细胞和精子细胞数量减少、畸形增多。到了DMT8W、DMT12W 时,生精小管进一步萎缩,精母细胞和精子细胞进一步减少,提示随着DM 病程加重,睾丸组织结构萎缩,睾丸功能进一步受损,与既往研究相符合。
而免疫组织化学结果显示,与NC 组相比,DMT 组大鼠睾丸组织生精小管内AIF-1 棕黄色或棕褐色阳性细胞多,染色程度深,提示DMT 组睾丸中AIF-1 蛋白表达明显升高,表明炎症因子AIF-1蛋白可能参与DMT 的发生发展。
核因子κB(NF-κB)是从B 淋巴细胞核抽提物中检出的一种能够与免疫球蛋白k 链和重链基因增强子序列特异结合的核蛋白因子,与细胞增殖、分化、免疫应激以及细胞周期和凋亡等密切相关。NF-κB p65 是NF-κB 中由p65 亚单位构成的一种异源二聚体,其表达增加可促进相关炎症因子增多和激活炎症反应[23]。相关研究[24-25]证实过表达AIF-1 后,通过IkBa 激酶磷酸化和促进p65/p50 异源二聚体从细胞质易位到细胞核,激活NFκB 信号通路,导致NF-κB p65 表达增加。那么在DMT 大鼠模型睾丸内AIF-1 过表达后,是否会促进NF-κB p65 表达增加?
为证实这一假说,本研究进一步结果显示,与NC 组相比,DMT 各组大鼠睾丸组织AIF-1 和NFκB p65 免疫荧光表达增加(P<0.05),提示DMT大鼠模型中,AIF-1 过表达后,有可能激活NF-κB信号通路,导致NF-κB p65 表达增加,从而促进炎症和氧化应激反应,导致睾丸功能受损。
本研究还存在以下不足:(1)没有对DMT 各组大鼠睾丸模型中的精子活力和精液常规进行检测,因而无法探讨精子活力与AIF-1 表达的相关性。(2)没有检测AIF-1 调控相关炎性因子IL-6、TNF-α 等表达。(3)没有进行体外细胞实验,从而探讨AIF-1 调控NF-κB p65 表达的机制和信号通路。
综上所述,本研究首次发现DMT 大鼠模型睾丸组织中AIF-1 过表达,有可能调控NF-κB 信号通路,因而促进NF-κB p65 过表达,激活炎症反应和氧化应激,从而破坏睾丸组织结构,影响睾丸功能。AIF-1 有可能成为治疗DMT 病变的新靶点和诊断标记物。
【Author contributions】ZHANG Mingjin,LAN Yibi and YANG Meizi performed the experiments and wrote the article.MA Chunlei performed the experiments.LI Dechao revised the article.FU Weijin designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
