Kruppel样因子14介导的JAK-STAT信号通路对非小细胞肺癌预后的影响
2024-01-30王鹏姚苏梅吕学东陈金亮
王鹏 姚苏梅 吕学东 陈金亮
南通市第一人民医院呼吸科(江苏南通 226000)
肺癌仍然是全球癌症相关死亡率的主要原因,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有病例的80%~85%,主要由肺腺癌和肺鳞癌组成[1]。在临床上,尽管手术、放化疗和靶向治疗提高了治疗效果,但NSCLC 预后仍然较差,5年生存率约为15%[2]。目前,通过低剂量CT 检查能够检出早期肿瘤,但由于对低剂量CT 的筛查价值和意义认识不够,导致其难以在高危人群的应用推广[3]。因此,迫切需要探索新的NSCLC 生物标志物。研究[4-5]证明,多种信号级联失调参与了NSCLC 的进展,如Kruppel 样因子(kruppel-like factors,KLFs)失调介导了肺癌的发生、发展、肿瘤干细胞特性和EGFR-TKI 药物的持久性。据报道[4]KLFs 参与多种疾病。KLF14 是KLFs 家族中新发现的成员,可能是免疫系统和肿瘤发病机制中的关键调节因子[6]。研究[7]发现,KLF14 通过降低肿瘤细胞增殖抑制HER2 阳性乳腺癌进展。此外,现有证据[8]表明KLF14 和肿瘤转移之间的相关性,例如在转移性和高级别脑癌中,KLF14 表达下调。然而,KLF14 在NSCLC 转移和预后中的作用仍不清楚。在本研究中,我们证实KLF14 表达在NSCLC 组织样本和细胞系中均下调。此外,我们评估了KLF14 过表达对细胞增殖、迁移、侵袭的影响,并阐明了相关的分子机制,旨在为理解KLF14 在NSCLC 进展中的可能作用机制。
1 材料与方法
1.1 组织标本收集2018年1 月至2019年9 月本院手术切除的80 例NSCLC 组织和25 例癌旁非肿瘤组织。术前没有患者接受化疗或放疗。本研究由本院伦理委员会批准(伦理号:2017026),所有患者均签署知情同意书。随访于2023年4月结束。
1.2 免疫组织化学术后石蜡包埋的组织切片标本保存在我院病理科。在二甲苯中脱蜡,在分级醇系列中再水合,高压下用柠檬酸盐缓冲液处理3 min。3%过氧化氢用于阻断内源性过氧化物酶活性。切片与正常山羊血清(5%)共孵育30 min。用KLF14 兔多克隆抗体免疫染色(1∶500 稀释)。使用Image-Pro Plus 6.0软件计算并测量每个图像的积分光密度(IOD)的平均值。根据KLF14表达的中值水平(45.77)将患者分为高表达组和低表达组。
1.3 细胞系和细胞转染人支气管上皮细胞系(Beas-2B)购自中国科学院昆明细胞库,在BEGM培养基(瑞士Lonza 公司)中培养。NSCLC 细胞系(SPC-A1、A549、HCC827、H1650 和H1975)购自中国科学院典型培养物保藏委员会细胞库,在RPMI-1640 培养基中(美国Gibco 公司)培养。
选择A549 细胞用于过表达KLF14、JAK1 和HCC827 细胞用于敲低KLF14、JAK1。将两种细胞系以3 × 105细胞/孔的浓度接种在6 孔板中。用Lipofectamine 2000 转染试剂(美国Thermo Fisher Scientific 公司)转染质粒(上海捷瑞生物工程有限公司)。转染48 h后,收获细胞用于进一步的实验。合成人KLF14、JAK1 编码DNA 序列(上海捷瑞生物工程有限公司)并亚克隆到pCDH慢病毒载体中,用于建立过表达KLF14、JAK1 质粒。慢病毒载体用于包装病毒颗粒。用嘌呤霉素(1 μg/mL,美国Sigma-Aldrich 公司)选择感染病毒48 h 的A549 细胞系1 周。
人重组shKLF14、shJAK1 慢病毒和阴性对照(shNC)慢病毒由上海捷瑞生物工程有限公司构建。用shRNA 慢病毒感染细胞48 h 后,用嘌呤霉素(1 μg/mL)选择稳定表达shKLF14、shJAK1 和shNC 的HCC827 细胞。shNC 的序列为5'-TTCTCGAACGTGTCACGT-3';shKLF14 的序列为5'-GAGUCUUUUCAUGUCCAUCA-3';shJAK1 的序列为5'-AGCTTAAAAAACTCCTCAATCTGAGT-3'。
1.4 细胞增殖试验在集落形成试验中,将大约500 个肺癌细胞接种到6 孔板中,培养2 周,细胞克隆形成。然后每孔加入2 mL 100%甲醇固定细胞30 min,弃去甲醇,加入结晶紫染色液染色20 min,然后用显微镜拍照。
1.5 细胞侵袭和迁移试验侵袭试验:将小室插入24 孔板(美国Corning 公司)中,并用基质胶包被至少3 h,模拟血管基底膜;迁移试验:将小室插入没有基质胶涂层的24 孔板中。将含有10% FBS的800 μL 细胞培养基作为化学引诱剂加入到下室中。向有涂层的上室中加入1 × 105个肺癌细胞,向无涂层的上室中加入0.5 × 105个肺癌细胞;在两种情况下,细胞都重悬于200 μL 无血清细胞培养基中。随后,用100%甲醇固定从上室通过膜迁移到室外的细胞30 min,并用结晶紫染色溶液对细胞染色20 min。随机选取9 块视野拍照,并对细胞进行计数。
1.6 蛋白质印迹法(Western blot)采用T-PER蛋白提取试剂(补充有磷酸酶抑制剂和蛋白酶抑制剂混合物)(美国Thermo Scientific 公司)对肺癌细胞或组织进行匀浆处理。然后,将等体积和等量(2 μg/μL)的蛋白质进行SDS-PAGE 分离,并将蛋白质从聚丙烯酰胺凝胶转移至PVDF 膜(美国Millipore公司)。将膜与以下抗体在4 ℃孵育过夜:抗KLF14 抗体(美国Proteintech 公司)、抗JAK1 抗体(美国Santa Cruz 公司)、抗Stat3 抗体(美国Santa Cruz 公司)、抗β-actin 抗体(美国Santa Cruz 公司)。第二日,将膜与辣根过氧化物酶(HRP)缀合的第二抗体(1∶5 000,美国Proteintech公司)孵育2 h。使用化学发光系统(美国Bio-Rad 公司)显示条带,并使用Quantity One软件(美国Bio-Rad公司)进行分析。
1.7 微阵列分析商业组织微阵列(购于上海生物芯片有限公司)评估有或无KLF14 过表达的A549 细胞中参与肿瘤进展的18 种典型信号通路分子的相对表达水平并分析结果。
1.8 统计学方法使用SPSS 20.0 软件进行统计分析。数据表示为平均值±标准偏差。两组间的平均值比较采用t检验。多组间的比较采用单因素方差分析(ANOVA)和最小显著距离事后检验。采用χ2检验检测KLF14 表达与临床病理特征之间的相关性。采用Kaplan-Meier 法计算生存曲线和生存率。使用对数秩方法进行生存分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 KLF14 在NSCLC 组织中表达下调免疫组织结果提示与癌旁正常组织相比,KLF14 在NSCLC 组织中表达降低(t=6.34,P<0.001)。此外,不同分期的NSCLC 组织中KLF14 表达存在显著差异,其中KLF14 在分期Ⅰ、Ⅱ的NSCLC 组织中表达较分期Ⅲ显著增加(P<0.001),并且分期Ⅰ的NSCLC 组织中KLF14 表达较分期Ⅱ显著增加(F=26.03,P<0.05)(图1A-C)。通过Western blot分析证实了癌旁正常组织中KLF14 表达高于NSCLC 组织(图1D)。
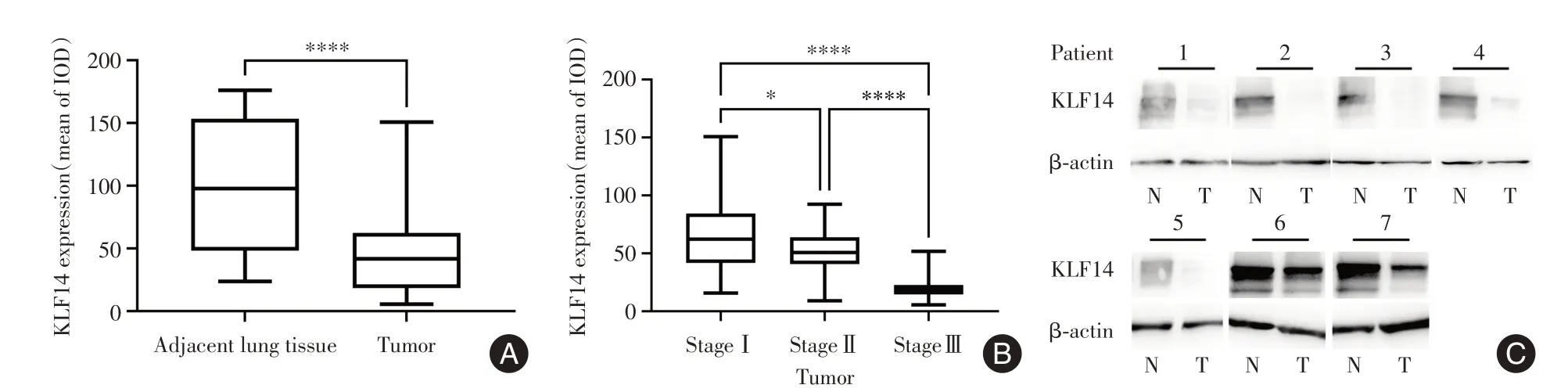
图1 KLF14 在NSCLC 组织中表达下调Fig.1 The expression of KLF14 is down-regulated in NSCLC.
2.2 KLF14 的表达与NSCLC 患者的临床特征相关根据免疫组化分析的KLF14 中位表达水平,将80 例NSCLC 患者分为低表达组和高表达组。结果显示KLF14 的低表达与肿瘤直径>3 cm、淋巴结转移、临床分期Ⅲ期显著相关(P=0.004、0.004、<0.001)(表1)。截至随访日,80 例NSCLC 患者中有44例死亡。生存分析显示中位生存时间为43个月。在高KLF14 表达组和低KLF14 表达组之间的总存活率有显著差异,低KLF14 表达的患者预后不良(P=0.039)(图2)。
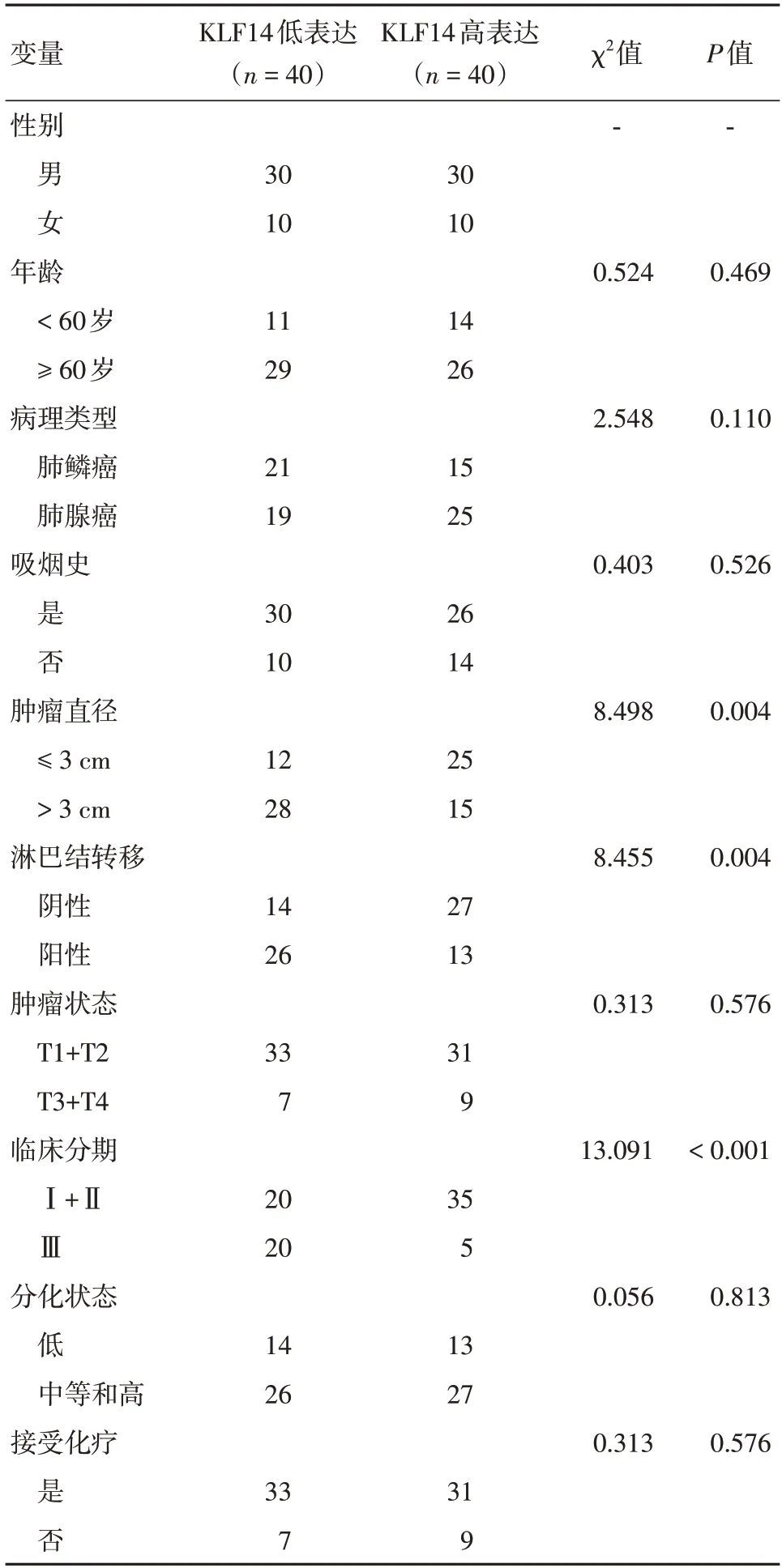
表1 KLF14 蛋白表达与NSCLC 临床病理特征的关系Tab.1 Relationship between KLF14 protein expression and clinicopathological features of NSCLC例
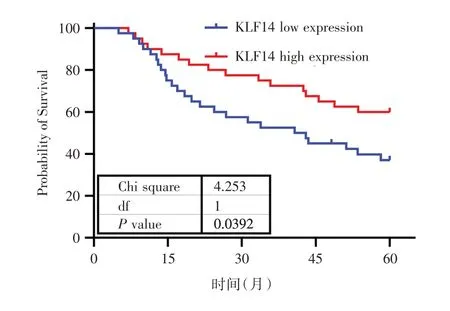
图2 生存分析KLF14 表达与NSCLC 患者的预后关系Fig.2 Relationship between KLF14 expression and prognosis of NSCLC patients by survival analysis.
2.3 KLF14 在NSCLC 细胞中表达下调并介导癌细胞的增殖、转移与Beas-2B 相比,KLF14 蛋白质表达在NSCLC 细胞系(SPC-A1、A549、HCC827、H1650 和H1975)中显著降低(F=58.06,P<0.01)(图3A-B)。在A549 细胞中转染KLF14 过表达质粒(KLF14)和在HCC827 细胞中转染KLF14 特异性短发夹RNA(shKLF14)来过表达或敲低KLF14(图3C-D)。KLF14 过表达后,A549 细胞的增殖能力、迁移和侵袭细胞数均显著降低(F=22.58、31.56、26.74,P<0.05),而KLF14 敲低后,HCC827细胞的增殖能力、迁移和侵袭细胞数均显著增加(F=28.53、21.93、22.50,P<0.05)(图3E-H)。
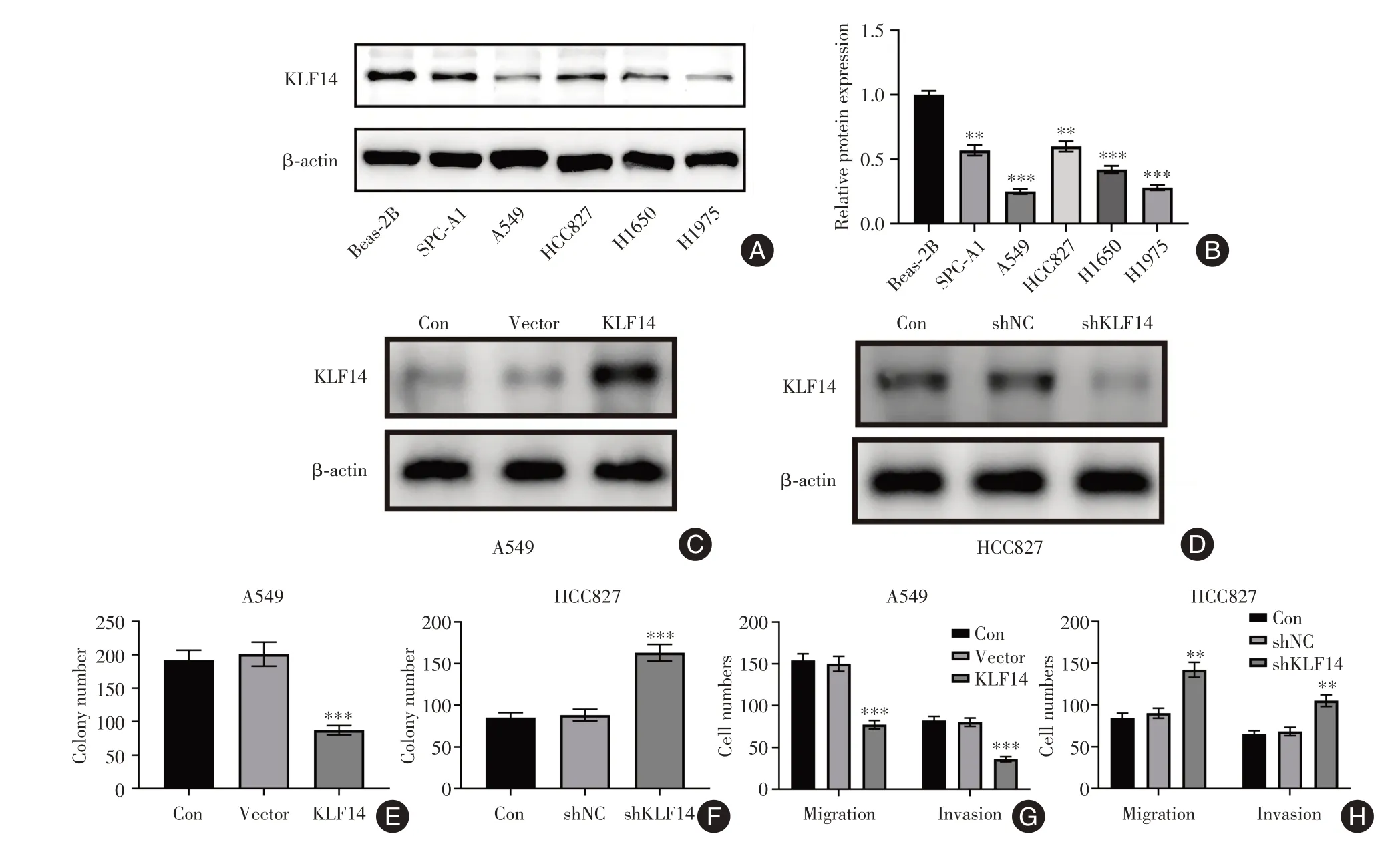
图3 KLF14在NSCLC细胞中表达下调并介导癌细胞的增殖、转移Fig.3 The expression of KLF14 is down-regulated in NSCLC cells and mediates the proliferation and metastasis of cancer cells
2.4 KLF14上调抑制了JAK-STAT信号通路使用购买的包含18 个典型信号通路分子的商业人类蛋白质阵列来验证KLF14 和参与肿瘤进展的下游信号通路的相关性。结果显示,STAT3 发生了显著改变。通过Western blot 进一步验证显示,KLF14 过表达后,A549 细胞中JAK1 和STAT3 蛋白表达降低,表明KLF14 影响肺癌中的JAK-STAT 信号传导途径(图4B)。
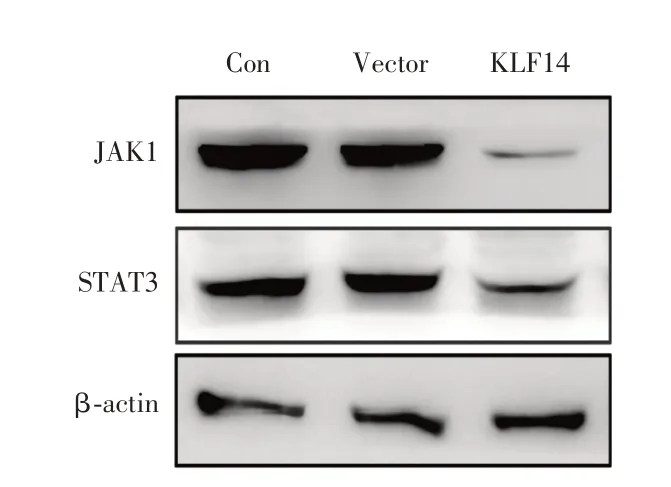
图4 KLF14 上调对A549 细胞中JAK1-STAT3 蛋白表达的影响Fig.4 The effect of KLF14 upregulation on JAK1-STAT3 protein expression in A549 cells
2.5 JAK-STAT 信号通路是KLF14 促进肺癌细胞增殖、转移所必需的功能靶点通过在KLF14过表达的A549 细胞中转染JAK1 质粒(JAK1)和在KLF14敲低的HCC827细胞中转染shJAK1(JAK1特异性短发夹RNA)来过表达或敲低JAK1(图5A-B)。与Vector + KLF14 组相比,JAK1 + KLF14 组A549细胞的集落数显著增加(t=4.26,P<0.05)(图5C);而shNC + shKLF14 组相比,shJAK1 + shKLF14 组HCC827细胞的集落数显著降低(t=3.79,P<0.05)(图5D)。Transwell 分析表明,与Vector + KLF14 组相比,JAK1 + KLF14 组A549 细胞迁移和侵袭数显著增加(t=4.33、4.42,P<0.05)(图5E);而与shNC +shKLF14 组相比,shJAK1+shKLF14 组HCC827 细胞迁移和侵袭数显著降低(t=4.37、3.89,P<0.05)(图5F)。
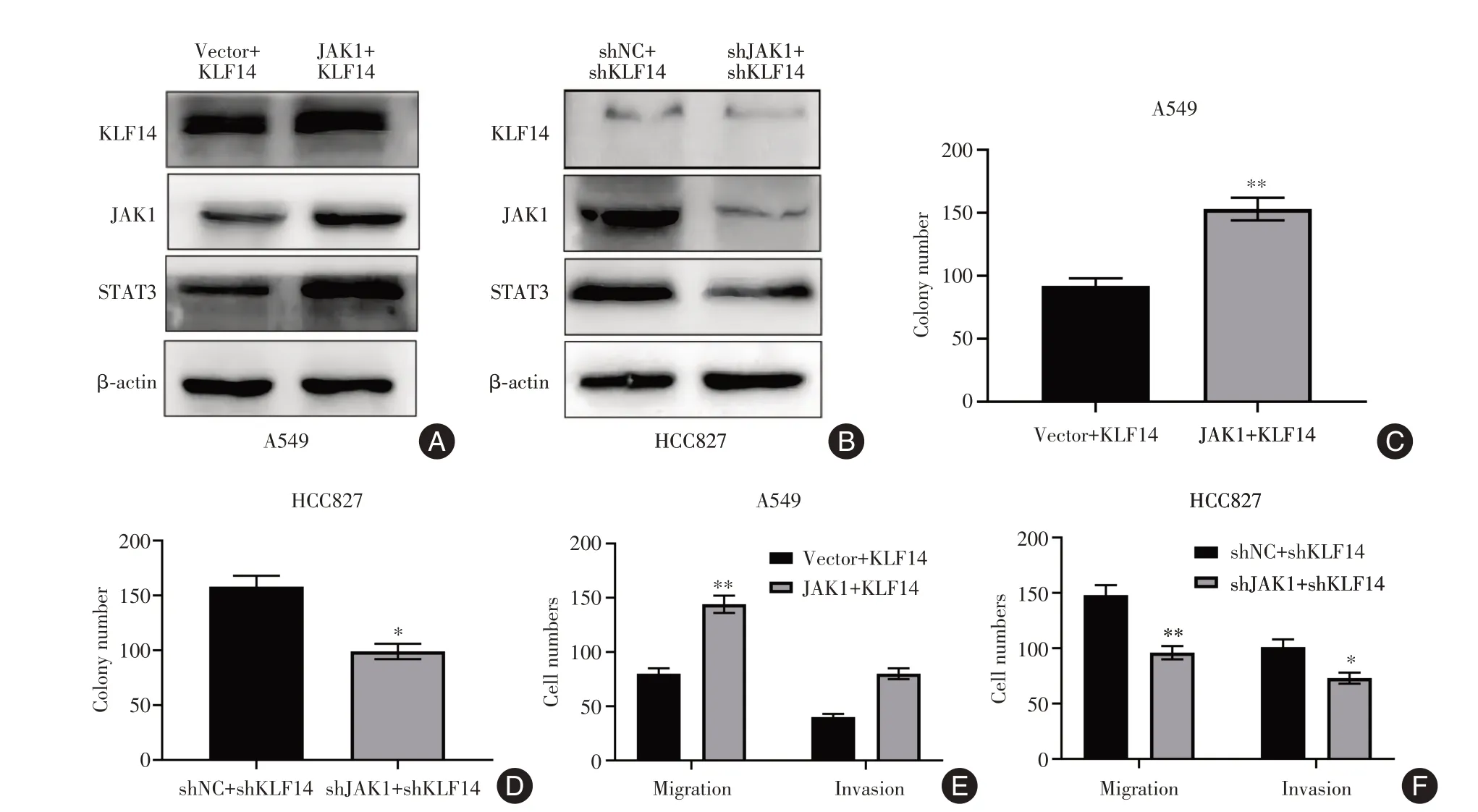
图5 JAK-STAT 信号通路是KLF14 抑制肺癌细胞增殖、转移所必需的功能靶点Fig.5 JAK-STAT signaling pathway is a necessary functional target for KLF14 to inhibit the proliferation and metastasis of lung cancer cells
3 讨论
肺癌是世界上发病率和死亡率最高的恶性肿瘤,5年生存率为4%~17%[9]。探索新的生物标志物对于NSCLC 靶向治疗具有重要意义。研究[10-11]表明,KLF14 在许多实体瘤如乳腺癌、肝细胞癌、宫颈癌和胰腺癌中起抑癌作用。通过搜索TCGA数据库,我们发现KLF14 在NSCLC 组织中表达降低。通过组织学和细胞学验证获得了相同的结果,KLF14 的低表达与NSCLC 患者的肿瘤直径>3 cm、淋巴结转移、临床分期Ⅲ期和较差的总生存期相关。因此,我们假设KLF14 在NSCLC 中也起到了抑癌作用。KLF14 对NSCLC 生物学行为影响的进一步研究表明,KLF14的上调抑制了NSCLC细胞的增殖、迁移和侵袭。
KLF14 被证明是多种人类疾病中的转录调节因子,如癌症和2 型糖尿病[12-13]。越来越多的报道表明KLF14 在肿瘤发生中经常作为肿瘤抑制因子发挥作用。例如,CHU 等[14]发现KLF14 通过调节SOCS3/RhoA/Rock/Stat3 信号通路减轻乳腺癌侵袭和M2 巨噬细胞极化。CHEN 等[15]指出,KLF14 下调导致结肠癌、乳腺癌和甲状腺癌细胞中细胞增殖减少、周期停滞和细胞凋亡增加。与先前研究一致,本研究发现,KLF14 在NSCLC 组织和细胞系中下调,KLF14 过表达显著降低了癌细胞体外增殖、侵袭,表明KLF14 可能是NSCLC 中的肿瘤抑制因子。目前,KLF14 在NSCLC 中的作用尚未完全确定,与肺癌发生和疾病进展相关的分子机制的数据非常有限。因此,我们使用人类蛋白质阵列对KLF14 影响肺癌转移的机制进行了初步研究,结果表明,KLF14 可以抑制细胞内JAK-STAT 信号通路,从而抑制数百个下游基因表达事件。我们的研究揭示了KLF14 抑制肺癌细胞转移的一种新的分子机制。
JAK1-STAT3 途径的异常激活与多种癌症的恶性发展有关,如肝细胞癌、胰腺癌、胃癌以及乳腺癌等[16-18]。一些文献已经证实,JAK1-STAT3 途径的激活促进了NSCLC 的恶性发展[19-20]。针对JAK1-STAT3 途径的治疗被认为是一种有前途的肿瘤治疗方案。目前正在探索JAK1-STAT3 途径的新型抑制剂[21-22]。本文进一步探讨了KLF14 对JAK1-STAT3 通路活性的影响。结果表明,KLF14的上调抑制了JAK1-STAT3通路的激活。深入研究表明,KLF14 的上调可能通过抑制JAK1-STAT3 通路抑制NSCLC 细胞恶性表型。这一发现为KLF14成为NSCLC 治疗的靶点提供了有利的分子证据。因此,KLF14 的上调可能通过抑制JAK1-STAT3 途径的活性来抑制NSCLC 的体外生长、转移。这些数据为KLF14 作为NSCLC 的靶点提供了更可靠的证据。然而,目前的研究缺少KLF14 在体内抑制NSCLC 细胞生长、转移以及对异种移植肿瘤组织中JAK1-STAT3 通路激活影响的证据,更准确的结论有待进一步体内研究。
总之,KLF14 低表达与NSCLC 肿瘤直径大、淋巴结转移、高临床分期和较差的总生存期相关。功能实验表明,KLF14 上调显著抑制肺癌细胞在体外的增殖、转移能力,其作用机制可能与抑制JAK-STAT 信号通路有关。因此,KLF14 可能是一个有价值的NSCLC 预后生物标志物。但KLF14 在NSCLC 中的作用还有待进一步研究。我们的研究结果将为今后NSCLC 的早期诊断和治疗提供新的潜在靶点。
【Author contributions】WANG Peng performed the experiments,revised the article and wrote the article.YAO Sumei performed the experiments.LV Xuedong and CHEN Jinliang designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
